ショウジョウバエの幼虫においてインスリン様ペプチドが栄養に依存して産生される分子機構
岡本直樹・西村隆史
(理化学研究所多細胞システム形成研究センター 成長シグナル研究チーム)
email:岡本直樹,西村隆史
DOI: 10.7875/first.author.2015.129
Signaling from glia and cholinergic neurons controls nutrient-dependent production of an insulin-like peptide for Drosophila body growth.
Naoki Okamoto, Takashi Nishimura
Developmental Cell, 35, 295-310 (2015)
すべての多細胞生物において,その恒常性は環境に応じて柔軟に変化し,発育の段階ごとに適切に制御されている.この研究において,ショウジョウバエの幼虫において恒常性の維持に必須のホルモンであるインスリン様ペプチドDILPが栄養に依存して産生される分子機構が明らかにされた.DILPは脳にあるインスリン産生細胞とよばれる神経内分泌細胞においておもに産生される.DILPをコードする遺伝子のうちdilp5遺伝子の発現は栄養状態の変化により顕著に変化することが知られていたが,dilp5遺伝子の発現は脳のグリア細胞およびコリン作動性ニューロンを介した栄養シグナルのリレーにより制御されていた.さらに,dilp5遺伝子の発現はアミノ酸シグナルおよびインスリン産生細胞から体液に分泌されたDILPが引き金になり,正のフィードバックにより増強されていた.この正のフィードバックによるdilp5遺伝子の発現の誘導は低栄養状態における幼虫の成長の維持に重要であった.以上の結果から,環境の変化に応じ組織あるいは細胞のあいだの相互作用を介して生体が恒常性を維持する機構の一端が明らかにされた.
多細胞生物の発生および成長の過程は組織あるいは時期に特異的な遺伝子発現の変化により内在的にプログラムされている.その一方で,多細胞生物はおのおのの発育の段階においてさまざまな環境の変化に応じて柔軟に恒常性を維持するプログラムをもつ.この恒常性の維持の柔軟性は生物の生存にとり不可欠な特性である.しかしながら,環境の変化に依存して恒常性を維持する分子基盤については不明な点が多く残されている.
個体において恒常性の維持を制御する因子としてもっともよく研究されているのがインスリン様ペプチドである1).これは,インスリンに構造のよく似たホルモンの総称であり,脊椎動物ではインスリンのほかIGF(insulin-like growth factor,インスリン様成長因子)がよく知られている.インスリン様ペプチドは昆虫をはじめとする無脊椎動物にも広く存在し,構造および機能とも高度に保存されている1).この研究においては,分子遺伝学的な解析にくわえ,生理的あるいは内分泌学的な解析,神経学的な解析の適応が可能なモデル生物であるショウジョウバエを用いて,組織あるいは細胞のあいだの相互作用による恒常性の維持機構の基本原理を明らかにすることをめざした.
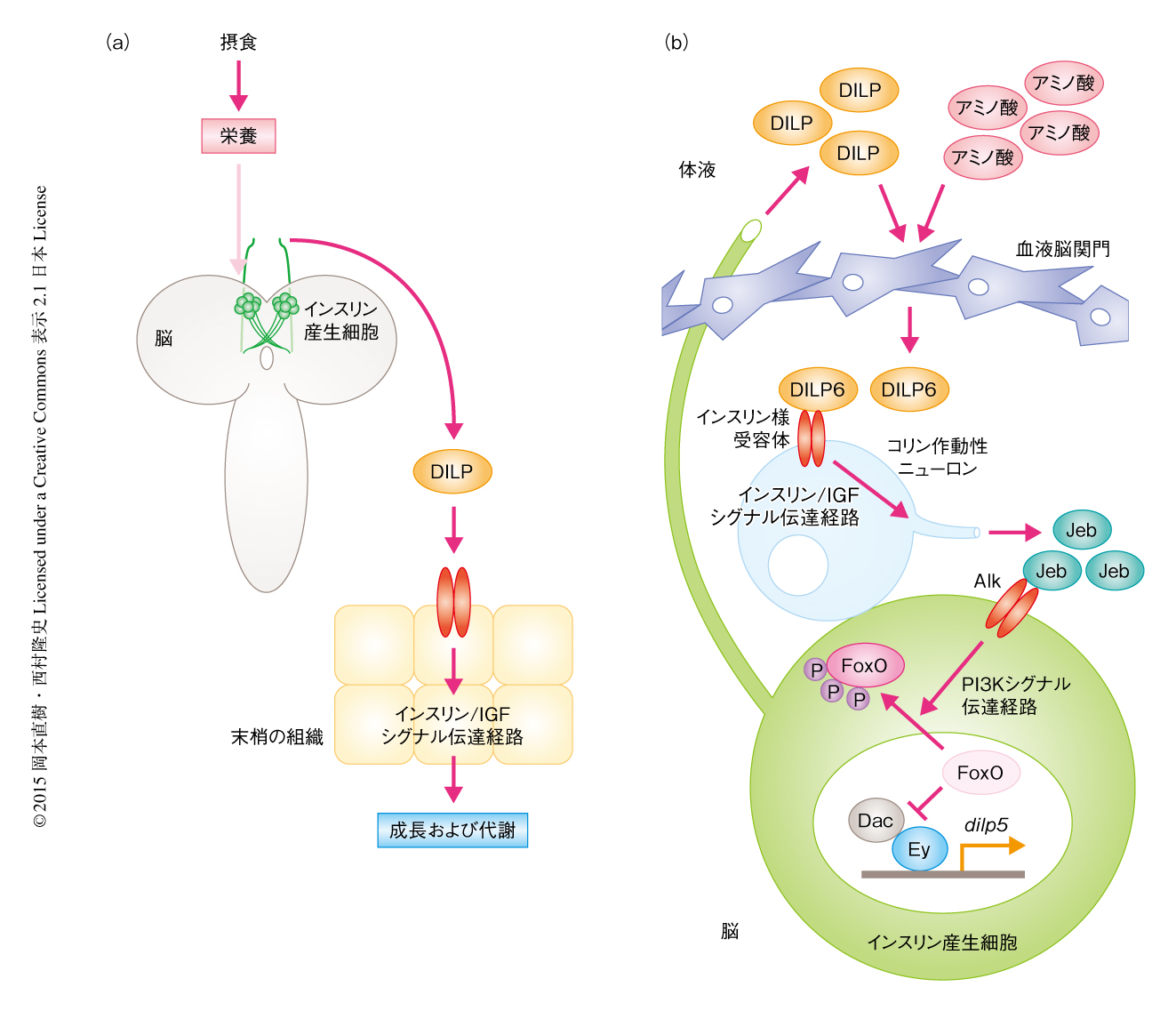
ショウジョウバエのもつインスリン様ペプチドであるDILPは,おもにインスリン産生細胞とよばれる脳間部にある数対の神経内分泌細胞において産生され,摂食にともなう栄養により体液に分泌される.分泌されたDILPは末梢組織のもつインスリン様受容体に作用してインスリン/IGFシグナル伝達経路を活性化させ,その結果,からだおよび組織の成長,糖代謝,エネルギー代謝を制御する2)(図1a).インスリン産生細胞を除去したショウジョウバエは,血糖値の上昇にくわえ,からだの大きさのいちじるしい減少および発生の遅延を示す3).したがって,インスリン産生細胞において産生されるDILPは,栄養状態の変化に応じて成長および代謝を直接的に制御する非常に重要なホルモンであるといえる.しかしながら,栄養状態の変化がどのようにインスリン産生細胞において感知されDILPの産生が制御されているのかについては,ほとんど明らかにされていない.
ショウジョウバエのインスリン産生細胞においてはDILPをコードする遺伝子として,おもにdilp2遺伝子,dilp3,dilp5遺伝子が発現するが,これらのうち,dilp5遺伝子の発現は栄養に依存して顕著に変化することが知られている4).すなわち,dilp5遺伝子の発現は摂食時に上昇し飢餓時に顕著に低下する.そこで,dilp5遺伝子の発現が栄養に依存して制御される分子機構に着目し,栄養状態の変化に応じた恒常性の維持機構の解明をめざした.筆者らは,これまでの研究により,dilp5遺伝子の発現は転写因子であるDac-Ey複合体により直接的に誘導されることを明らかにしてきた5).しかしながら,どのような分子機構により栄養に依存してDac-Ey複合体の活性が制御されdilp5遺伝子の発現が制御されているのかについては不明であった.
インスリン産生細胞におけるDacおよびEyの発現および局在について解析したところ,栄養に依存して制御されてはいなかった.つまり,栄養に依存して発現あるいは活性の変動するDacおよびEy以外の因子がdilp5遺伝子の栄養に依存した発現の制御に関与している可能性が示唆された.
栄養に依存してその局在および活性の変化することの知られる進化的に保存された転写因子であるFoxOに着目した6).インスリン産生細胞におけるFoxOの機能について解析したところ,1)FoxOはインスリン産生細胞において強く発現し,栄養に依存して局在が変化すること(摂食時は細胞質,飢餓時は核に局在),2)インスリン産生細胞に特異的なFoxOのノックダウンにより飢餓によるdilp5遺伝子の発現の低下が抑制されること,3)インスリン産生細胞に特異的なFoxOの過剰発現によりdilp5遺伝子の発現が顕著に低下すること,4)ショウジョウバエに由来する培養細胞株であるS2細胞を用いたレポーターアッセイにおいて,Dac-Ey複合体により誘導されるdilp5遺伝子の発現がFoxOの存在下では抑制されること,が見い出された.以上の結果は,FoxOがDac-Ey複合体によるdilp5遺伝子の発現の誘導を栄養に依存して抑制する転写因子として機能することを強く示唆した.
FoxOはインスリン産生細胞においてどのような分子機構によりDac-Ey複合体によるdilp5遺伝子の発現の誘導を抑制するのだろうか.免疫沈降実験の結果,FoxOはEyのもつペアードドメインと直接的に結合した.ペアードドメインはEyがDacと直接的に結合するのに必要であることから5),FoxOがEyとDacとの結合を競合的に阻害することが予想された.Eyに対するFoxOとDacとのあいだの競合実験の結果,FoxOはDacより強い親和性をもってEyと結合すること,Dac-Ey複合体は活性型FoxO(核局在型FoxO)の存在下では形成されなくなることが明らかにされた.以上の結果は,飢餓時においてFoxOは核に局在しEyと直接的に複合体を形成することにより,Dac-Ey複合体によるdilp5遺伝子の発現の誘導を阻害することを示した.逆に,摂食時においてFoxOは細胞質に局在するため,Dac-Ey複合体によりdilp5遺伝子の発現が誘導されることが明らかにされた.
インスリン産生細胞におけるFoxOの局在を制御する分子機構を解析した.FoxOの核への局在はPI3Kシグナル伝達経路の構成タンパク質のひとつであるAktによるリン酸化により負に制御されることが知られている6).そこで,インスリン産生細胞において特異的にAktをはじめとするPI3Kシグナル伝達経路の構成タンパク質をノックダウンしたところ,FoxOは摂食時にもかかわらず核に局在し,dilp5遺伝子の発現は顕著に低下した.上流の受容体の探索するため,受容体チロシンキナーゼファミリーをインスリン産生細胞に特異的な網羅的なノックダウンによりスクリーニングした.その結果,AlkのノックダウンによりFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.このとき,DILPの受容体であるインスリン様受容体をインスリン産生細胞において特異的にノックダウンしてもdilp5遺伝子の発現はわずかしか低下しなかった.また,インスリン産生細胞において特異的にAlkおよびFoxOをダブルノックダウンしたところ,Alkのノックダウンによるdilp5遺伝子の発現の低下は回復した.以上の結果から,インスリン産生細胞においてFoxOの局在とdilp5遺伝子の発現を制御するおもな上流の受容体はAlkであると結論づけた.実際に,抗Alk抗体による抗体染色により,インスリン産生細胞におけるAlkの発現が確認された.
ショウジョウバエにおけるAlkのリガンドとして分泌性タンパク質であるJebが知られている7).さまざまな組織においてJebの発現を解析したところ,おもに脳神経系において発現していた.さまざまなニューロンにおいて特異的にJebをノックダウンしたところ,コリン作動性ニューロンに特異的なノックダウンにより摂食時にもかかわらずインスリン産生細胞においてFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.実際に,抗Jeb抗体による抗体染色により,Jebはコリン作動性ニューロンにおいて強く発現していること,さらに,Jebを産生するコリン作動性ニューロンはインスリン産生細胞に隣接することが明らかにされた.そこで,コリン作動性ニューロンに由来するJebが実際にインスリン産生細胞に作用するかどうか確認するため,コリン作動性ニューロンにおいて特異的にJebを過剰発現させたところ,飢餓によるFoxOの核への局在およびdilp5遺伝子の発現の低下は回復した.以上の結果から,コリン作動性ニューロンから分泌されたJebがインスリン産生細胞に作用し,受容体であるAlkを介してFoxOの局在およびdilp5遺伝子の発現を制御していることが明らかにされた(図1b).
インスリン産生細胞においてdilp5遺伝子の発現を制御する栄養はどのような情報であり,また,どの組織あるいは細胞において感知されているのだろうか.ショウジョウバエのえさに含まれる成分を解析したところ,酵母がdilp5遺伝子の発現に必要かつ十分であった.酵母はショウジョウバエのえさにおけるおもなアミノ酸源であることから,dilp5遺伝子の発現はアミノ酸シグナルにより制御されていると予想された.そこで,アミノ酸シグナル応答において重要な役割をはたすことの知られるTORシグナル伝達経路に着目した.さまざまな組織においてTORシグナル伝達経路の構成タンパク質をノックダウンしたところ,グリア細胞におけるノックダウンによりdilp5遺伝子の発現が顕著に低下した.さらに,どのグリア細胞が栄養の感知に重要かを調べた結果,血液脳関門を形成するsubperineurial gliaとよばれるグリア細胞が重要であることがわかった.この結果は,脳の表層をとりかこむ血液脳関門において栄養の情報が感知され,なんらかの栄養シグナルがコリン作動性ニューロンに伝達されることにより,インスリン産生細胞においてJebおよびAlkを介しdilp5遺伝子の発現が制御されることが示唆された.
インスリン産生細胞以外で産生されるDILPであるDILP6に着目した.最近,DILP6は血液脳関門から脳に局所的に分泌され,脳における神経幹細胞の分裂の開始を栄養に依存して制御していることが明らかにされた8,9).実際にdilp6遺伝子の発現のパターンを解析したところ,摂食時には血液脳関門において高く発現していたが,飢餓時には発現は顕著に低くなっていた.そこで,血液脳関門から分泌されるDILP6が栄養シグナルとしてコリン作動性ニューロンに作用すると予想した.DILPの下流においてはたらくインスリン様受容体を含むインスリン/IGFシグナル伝達経路の構成タンパク質をコリン作動性ニューロンにおいて特異的にノックダウンしたところ,dilp5遺伝子の発現が顕著に低下した.このとき,コリン作動性ニューロンにおいて特異的にJebを過剰発現させたところ,dilp5遺伝子の発現の低下は回復した.さらに,血液脳関門において特異的にDILP6をノックダウンしたところ,摂食時にもかかわらずインスリン産生細胞においてFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.逆に,血液脳関門において特異的にDILP6を過剰発現させたところ,飢餓によるFoxOの核への局在およびdilp5遺伝子の発現の低下は回復した.ここで重要なのは,さきに述べたとおり,インスリン産生細胞において特異的にインスリン様受容体をノックダウンしてもdilp5遺伝子の発現はわずかしか低下しなかったことである.以上の結果から,血液脳関門から分泌されたDILP6が栄養シグナルとしてコリン作動性ニューロンに作用することにより,JebおよびAlkを介してインスリン産生細胞においてdilp5遺伝子の発現が制御されることが明らかにされた(図1b).
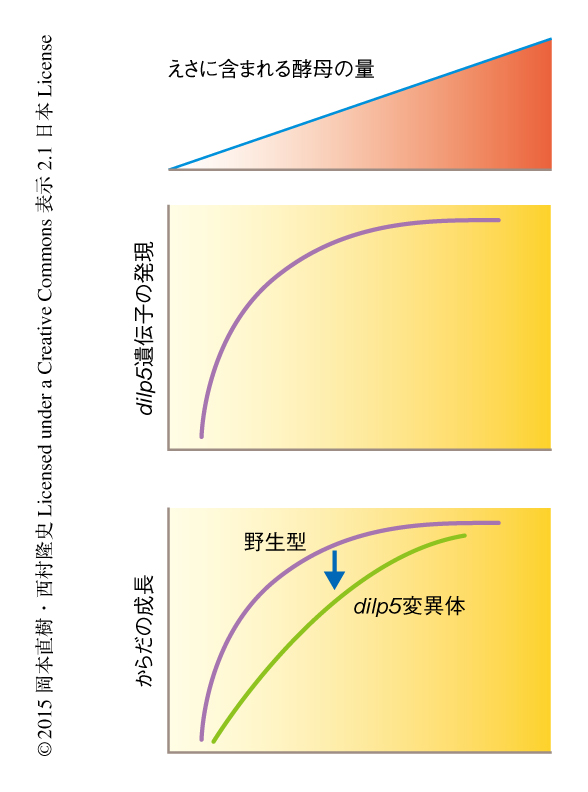
栄養シグナルとしてはたらくdilp6遺伝子の発現はどのような分子機構により栄養に依存して制御されているのだろうか.さきに述べたように,dilp5遺伝子の発現においては血液脳関門におけるアミノ酸シグナル応答が必要であった.そこで,グリア細胞において特異的にTORシグナル伝達経路の構成タンパク質をノックダウンしたところ,dilp6遺伝子の発現は顕著に低下した.また,グリア細胞において特異的にインスリン様受容体を含むインスリン/IGFシグナル伝達経路の構成タンパク質をノックダウンした場合も同様に,dilp6遺伝子の発現は顕著に低下した.血液脳関門は循環する体液に接することから,血液脳関門におけるdilp6遺伝子の発現は体液のアミノ酸およびDILPにより制御されていることが予想された.そこで,幼虫期においてDILPのおもな産生細胞であるインスリン産生細胞を遺伝学的に除去したところ,dilp6遺伝子の発現は顕著に低下した.同様に,インスリン産生細胞において発現するDILPの遺伝子であるdilp2遺伝子,dilp3遺伝子,dilp5遺伝子の三重変異体においてもdilp6遺伝子の発現は顕著に低下した.一方,dilp2 dilp3 dilp5三重変異体において脂肪体とよばれる組織にてDILP5を過剰発現させたところ,dilp6遺伝子の発現の低下は回復した.これらの結果は,体液に分泌されたDILPが脳の表層の血液脳関門に作用し,dilp6遺伝子の発現を制御することを示した.つまり,インスリン産生細胞から体液に分泌されたDILPがアミノ酸シグナルと協調的に血液脳関門におけるdilp6遺伝子の発現を制御し,最終的にインスリン産生細胞におけるdilp5遺伝子の発現が誘導されるという,組織あるいは細胞のあいだの相互作用を介した正のフィードバックの存在することを意味した(図1b).実際に,ショウジョウバエのえさにおけるおもなアミノ酸源である酵母の量を変化させdilp5遺伝子の発現を解析したところ,酵母の量に依存して正のフィードバックにおいて典型的なシグモイド様の非線形曲線が得られた.さらに,えさに含まれる酵母の量を変化させてdilp5遺伝子に変異をもつ幼虫の成長率および発生のタイミングを解析したところ,正のフィードバックによりdilp5遺伝子の発現が維持される低栄養条件において,幼虫の成長率の低下および発生タイミングの遅れが顕著に観察された.この結果は,正のフィードバックによるdilp5遺伝子の発現の誘導が低栄養状態における幼虫の成長の維持に重要であることを強く示した(図2).
多細胞生物における恒常性は環境条件の変化に応じて柔軟に適応し制御されている.筆者らは,この研究により,ショウジョウバエを用いて恒常性の維持に必須のホルモンであるインスリン様ペプチドの産生にかかわるシグナル伝達経路,神経回路,さらには,栄養シグナルの入力機構にいたる,一連の分子機構について明らかにした.また,この複雑な分子機構によりひき起こされる正のフィードバックは,栄養状態の変化に応じてショウジョウバエの幼虫が恒常性を維持するのに重要であることが明らかにされた.しかしながら,インスリン様ペプチドの機能は,遺伝子発現,分泌,体液における活性の制御など,異なるステップにおいて複雑かつ厳密に制御されている.今後,環境の変化に応じたインスリン様ペプチドの機能の制御機構をさらに包括的に理解することにより,生物に備わる恒常性の維持機構の全容がみえてくるかもしれない.
略歴:2009年 名古屋大学大学院理学研究科にて博士号取得,同年 名古屋大学大学院生命農学研究科 研究員,2010年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2015年より米国California大学Riverside校Assistant Project Scientist.
研究テーマ:内分泌系を介した発生および成長の制御機構.
関心事:おいしいアメリカ地ビールの探索.
西村 隆史(Takashi Nishimura)
理化学研究所多細胞システム形成研究センター チームリーダー.
研究室URL:http://www.cdb.riken.jp/gcs/
© 2015 岡本直樹・西村隆史 Licensed under CC 表示 2.1 日本
(理化学研究所多細胞システム形成研究センター 成長シグナル研究チーム)
email:岡本直樹,西村隆史
DOI: 10.7875/first.author.2015.129
Signaling from glia and cholinergic neurons controls nutrient-dependent production of an insulin-like peptide for Drosophila body growth.
Naoki Okamoto, Takashi Nishimura
Developmental Cell, 35, 295-310 (2015)
要 約
すべての多細胞生物において,その恒常性は環境に応じて柔軟に変化し,発育の段階ごとに適切に制御されている.この研究において,ショウジョウバエの幼虫において恒常性の維持に必須のホルモンであるインスリン様ペプチドDILPが栄養に依存して産生される分子機構が明らかにされた.DILPは脳にあるインスリン産生細胞とよばれる神経内分泌細胞においておもに産生される.DILPをコードする遺伝子のうちdilp5遺伝子の発現は栄養状態の変化により顕著に変化することが知られていたが,dilp5遺伝子の発現は脳のグリア細胞およびコリン作動性ニューロンを介した栄養シグナルのリレーにより制御されていた.さらに,dilp5遺伝子の発現はアミノ酸シグナルおよびインスリン産生細胞から体液に分泌されたDILPが引き金になり,正のフィードバックにより増強されていた.この正のフィードバックによるdilp5遺伝子の発現の誘導は低栄養状態における幼虫の成長の維持に重要であった.以上の結果から,環境の変化に応じ組織あるいは細胞のあいだの相互作用を介して生体が恒常性を維持する機構の一端が明らかにされた.
はじめに
多細胞生物の発生および成長の過程は組織あるいは時期に特異的な遺伝子発現の変化により内在的にプログラムされている.その一方で,多細胞生物はおのおのの発育の段階においてさまざまな環境の変化に応じて柔軟に恒常性を維持するプログラムをもつ.この恒常性の維持の柔軟性は生物の生存にとり不可欠な特性である.しかしながら,環境の変化に依存して恒常性を維持する分子基盤については不明な点が多く残されている.
個体において恒常性の維持を制御する因子としてもっともよく研究されているのがインスリン様ペプチドである1).これは,インスリンに構造のよく似たホルモンの総称であり,脊椎動物ではインスリンのほかIGF(insulin-like growth factor,インスリン様成長因子)がよく知られている.インスリン様ペプチドは昆虫をはじめとする無脊椎動物にも広く存在し,構造および機能とも高度に保存されている1).この研究においては,分子遺伝学的な解析にくわえ,生理的あるいは内分泌学的な解析,神経学的な解析の適応が可能なモデル生物であるショウジョウバエを用いて,組織あるいは細胞のあいだの相互作用による恒常性の維持機構の基本原理を明らかにすることをめざした.
ショウジョウバエのもつインスリン様ペプチドであるDILPは,おもにインスリン産生細胞とよばれる脳間部にある数対の神経内分泌細胞において産生され,摂食にともなう栄養により体液に分泌される.分泌されたDILPは末梢組織のもつインスリン様受容体に作用してインスリン/IGFシグナル伝達経路を活性化させ,その結果,からだおよび組織の成長,糖代謝,エネルギー代謝を制御する2)(図1a).インスリン産生細胞を除去したショウジョウバエは,血糖値の上昇にくわえ,からだの大きさのいちじるしい減少および発生の遅延を示す3).したがって,インスリン産生細胞において産生されるDILPは,栄養状態の変化に応じて成長および代謝を直接的に制御する非常に重要なホルモンであるといえる.しかしながら,栄養状態の変化がどのようにインスリン産生細胞において感知されDILPの産生が制御されているのかについては,ほとんど明らかにされていない.
ショウジョウバエのインスリン産生細胞においてはDILPをコードする遺伝子として,おもにdilp2遺伝子,dilp3,dilp5遺伝子が発現するが,これらのうち,dilp5遺伝子の発現は栄養に依存して顕著に変化することが知られている4).すなわち,dilp5遺伝子の発現は摂食時に上昇し飢餓時に顕著に低下する.そこで,dilp5遺伝子の発現が栄養に依存して制御される分子機構に着目し,栄養状態の変化に応じた恒常性の維持機構の解明をめざした.筆者らは,これまでの研究により,dilp5遺伝子の発現は転写因子であるDac-Ey複合体により直接的に誘導されることを明らかにしてきた5).しかしながら,どのような分子機構により栄養に依存してDac-Ey複合体の活性が制御されdilp5遺伝子の発現が制御されているのかについては不明であった.
1.dilp5遺伝子の発現は転写因子FoxOの局在の変化により制御される
インスリン産生細胞におけるDacおよびEyの発現および局在について解析したところ,栄養に依存して制御されてはいなかった.つまり,栄養に依存して発現あるいは活性の変動するDacおよびEy以外の因子がdilp5遺伝子の栄養に依存した発現の制御に関与している可能性が示唆された.
栄養に依存してその局在および活性の変化することの知られる進化的に保存された転写因子であるFoxOに着目した6).インスリン産生細胞におけるFoxOの機能について解析したところ,1)FoxOはインスリン産生細胞において強く発現し,栄養に依存して局在が変化すること(摂食時は細胞質,飢餓時は核に局在),2)インスリン産生細胞に特異的なFoxOのノックダウンにより飢餓によるdilp5遺伝子の発現の低下が抑制されること,3)インスリン産生細胞に特異的なFoxOの過剰発現によりdilp5遺伝子の発現が顕著に低下すること,4)ショウジョウバエに由来する培養細胞株であるS2細胞を用いたレポーターアッセイにおいて,Dac-Ey複合体により誘導されるdilp5遺伝子の発現がFoxOの存在下では抑制されること,が見い出された.以上の結果は,FoxOがDac-Ey複合体によるdilp5遺伝子の発現の誘導を栄養に依存して抑制する転写因子として機能することを強く示唆した.
FoxOはインスリン産生細胞においてどのような分子機構によりDac-Ey複合体によるdilp5遺伝子の発現の誘導を抑制するのだろうか.免疫沈降実験の結果,FoxOはEyのもつペアードドメインと直接的に結合した.ペアードドメインはEyがDacと直接的に結合するのに必要であることから5),FoxOがEyとDacとの結合を競合的に阻害することが予想された.Eyに対するFoxOとDacとのあいだの競合実験の結果,FoxOはDacより強い親和性をもってEyと結合すること,Dac-Ey複合体は活性型FoxO(核局在型FoxO)の存在下では形成されなくなることが明らかにされた.以上の結果は,飢餓時においてFoxOは核に局在しEyと直接的に複合体を形成することにより,Dac-Ey複合体によるdilp5遺伝子の発現の誘導を阻害することを示した.逆に,摂食時においてFoxOは細胞質に局在するため,Dac-Ey複合体によりdilp5遺伝子の発現が誘導されることが明らかにされた.
2.インスリン産生細胞におけるFoxOの局在は受容体チロシンキナーゼAlkを介し分泌性タンパク質Jebにより制御される
インスリン産生細胞におけるFoxOの局在を制御する分子機構を解析した.FoxOの核への局在はPI3Kシグナル伝達経路の構成タンパク質のひとつであるAktによるリン酸化により負に制御されることが知られている6).そこで,インスリン産生細胞において特異的にAktをはじめとするPI3Kシグナル伝達経路の構成タンパク質をノックダウンしたところ,FoxOは摂食時にもかかわらず核に局在し,dilp5遺伝子の発現は顕著に低下した.上流の受容体の探索するため,受容体チロシンキナーゼファミリーをインスリン産生細胞に特異的な網羅的なノックダウンによりスクリーニングした.その結果,AlkのノックダウンによりFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.このとき,DILPの受容体であるインスリン様受容体をインスリン産生細胞において特異的にノックダウンしてもdilp5遺伝子の発現はわずかしか低下しなかった.また,インスリン産生細胞において特異的にAlkおよびFoxOをダブルノックダウンしたところ,Alkのノックダウンによるdilp5遺伝子の発現の低下は回復した.以上の結果から,インスリン産生細胞においてFoxOの局在とdilp5遺伝子の発現を制御するおもな上流の受容体はAlkであると結論づけた.実際に,抗Alk抗体による抗体染色により,インスリン産生細胞におけるAlkの発現が確認された.
ショウジョウバエにおけるAlkのリガンドとして分泌性タンパク質であるJebが知られている7).さまざまな組織においてJebの発現を解析したところ,おもに脳神経系において発現していた.さまざまなニューロンにおいて特異的にJebをノックダウンしたところ,コリン作動性ニューロンに特異的なノックダウンにより摂食時にもかかわらずインスリン産生細胞においてFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.実際に,抗Jeb抗体による抗体染色により,Jebはコリン作動性ニューロンにおいて強く発現していること,さらに,Jebを産生するコリン作動性ニューロンはインスリン産生細胞に隣接することが明らかにされた.そこで,コリン作動性ニューロンに由来するJebが実際にインスリン産生細胞に作用するかどうか確認するため,コリン作動性ニューロンにおいて特異的にJebを過剰発現させたところ,飢餓によるFoxOの核への局在およびdilp5遺伝子の発現の低下は回復した.以上の結果から,コリン作動性ニューロンから分泌されたJebがインスリン産生細胞に作用し,受容体であるAlkを介してFoxOの局在およびdilp5遺伝子の発現を制御していることが明らかにされた(図1b).
3.グリア細胞に由来するDILP6がインスリン産生細胞におけるFoxOの局在およびdilp5遺伝子の発現を制御する
インスリン産生細胞においてdilp5遺伝子の発現を制御する栄養はどのような情報であり,また,どの組織あるいは細胞において感知されているのだろうか.ショウジョウバエのえさに含まれる成分を解析したところ,酵母がdilp5遺伝子の発現に必要かつ十分であった.酵母はショウジョウバエのえさにおけるおもなアミノ酸源であることから,dilp5遺伝子の発現はアミノ酸シグナルにより制御されていると予想された.そこで,アミノ酸シグナル応答において重要な役割をはたすことの知られるTORシグナル伝達経路に着目した.さまざまな組織においてTORシグナル伝達経路の構成タンパク質をノックダウンしたところ,グリア細胞におけるノックダウンによりdilp5遺伝子の発現が顕著に低下した.さらに,どのグリア細胞が栄養の感知に重要かを調べた結果,血液脳関門を形成するsubperineurial gliaとよばれるグリア細胞が重要であることがわかった.この結果は,脳の表層をとりかこむ血液脳関門において栄養の情報が感知され,なんらかの栄養シグナルがコリン作動性ニューロンに伝達されることにより,インスリン産生細胞においてJebおよびAlkを介しdilp5遺伝子の発現が制御されることが示唆された.
インスリン産生細胞以外で産生されるDILPであるDILP6に着目した.最近,DILP6は血液脳関門から脳に局所的に分泌され,脳における神経幹細胞の分裂の開始を栄養に依存して制御していることが明らかにされた8,9).実際にdilp6遺伝子の発現のパターンを解析したところ,摂食時には血液脳関門において高く発現していたが,飢餓時には発現は顕著に低くなっていた.そこで,血液脳関門から分泌されるDILP6が栄養シグナルとしてコリン作動性ニューロンに作用すると予想した.DILPの下流においてはたらくインスリン様受容体を含むインスリン/IGFシグナル伝達経路の構成タンパク質をコリン作動性ニューロンにおいて特異的にノックダウンしたところ,dilp5遺伝子の発現が顕著に低下した.このとき,コリン作動性ニューロンにおいて特異的にJebを過剰発現させたところ,dilp5遺伝子の発現の低下は回復した.さらに,血液脳関門において特異的にDILP6をノックダウンしたところ,摂食時にもかかわらずインスリン産生細胞においてFoxOは核に局在し,dilp5遺伝子の発現は顕著に低下した.逆に,血液脳関門において特異的にDILP6を過剰発現させたところ,飢餓によるFoxOの核への局在およびdilp5遺伝子の発現の低下は回復した.ここで重要なのは,さきに述べたとおり,インスリン産生細胞において特異的にインスリン様受容体をノックダウンしてもdilp5遺伝子の発現はわずかしか低下しなかったことである.以上の結果から,血液脳関門から分泌されたDILP6が栄養シグナルとしてコリン作動性ニューロンに作用することにより,JebおよびAlkを介してインスリン産生細胞においてdilp5遺伝子の発現が制御されることが明らかにされた(図1b).
4.正のフィードバックによるdilp5遺伝子の発現の誘導が低栄養状態における幼虫の成長に重要である
栄養シグナルとしてはたらくdilp6遺伝子の発現はどのような分子機構により栄養に依存して制御されているのだろうか.さきに述べたように,dilp5遺伝子の発現においては血液脳関門におけるアミノ酸シグナル応答が必要であった.そこで,グリア細胞において特異的にTORシグナル伝達経路の構成タンパク質をノックダウンしたところ,dilp6遺伝子の発現は顕著に低下した.また,グリア細胞において特異的にインスリン様受容体を含むインスリン/IGFシグナル伝達経路の構成タンパク質をノックダウンした場合も同様に,dilp6遺伝子の発現は顕著に低下した.血液脳関門は循環する体液に接することから,血液脳関門におけるdilp6遺伝子の発現は体液のアミノ酸およびDILPにより制御されていることが予想された.そこで,幼虫期においてDILPのおもな産生細胞であるインスリン産生細胞を遺伝学的に除去したところ,dilp6遺伝子の発現は顕著に低下した.同様に,インスリン産生細胞において発現するDILPの遺伝子であるdilp2遺伝子,dilp3遺伝子,dilp5遺伝子の三重変異体においてもdilp6遺伝子の発現は顕著に低下した.一方,dilp2 dilp3 dilp5三重変異体において脂肪体とよばれる組織にてDILP5を過剰発現させたところ,dilp6遺伝子の発現の低下は回復した.これらの結果は,体液に分泌されたDILPが脳の表層の血液脳関門に作用し,dilp6遺伝子の発現を制御することを示した.つまり,インスリン産生細胞から体液に分泌されたDILPがアミノ酸シグナルと協調的に血液脳関門におけるdilp6遺伝子の発現を制御し,最終的にインスリン産生細胞におけるdilp5遺伝子の発現が誘導されるという,組織あるいは細胞のあいだの相互作用を介した正のフィードバックの存在することを意味した(図1b).実際に,ショウジョウバエのえさにおけるおもなアミノ酸源である酵母の量を変化させdilp5遺伝子の発現を解析したところ,酵母の量に依存して正のフィードバックにおいて典型的なシグモイド様の非線形曲線が得られた.さらに,えさに含まれる酵母の量を変化させてdilp5遺伝子に変異をもつ幼虫の成長率および発生のタイミングを解析したところ,正のフィードバックによりdilp5遺伝子の発現が維持される低栄養条件において,幼虫の成長率の低下および発生タイミングの遅れが顕著に観察された.この結果は,正のフィードバックによるdilp5遺伝子の発現の誘導が低栄養状態における幼虫の成長の維持に重要であることを強く示した(図2).
おわりに
多細胞生物における恒常性は環境条件の変化に応じて柔軟に適応し制御されている.筆者らは,この研究により,ショウジョウバエを用いて恒常性の維持に必須のホルモンであるインスリン様ペプチドの産生にかかわるシグナル伝達経路,神経回路,さらには,栄養シグナルの入力機構にいたる,一連の分子機構について明らかにした.また,この複雑な分子機構によりひき起こされる正のフィードバックは,栄養状態の変化に応じてショウジョウバエの幼虫が恒常性を維持するのに重要であることが明らかにされた.しかしながら,インスリン様ペプチドの機能は,遺伝子発現,分泌,体液における活性の制御など,異なるステップにおいて複雑かつ厳密に制御されている.今後,環境の変化に応じたインスリン様ペプチドの機能の制御機構をさらに包括的に理解することにより,生物に備わる恒常性の維持機構の全容がみえてくるかもしれない.
文 献
- Taguchi, A. & White, M. F.: Insulin-like signaling, nutrient homeostasis, and life-span. Annu. Rev. Physiol., 70, 191-212 (2008)[PubMed]
- Edgar, B. A.: How flies get their size: genetics meets physiology. Nat. Rev. Genet., 7, 907-916 (2006)[PubMed]
- Rulifson, E. J., Kim, S. K. & Nusse, R.: Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science, 296, 1118-1120 (2002)[PubMed]
- Ikeya, T., Galic, M., Belawat, P. et al.: Nutrient-dependent expression of insulin-like peptides from neuroendocrine cells in the CNS contributes to growth regulation in Drosophila. Curr. Biol., 12, 1293-1300 (2002)[PubMed]
- Okamoto, N., Nishimori, Y. & Nishimura, T.: Conserved role for the Dachshund protein with Drosophila Pax6 homolog Eyeless in insulin expression. Proc. Natl. Acad. Sci. USA, 109, 2406-2411 (2012)[PubMed]
- Calnan, D. R. & Brunet. A.: The FoxO code. Oncogene, 27, 2276-2288 (2008)[PubMed]
- Palmer, R. H., Vernersson, E., Grabbe, C. et al.: Anaplastic lymphoma kinase: signalling in development and disease. Biochem. J., 420, 345-361 (2009)[PubMed]
- Chell, J. M. & Brand, A. H.: Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell, 143, 1161-1173 (2011)[PubMed]
- Sousa-Nunes, R., Yee, L. L. & Gould, A. P.: Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature, 471, 508-512 (2011)[PubMed]
著者プロフィール
略歴:2009年 名古屋大学大学院理学研究科にて博士号取得,同年 名古屋大学大学院生命農学研究科 研究員,2010年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2015年より米国California大学Riverside校Assistant Project Scientist.
研究テーマ:内分泌系を介した発生および成長の制御機構.
関心事:おいしいアメリカ地ビールの探索.
西村 隆史(Takashi Nishimura)
理化学研究所多細胞システム形成研究センター チームリーダー.
研究室URL:http://www.cdb.riken.jp/gcs/
© 2015 岡本直樹・西村隆史 Licensed under CC 表示 2.1 日本