抗炎症タンパク質Del-1はサルにおいて炎症性の骨吸収を抑制する
前川 知樹
(米国Pennsylvania大学School of Dental Medicine,Department of Microbiology)
email:前川知樹
DOI: 10.7875/first.author.2015.123
DEL-1 restrains osteoclastogenesis and inhibits inflammatory bone loss in nonhuman primates.
Jieun Shin, Tomoki Maekawa, Toshiharu Abe, Evlambia Hajishengallis, Kavita Hosur, Kalyani Pyaram, Ioannis Mitroulis, Triantafyllos Chavakis, George Hajishengallis
Science Translational Medicine, 7, 307ra155 (2015)
Del-1はおもに血管内皮細胞から産生される抗炎症作用をもつタンパク質であり,インテグリン受容体を介して好中球の過度な遊走を阻止している.今回,筆者らは,Del-1の破骨細胞に対する抑制の新しい分子機構を,マウス,サル,ヒトを用いて明らかにした.Del-1はマウスあるいはヒトの細胞から分化させた破骨細胞からも産生され,破骨細胞の分化および骨吸収を抑制した.その分子機構として,Del-1は破骨細胞の分化に機能する転写因子NFATc1を抑制していることが示唆された.さらに,サルの歯周炎モデルにおいて疾患の局所にDel-1を接種したところ,炎症および骨吸収が抑制された.したがって,Del-1は好中球の遊走を阻止することによる炎症の抑制とともに,破骨細胞の分化を抑制することにより炎症および骨吸収を抑制することが明らかにされた.Del-1は歯周病のほか,多発性硬化症など炎症性疾患の治療において新しい標的になる可能性がある.
歯周炎は慢性炎症をともなう歯周結合組織や周囲骨組織の破壊を特徴とする疾患で,動脈硬化症やリウマチ関節症など全身性の疾患へも波及するといわれている1).歯周炎は局所における細菌のバランスの破綻によりひき起こされ,宿主の細菌に対する過度な免疫応答により組織の重度な破壊,破骨細胞の分化,骨吸収がひき起こされる.多種の炎症性細胞がトリガーとなり歯周結合組織の破壊および骨吸収をひき起こすが,とくに大きな役割をもつのが好中球である.筆者らは,好中球の過度の遊走の抑制および付随する破骨細胞による骨吸収の抑制にDel-1を応用することを考えた.
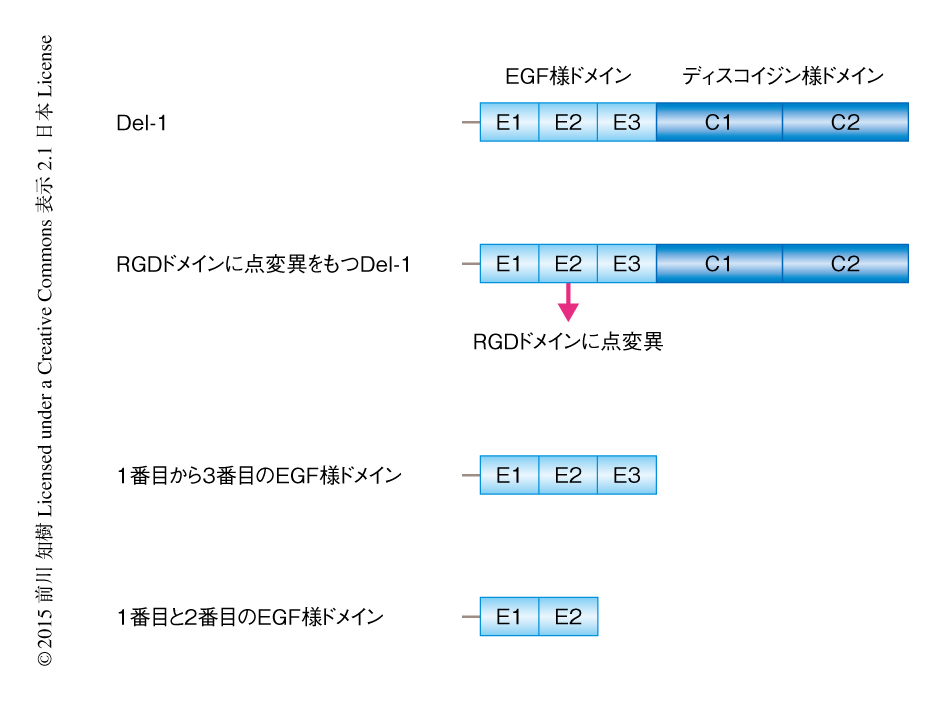
Del-1は循環器の分野において発見されたが2),そののち,自然炎症を抑制し恒常性を維持する機能をもつことが明らかにされた.Del-1はおもに血管内皮細胞が分泌する52 kDaのタンパク質であり,3つのEGF様ドメインおよび2つのディスコイジン様ドメインから構成される(図1).2番目に位置するEGF様ドメインにはRGDモチーフが含まれインテグリン受容体を介して,また,ディスコイジン様ドメインはグリコサミノグリカンおよびホスファチジルセリンを介して,機能すると考えられてきた.しかし近年,Del-1はRGDモチーフに非依存的にインテグリン受容体を介して機能することが明らかにされた.とくに注目されるのは,粘膜や中枢神経系においてDel-1が好中球のもつインテグリンに対し拮抗するため,好中球の血管の外への遊走を阻止し炎症を抑制する機能をもつことである.事実,実験的自己免疫性脳脊髄炎あるいは歯周炎をひき起こしたDel-1ノックアウトマウスにおいては,好中球の組織への過度な遊走および組織の重度な破壊が認められ,それはDel-1の投与により治療が可能であった3).同様に,Del-1をコードする遺伝子が欠損あるいは変異していると炎症性疾患である多発性硬化症やアルツハイマー病に罹患しやすくなることがわかっていた.この研究においては,Del-1を炎症性の骨吸収の治療に応用するという新しい可能性をin vitroおよびin vivoにおいて検討した.
骨を含む歯周結合組織切片を免疫組織染色により解析したところ,Del-1は破骨細胞のマーカーであるカテプシンKおよびTRAPと同じ位置に存在したことから,破骨細胞がDel-1を発現している可能性が考えられた.そこで,マウスの骨髄に由来する破骨前駆細胞を破骨細胞へと分化させてDel-1の発現を解析した結果,遺伝子レベルおよびタンパク質レベルにて,破骨細胞において破骨前駆細胞の100倍近いDel-1の発現が認められた.さらに,破骨細胞の機能活性のマーカーであるNFATc1,CD51/CD61,カテプシンKの発現も上昇していた.同様に,ヒトのCD14陽性単球から分化させた破骨細胞においても高いDel-1の発現が認められた.そこで,Del-1は破骨細胞の分化を抑制する新規のタンパク質ではないかと考えた.
破骨前駆細胞であるRaw264.7細胞においてDel-1をノックダウンしたところ,ノックダウンしていないときと比べ破骨細胞への分化が容易に誘導され,NFATc1,カテプシンK,TRAPの発現も有意に高かった.また,カルシウムプレートを用いた骨吸収の活性の試験において,Del-1のノックダウンにより破骨細胞のもつ骨吸収の活性も上昇した.さらに,Del-1の添加により破骨細胞による骨吸収が抑制された.しかし,カルシウムプレートの吸収はDel-1により破骨細胞の分化が抑制されてその数が減少したことによるためで,骨吸収の活性が低下したからではないのではという疑問が生じた.そこで,Del-1が破骨細胞の分化におよぼす影響,および,骨吸収の活性におよぼす影響のそれぞれを検討するため,Raw264.7細胞にRANKLおよびDel-1を添加し破骨細胞への分化を測定する,および,分化した破骨細胞をカルシウムプレートに播種したのちDel-1を添加し骨吸収の活性を測定する,という方法を用いた.その結果,Del-1は破骨細胞への分化能と骨吸収能の2つに対する抑制効果をもつことが明らかにされた.
転写因子であるNFATc1に応答する配列をRaw264.7細胞に組み込んでレポーターアッセイを行ったところ,Del-1をノックダウンしたRaw264.7細胞においてNFATc1の発現が有意に上昇していた.じつはすでに,破骨前駆細胞の表面にはMac-1インテグリン(CD11b/CD18)が発現しており,Mac-1受容体はNFATc1を抑制することが明らかにされている4).また近年,筆者らの研究により,Del-1はMac-1インテグリンと結合することが明らかにされている5).この現象を確認するため,Raw264.7細胞においてCD11a,CD11b,CD18をノックダウンしてDel-1を添加すると,CD11bおよびCD18をノックダウンした場合にはDel-1の作用は減弱したが,CD11aのノックダウンはなんら影響しなかった.したがって,Del-1はMac-1インテグリンを介してNFATc1を抑制することが示唆された.
破骨前駆細胞は表面にαvβ3インテグリン受容体を発現しており,そこからのシグナルが破骨細胞への分化能および骨吸収能を制御している.一方,αvβ3インテグリン受容体のブロック抗体やRGDペプチドはその機能を阻害する6).Del-1の2番目に位置するEGF様ドメインはRGDモチーフをもち(図1),αvβ3インテグリン受容体を介した破骨細胞の抑制において重要な役割をはたす2).点変異を導入したRGEモチーフをもつDel-1(図1)は,野生型のDel-1と比較し破骨細胞の抑制が減弱していたが,骨吸収を抑制する効果は高く,マウスの歯周炎モデルに投与して骨吸収および破骨細胞の数を測定したところ,強い効果を保っていた.したがって,αvβ3インテグリン受容体を介した経路のほかにも,破骨細胞の分化および骨吸収を抑制する機構のあることが予想された.
マウスの口腔において実験的に歯周炎を引き起こすことのできるマウス歯牙結紮モデルを用いて,Del-1による骨吸収の抑制について検討した.炎症がひき起こされた部位に,野生型のDel-1,点変異を導入したRGEモチーフをもつDel-1,Del-1の1番目から3番目のEGF様ドメイン,Del-1の1番目と2番目のEGF様ドメイン,を接種したところ(図1),野生型のDel-1および点変異をもつDel-1は歯周炎による骨吸収を有意に抑制したが,1番目から3番目のEGF様ドメインおよび1番目と2番目のEGF様ドメインはその機能を失っていた.以上の結果から,ディスコイジン様ドメインもEGFドメインと同様に骨吸収の抑制において重要な役割をもち,破骨細胞の分化および骨吸収の抑制を発揮するために必要不可欠であることが明らかになった.1番目からの3番目のEGF様ドメインを高濃度で接種すると骨吸収が抑制されたが,1番目と2番目のEGF様ドメインの接種では骨吸収の抑制は認められなかった.このことから,3番目のEGF様ドメインに骨吸収を抑制する機能があると考えられたが,じつはすでに,3番目のEGF様ドメインは強い抗炎症作用をもつことが明らかにされていた5,7).つまり,3番目のEGF様ドメインが組織への好中球の過度な遊走を抑制することにより炎症を抑制し,破骨細胞の活性を間接的にさまたげていると考えられた.
カニクイザルの歯牙に絹糸を結紮することにより実験的な歯周炎をひき起こし,結紮の3日後からDel-1の接種を開始し,週に2回,6週間にわたり接種した.Del-1の接種により歯周炎の炎症は抑制され,骨吸収の有意な抑制が認められた.さらに,組織切片における破骨細胞や炎症性細胞の数にも有意な減少が認められた.歯肉溝からの浸出液を高感度サイトカインアッセイにより測定したところ,Del-1の接種によりTNF,インターロイキン1β,インターロイキン17などの炎症性サイトカインや,RANKLの発現の低下が認められた.また,Del-1の接種によりRANKLのインヒビターであるオステオプロテジェリンの発現が有意に上昇した.免疫組織染色による解析においても,サイトカインアッセイの結果と同様に,Del-1の接種により各種の炎症性サイトカインおよびRANKLの発現が低下しオステオプロテジェリンの発現の上昇が認められた.
この研究により,Del-1において,好中球の遊走の抑制による炎症の抑制とは別に,新たに直接的な破骨細胞の分化の抑制および活性の抑制という機能のあることが明らかにされた.Del-1が同定されてからまだ数年だが7),疾患への応用の可能性はまだまだ大きいと考えられる.
歯周炎は慢性炎症をともなう歯周結合組織および周囲骨組織の破壊を特徴とする疾患であり,人類史上,もっとも感染者の多い疾患とされている.また,全身への増悪的な波及も示唆されているが,病因になる細菌や病態の形成の複雑さから有効な治療法は確立されていない.今回,ヒトに近いサルを用いて炎症性の骨吸収のモデルを作製し,Del-1の応用について検討するというトランスレーショナルリサーチを行った.実験的に歯周炎をひき起こし解析したところ,炎症の部位における細菌のバランスや歯周病の指標はヒトの歯周炎とほぼ同様であった.Del-1に有効な効果が認められたことから,ヒトにおける治療に応用できる可能性が示唆された.このDel-1のユニークな炎症および骨吸収の抑制の機能は,今後,歯周炎のみならず多発性硬化症や強直性脊椎炎などほかの炎症性疾患の治療に応用できることが予想される.
略歴:2011年 新潟大学大学院医歯学総合研究科 修了,2012年 米国Pennsylvania大学School of Dental Medicine博士研究員を経て,2015年より新潟大学大学院医歯学総合研究科 助教.
研究テーマ:Del-1による炎症の制御およびその応用.
抱負:Del-1による難治性疾患の治療の基盤を構築したい.
© 2015 前川 知樹 Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学School of Dental Medicine,Department of Microbiology)
email:前川知樹
DOI: 10.7875/first.author.2015.123
DEL-1 restrains osteoclastogenesis and inhibits inflammatory bone loss in nonhuman primates.
Jieun Shin, Tomoki Maekawa, Toshiharu Abe, Evlambia Hajishengallis, Kavita Hosur, Kalyani Pyaram, Ioannis Mitroulis, Triantafyllos Chavakis, George Hajishengallis
Science Translational Medicine, 7, 307ra155 (2015)
要 約
Del-1はおもに血管内皮細胞から産生される抗炎症作用をもつタンパク質であり,インテグリン受容体を介して好中球の過度な遊走を阻止している.今回,筆者らは,Del-1の破骨細胞に対する抑制の新しい分子機構を,マウス,サル,ヒトを用いて明らかにした.Del-1はマウスあるいはヒトの細胞から分化させた破骨細胞からも産生され,破骨細胞の分化および骨吸収を抑制した.その分子機構として,Del-1は破骨細胞の分化に機能する転写因子NFATc1を抑制していることが示唆された.さらに,サルの歯周炎モデルにおいて疾患の局所にDel-1を接種したところ,炎症および骨吸収が抑制された.したがって,Del-1は好中球の遊走を阻止することによる炎症の抑制とともに,破骨細胞の分化を抑制することにより炎症および骨吸収を抑制することが明らかにされた.Del-1は歯周病のほか,多発性硬化症など炎症性疾患の治療において新しい標的になる可能性がある.
はじめに
歯周炎は慢性炎症をともなう歯周結合組織や周囲骨組織の破壊を特徴とする疾患で,動脈硬化症やリウマチ関節症など全身性の疾患へも波及するといわれている1).歯周炎は局所における細菌のバランスの破綻によりひき起こされ,宿主の細菌に対する過度な免疫応答により組織の重度な破壊,破骨細胞の分化,骨吸収がひき起こされる.多種の炎症性細胞がトリガーとなり歯周結合組織の破壊および骨吸収をひき起こすが,とくに大きな役割をもつのが好中球である.筆者らは,好中球の過度の遊走の抑制および付随する破骨細胞による骨吸収の抑制にDel-1を応用することを考えた.
Del-1は循環器の分野において発見されたが2),そののち,自然炎症を抑制し恒常性を維持する機能をもつことが明らかにされた.Del-1はおもに血管内皮細胞が分泌する52 kDaのタンパク質であり,3つのEGF様ドメインおよび2つのディスコイジン様ドメインから構成される(図1).2番目に位置するEGF様ドメインにはRGDモチーフが含まれインテグリン受容体を介して,また,ディスコイジン様ドメインはグリコサミノグリカンおよびホスファチジルセリンを介して,機能すると考えられてきた.しかし近年,Del-1はRGDモチーフに非依存的にインテグリン受容体を介して機能することが明らかにされた.とくに注目されるのは,粘膜や中枢神経系においてDel-1が好中球のもつインテグリンに対し拮抗するため,好中球の血管の外への遊走を阻止し炎症を抑制する機能をもつことである.事実,実験的自己免疫性脳脊髄炎あるいは歯周炎をひき起こしたDel-1ノックアウトマウスにおいては,好中球の組織への過度な遊走および組織の重度な破壊が認められ,それはDel-1の投与により治療が可能であった3).同様に,Del-1をコードする遺伝子が欠損あるいは変異していると炎症性疾患である多発性硬化症やアルツハイマー病に罹患しやすくなることがわかっていた.この研究においては,Del-1を炎症性の骨吸収の治療に応用するという新しい可能性をin vitroおよびin vivoにおいて検討した.
1.破骨細胞におけるDel-1の発現および制御
骨を含む歯周結合組織切片を免疫組織染色により解析したところ,Del-1は破骨細胞のマーカーであるカテプシンKおよびTRAPと同じ位置に存在したことから,破骨細胞がDel-1を発現している可能性が考えられた.そこで,マウスの骨髄に由来する破骨前駆細胞を破骨細胞へと分化させてDel-1の発現を解析した結果,遺伝子レベルおよびタンパク質レベルにて,破骨細胞において破骨前駆細胞の100倍近いDel-1の発現が認められた.さらに,破骨細胞の機能活性のマーカーであるNFATc1,CD51/CD61,カテプシンKの発現も上昇していた.同様に,ヒトのCD14陽性単球から分化させた破骨細胞においても高いDel-1の発現が認められた.そこで,Del-1は破骨細胞の分化を抑制する新規のタンパク質ではないかと考えた.
破骨前駆細胞であるRaw264.7細胞においてDel-1をノックダウンしたところ,ノックダウンしていないときと比べ破骨細胞への分化が容易に誘導され,NFATc1,カテプシンK,TRAPの発現も有意に高かった.また,カルシウムプレートを用いた骨吸収の活性の試験において,Del-1のノックダウンにより破骨細胞のもつ骨吸収の活性も上昇した.さらに,Del-1の添加により破骨細胞による骨吸収が抑制された.しかし,カルシウムプレートの吸収はDel-1により破骨細胞の分化が抑制されてその数が減少したことによるためで,骨吸収の活性が低下したからではないのではという疑問が生じた.そこで,Del-1が破骨細胞の分化におよぼす影響,および,骨吸収の活性におよぼす影響のそれぞれを検討するため,Raw264.7細胞にRANKLおよびDel-1を添加し破骨細胞への分化を測定する,および,分化した破骨細胞をカルシウムプレートに播種したのちDel-1を添加し骨吸収の活性を測定する,という方法を用いた.その結果,Del-1は破骨細胞への分化能と骨吸収能の2つに対する抑制効果をもつことが明らかにされた.
転写因子であるNFATc1に応答する配列をRaw264.7細胞に組み込んでレポーターアッセイを行ったところ,Del-1をノックダウンしたRaw264.7細胞においてNFATc1の発現が有意に上昇していた.じつはすでに,破骨前駆細胞の表面にはMac-1インテグリン(CD11b/CD18)が発現しており,Mac-1受容体はNFATc1を抑制することが明らかにされている4).また近年,筆者らの研究により,Del-1はMac-1インテグリンと結合することが明らかにされている5).この現象を確認するため,Raw264.7細胞においてCD11a,CD11b,CD18をノックダウンしてDel-1を添加すると,CD11bおよびCD18をノックダウンした場合にはDel-1の作用は減弱したが,CD11aのノックダウンはなんら影響しなかった.したがって,Del-1はMac-1インテグリンを介してNFATc1を抑制することが示唆された.
2.Del-1のどのドメインが破骨細胞の抑制において重要な役割をもつか
破骨前駆細胞は表面にαvβ3インテグリン受容体を発現しており,そこからのシグナルが破骨細胞への分化能および骨吸収能を制御している.一方,αvβ3インテグリン受容体のブロック抗体やRGDペプチドはその機能を阻害する6).Del-1の2番目に位置するEGF様ドメインはRGDモチーフをもち(図1),αvβ3インテグリン受容体を介した破骨細胞の抑制において重要な役割をはたす2).点変異を導入したRGEモチーフをもつDel-1(図1)は,野生型のDel-1と比較し破骨細胞の抑制が減弱していたが,骨吸収を抑制する効果は高く,マウスの歯周炎モデルに投与して骨吸収および破骨細胞の数を測定したところ,強い効果を保っていた.したがって,αvβ3インテグリン受容体を介した経路のほかにも,破骨細胞の分化および骨吸収を抑制する機構のあることが予想された.
3.Del-1はマウスにおいて骨吸収を抑制する
マウスの口腔において実験的に歯周炎を引き起こすことのできるマウス歯牙結紮モデルを用いて,Del-1による骨吸収の抑制について検討した.炎症がひき起こされた部位に,野生型のDel-1,点変異を導入したRGEモチーフをもつDel-1,Del-1の1番目から3番目のEGF様ドメイン,Del-1の1番目と2番目のEGF様ドメイン,を接種したところ(図1),野生型のDel-1および点変異をもつDel-1は歯周炎による骨吸収を有意に抑制したが,1番目から3番目のEGF様ドメインおよび1番目と2番目のEGF様ドメインはその機能を失っていた.以上の結果から,ディスコイジン様ドメインもEGFドメインと同様に骨吸収の抑制において重要な役割をもち,破骨細胞の分化および骨吸収の抑制を発揮するために必要不可欠であることが明らかになった.1番目からの3番目のEGF様ドメインを高濃度で接種すると骨吸収が抑制されたが,1番目と2番目のEGF様ドメインの接種では骨吸収の抑制は認められなかった.このことから,3番目のEGF様ドメインに骨吸収を抑制する機能があると考えられたが,じつはすでに,3番目のEGF様ドメインは強い抗炎症作用をもつことが明らかにされていた5,7).つまり,3番目のEGF様ドメインが組織への好中球の過度な遊走を抑制することにより炎症を抑制し,破骨細胞の活性を間接的にさまたげていると考えられた.
4.Del-1の接種はサルにおいて歯周炎を抑制する
カニクイザルの歯牙に絹糸を結紮することにより実験的な歯周炎をひき起こし,結紮の3日後からDel-1の接種を開始し,週に2回,6週間にわたり接種した.Del-1の接種により歯周炎の炎症は抑制され,骨吸収の有意な抑制が認められた.さらに,組織切片における破骨細胞や炎症性細胞の数にも有意な減少が認められた.歯肉溝からの浸出液を高感度サイトカインアッセイにより測定したところ,Del-1の接種によりTNF,インターロイキン1β,インターロイキン17などの炎症性サイトカインや,RANKLの発現の低下が認められた.また,Del-1の接種によりRANKLのインヒビターであるオステオプロテジェリンの発現が有意に上昇した.免疫組織染色による解析においても,サイトカインアッセイの結果と同様に,Del-1の接種により各種の炎症性サイトカインおよびRANKLの発現が低下しオステオプロテジェリンの発現の上昇が認められた.
おわりに
この研究により,Del-1において,好中球の遊走の抑制による炎症の抑制とは別に,新たに直接的な破骨細胞の分化の抑制および活性の抑制という機能のあることが明らかにされた.Del-1が同定されてからまだ数年だが7),疾患への応用の可能性はまだまだ大きいと考えられる.
歯周炎は慢性炎症をともなう歯周結合組織および周囲骨組織の破壊を特徴とする疾患であり,人類史上,もっとも感染者の多い疾患とされている.また,全身への増悪的な波及も示唆されているが,病因になる細菌や病態の形成の複雑さから有効な治療法は確立されていない.今回,ヒトに近いサルを用いて炎症性の骨吸収のモデルを作製し,Del-1の応用について検討するというトランスレーショナルリサーチを行った.実験的に歯周炎をひき起こし解析したところ,炎症の部位における細菌のバランスや歯周病の指標はヒトの歯周炎とほぼ同様であった.Del-1に有効な効果が認められたことから,ヒトにおける治療に応用できる可能性が示唆された.このDel-1のユニークな炎症および骨吸収の抑制の機能は,今後,歯周炎のみならず多発性硬化症や強直性脊椎炎などほかの炎症性疾患の治療に応用できることが予想される.
文 献
- Hajishengallis, G.: Periodontitis: from microbial immune subversion to systemic inflammation. Nat. Rev. Immunol., 15, 30-44 (2015)[PubMed]
- Hidai, C., Zupancic, T., Penta, K. et al.: Cloning and characterization of developmental endothelial locus-1: an embryonic endothelial cell protein that binds the αvβ3 integrin receptor. Genes Dev., 12, 21-33 (1998)[PubMed]
- Eskan, M. A., Jotwani, R., Abe, T. et al.: The leukocyte integrin antagonist Del-1 inhibits IL-17-mediated inflammatory bone loss. Nat. Immunol., 13, 465-473 (2012)[PubMed]
- Park-Min, K. H., Lee, E. Y., Moskowitz, M. K. et al.: Negative regulation of osteoclast precursor differentiation by CD11b and β2 integrin-B-cell lymphoma 6 signaling. J. Bone Miner. Res., 28, 135-149 (2013)[PubMed]
- Mitroulis, I., Kang, Y. Y., Gahmberg, C. G. et al.: Developmental endothelial locus-1 attenuates complement-dependent phagocytosis through inhibition of Mac-1-integrin. Thromb. Haemost., 111, 781-1006 (2014)[PubMed]
- Nakamura, I., Duong, L. T., Rodan, S. B. et al.: Involvement of αvβ3 integrins in osteoclast function. J. Bone Miner. Metab., 25, 337-344 (2007)[PubMed]
- Choi, E. Y., Chavakis, E., Czabanka, M. A. et al.: Del-1, an endogenous leukocyte-endothelial adhesion inhibitor, limits inflammatory cell recruitment. Science, 322, 1101-1104 (2008)[PubMed]
著者プロフィール
略歴:2011年 新潟大学大学院医歯学総合研究科 修了,2012年 米国Pennsylvania大学School of Dental Medicine博士研究員を経て,2015年より新潟大学大学院医歯学総合研究科 助教.
研究テーマ:Del-1による炎症の制御およびその応用.
抱負:Del-1による難治性疾患の治療の基盤を構築したい.
© 2015 前川 知樹 Licensed under CC 表示 2.1 日本