精子カルシニューリンはオスの生殖能に必須である
宮田治彦・伊川正人
(大阪大学微生物病研究所 遺伝情報実験センター遺伝子機能解析分野)
email:宮田治彦,伊川正人
DOI: 10.7875/first.author.2015.121
Sperm calcineurin inhibition prevents mouse fertility with implications for male contraceptive.
Haruhiko Miyata, Yuhkoh Satouh, Daisuke Mashiko, Masanaga Muto, Kaori Nozawa, Kogiku Shiba, Yoshitaka Fujihara, Ayako Isotani, Kazuo Inaba, Masahito Ikawa
Science, 350, 442-445 (2015)
カルシニューリンはさまざまな組織で発現する脱リン酸化酵素であり,その阻害剤は免疫抑制剤として広く用いられている.筆者らは,精子に特異的に存在するカルシニューリンとしてPPP3CCとPPP3R2からなる精子カルシニューリンを同定した.PPP3CCノックアウトマウスおよびPPP3R2ノックアウトマウスを作製したところ,ともに,精子の鞭毛の中片部が屈曲せずオスのマウスは不妊になった.また,カルシニューリンの阻害剤をオスの野生型マウスに投与したところ,同じく,精子の中片部の屈曲能が低下し不妊になった.阻害剤の投与を開始してから数日間で屈曲能は低下し,投与を中止すると1週間で回復したことから,精子カルシニューリンは精巣において形成された精子が精巣上体を移行する約10日間のあいだに機能すると考えられた.精子カルシニューリンを特異的に阻害することができれば,短期間で効果があり可逆的な男性避妊薬の開発につながると期待される.
カルシニューリンは全身に発現するCa2+依存性の脱リン酸化酵素であり1,2),免疫細胞においては転写因子であるNFATを脱リン酸化することにより核への移行を促進する.核に移行したNFATはインターロイキン2の発現を誘導してT細胞を活性化させる.カルシニューリンの阻害剤であるシクロスポリンAおよびFK506はこの過程を阻害することから,臓器移植ののちの免疫抑制剤として広く用いられている.一方,ラットやマウスを用いた毒性試験では,シクロスポリンAあるいはFK506によりオスの生殖能が低下することも知られている3,4).また,成熟した精子をシクロスポリンAあるいはFK506を含む培地で培養すると精子の運動や先体反応がさまたげられるという報告もある5,6).これらのことから,カルシニューリンは受精においても重要な機能をはたすと考えられていたが,精巣においてはさまざまなアイソフォームが発現していることもあり,受精におけるカルシニューリンの機能や阻害剤の作用機序については明らかにされていなかった.
カルシニューリンは触媒サブユニットと制御サブユニットからなる二量体である.哺乳類においては,3種類の触媒サブユニットPPP3CA,PPP3CB,PPP3CC,および,2種類の制御サブユニットPPP3R1,PPP3R2が知られている.PPP3CA,PPP3CB,PPP3R1は全身において発現しており,PPP3CCおよびPPP3R2は精巣に特異的に発現している7).生殖細胞を欠損するマウスの精巣を用いた免疫ブロット法において,PPP3CCおよびPPP3R2のシグナルは検出されなかった.つまり,PPP3CCおよびPPP3R2は精細胞のみで発現しており,カルシニューリンを構成すると考えられた.成熟した精子を頭部と尾部とに分画したところ,PPP3CCおよびPPP3R2は尾部に局在していた.さらに,培養細胞における組換え体の発現から,PPP3CCとPPP3R2は結合して互いに安定化し,脱リン酸化酵素活性をもつことが確認され,PPP3CCおよびPPP3R2が精子に特異的に存在する精子カルシニューリンであると結論づけた.
精子カルシニューリンの機能を調べるため,触媒サブユニットであるPPP3CCのノックアウトマウスを作製した.このノックアウトマウスの精子においてはPPP3CCが欠損しているだけでなくPPP3R2のタンパク質量も減少しており,PPP3CCとPPP3R2との共発現がそれらの安定化に寄与することが確認された.ノックアウトマウスにおいて精巣の形態および精子の数に異常は認められなかった.さらに,精子の微細な構造を電子顕微鏡により観察したが異常は認められなかった.
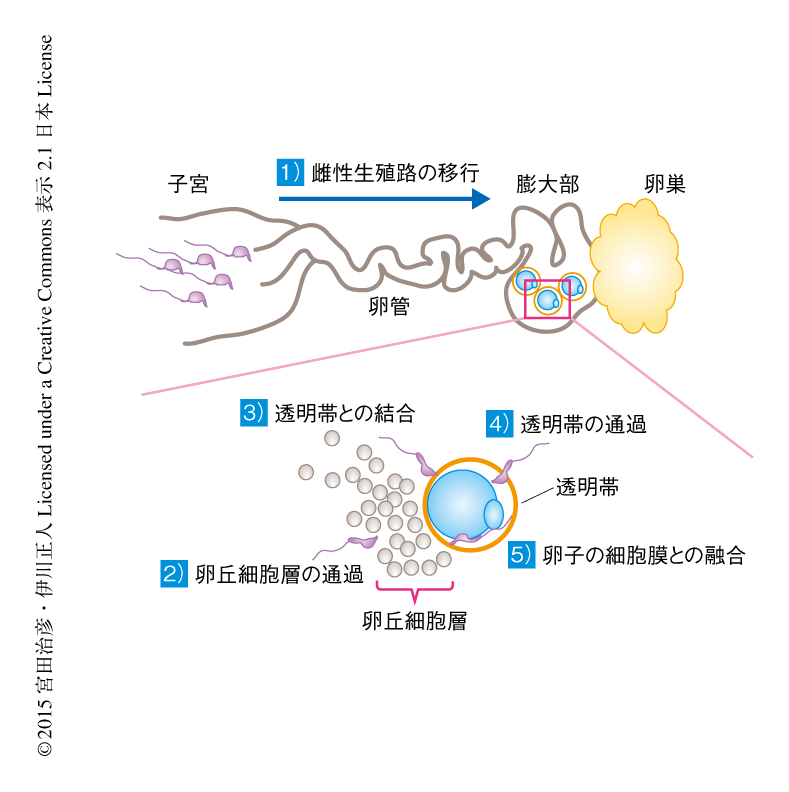
しかし,オスのPPP3CCノックアウトマウスはメスの野生型マウスと正常に交配したものの不妊であった.不妊の原因を調べるため,雌性生殖路を移行している精子を観察したが,数は少ないものの排卵された卵子が存在する膨大部まで到達していた(図1).そこで,体外受精の系を用いて不妊の原因をさぐることにした.精子は卵子のまわりにある卵丘細胞の層を通過しなくてはならないが,ノックアウトマウスの精子はこの層を通過した.卵丘細胞の層を取り除いた卵子を用いて体外受精したところ,ノックアウトマウスの精子は卵子をとりかこむ透明帯に結合したものの卵子と受精しなかった.しかし,グルタチオンにより透明帯を不安定化すると8),ノックアウトマウスの精子も卵子と受精した.これらのことから,PPP3CCノックアウトマウスの精子は透明帯を通過できないために不妊であることがわかった.受精した卵子を偽妊娠マウスにもどすと正常な仔が生まれたことから,ノックアウトマウスの精子におけるゲノムの完全性に問題はないと考えられた.
これらの表現型は減数分裂期の精細胞において特異的に機能する遺伝子プロモーターのもとPpp3cc遺伝子を発現するトランス遺伝子によりレスキューされ,精巣に発現したPPP3CCが表現型にかかわることが確認された.なお,このPpp3cc遺伝子にはタグとして蛍光タンパク質mCherryをコードする遺伝子が付加されていたが,精子の尾部の全長にmCherryが付加したPPP3CCが局在した.
なぜPPP3CCノックアウトマウスの精子は透明帯を通過できないのだろうか? 透明帯の通過にさきだち,精子は先体反応を起こす必要があるが,ノックアウトマウスの精子において先体反応は低下していなかった.透明帯の通過に重要なほかの因子として精子の運動がある.ノックアウトマウスにおける精子の運動速度は同じ系統の野生型マウスの精子よりも低いという結果が得られたが,交雑系統を背景にもつノックアウトマウスの精子と近交系の野生型マウスの精子とのあいだで運動速度に差はなかった.近交系の野生型マウスの精子は卵子と受精することから,運動速度の低下だけでは透明帯の通過の不全を説明できなかった.
そこで,高速カメラを用いて精子の鞭毛運動の波形を調べてみたところ,ノックアウトマウスの精子においては中片部が屈曲していないことが明らかにされた.ノックアウトマウスのほぼすべての精子の中片部が,わずかに頭部の先端の鍵状の突起と逆方向に屈曲した状態で動かなくなっていたのである.精子の運動のビデオをはじめて観たときに違いに気づく人はおらず,中片部が屈曲していないといわれたあとにようやく気づくほどのわずかな違いであった.さらに,オスのPPP3R2ノックアウトマウスも同じように精子の中片部が屈曲せず不妊になったため,精子カルシニューリンは精子の中片部の屈曲を可能にするのに必須であり,それが透明帯を通過するのに重要であることがわかった.
精子に存在するCATSPER1とよばれるCa2+チャネルは精子におけるCa2+濃度の上昇に重要であり精子の運動にかかわることが知られていたが9),CATSPER1を欠損した精子において中片部の屈曲の異常は認められなかった.そのため,ほかのCa2+チャネルや細胞におけるCa2+ストアなどが精子カルシニューリンの活性化にかかわると考えられた.
精子の尾部のうちなぜ中片部だけが屈曲できないのかという疑問が残った.精子の鞭毛運動にはダイニンとよばれるモータータンパク質がかかわるが,中片部のダイニンだけが力を発生できなくなっている可能性が考えられた.そこで,精子から細胞膜を取り除きダイニンの力によりスライド運動する微小管を観察した.PPP3CCノックアウトマウスの精子においても野生型マウスの精子と同じ頻度で中片部においてスライド運動が観察され,中片部の微小管はスライド運動を起こすことができると結論づけられた.これらの実験の際に,ノックアウトマウスにおいて頭部の先端の鍵状の突起の方向に中片部が屈曲している精子が観察された.この実験では中片部に存在するミトコンドリア鞘を取り除いていたことから,ミトコンドリア鞘が中片部を頭部の先端の鍵状の突起と逆の方向に固定しているのではないかと考えられた.
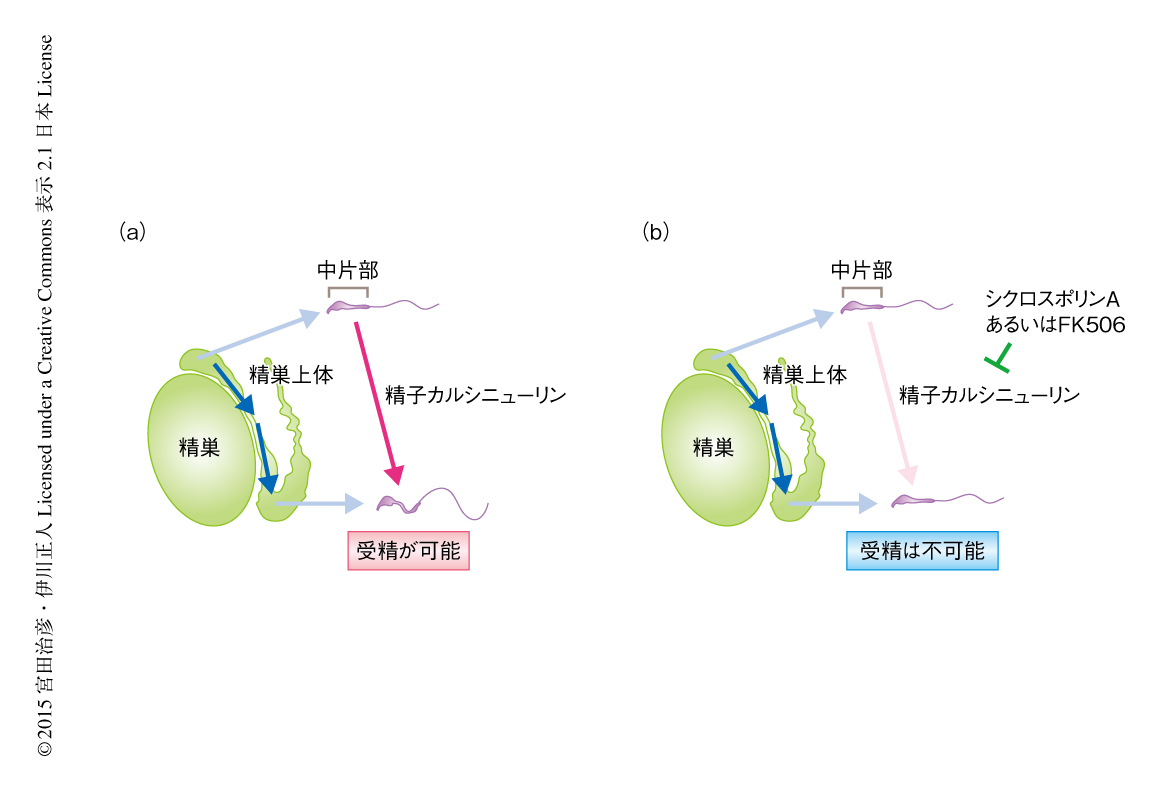
精子カルシニューリンの機能をさらに調べるため,成熟した精子をシクロスポリンAあるいはFK506を含む培地で培養したが,中片部の屈曲の不全は起こらなかった.精子カルシニューリンはこれらの薬剤により阻害されることから,精子カルシニューリンの脱リン酸化酵素活性は成熟した精子においては重要ではないと考えられた.そこで,精巣における精子の形成あるいは精巣上体における精子の成熟の過程において精子カルシニューリンが機能しているかどうかを調べるため,オスの野生型マウスにシクロスポリンAあるいはFK506を投与した.その結果,2週間にわたる投与により,PPP3CCノックアウトマウスと同様に精子の中片部が屈曲しなくなり不妊になった.精子の形成と精子の成熟のどちらの過程において精子カルシニューリンが機能しているのか調べるため,シクロスポリンAあるいはFK506を短期間だけ投与したところ,4~5日間で精子の中片部において屈曲の不全が確認された.精子の精巣上体への移行には約10日間かかることから10),精子カルシニューリンが精巣上体を移行しているときに中片部の屈曲は可能になっていた(図2).実際に,野生型マウスの精巣上体の入口の付近から精子を採取して運動能を調べてみると,中片部は屈曲できなかった.
精巣における精子の形成(約35日)に比べ,精巣上体における精子の成熟(約10日)は短期間の過程であるため,阻害剤の投与を中止したのちすぐに生殖能は回復すると考えられた.実際に,投与を中止してから1週間で精子の中片部の屈曲能は回復し,オスの生殖能も回復した.
ヒトにも精子カルシニューリンが存在し,脱リン酸化酵素活性をもつことが明らかにされた.シクロスポリンAあるいはFK506は免疫を抑制するため避妊薬としては使用できないが,精子カルシニューリンを特異的に阻害することができれば即効性があり可逆的な男性用の経口避妊薬の開発につながると期待される.また,精巣上体を移行している精子においては転写が停止しており,精子カルシニューリンの基質はNFATのような転写因子ではなく,細胞骨格にかかわるタンパク質である可能性が高い.精子の鞭毛には特殊な構造タンパク質が多いことから,精子カルシニューリンと基質との相互作用を阻害する分子も副作用の少ない男性避妊薬の候補になるだろう.また,精子の中片部の屈曲能が受精能に重要であることが明らかにされたことにより,不妊症の原因の究明および診断に新たな視点がくわわった.
略歴:2010年 米国California大学Riverside校博士課程 修了,2011年 大阪大学微生物病研究所 特任研究員,2013年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2014年より大阪大学微生物病研究所 助教.
研究テーマ:哺乳類の受精における精子の機能の制御.
抱負:精子の機能の研究をとおして,不妊症の原因の究明や避妊薬の開発に貢献したい.
伊川 正人(Masahito Ikawa)
大阪大学微生物病研究所 教授.
研究室URL:http://www.egr.biken.osaka-u.ac.jp/information/index.html
© 2015 宮田治彦・伊川正人 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 遺伝情報実験センター遺伝子機能解析分野)
email:宮田治彦,伊川正人
DOI: 10.7875/first.author.2015.121
Sperm calcineurin inhibition prevents mouse fertility with implications for male contraceptive.
Haruhiko Miyata, Yuhkoh Satouh, Daisuke Mashiko, Masanaga Muto, Kaori Nozawa, Kogiku Shiba, Yoshitaka Fujihara, Ayako Isotani, Kazuo Inaba, Masahito Ikawa
Science, 350, 442-445 (2015)
要 約
カルシニューリンはさまざまな組織で発現する脱リン酸化酵素であり,その阻害剤は免疫抑制剤として広く用いられている.筆者らは,精子に特異的に存在するカルシニューリンとしてPPP3CCとPPP3R2からなる精子カルシニューリンを同定した.PPP3CCノックアウトマウスおよびPPP3R2ノックアウトマウスを作製したところ,ともに,精子の鞭毛の中片部が屈曲せずオスのマウスは不妊になった.また,カルシニューリンの阻害剤をオスの野生型マウスに投与したところ,同じく,精子の中片部の屈曲能が低下し不妊になった.阻害剤の投与を開始してから数日間で屈曲能は低下し,投与を中止すると1週間で回復したことから,精子カルシニューリンは精巣において形成された精子が精巣上体を移行する約10日間のあいだに機能すると考えられた.精子カルシニューリンを特異的に阻害することができれば,短期間で効果があり可逆的な男性避妊薬の開発につながると期待される.
はじめに
カルシニューリンは全身に発現するCa2+依存性の脱リン酸化酵素であり1,2),免疫細胞においては転写因子であるNFATを脱リン酸化することにより核への移行を促進する.核に移行したNFATはインターロイキン2の発現を誘導してT細胞を活性化させる.カルシニューリンの阻害剤であるシクロスポリンAおよびFK506はこの過程を阻害することから,臓器移植ののちの免疫抑制剤として広く用いられている.一方,ラットやマウスを用いた毒性試験では,シクロスポリンAあるいはFK506によりオスの生殖能が低下することも知られている3,4).また,成熟した精子をシクロスポリンAあるいはFK506を含む培地で培養すると精子の運動や先体反応がさまたげられるという報告もある5,6).これらのことから,カルシニューリンは受精においても重要な機能をはたすと考えられていたが,精巣においてはさまざまなアイソフォームが発現していることもあり,受精におけるカルシニューリンの機能や阻害剤の作用機序については明らかにされていなかった.
1.精子カルシニューリンはPPP3CCとPPP3R2から構成される
カルシニューリンは触媒サブユニットと制御サブユニットからなる二量体である.哺乳類においては,3種類の触媒サブユニットPPP3CA,PPP3CB,PPP3CC,および,2種類の制御サブユニットPPP3R1,PPP3R2が知られている.PPP3CA,PPP3CB,PPP3R1は全身において発現しており,PPP3CCおよびPPP3R2は精巣に特異的に発現している7).生殖細胞を欠損するマウスの精巣を用いた免疫ブロット法において,PPP3CCおよびPPP3R2のシグナルは検出されなかった.つまり,PPP3CCおよびPPP3R2は精細胞のみで発現しており,カルシニューリンを構成すると考えられた.成熟した精子を頭部と尾部とに分画したところ,PPP3CCおよびPPP3R2は尾部に局在していた.さらに,培養細胞における組換え体の発現から,PPP3CCとPPP3R2は結合して互いに安定化し,脱リン酸化酵素活性をもつことが確認され,PPP3CCおよびPPP3R2が精子に特異的に存在する精子カルシニューリンであると結論づけた.
2.オスのPPP3CCノックアウトマウスは精子が透明帯を通過できないため不妊になる
精子カルシニューリンの機能を調べるため,触媒サブユニットであるPPP3CCのノックアウトマウスを作製した.このノックアウトマウスの精子においてはPPP3CCが欠損しているだけでなくPPP3R2のタンパク質量も減少しており,PPP3CCとPPP3R2との共発現がそれらの安定化に寄与することが確認された.ノックアウトマウスにおいて精巣の形態および精子の数に異常は認められなかった.さらに,精子の微細な構造を電子顕微鏡により観察したが異常は認められなかった.
しかし,オスのPPP3CCノックアウトマウスはメスの野生型マウスと正常に交配したものの不妊であった.不妊の原因を調べるため,雌性生殖路を移行している精子を観察したが,数は少ないものの排卵された卵子が存在する膨大部まで到達していた(図1).そこで,体外受精の系を用いて不妊の原因をさぐることにした.精子は卵子のまわりにある卵丘細胞の層を通過しなくてはならないが,ノックアウトマウスの精子はこの層を通過した.卵丘細胞の層を取り除いた卵子を用いて体外受精したところ,ノックアウトマウスの精子は卵子をとりかこむ透明帯に結合したものの卵子と受精しなかった.しかし,グルタチオンにより透明帯を不安定化すると8),ノックアウトマウスの精子も卵子と受精した.これらのことから,PPP3CCノックアウトマウスの精子は透明帯を通過できないために不妊であることがわかった.受精した卵子を偽妊娠マウスにもどすと正常な仔が生まれたことから,ノックアウトマウスの精子におけるゲノムの完全性に問題はないと考えられた.
これらの表現型は減数分裂期の精細胞において特異的に機能する遺伝子プロモーターのもとPpp3cc遺伝子を発現するトランス遺伝子によりレスキューされ,精巣に発現したPPP3CCが表現型にかかわることが確認された.なお,このPpp3cc遺伝子にはタグとして蛍光タンパク質mCherryをコードする遺伝子が付加されていたが,精子の尾部の全長にmCherryが付加したPPP3CCが局在した.
3.PPP3CCを欠損した精子は中片部が屈曲しないため透明帯を通過できない
なぜPPP3CCノックアウトマウスの精子は透明帯を通過できないのだろうか? 透明帯の通過にさきだち,精子は先体反応を起こす必要があるが,ノックアウトマウスの精子において先体反応は低下していなかった.透明帯の通過に重要なほかの因子として精子の運動がある.ノックアウトマウスにおける精子の運動速度は同じ系統の野生型マウスの精子よりも低いという結果が得られたが,交雑系統を背景にもつノックアウトマウスの精子と近交系の野生型マウスの精子とのあいだで運動速度に差はなかった.近交系の野生型マウスの精子は卵子と受精することから,運動速度の低下だけでは透明帯の通過の不全を説明できなかった.
そこで,高速カメラを用いて精子の鞭毛運動の波形を調べてみたところ,ノックアウトマウスの精子においては中片部が屈曲していないことが明らかにされた.ノックアウトマウスのほぼすべての精子の中片部が,わずかに頭部の先端の鍵状の突起と逆方向に屈曲した状態で動かなくなっていたのである.精子の運動のビデオをはじめて観たときに違いに気づく人はおらず,中片部が屈曲していないといわれたあとにようやく気づくほどのわずかな違いであった.さらに,オスのPPP3R2ノックアウトマウスも同じように精子の中片部が屈曲せず不妊になったため,精子カルシニューリンは精子の中片部の屈曲を可能にするのに必須であり,それが透明帯を通過するのに重要であることがわかった.
精子に存在するCATSPER1とよばれるCa2+チャネルは精子におけるCa2+濃度の上昇に重要であり精子の運動にかかわることが知られていたが9),CATSPER1を欠損した精子において中片部の屈曲の異常は認められなかった.そのため,ほかのCa2+チャネルや細胞におけるCa2+ストアなどが精子カルシニューリンの活性化にかかわると考えられた.
精子の尾部のうちなぜ中片部だけが屈曲できないのかという疑問が残った.精子の鞭毛運動にはダイニンとよばれるモータータンパク質がかかわるが,中片部のダイニンだけが力を発生できなくなっている可能性が考えられた.そこで,精子から細胞膜を取り除きダイニンの力によりスライド運動する微小管を観察した.PPP3CCノックアウトマウスの精子においても野生型マウスの精子と同じ頻度で中片部においてスライド運動が観察され,中片部の微小管はスライド運動を起こすことができると結論づけられた.これらの実験の際に,ノックアウトマウスにおいて頭部の先端の鍵状の突起の方向に中片部が屈曲している精子が観察された.この実験では中片部に存在するミトコンドリア鞘を取り除いていたことから,ミトコンドリア鞘が中片部を頭部の先端の鍵状の突起と逆の方向に固定しているのではないかと考えられた.
4.精子カルシニューリンは精子が精巣上体を移行しているときに中片部の屈曲を可能にする
精子カルシニューリンの機能をさらに調べるため,成熟した精子をシクロスポリンAあるいはFK506を含む培地で培養したが,中片部の屈曲の不全は起こらなかった.精子カルシニューリンはこれらの薬剤により阻害されることから,精子カルシニューリンの脱リン酸化酵素活性は成熟した精子においては重要ではないと考えられた.そこで,精巣における精子の形成あるいは精巣上体における精子の成熟の過程において精子カルシニューリンが機能しているかどうかを調べるため,オスの野生型マウスにシクロスポリンAあるいはFK506を投与した.その結果,2週間にわたる投与により,PPP3CCノックアウトマウスと同様に精子の中片部が屈曲しなくなり不妊になった.精子の形成と精子の成熟のどちらの過程において精子カルシニューリンが機能しているのか調べるため,シクロスポリンAあるいはFK506を短期間だけ投与したところ,4~5日間で精子の中片部において屈曲の不全が確認された.精子の精巣上体への移行には約10日間かかることから10),精子カルシニューリンが精巣上体を移行しているときに中片部の屈曲は可能になっていた(図2).実際に,野生型マウスの精巣上体の入口の付近から精子を採取して運動能を調べてみると,中片部は屈曲できなかった.
精巣における精子の形成(約35日)に比べ,精巣上体における精子の成熟(約10日)は短期間の過程であるため,阻害剤の投与を中止したのちすぐに生殖能は回復すると考えられた.実際に,投与を中止してから1週間で精子の中片部の屈曲能は回復し,オスの生殖能も回復した.
おわりに
ヒトにも精子カルシニューリンが存在し,脱リン酸化酵素活性をもつことが明らかにされた.シクロスポリンAあるいはFK506は免疫を抑制するため避妊薬としては使用できないが,精子カルシニューリンを特異的に阻害することができれば即効性があり可逆的な男性用の経口避妊薬の開発につながると期待される.また,精巣上体を移行している精子においては転写が停止しており,精子カルシニューリンの基質はNFATのような転写因子ではなく,細胞骨格にかかわるタンパク質である可能性が高い.精子の鞭毛には特殊な構造タンパク質が多いことから,精子カルシニューリンと基質との相互作用を阻害する分子も副作用の少ない男性避妊薬の候補になるだろう.また,精子の中片部の屈曲能が受精能に重要であることが明らかにされたことにより,不妊症の原因の究明および診断に新たな視点がくわわった.
文 献
- Klee, C. B., Ren, H. & Wang, X.: Regulation of the calmodulin-stimulated protein phosphatase, calcineurin. J. Biol. Chem., 273, 13367-13370 (1998)[PubMed]
- Rusnak, F. & Mertz, P.: Calcineurin: form and function. Physiol. Rev., 80, 1483-1521 (2000)[PubMed]
- Seethalakshmi, L., Menon, M., Malhotra, R. K. et al.: Effect of cyclosporine A on male reproduction in rats. J. Urol., 138, 991-995 (1987)[PubMed]
- Hisatomi, A., Fujihira, S., Fujimoto, Y. et al.: Effect of Prograf (FK506) on spermatogenesis in rats. Toxicology, 109, 75-83 (1996)[PubMed]
- Misro, M. M., Chaki, S. P., Srinivas, M. et al.: Effect of cyclosporine on human sperm motility in vitro. Arch. Androl., 43, 215-220 (1999)[PubMed]
- Castillo Bennett, J., Roggero, C. M., Mancifesta, F. E. et al.: Calcineurin-mediated dephosphorylation of synaptotagmin VI is necessary for acrosomal exocytosis. J. Biol. Chem., 285, 26269-26278 (2010)[PubMed]
- Muramatsu, T., Giri, P. R., Higuchi, S. et al.: Molecular cloning of a calmodulin-dependent phosphatase from murine testis: identification of a developmentally expressed nonneural isoenzyme. Proc. Natl. Acad. Sci. USA, 89, 529-533 (1992)[PubMed]
- Takeo, T. & Nakagata, N.: Reduced glutathione enhances fertility of frozen/thawed C57BL/6 mouse sperm after exposure to methyl-beta-cyclodextrin. Biol. Reprod., 85, 1066-1072 (2011)[PubMed]
- Ren, D., Navarro, B., Perez, G. et al.: A sperm ion channel required for sperm motility and male fertility. Nature, 413, 603-609 (2001)[PubMed]
- Meistrich, M. L., Hughes, T. H. & Bruce, W. R.: Alteration of epididymal sperm transport and maturation in mice by oestrogen and testosterone. Nature, 258, 145-147 (1975)[PubMed]
著者プロフィール
略歴:2010年 米国California大学Riverside校博士課程 修了,2011年 大阪大学微生物病研究所 特任研究員,2013年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2014年より大阪大学微生物病研究所 助教.
研究テーマ:哺乳類の受精における精子の機能の制御.
抱負:精子の機能の研究をとおして,不妊症の原因の究明や避妊薬の開発に貢献したい.
伊川 正人(Masahito Ikawa)
大阪大学微生物病研究所 教授.
研究室URL:http://www.egr.biken.osaka-u.ac.jp/information/index.html
© 2015 宮田治彦・伊川正人 Licensed under CC 表示 2.1 日本