ミクログリアの放出するエキソソームによる初期のアルツハイマー病におけるタウの沈着の進展の機構
池津聖子・池津庸哉
(米国Boston大学School of Medicine,Department of Pharmacology and Experimental Therapeutics,Laboratory of Molecular NeuroTherapeutics)
email:池津庸哉
DOI: 10.7875/first.author.2015.115
Depletion of microglia and inhibition of exosome synthesis halt tau propagation.
Hirohide Asai, Seiko Ikezu, Satoshi Tsunoda, Maria Medalla, Jennifer Luebke, Tarik Haydar, Benjamin Wolozin, Oleg Butovsky, Sebastian Kügler, Tsuneya Ikezu
Nature Neuroscience, 18, 1584-1593 (2015)
神経原線維変化はアルツハイマー病に特徴的な所見であり,過剰にリン酸化されたタウというタンパク質が線維化して沈着したものである.タウの沈着は加齢とともに脳の嗅内野第2層にみられ,そののち,海馬に進展することが報告されている.脳の免疫細胞であるミクログリアはタウの沈着と密接に関連することが報告されているが,タウの沈着の進展に直接的にかかわるのかどうかは不明であった.筆者らは,ニューロンにおいて特異的に遺伝子を発現するアデノ随伴ウイルスベクターを用いて,嗅内野から海馬へのタウの沈着の進展を短時間で観察することのできるマウスのモデルを開発した.マウスにミクログリアを特異的に除去する試薬を投与すると,嗅内野から海馬へのタウの沈着の進展が抑制され,さらに,タウの沈着による歯状回における興奮性の低下が改善した.また,ミクログリアがエキソソームの放出によりタウを分泌し,このエキソソームはニューロンに直接的に取り込まれた.さらに,ミクログリアにおけるタウを含むエキソソームの産生はセラミドを合成する中性スフィンゴミエリナーゼに依存し,この中性スフィンゴミエリナーゼに対する阻害剤の投与によりタウの沈着の進展は抑制された.これらの結果から,ミクログリアにおけるエキソソームの産生の抑制はアルツハイマー病の初期の段階におけるタウの沈着の進展の予防に有効である可能性が示唆された.
アルツハイマー病は認知症の6~7割をしめる神経変性疾患である.認知症の全世界における患者の数は2050年には1億人をはるかにこえると予測され,その社会的および経済的な負担が深く懸念されている.老年人口の加速の認められるわが国においては,アルツハイマー病の予防的な治療が早急に望まれるところである.アルツハイマー病の主要な病理所見としてニューロンの細胞死,老人斑の沈着,神経原線維変化の3つがある.このうち神経原線維変化は加齢による生理的な変化として経嗅内野に出現し,そののち,嗅内野,海馬支脚,海馬野へと進展していくことが知られている1).神経原線維変化がさらに海馬のアンモン角から大脳新皮質へと進展すると徐々に認知機能の低下が認められ,初期のアルツハイマー病の症状を示す.
近年のマウスのモデルを用いた研究により,神経原線維変化が特異的なニューロンに階層的に出現する分子機構が明らかにされつつある.神経原線維変化は過剰にリン酸化したタウというタンパク質が線維化して沈着したものであり,このタウがニューロンのあいだを移動し,移動したさきのニューロンにおいてまた沈着することが確認されている.しかしながら,タウの沈着が進展する過程において,細胞に毒性のあるタウのオリゴマーあるいは繊維化したオリゴマーのどちらの形態をとっているのかについては結論がでていない.また,近年,タウがシナプス間隙を介して移動するという説が提唱されているが,嗅内野第2層から海馬へは貫通線維を介して投射しており,海馬支脚および第1アンモン角,あるいは,大脳新皮質への進展はシナプス間隙を介したタウの移動では説明が困難である.
ミクログリアは脳における免疫細胞として細胞死や感染などの病的な変化を探知し,それらを貪食する役割をもつ.また,近年,ミクログリアがエキソソームを放出することによりさまざまなシグナル伝達タンパク質を分泌することが知られている2).エキソソームにより分泌されるタンパク質としては,タウのほかにもβアミロイド,プリオンタンパク質,パーキンソン病において沈着のみられるαシヌクレインなどが報告されており,さまざまな神経変性疾患の進行に関与することが示唆されている3,4).以上の報告をふまえて,この研究においては,タウの沈着が短時間で進展するマウスのモデルを開発し,タウの沈着の進行にミクログリアの放出するエキソソームがどのように関与しているのか検討した.
近年,発表されたマウスのモデルは嗅内野に特異的に発現したタウ点変異体がシナプスのあいだを移動することを示したが5-7),歯状回の顆粒細胞層においてタウの沈着が形成されるのに約2年もかかること,また,ヒトの海馬の歯状回の顆粒細胞層および海馬の苔状線維には生後4カ月からタウの発現がみられタウ点変異体の発現が嗅内野に特異的でない可能性があることといった問題点があった.そこで,シナプシンI型プロモーターのもとでニューロンに特異的にタウ点変異体を発現するアデノ随伴ウイルスベクター,および,同様にGFPを発現するアデノ随伴ウイルスベクターを生後4カ月のマウスの嗅内野第2層および第3層に定位的に注入し,嗅内野および海馬におけるリン酸化タウおよびGFPの集積を蛍光組織免疫染色法により検討した.その結果,タウ点変異体を発現するベクターおよびGFPを発現するベクターをともに投与したマウスにおいては4週間後に嗅内野,外分子層,歯状回にリン酸化タウに対する抗体およびヒトのタウに対する抗体に陽性を示す細胞が認められたが,GFPの発現は嗅内野および外分子層にとどまり歯状回には確認されなかった.蓄積したタウは過剰リン酸化型ではあるが繊維化はしていなかった.アデノ随伴ウイルスに対し特異的なプローブを用いた蛍光in situハイブリダイゼーション法では嗅内野のみにアデノ随伴ウイルスに由来するRNAの発現が確認され,アデノ随伴ウイルスの歯状回への直接的な感染は否定された.1週間後に歯状回においてリン酸化タウは確認されなかったが,タウのオリゴマーや初期の段階のリン酸化タウが確認された.それらの多くは新生ニューロンに存在し,ミクログリアにも存在が確認された.これらの結果から,新生ニューロンおよびミクログリアがタウの沈着の進展に関与することが示唆された.
ミクログリアがタウのオリゴマーを直接的に貪食するかどうかを検証するため,タウ点変異体をプリオンプロモーターのもとで強発現するマウス8) の脳の組織を免疫染色ののち共焦点顕微鏡および電子顕微鏡により検討した結果,ミクログリアの内部にニューロンに由来するリン酸化タウの存在が認められ,ミクログリアがリン酸化タウを貪食することが直接的に示された.タウの沈着の進展へのミクログリアの関与について明らかにするため,ミクログリアを除去する作用をもつ試薬9) を含むえさをマウスに1カ月にわたりあたえ,タウ点変異体を発現するベクターを嗅内野第2層および第3層に注入し,さらに1カ月にわたり同じえさをあたえた.また,別の実験として,マクロファージを除去する作用のあるクロドロネートリポソームをマウスの側脳室にカニューレを介して投与した.これらの試薬の投与により脳のミクログリアは顕著に減少し,同時に,リン酸化タウを沈着した歯状回の細胞の数は有意に減少し,タウの沈着の進展へのミクログリアの関与が直接的に示された.同様の結果は,タウ点変異体をプリオンプロモーターのもとで強発現するマウスにおいても確認された.
歯状回の顆粒細胞層におけるタウの沈着およびミクログリアの除去による神経生理的な効果を電気生理学的に検討した.ミクログリアを特異的に除去する試薬を含むえさを1カ月にわたりあたえたマウスの嗅内野第2層および第3層にタウ点変異体を発現するベクターを注入し,さらに1カ月にわたり同じえさをあたえたのち,海馬を含む脳の切片を用いて貫通線維に対する電気刺激ののち歯状回の局所の電位を測定した.タウ点変異体を発現するベクターを注入したマウスにおいては,対照となるマウスに比べ歯状回における興奮性が有意に低下した.ミクログリアを特異的に除去する試薬をあたえたマウスにおいては,この興奮性は対照となるマウスと同じ程度にまで回復した.また,ミクログリアを特異的に除去する試薬をあたえたマウスにタウ点変異体を発現するベクターを注入したマウスにおいては,興奮性の変化は認められなかった.以上のことから,歯状回の顆粒細胞層におけるタウの沈着は興奮性を低下させたが,これは,ミクログリアの除去により正常に回復することが認められた.
これらの実験から,ミクログリアはタウを貪食し細胞の外に分泌する役割をはたしていることが示唆されたが,どのようにタウを細胞外へ分泌しているのか,マウスの初代組織培養したミクログリア,ニューロン,アストロサイトを用いて検討した.タウのオリゴマーはニューロンやアストロサイトと比較してミクログリアにより効率よく貪食され,ATPの刺激によりエキソソームの画分に移行した.ミクログリアの培養液から調製したエキソソームの画分からは免疫電子顕微鏡により直径50~100 nmのエキソソームが確認された.免疫沈降ののちのウェスタンブロット解析により,ミクログリアの放出したエキソソームにタウが存在することが確認された.このエキソソームはマウスの初代組織培養ニューロンに効率よく取り込まれ,このニューロンにおいてヒトのタウおよびリン酸化タウが検出された.これらの結果から,ニューロンやアストロサイトと比較して,ミクログリアはタウのオリゴマーを効率よく貪食しタウを含むエキソソームを放出し,このエキソソームはニューロンに効率よく取り込まれることが示唆された.
ミクログリアから放出されたタウを含むエキソソームが海馬において歯状回の顆粒細胞層に拡散しうることを直接的に検討するため,タウのオリゴマーを貪食したミクログリアからエキソソームを精製し,これをマウスの海馬の外分子層に定位的に注入した.3週間後,蛍光免疫組織染色法により歯状回の顆粒細胞層にヒトのタウが検出された.エキソソームの内部と同じ量のタウそのもの,あるいは,タウを含まないエキソソームを同様に海馬の外分子層に定位的に注入したところ,どちらも,歯状回の顆粒細胞層にヒトのタウは検出されなかった.この結果から,ミクログリアのエキソソームはヒトのタウをマウスの脳の歯状回の顆粒細胞層に効率よく輸送することが直接的に確認された.
マウスの脳に内在性にタウを含むエキソソームが存在するかどうか検討した.タウ点変異体をプリオンプロモーターのもとで強発現するマウスの脳からエキソソームを精製し超薄切片を調製したところ,免疫電子顕微鏡法によりタウあるいはエキソソームに特異的な抗体に対し陽性,かつ,エキソソームの特徴であるカップ様の形態を示す直径が約50~100 nmの小胞体が確認された.タウ点変異体をプリオンプロモーターのもとで強発現するマウスにミクログリアを特異的に除去する試薬を含むえさを1カ月にわたりあたえたのち,脳からエキソソームを精製し,エキソソームの指標であるアセチルコリンエステラーゼの活性およびヒトのタウのタンパク質量を定量したところ,それらの低下が認められた.このエキソソームをマウスの初代培養ニューロンにくわえたところ,エキソソームからのヒトのタウのニューロンへの移行は有意に低下した.以上の結果から,マウスの脳には内在性にタウを含むエキソソームが存在し,このエキソソームからニューロンにタウが移行しうること,また,これがミクログリアの除去により有意に低下することが確認された.
エキソソームの一部はセラミドから形成されており,細胞の多小胞体においてエキソソームが合成される過程においては,スフィンゴミエリンから中性スフィンゴミエリナーゼにより合成されるセラミドが必須である10).このことから,ミクログリアにおけるタウを含むエキソソームの産生はセラミドの合成に依存するのかどうか検討した.マウスの初代組織培養ミクログリアに中性スフィンゴミエリナーゼに対する特異的なsiRNAあるいは阻害剤を投与したところ,エキソソームの画分におけるヒトのタウのタンパク質量が減少し,エキソソームからのヒトのタウのニューロンへの移行も有意に低下した.脳への移行性のある中性スフィンゴミエリナーゼに特異的な阻害剤を,タウ点変異体を発現するベクターを注入したマウスおよびタウ点変異体をプリオンプロモーターのもとで強発現するマウスに28日間にわたり腹腔投与したところ,ともに,歯状回においてリン酸化タウのタンパク質量が有意に低下した.これらの結果から,タウはセラミドの合成に依存してエキソソームに取り込まれ,また,中性スフィンゴミエリナーゼの阻害剤は歯状回へのタウの沈着の進展を有意に抑制することが示された.
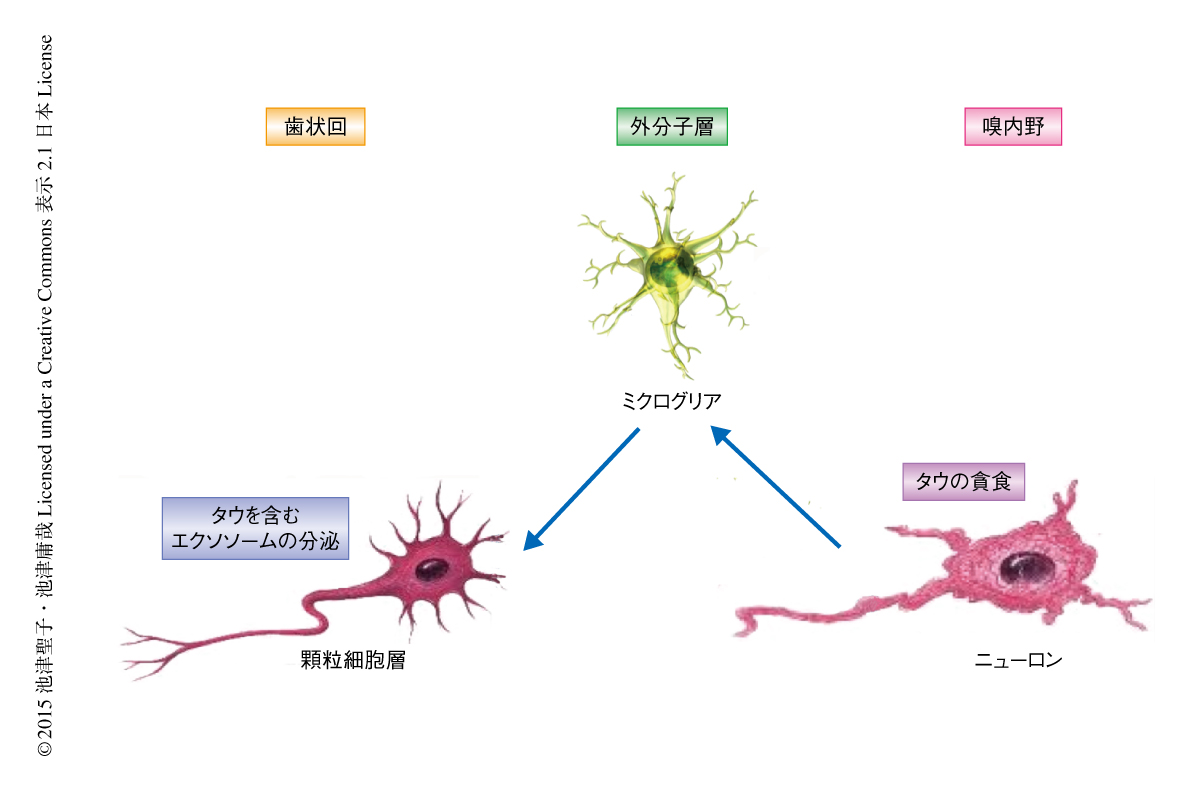
以上の結果から,アルツハイマー病の初期の段階において,タウの沈着が嗅内野から海馬に進展する際にミクログリアの放出するエキソソームが直接的に関与することを示唆された(図1).ひとつの可能性として,これはタウがシナプス間隙を介して移行するという説とは別に,シナプスの外部においてミクログリアが不活性化したシナプスや樹状突起あるいは細胞体を貪食することによりタウを取り込み,消化できない部分をエキソソームを介し放出することがタウの沈着の進展に関与することが示唆される.ミクログリアやエキソソームはさまざまな役割をはたしており,今回の結果が臨床への直接的な応用にはつながりにくいが,新しい予防薬や治療薬の開発の対象として今後の発展が期待される.
略歴:米国Boston大学School of Medicine主任研究員.
研究テーマ:アルツハイマー病および自閉症におけるミクログリアのかかわる病態の解明および治療法の開発.
池津 庸哉(Tsuneya Ikezu)
米国Boston大学School of Medicine教授.
研究室URL:http://www.bumc.bu.edu/busm-pm/research/laboratories/lmnt/
© 2015 池津聖子・池津庸哉 Licensed under CC 表示 2.1 日本
(米国Boston大学School of Medicine,Department of Pharmacology and Experimental Therapeutics,Laboratory of Molecular NeuroTherapeutics)
email:池津庸哉
DOI: 10.7875/first.author.2015.115
Depletion of microglia and inhibition of exosome synthesis halt tau propagation.
Hirohide Asai, Seiko Ikezu, Satoshi Tsunoda, Maria Medalla, Jennifer Luebke, Tarik Haydar, Benjamin Wolozin, Oleg Butovsky, Sebastian Kügler, Tsuneya Ikezu
Nature Neuroscience, 18, 1584-1593 (2015)
要 約
神経原線維変化はアルツハイマー病に特徴的な所見であり,過剰にリン酸化されたタウというタンパク質が線維化して沈着したものである.タウの沈着は加齢とともに脳の嗅内野第2層にみられ,そののち,海馬に進展することが報告されている.脳の免疫細胞であるミクログリアはタウの沈着と密接に関連することが報告されているが,タウの沈着の進展に直接的にかかわるのかどうかは不明であった.筆者らは,ニューロンにおいて特異的に遺伝子を発現するアデノ随伴ウイルスベクターを用いて,嗅内野から海馬へのタウの沈着の進展を短時間で観察することのできるマウスのモデルを開発した.マウスにミクログリアを特異的に除去する試薬を投与すると,嗅内野から海馬へのタウの沈着の進展が抑制され,さらに,タウの沈着による歯状回における興奮性の低下が改善した.また,ミクログリアがエキソソームの放出によりタウを分泌し,このエキソソームはニューロンに直接的に取り込まれた.さらに,ミクログリアにおけるタウを含むエキソソームの産生はセラミドを合成する中性スフィンゴミエリナーゼに依存し,この中性スフィンゴミエリナーゼに対する阻害剤の投与によりタウの沈着の進展は抑制された.これらの結果から,ミクログリアにおけるエキソソームの産生の抑制はアルツハイマー病の初期の段階におけるタウの沈着の進展の予防に有効である可能性が示唆された.
はじめに
アルツハイマー病は認知症の6~7割をしめる神経変性疾患である.認知症の全世界における患者の数は2050年には1億人をはるかにこえると予測され,その社会的および経済的な負担が深く懸念されている.老年人口の加速の認められるわが国においては,アルツハイマー病の予防的な治療が早急に望まれるところである.アルツハイマー病の主要な病理所見としてニューロンの細胞死,老人斑の沈着,神経原線維変化の3つがある.このうち神経原線維変化は加齢による生理的な変化として経嗅内野に出現し,そののち,嗅内野,海馬支脚,海馬野へと進展していくことが知られている1).神経原線維変化がさらに海馬のアンモン角から大脳新皮質へと進展すると徐々に認知機能の低下が認められ,初期のアルツハイマー病の症状を示す.
近年のマウスのモデルを用いた研究により,神経原線維変化が特異的なニューロンに階層的に出現する分子機構が明らかにされつつある.神経原線維変化は過剰にリン酸化したタウというタンパク質が線維化して沈着したものであり,このタウがニューロンのあいだを移動し,移動したさきのニューロンにおいてまた沈着することが確認されている.しかしながら,タウの沈着が進展する過程において,細胞に毒性のあるタウのオリゴマーあるいは繊維化したオリゴマーのどちらの形態をとっているのかについては結論がでていない.また,近年,タウがシナプス間隙を介して移動するという説が提唱されているが,嗅内野第2層から海馬へは貫通線維を介して投射しており,海馬支脚および第1アンモン角,あるいは,大脳新皮質への進展はシナプス間隙を介したタウの移動では説明が困難である.
ミクログリアは脳における免疫細胞として細胞死や感染などの病的な変化を探知し,それらを貪食する役割をもつ.また,近年,ミクログリアがエキソソームを放出することによりさまざまなシグナル伝達タンパク質を分泌することが知られている2).エキソソームにより分泌されるタンパク質としては,タウのほかにもβアミロイド,プリオンタンパク質,パーキンソン病において沈着のみられるαシヌクレインなどが報告されており,さまざまな神経変性疾患の進行に関与することが示唆されている3,4).以上の報告をふまえて,この研究においては,タウの沈着が短時間で進展するマウスのモデルを開発し,タウの沈着の進行にミクログリアの放出するエキソソームがどのように関与しているのか検討した.
1.タウの沈着が短時間で進展するマウスのモデルの開発
近年,発表されたマウスのモデルは嗅内野に特異的に発現したタウ点変異体がシナプスのあいだを移動することを示したが5-7),歯状回の顆粒細胞層においてタウの沈着が形成されるのに約2年もかかること,また,ヒトの海馬の歯状回の顆粒細胞層および海馬の苔状線維には生後4カ月からタウの発現がみられタウ点変異体の発現が嗅内野に特異的でない可能性があることといった問題点があった.そこで,シナプシンI型プロモーターのもとでニューロンに特異的にタウ点変異体を発現するアデノ随伴ウイルスベクター,および,同様にGFPを発現するアデノ随伴ウイルスベクターを生後4カ月のマウスの嗅内野第2層および第3層に定位的に注入し,嗅内野および海馬におけるリン酸化タウおよびGFPの集積を蛍光組織免疫染色法により検討した.その結果,タウ点変異体を発現するベクターおよびGFPを発現するベクターをともに投与したマウスにおいては4週間後に嗅内野,外分子層,歯状回にリン酸化タウに対する抗体およびヒトのタウに対する抗体に陽性を示す細胞が認められたが,GFPの発現は嗅内野および外分子層にとどまり歯状回には確認されなかった.蓄積したタウは過剰リン酸化型ではあるが繊維化はしていなかった.アデノ随伴ウイルスに対し特異的なプローブを用いた蛍光in situハイブリダイゼーション法では嗅内野のみにアデノ随伴ウイルスに由来するRNAの発現が確認され,アデノ随伴ウイルスの歯状回への直接的な感染は否定された.1週間後に歯状回においてリン酸化タウは確認されなかったが,タウのオリゴマーや初期の段階のリン酸化タウが確認された.それらの多くは新生ニューロンに存在し,ミクログリアにも存在が確認された.これらの結果から,新生ニューロンおよびミクログリアがタウの沈着の進展に関与することが示唆された.
2.ミクログリアはタウの沈着の進展を担う
ミクログリアがタウのオリゴマーを直接的に貪食するかどうかを検証するため,タウ点変異体をプリオンプロモーターのもとで強発現するマウス8) の脳の組織を免疫染色ののち共焦点顕微鏡および電子顕微鏡により検討した結果,ミクログリアの内部にニューロンに由来するリン酸化タウの存在が認められ,ミクログリアがリン酸化タウを貪食することが直接的に示された.タウの沈着の進展へのミクログリアの関与について明らかにするため,ミクログリアを除去する作用をもつ試薬9) を含むえさをマウスに1カ月にわたりあたえ,タウ点変異体を発現するベクターを嗅内野第2層および第3層に注入し,さらに1カ月にわたり同じえさをあたえた.また,別の実験として,マクロファージを除去する作用のあるクロドロネートリポソームをマウスの側脳室にカニューレを介して投与した.これらの試薬の投与により脳のミクログリアは顕著に減少し,同時に,リン酸化タウを沈着した歯状回の細胞の数は有意に減少し,タウの沈着の進展へのミクログリアの関与が直接的に示された.同様の結果は,タウ点変異体をプリオンプロモーターのもとで強発現するマウスにおいても確認された.
3.タウの沈着による歯状核における興奮性の低下
歯状回の顆粒細胞層におけるタウの沈着およびミクログリアの除去による神経生理的な効果を電気生理学的に検討した.ミクログリアを特異的に除去する試薬を含むえさを1カ月にわたりあたえたマウスの嗅内野第2層および第3層にタウ点変異体を発現するベクターを注入し,さらに1カ月にわたり同じえさをあたえたのち,海馬を含む脳の切片を用いて貫通線維に対する電気刺激ののち歯状回の局所の電位を測定した.タウ点変異体を発現するベクターを注入したマウスにおいては,対照となるマウスに比べ歯状回における興奮性が有意に低下した.ミクログリアを特異的に除去する試薬をあたえたマウスにおいては,この興奮性は対照となるマウスと同じ程度にまで回復した.また,ミクログリアを特異的に除去する試薬をあたえたマウスにタウ点変異体を発現するベクターを注入したマウスにおいては,興奮性の変化は認められなかった.以上のことから,歯状回の顆粒細胞層におけるタウの沈着は興奮性を低下させたが,これは,ミクログリアの除去により正常に回復することが認められた.
4.ミクログリアによるタウの貪食およびエキソソームの放出
これらの実験から,ミクログリアはタウを貪食し細胞の外に分泌する役割をはたしていることが示唆されたが,どのようにタウを細胞外へ分泌しているのか,マウスの初代組織培養したミクログリア,ニューロン,アストロサイトを用いて検討した.タウのオリゴマーはニューロンやアストロサイトと比較してミクログリアにより効率よく貪食され,ATPの刺激によりエキソソームの画分に移行した.ミクログリアの培養液から調製したエキソソームの画分からは免疫電子顕微鏡により直径50~100 nmのエキソソームが確認された.免疫沈降ののちのウェスタンブロット解析により,ミクログリアの放出したエキソソームにタウが存在することが確認された.このエキソソームはマウスの初代組織培養ニューロンに効率よく取り込まれ,このニューロンにおいてヒトのタウおよびリン酸化タウが検出された.これらの結果から,ニューロンやアストロサイトと比較して,ミクログリアはタウのオリゴマーを効率よく貪食しタウを含むエキソソームを放出し,このエキソソームはニューロンに効率よく取り込まれることが示唆された.
5.エキソソームに含まれるタウの歯状回の顆粒細胞による取り込み
ミクログリアから放出されたタウを含むエキソソームが海馬において歯状回の顆粒細胞層に拡散しうることを直接的に検討するため,タウのオリゴマーを貪食したミクログリアからエキソソームを精製し,これをマウスの海馬の外分子層に定位的に注入した.3週間後,蛍光免疫組織染色法により歯状回の顆粒細胞層にヒトのタウが検出された.エキソソームの内部と同じ量のタウそのもの,あるいは,タウを含まないエキソソームを同様に海馬の外分子層に定位的に注入したところ,どちらも,歯状回の顆粒細胞層にヒトのタウは検出されなかった.この結果から,ミクログリアのエキソソームはヒトのタウをマウスの脳の歯状回の顆粒細胞層に効率よく輸送することが直接的に確認された.
6.内在性のエキソソームによるタウの取り込み
マウスの脳に内在性にタウを含むエキソソームが存在するかどうか検討した.タウ点変異体をプリオンプロモーターのもとで強発現するマウスの脳からエキソソームを精製し超薄切片を調製したところ,免疫電子顕微鏡法によりタウあるいはエキソソームに特異的な抗体に対し陽性,かつ,エキソソームの特徴であるカップ様の形態を示す直径が約50~100 nmの小胞体が確認された.タウ点変異体をプリオンプロモーターのもとで強発現するマウスにミクログリアを特異的に除去する試薬を含むえさを1カ月にわたりあたえたのち,脳からエキソソームを精製し,エキソソームの指標であるアセチルコリンエステラーゼの活性およびヒトのタウのタンパク質量を定量したところ,それらの低下が認められた.このエキソソームをマウスの初代培養ニューロンにくわえたところ,エキソソームからのヒトのタウのニューロンへの移行は有意に低下した.以上の結果から,マウスの脳には内在性にタウを含むエキソソームが存在し,このエキソソームからニューロンにタウが移行しうること,また,これがミクログリアの除去により有意に低下することが確認された.
7.エキソソームの合成阻害剤によるタウの沈着の進展の抑制
エキソソームの一部はセラミドから形成されており,細胞の多小胞体においてエキソソームが合成される過程においては,スフィンゴミエリンから中性スフィンゴミエリナーゼにより合成されるセラミドが必須である10).このことから,ミクログリアにおけるタウを含むエキソソームの産生はセラミドの合成に依存するのかどうか検討した.マウスの初代組織培養ミクログリアに中性スフィンゴミエリナーゼに対する特異的なsiRNAあるいは阻害剤を投与したところ,エキソソームの画分におけるヒトのタウのタンパク質量が減少し,エキソソームからのヒトのタウのニューロンへの移行も有意に低下した.脳への移行性のある中性スフィンゴミエリナーゼに特異的な阻害剤を,タウ点変異体を発現するベクターを注入したマウスおよびタウ点変異体をプリオンプロモーターのもとで強発現するマウスに28日間にわたり腹腔投与したところ,ともに,歯状回においてリン酸化タウのタンパク質量が有意に低下した.これらの結果から,タウはセラミドの合成に依存してエキソソームに取り込まれ,また,中性スフィンゴミエリナーゼの阻害剤は歯状回へのタウの沈着の進展を有意に抑制することが示された.
おわりに
以上の結果から,アルツハイマー病の初期の段階において,タウの沈着が嗅内野から海馬に進展する際にミクログリアの放出するエキソソームが直接的に関与することを示唆された(図1).ひとつの可能性として,これはタウがシナプス間隙を介して移行するという説とは別に,シナプスの外部においてミクログリアが不活性化したシナプスや樹状突起あるいは細胞体を貪食することによりタウを取り込み,消化できない部分をエキソソームを介し放出することがタウの沈着の進展に関与することが示唆される.ミクログリアやエキソソームはさまざまな役割をはたしており,今回の結果が臨床への直接的な応用にはつながりにくいが,新しい予防薬や治療薬の開発の対象として今後の発展が期待される.
文 献
- Braak, H. & Braak, E.: Neuropathological staging of Alzheimer-related changes. Acta Neuropathol., 82, 239-259 (1991)[PubMed]
- Andaloussi-S, E. L., Mager, I., Breakefield, X. O. et al.: Extracellular vesicles: biology and emerging therapeutic opportunities. Nat. Rev. Drug Discov., 12, 347-357 (2013)[PubMed]
- Saman, S., Kim, W., Raya, M. et al.: Exosome-associated tau is secreted in tauopathy models and is selectively phosphorylated in cerebrospinal fluid in early Alzheimer disease. J. Biol. Chem., 287, 3842-3849 (2012)[PubMed]
- Fiandaca, M. S., Kapogiannis, D., Mapstone, M. et al.: Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: a case-control study. Alzheimers Dement., 11, 600-607 e601 (2015)[PubMed]
- Harris, J. A., Koyama, A., Maeda, S. et al.: Human P301L-mutant tau expression in mouse entorhinal-hippocampal network causes tau aggregation and presynaptic pathology but no cognitive deficits. PLoS One, 7, e45881 (2012)[PubMed]
- de Calignon, A., Polydoro, M., Suarez-Calvet, M. et al.: Propagation of tau pathology in a model of early Alzheimer's disease. Neuron, 73, 685-697 (2012)[PubMed]
- Liu, L., Drouet, V., Wu, J. W. et al.: Trans-synaptic spread of tau pathology in vivo. PLoS One, 7, e31302 (2012)[PubMed]
- Yoshiyama, Y., Higuchi, M., Zhang, B. et al.: Synapse loss and microglial activation precede tangles in a P301S tauopathy mouse model. Neuron, 53, 337-351 (2007)[PubMed]
- Elmore, M. R., Najafi, A. R., Koike, M. A. et al.: Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron, 82, 380-397 (2014)[PubMed]
- Trajkovic, K., Hsu, C., Chiantia, S. et al.: Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science, 319, 1244-1247 (2008)[PubMed]
著者プロフィール
略歴:米国Boston大学School of Medicine主任研究員.
研究テーマ:アルツハイマー病および自閉症におけるミクログリアのかかわる病態の解明および治療法の開発.
池津 庸哉(Tsuneya Ikezu)
米国Boston大学School of Medicine教授.
研究室URL:http://www.bumc.bu.edu/busm-pm/research/laboratories/lmnt/
© 2015 池津聖子・池津庸哉 Licensed under CC 表示 2.1 日本