転写因子Runx3による自然リンパ球の分化の制御
海老原 敬
(米国Washington大学School of Medicine,Division of Rheumatology)
email:海老原 敬
DOI: 10.7875/first.author.2015.111
Runx3 specifies lineage commitment of innate lymphoid cells.
Takashi Ebihara, Christina Song, Stacy H. Ryu, Beatrice Plougastel-Douglas, Liping Yang, Ditsa Levanon, Yoram Groner, Michael D. Bern, Thaddeus S. Stappenbeck, Marco Colonna, Takeshi Egawa, Wayne M. Yokoyama
Nature Immunology, 16, 1124-1133 (2015)
自然リンパ球は粘膜に存在し,外界からの病原体に対する初期の免疫応答を担当し粘膜を維持する機能をもつ.分泌するサイトカインにより1型自然リンパ球,2型自然リンパ球,3型自然リンパ球の3つのサブセットに大きく分類されるが,おのおののサブセットへの分化の決定機構についてはいまだ詳細は明らかにされていない.筆者らは,転写因子Runx3は1型自然リンパ球および3型自然リンパ球の分化において必須であるが,2型自然リンパ球の分化には必要のないことを明らかにした.Runx3は1型自然リンパ球の生存に必須であり,3型自然リンパ球の機能および分化に必須の転写因子RORγtとその下流の転写因子AHRを制御していた.また,自然リンパ球において特異的にRunx3を欠失したマウスは病原大腸菌であるCitrobacter rodentiumに対し易感染性を示した.
自然リンパ球は粘膜において初期の免疫誘導を担当し,粘膜を維持しリンパ組織の形成にも関与する.自然リンパ球のサブセットは大きく分けて3種類,I型サイトカインを分泌する1型自然リンパ球,II型サイトカインを分泌する2型自然リンパ球,III型サイトカインを分泌する3型自然リンパ球に分類される1)(図1).近年,自然リンパ球に特異的な前駆細胞としてCHILPおよびILCPが発見されたが,自然リンパ球サブセットへの分化の決定機構について,いまだ詳細は明らかにされていない.
転写因子であるRunxファミリーはRunx1,Runx2,Runx3から構成され,いずれもCBFβと結合してはじめて転写因子として機能する.Runx2はおもに骨芽細胞に,Runx1およびRunx3はさまざまな血球に発現しており,血球の機能および分化をつかさどる2).この研究では,自然リンパ球サブセットの分化の決定機構におけるRunxファミリーの役割について追求した.
Runxファミリーは遠位プロモーターおよび近位プロモーターから2つの転写産物が産生されるが,とくに,遠位プロモーターからの転写産物がタンパク質レベルと相関する3).RT-PCR法により,消化管の自然リンパ球サブセットはおもにRunx3を発現していること,1型自然リンパ球および3型自然リンパ球においては遠位プロモーターからRunx3の転写産物が発現しているが,2型自然リンパ球においては発現していないことが明らかにされた.さらに,自然リンパ球サブセットにおける遠位プロモーターからのRunx3の転写産物の発現は,1型自然リンパ球において非常に高く,3型自然リンパ球においては中程度,2型自然リンパ球において発現はほとんど検出されなかった.
Runx3を発現している自然リンパ球はNKp46陰性3型自然リンパ球のほかはすべてNKp46を発現している.Runx3の欠損による機能の不全はRunx1により部分的に補償されることが報告されていることから4),Runxファミリーの結合パートナーであるCBFβを,NKp46を発現している1型自然リンパ球およびNKp46陽性3型自然リンパ球において特異的に欠損させることにより,1型自然リンパ球およびNKp46陽性3型自然リンパ球においてすべてのRunxファミリーが機能しないマウスを作製した.このマウスでは消化管において1型自然リンパ球およびNKp46陽性3型自然リンパ球がほぼ消失した.このことから,CBFβは1型自然リンパ球およびNKp46陽性3型自然リンパ球の分化に必要であることが示された.
NKp46を発現している細胞のみでRunx3を欠損するマウス,および,すべての血球においてRunx3を欠損するマウスを作製した.NKp46を発現している細胞のみでRunx3を欠損するマウスにおいては1型自然リンパ球およびNKp46陽性3型自然リンパ球の著明な減少が認められたが,NKp46を発現している細胞においてCBFβを欠損するマウスと比べるとその減少は軽度であった.すべての血球においてRunx3を欠損するマウスでは骨髄において既知の自然リンパ球の前駆細胞が正常に分化していたが,消化管粘膜固有層やパイエル板から3型自然リンパ球はほとんど検出されなかった.一方,消化管において2型自然リンパ球の分化は正常であった.以上より,Runx3は1型自然リンパ球およびすべての3型自然リンパ球の分化に必須であることが示された.
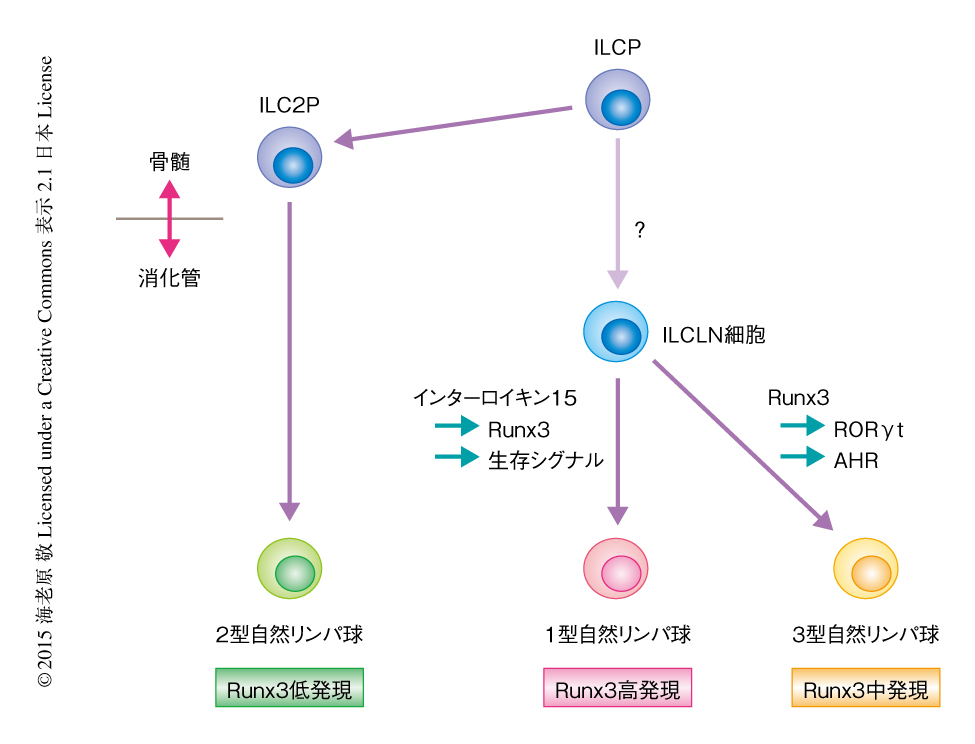
すべての血球においてRunx3を欠損するマウスにおいては自然リンパ球の前駆細胞としてILCPまでは正常に分化していた.ILCPは転写因子GATA3を発現するが転写因子RORγtは発現しない.一方,3型自然リンパ球はGATA3およびRORγtを発現する.そこで,3型自然リンパ球はRunx3が欠損しているとRORγtを発現できないという仮説をたてた.すべての血球においてRunx3を欠損するマウスにて消化管粘膜固有層でのGATA3およびRORγtの発現について検討した結果,GATA3を中程度まで発現するがRORγtを発現しない細胞が蓄積していた.この細胞はおのおのの自然リンパ球のサブセットのマーカーの発現はなくILCLN細胞と名づけた.この細胞の集団は野生型のマウスにも少数が存在していたため,RORγtのノックインマウスからILCLN細胞を分離しリンパ球を欠損するマウスに移入したところ,消化管において1型自然リンパ球および3型自然リンパ球へと分化したが2型自然リンパ球には分化しなかった.一方,Runx3を欠損するILCLN細胞は野生型のILCLN細胞より低い頻度で1型自然リンパ球へと分化したが,3型自然リンパ球にはほとんど分化しなかった.以上より,ILCLN細胞は1型自然リンパ球および3型自然リンパ球に特異的に分化する前駆細胞であり,Runx3は3型自然リンパ球がRORγtを発現するのに必須の転写因子であることが示唆された.
Runx3によるRORγtの発現制御の機構について検討した.Th17細胞においてはRunx1がRORγtの発現を制御しており5),また,Runx3はRunx1と同じ部位と結合する.これらのことから,Runx3がRORγtの発現を直接的に制御しているという仮説をたてた.ヒトのナチュラルキラー細胞系列を用いたルシフェラーゼアッセイにより,Runx3はRORγtの遺伝子プロモーターにある結合部位に依存してその転写を制御すること,3型自然リンパ球を用いたクロマチン免疫沈降法により,Runx3はRORγtの遺伝子プロモーターと結合することが明らかにされた.以上より,Runx3はRORγtを直接的に制御していることが示唆された.
転写因子AHRは3型自然リンパ球の機能および分化に必須であることから,Runx3の欠損によりAHRの発現が影響をうけるかどうか検討した.すべての血球においてRunx3を欠損するマウスの消化管粘膜固有層からは,RORγtと同様にAHRも検出されなかった.このことから,AHRの発現がRunx3の下流において制御されていることが示唆された.これが,Runx3がAHRの発現を直接的に制御しているためなのか,あるいは,RORγtを介した間接的な作用なのかを検討するため,RORγtのノックインマウスを用いて同様の実験を行った.ノックインマウスにおけるRORγtの発現は野生型のマウスと比べ約50%低下するが,それとともに,AHRの発現も約50%低下した.このことから,AHRの発現がRORγtの下流において直接的に制御されていることが示唆された.また,3型自然リンパ球と同じサイトカインを分泌しAHRおよびRORγtを発現するTh17細胞において,RORγtはAHRの遺伝子エンハンサー領域と結合する6).したがって,3型自然リンパ球においても同様の機序がはたらいているのかもしれない.以上より,Runx3はRORγtの発現およびその下流にあるAHRの発現をともに制御することにより,3型自然リンパ球の分化に寄与することが明らかにされた.
1型自然リンパ球の分化におけるRunx3の作用機序について検討した.脾臓のナチュラルキラー細胞ではRunx3はインターロイキン15シグナルの下流において生存や増殖を制御している7).消化管の1型自然リンパ球も同様にその分化や生存にインターロイキン15を必要とするため,Runx3は消化管の1型自然リンパ球の生存において必須であるという仮説をたてた.アポトーシスアッセイをしたところ,CBFβを欠損した1型自然リンパ球およびRunx3を欠損した1型自然リンパ球は,野生型の1型自然リンパ球と比べ,有意にアポトーシスを起こした.ナチュラルキラー細胞において抗アポトーシスタンパク質であるBcl-2の発現はインターロイキン15の刺激により誘導されその生存に寄与する8).インターロイキン15により刺激した消化管の1型自然リンパ球において,Bcl-2はCBFβの欠損により著明に減少した.以上より,Runx3は1型自然リンパ球の生存に必須の転写因子であることが示された.また,Runx3は3型自然リンパ球の生存を制御しているのかどうか検討したが,すべての血球においてRunx3を欠損することにより消化管に蓄積するILCLN細胞はアポトーシスを起こさなかった.したがって,Runx3は1型自然リンパ球の生存および維持を制御しているが,3型自然リンパ球の生存には必須でないことが示された.
Runx3は自然リンパ球のほかにものさまざまな血球において発現していることから,すべての血球においてRunx3を欠損するマウスにおいて,自然リンパ球以外の血球が自然リンパ球の分化を制御している可能性があった.そこで,すべての血球においてRunx3を欠損するマウス(Ly5.2)および対象となるマウス(Ly5.2)から骨髄を採取し,それぞれ,Ly5.1マウスの骨髄と1対1で混合し,放射線を照射したLy5.1マウスに移入して競合的な骨髄キメラを作製した.その結果,Runx3を欠損すると1型自然リンパ球および3型自然リンパ球の分化の不全を起こすこと,2型自然リンパ球の分化はRunx3の欠損に影響をうけないことが明らかにされた.以上より,1型自然リンパ球および3型自然リンパ球においては細胞内在性のRunx3がそれぞれの分化に必須であることが示された.
自然リンパ球におけるRunx3の生理的な意義について検討するため,マウスの病原大腸菌であるCitrobacter rodentiumの感染モデルを用いた.すべての血球においてRunx3を欠損するマウスは自然リンパ球以外の細胞も影響をうけているため,NKp46を発現している細胞のみでRunx3を欠損するマウスを使用した.C. rodentiumの感染から8日のちの重症度を評価したところ,NKp46を発現している細胞のみでRunx3を欠損するマウスでは対照となるマウスに比べ,炎症のため消化管が短くなり,脾臓においてより多くのC. rodentiumが検出され,組織学的にもより重度であった.C. rodentium感染症の急性期の制御にはインターフェロンγおよびインターロイキン22の産生が重要であることから9),大腸における1型自然リンパ球によるインターフェロンγの産生,および,NKp46陽性3型自然リンパ球によるインターロイキン22の産生について評価した.その結果,インターフェロンγを産生する1型自然リンパ球およびインターロイキン22を産生するNKp46陽性3型自然リンパ球は感染ののちほぼ消失した.以上より,自然リンパ球においてRunx3はC. rodentiumに対する感染防御に寄与することが示された.
今回の研究により,Runx3による自然リンパ球サブセットの分化の決定機構が明らかにされた(図2).これまで,2型自然リンパ球に特異的な前駆細胞は発見されていたが,1型自然リンパ球および3型自然リンパ球に特異的に分化する前駆細胞については明らかにされていなかった.これまでにみつかった自然リンパ球に特異的な前駆細胞はいずれも消化管へのホーミングに必須とされるインテグリンα4β7を発現していたが,ILCLN細胞はα4β7は発現していなかった.すでに,消化管の自然リンパ球は生後すぐにはα4β7を発現しているが,しだいにその発現は低下することが明らかにされている10).今回,筆者らが同定したILCLN細胞は,すでにホーミングが終了し,最終的に1型自然リンパ球および3型自然リンパ球に分化する直前の前駆細胞であると推察された.
略歴:2007年 北海道大学大学院医学研究科にて博士号取得,同年 北海道大学大学院先端生命科学院 特任助教,2009年 米国Washington大学School of Medicine博士研究員を経て,2014年にて同Research specialist.
研究テーマ:ナチュラルキラー細胞および自然リンパ球.
関心事:ナチュラルキラー細胞を“強く”すること.
© 2015 海老原 敬 Licensed under CC 表示 2.1 日本
(米国Washington大学School of Medicine,Division of Rheumatology)
email:海老原 敬
DOI: 10.7875/first.author.2015.111
Runx3 specifies lineage commitment of innate lymphoid cells.
Takashi Ebihara, Christina Song, Stacy H. Ryu, Beatrice Plougastel-Douglas, Liping Yang, Ditsa Levanon, Yoram Groner, Michael D. Bern, Thaddeus S. Stappenbeck, Marco Colonna, Takeshi Egawa, Wayne M. Yokoyama
Nature Immunology, 16, 1124-1133 (2015)
要 約
自然リンパ球は粘膜に存在し,外界からの病原体に対する初期の免疫応答を担当し粘膜を維持する機能をもつ.分泌するサイトカインにより1型自然リンパ球,2型自然リンパ球,3型自然リンパ球の3つのサブセットに大きく分類されるが,おのおののサブセットへの分化の決定機構についてはいまだ詳細は明らかにされていない.筆者らは,転写因子Runx3は1型自然リンパ球および3型自然リンパ球の分化において必須であるが,2型自然リンパ球の分化には必要のないことを明らかにした.Runx3は1型自然リンパ球の生存に必須であり,3型自然リンパ球の機能および分化に必須の転写因子RORγtとその下流の転写因子AHRを制御していた.また,自然リンパ球において特異的にRunx3を欠失したマウスは病原大腸菌であるCitrobacter rodentiumに対し易感染性を示した.
はじめに
自然リンパ球は粘膜において初期の免疫誘導を担当し,粘膜を維持しリンパ組織の形成にも関与する.自然リンパ球のサブセットは大きく分けて3種類,I型サイトカインを分泌する1型自然リンパ球,II型サイトカインを分泌する2型自然リンパ球,III型サイトカインを分泌する3型自然リンパ球に分類される1)(図1).近年,自然リンパ球に特異的な前駆細胞としてCHILPおよびILCPが発見されたが,自然リンパ球サブセットへの分化の決定機構について,いまだ詳細は明らかにされていない.
転写因子であるRunxファミリーはRunx1,Runx2,Runx3から構成され,いずれもCBFβと結合してはじめて転写因子として機能する.Runx2はおもに骨芽細胞に,Runx1およびRunx3はさまざまな血球に発現しており,血球の機能および分化をつかさどる2).この研究では,自然リンパ球サブセットの分化の決定機構におけるRunxファミリーの役割について追求した.
1.1型自然リンパ球および3型自然リンパ球はRunx3を発現する
Runxファミリーは遠位プロモーターおよび近位プロモーターから2つの転写産物が産生されるが,とくに,遠位プロモーターからの転写産物がタンパク質レベルと相関する3).RT-PCR法により,消化管の自然リンパ球サブセットはおもにRunx3を発現していること,1型自然リンパ球および3型自然リンパ球においては遠位プロモーターからRunx3の転写産物が発現しているが,2型自然リンパ球においては発現していないことが明らかにされた.さらに,自然リンパ球サブセットにおける遠位プロモーターからのRunx3の転写産物の発現は,1型自然リンパ球において非常に高く,3型自然リンパ球においては中程度,2型自然リンパ球において発現はほとんど検出されなかった.
2.CBFβは1型自然リンパ球およびNKp46陽性3型自然リンパ球の分化に必須である
Runx3を発現している自然リンパ球はNKp46陰性3型自然リンパ球のほかはすべてNKp46を発現している.Runx3の欠損による機能の不全はRunx1により部分的に補償されることが報告されていることから4),Runxファミリーの結合パートナーであるCBFβを,NKp46を発現している1型自然リンパ球およびNKp46陽性3型自然リンパ球において特異的に欠損させることにより,1型自然リンパ球およびNKp46陽性3型自然リンパ球においてすべてのRunxファミリーが機能しないマウスを作製した.このマウスでは消化管において1型自然リンパ球およびNKp46陽性3型自然リンパ球がほぼ消失した.このことから,CBFβは1型自然リンパ球およびNKp46陽性3型自然リンパ球の分化に必要であることが示された.
3.Runx3は1型自然リンパ球および3型自然リンパ球の分化に必須である
NKp46を発現している細胞のみでRunx3を欠損するマウス,および,すべての血球においてRunx3を欠損するマウスを作製した.NKp46を発現している細胞のみでRunx3を欠損するマウスにおいては1型自然リンパ球およびNKp46陽性3型自然リンパ球の著明な減少が認められたが,NKp46を発現している細胞においてCBFβを欠損するマウスと比べるとその減少は軽度であった.すべての血球においてRunx3を欠損するマウスでは骨髄において既知の自然リンパ球の前駆細胞が正常に分化していたが,消化管粘膜固有層やパイエル板から3型自然リンパ球はほとんど検出されなかった.一方,消化管において2型自然リンパ球の分化は正常であった.以上より,Runx3は1型自然リンパ球およびすべての3型自然リンパ球の分化に必須であることが示された.
4.3型自然リンパ球においてRunx3はRORγtの発現を制御する
すべての血球においてRunx3を欠損するマウスにおいては自然リンパ球の前駆細胞としてILCPまでは正常に分化していた.ILCPは転写因子GATA3を発現するが転写因子RORγtは発現しない.一方,3型自然リンパ球はGATA3およびRORγtを発現する.そこで,3型自然リンパ球はRunx3が欠損しているとRORγtを発現できないという仮説をたてた.すべての血球においてRunx3を欠損するマウスにて消化管粘膜固有層でのGATA3およびRORγtの発現について検討した結果,GATA3を中程度まで発現するがRORγtを発現しない細胞が蓄積していた.この細胞はおのおのの自然リンパ球のサブセットのマーカーの発現はなくILCLN細胞と名づけた.この細胞の集団は野生型のマウスにも少数が存在していたため,RORγtのノックインマウスからILCLN細胞を分離しリンパ球を欠損するマウスに移入したところ,消化管において1型自然リンパ球および3型自然リンパ球へと分化したが2型自然リンパ球には分化しなかった.一方,Runx3を欠損するILCLN細胞は野生型のILCLN細胞より低い頻度で1型自然リンパ球へと分化したが,3型自然リンパ球にはほとんど分化しなかった.以上より,ILCLN細胞は1型自然リンパ球および3型自然リンパ球に特異的に分化する前駆細胞であり,Runx3は3型自然リンパ球がRORγtを発現するのに必須の転写因子であることが示唆された.
Runx3によるRORγtの発現制御の機構について検討した.Th17細胞においてはRunx1がRORγtの発現を制御しており5),また,Runx3はRunx1と同じ部位と結合する.これらのことから,Runx3がRORγtの発現を直接的に制御しているという仮説をたてた.ヒトのナチュラルキラー細胞系列を用いたルシフェラーゼアッセイにより,Runx3はRORγtの遺伝子プロモーターにある結合部位に依存してその転写を制御すること,3型自然リンパ球を用いたクロマチン免疫沈降法により,Runx3はRORγtの遺伝子プロモーターと結合することが明らかにされた.以上より,Runx3はRORγtを直接的に制御していることが示唆された.
5.Runx3はRORγtを介してAHRの発現を制御する
転写因子AHRは3型自然リンパ球の機能および分化に必須であることから,Runx3の欠損によりAHRの発現が影響をうけるかどうか検討した.すべての血球においてRunx3を欠損するマウスの消化管粘膜固有層からは,RORγtと同様にAHRも検出されなかった.このことから,AHRの発現がRunx3の下流において制御されていることが示唆された.これが,Runx3がAHRの発現を直接的に制御しているためなのか,あるいは,RORγtを介した間接的な作用なのかを検討するため,RORγtのノックインマウスを用いて同様の実験を行った.ノックインマウスにおけるRORγtの発現は野生型のマウスと比べ約50%低下するが,それとともに,AHRの発現も約50%低下した.このことから,AHRの発現がRORγtの下流において直接的に制御されていることが示唆された.また,3型自然リンパ球と同じサイトカインを分泌しAHRおよびRORγtを発現するTh17細胞において,RORγtはAHRの遺伝子エンハンサー領域と結合する6).したがって,3型自然リンパ球においても同様の機序がはたらいているのかもしれない.以上より,Runx3はRORγtの発現およびその下流にあるAHRの発現をともに制御することにより,3型自然リンパ球の分化に寄与することが明らかにされた.
6.Runx3は1型自然リンパ球の生存に必須である
1型自然リンパ球の分化におけるRunx3の作用機序について検討した.脾臓のナチュラルキラー細胞ではRunx3はインターロイキン15シグナルの下流において生存や増殖を制御している7).消化管の1型自然リンパ球も同様にその分化や生存にインターロイキン15を必要とするため,Runx3は消化管の1型自然リンパ球の生存において必須であるという仮説をたてた.アポトーシスアッセイをしたところ,CBFβを欠損した1型自然リンパ球およびRunx3を欠損した1型自然リンパ球は,野生型の1型自然リンパ球と比べ,有意にアポトーシスを起こした.ナチュラルキラー細胞において抗アポトーシスタンパク質であるBcl-2の発現はインターロイキン15の刺激により誘導されその生存に寄与する8).インターロイキン15により刺激した消化管の1型自然リンパ球において,Bcl-2はCBFβの欠損により著明に減少した.以上より,Runx3は1型自然リンパ球の生存に必須の転写因子であることが示された.また,Runx3は3型自然リンパ球の生存を制御しているのかどうか検討したが,すべての血球においてRunx3を欠損することにより消化管に蓄積するILCLN細胞はアポトーシスを起こさなかった.したがって,Runx3は1型自然リンパ球の生存および維持を制御しているが,3型自然リンパ球の生存には必須でないことが示された.
7.1型自然リンパ球および3型自然リンパ球の分化において細胞内在性のRunx3が必須である
Runx3は自然リンパ球のほかにものさまざまな血球において発現していることから,すべての血球においてRunx3を欠損するマウスにおいて,自然リンパ球以外の血球が自然リンパ球の分化を制御している可能性があった.そこで,すべての血球においてRunx3を欠損するマウス(Ly5.2)および対象となるマウス(Ly5.2)から骨髄を採取し,それぞれ,Ly5.1マウスの骨髄と1対1で混合し,放射線を照射したLy5.1マウスに移入して競合的な骨髄キメラを作製した.その結果,Runx3を欠損すると1型自然リンパ球および3型自然リンパ球の分化の不全を起こすこと,2型自然リンパ球の分化はRunx3の欠損に影響をうけないことが明らかにされた.以上より,1型自然リンパ球および3型自然リンパ球においては細胞内在性のRunx3がそれぞれの分化に必須であることが示された.
8.自然リンパ球においてRunx3は病原細菌に対する感染防御に寄与する
自然リンパ球におけるRunx3の生理的な意義について検討するため,マウスの病原大腸菌であるCitrobacter rodentiumの感染モデルを用いた.すべての血球においてRunx3を欠損するマウスは自然リンパ球以外の細胞も影響をうけているため,NKp46を発現している細胞のみでRunx3を欠損するマウスを使用した.C. rodentiumの感染から8日のちの重症度を評価したところ,NKp46を発現している細胞のみでRunx3を欠損するマウスでは対照となるマウスに比べ,炎症のため消化管が短くなり,脾臓においてより多くのC. rodentiumが検出され,組織学的にもより重度であった.C. rodentium感染症の急性期の制御にはインターフェロンγおよびインターロイキン22の産生が重要であることから9),大腸における1型自然リンパ球によるインターフェロンγの産生,および,NKp46陽性3型自然リンパ球によるインターロイキン22の産生について評価した.その結果,インターフェロンγを産生する1型自然リンパ球およびインターロイキン22を産生するNKp46陽性3型自然リンパ球は感染ののちほぼ消失した.以上より,自然リンパ球においてRunx3はC. rodentiumに対する感染防御に寄与することが示された.
おわりに
今回の研究により,Runx3による自然リンパ球サブセットの分化の決定機構が明らかにされた(図2).これまで,2型自然リンパ球に特異的な前駆細胞は発見されていたが,1型自然リンパ球および3型自然リンパ球に特異的に分化する前駆細胞については明らかにされていなかった.これまでにみつかった自然リンパ球に特異的な前駆細胞はいずれも消化管へのホーミングに必須とされるインテグリンα4β7を発現していたが,ILCLN細胞はα4β7は発現していなかった.すでに,消化管の自然リンパ球は生後すぐにはα4β7を発現しているが,しだいにその発現は低下することが明らかにされている10).今回,筆者らが同定したILCLN細胞は,すでにホーミングが終了し,最終的に1型自然リンパ球および3型自然リンパ球に分化する直前の前駆細胞であると推察された.
文 献
- Sonnenberg, G. F. & Artis, D.: Innate lymphoid cells in the initiation, regulation and resolution of inflammation. Nat. Med., 21, 698-708 (2015)[PubMed]
- Wong, W. F., Kohu, K., Chiba, T. et al.: Interplay of transcription factors in T-cell differentiation and function: the role of Runx. Immunology, 132, 157-164 (2011)[PubMed]
- Egawa, T. & Littman, D. R.: ThPOK acts late in specification of the helper T cell lineage and suppresses Runx-mediated commitment to the cytotoxic T cell lineage. Nat. Immunol., 9, 1131-1139 (2008)[PubMed]
- Egawa, T., Tillman, R. E., Naoe, Y. et al.: The role of the Runx transcription factors in thymocyte differentiation and in homeostasis of naive T cells. J. Exp. Med., 204, 1945-1957 (2007)[PubMed]
- Lazarevic, V., Chen, X., Shim, J. H. et al.: T-bet represses TH17 differentiation by preventing Runx1-mediated activation of the gene encoding RORγt. Nat. Immunol., 12, 96-104 (2011)[PubMed]
- Ciofani, M., Madar, A., Galan, C. et al.: A validated regulatory network for Th17 cell specification. Cell, 151, 289-303 (2012)[PubMed]
- Levanon, D., Negreanu, V., Lotem, J. et al.: Transcription factor Runx3 regulates interleukin-15-dependent natural killer cell activation. Mol. Cell. Biol., 34, 1158-1169 (2014)[PubMed]
- Cooper, M. A., Bush, J. E., Fehniger, T. A. et al.: In vivo evidence for a dependence on interleukin 15 for survival of natural killer cells. Blood, 100, 3633-3638 (2002)[PubMed]
- Hwang, E. S., Jang, E., Bolm, A. N. et al.: Citrobacter rodentium: infection, inflammation and the microbiota. Nat. Rev. Microbiol., 12, 612-623 (2014)[PubMed]
- Hoyler, T., Klose, C. S., Souabni, A. et al.: The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity, 37, 634-648 (2012)[PubMed]
著者プロフィール
略歴:2007年 北海道大学大学院医学研究科にて博士号取得,同年 北海道大学大学院先端生命科学院 特任助教,2009年 米国Washington大学School of Medicine博士研究員を経て,2014年にて同Research specialist.
研究テーマ:ナチュラルキラー細胞および自然リンパ球.
関心事:ナチュラルキラー細胞を“強く”すること.
© 2015 海老原 敬 Licensed under CC 表示 2.1 日本