モータータンパク質kinesin-5が隣接する微小管を架橋しながら集団で発生する力の制御
島本 勇太
(米国Rockefeller大学Laboratory of Chemistry and Cell Biology)
email:島本勇太
DOI: 10.7875/first.author.2015.110
Measuring pushing and braking forces generated by ensembles of kinesin-5 crosslinking two microtubules.
Yuta Shimamoto, Scott Forth, Tarun M. Kapoor
Developmental Cell, 34, 669-681 (2015)
紡錘体は微小管を基礎とした染色体の分配装置である.この装置の集合と機能においては,微小管を架橋して運動するモータータンパク質が力の発生の方向や大きさを紡錘体の構造的な特徴に応じて制御することが必要だと考えられている.しかしながら,いかなるモータータンパク質がこのような方式により力を制御するかについては不明であった.筆者らは,光ピンセット法および蛍光1分子計測法を基礎としたin vitro力計測系により,真核生物に高度に保存された四量体からなるモータータンパク質であるkinesin-5が,反平行に相互作用する微小管の重なりの大きさに応じて集団で発生する力を増減させることを明らかにした.さらに,kinesin-5は平行あるいは反平行に相互作用する微小管のあいだで起こるスライド運動に対して抵抗力を発生することがわかった.これらの実験的な観察および数値シミュレーションにより,kinesin-5が細胞骨格の構造および運動のダイナミクスに応じて発生する力をいかに制御しているのかが明らかにされた.
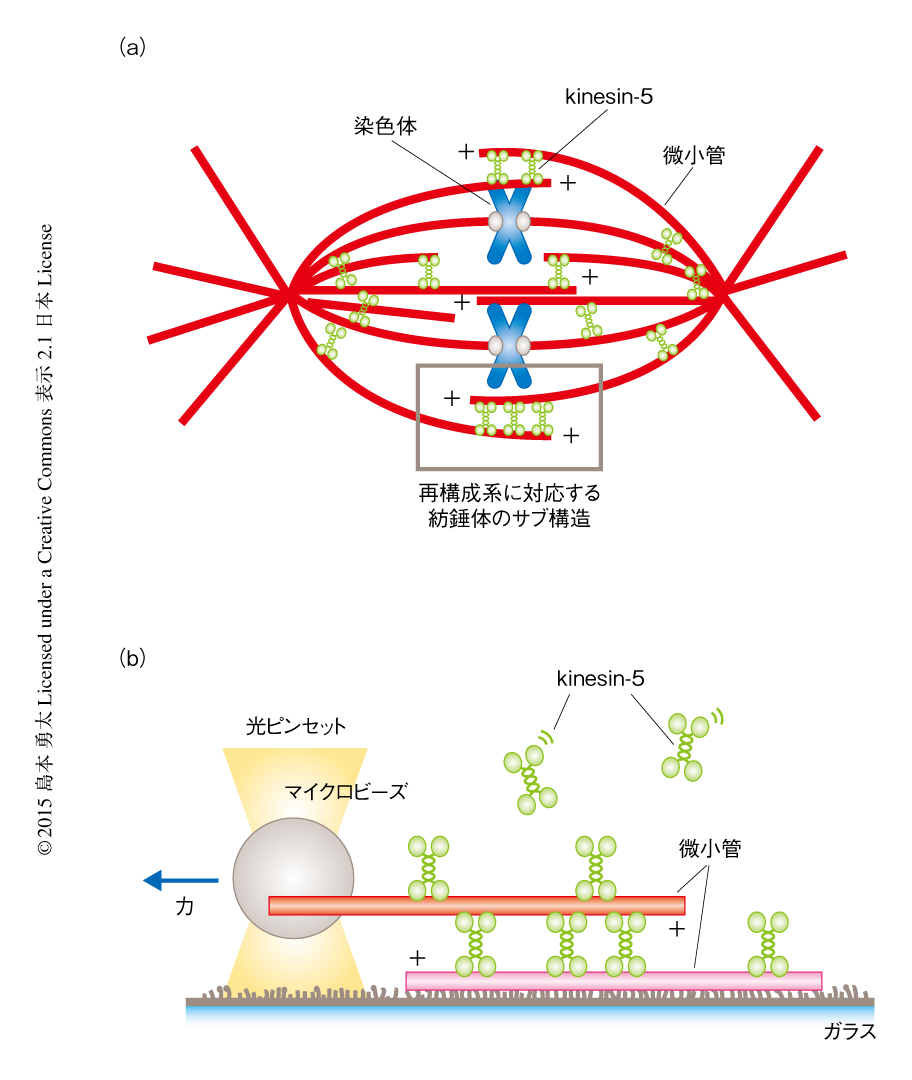
有糸分裂は紡錘体とよばれる微小管を基礎とした双極構造の細胞骨格装置により駆動される1).kinesin-5は微小管のうえを運動する四量体からなるモータータンパク質であり,長さ60 nmほどのダンベル状の構造の両端に,微小管と結合する1対の二量体からなるモータードメインをもつ2).kinesin-5は紡錘体の赤道面の付近に局在し,外向きの力を発生することにより双極構造の形成および維持に本質的な役割をはたすと考えられている1,3)(図1a).また,紡錘体極の付近にも強く局在することから極の形成において力学的な役割を担うこと,細胞分裂の後期には紡錘体の伸長を減速させる抵抗力としてはたらくことなど,ほかの機能も多く示唆されている1,3,4).紡錘体を形成する微小管は,赤道面の付近ではおもに反平行,極の付近ではおもに平行に相互作用する5).隣接する微小管の重なりの領域には多数のkinesin-5が局在し微小管を架橋する.kinesin-1などの単一の微小管のうえを運動するモータータンパク質に比べ,2本の微小管のあいだで力を発生するkinesin-5が多分子の集団としていかに協調的に運動し,発生する力の大きさや方向を決めているのかについてはこれまで調べられていなかった.したがって,kinesin-5は細胞生物学的な観察から示唆された機能をはたすことができるのか,また,そうであるならば,どのような力の発生および制御のしくみにより動いているのかは明らかでなかった.
精製した微小管およびkinesin-5を用いin vitroにおいて“小さな紡錘体”を再構成し,光ピンセット法および蛍光1分子計測法を用いてこの構造体が発生する力を直接的に計測した(図1b).この力計測系は,フローセルの内部にアビジンとビオチンを介して固定された微小管と,マイクロビーズを介して光ピンセットにより捕捉された微小管を基礎とする.これら2本の微小管は重なりの領域において溶液に含まれるkinesin-5により架橋され,kinesin-5による力の発生にともない運動する.力の大きさは光ピンセットのバネ定数とマイクロビーズの変位とを掛け算することにより決定される.微小管とkinesin-5はそれぞれローダミンとGFPにより標識されているため,微小管の重なりの大きさおよび局在するkinesin-5の数を見積もることができる.この力計測系を用いて,kinesin-5の集団が2本の微小管のあいだの重なりの大きさおよび相対的な極性あるいは運動の速度に応じていかに発生する力を制御しているかを定量的に計測した.
kinesin-5を介して反平行に相互作用する微小管のあいだに生じた力を計測したところ,微小管の対はそれぞれのマイナス端の位置が離れる方向に運動し,その力の大きさは微小管の重なりの増加とともに大きくなった.これと相関して,この領域に局在するGFPの蛍光シグナルの強度も増加した.このことから,反平行に相互作用する微小管に生じる力は,その重なりの大きさに応じて増減するkinesin-5の量により制御されることが示唆された.
微小管の重なりの領域に局在するkinesin-5は,そのすべてが隣接する2本の微小管と同時に相互作用しているとはかぎらない(図1b).そこで,光ピンセットを用いて一方の微小管を端から強制的に引きはがし,それにともない生じる破断の数から架橋を形成するkinesin-5の数を見積もった.その結果,架橋を形成していたkinesin-5の数はGFPの蛍光シグナルの強度から見積もった数の約1/3であったが,微小管の重なりの量と相関して増加することがわかった.kinesin-1をはじめとする代表的なモータータンパク質は多数の集団で運動するときしばしば非加算的な力の発生を示す6,7).kinesin-5が架橋する反平行に相互作用する微小管のあいだに生じた力は,おのおののkinesin-5が集団のなかで発生する力の加算的な結果であり,重なりの領域において発生した力が数μm離れた微小管の端まで効率よく伝達していることが示された.
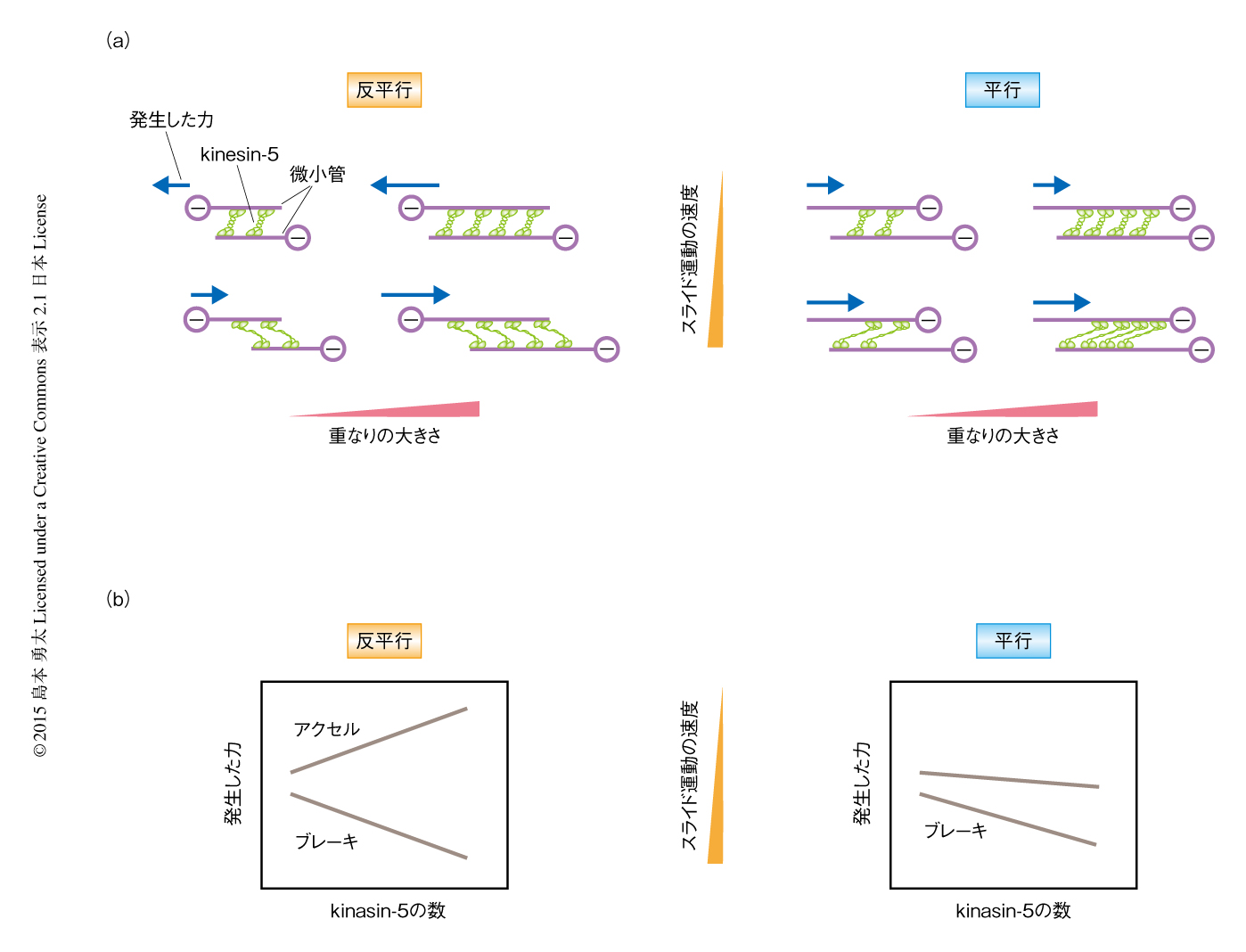
紡錘体を形成する微小管は連続的にスライド運動していることが知られている.とくに赤道面の付近では平均速度30~50 nm/secの極方向の定常的な運動を示す8).また,細胞分裂の後期において紡錘体は数百nm/secの速度で伸長する3,4).kinesin-5のもつ力の加算性がこのような状況においても保存されているかどうかを確かめるため,顕微鏡の試料ステージを一定の速度で動かすことにより微小管に外から強制的にスライド運動をあたえ,そのとき発生する力を計測した.その結果,kinesin-5は微小管の運動速度が遅い(20 nm/s以下)ときにはそのマイナス端を押し離す方向に加速する力を発生し,一方で,微小管の運動速度が非常に速くなると(200 nm/s以上)それに対し抵抗力を発生することが明らかにされた.どちらの速度においても微小管の重なりの量に依存した力の加算性は保存されていた.また,この力は微小管の運動速度が約50 nm/sのときほぼゼロになり,どちらの方向にも力を発生せず微小管の一方向性の運動を許容することがわかった.この速度はkinesin-5が最大の酵素活性速度で微小管のうえを運動するときの値とよく一致した.したがって,kinesin-5は微小管の相対的な運動の速度がkinesin-5自体の内在的な速度よりも遅いか速いかによりアクセルとブレーキを踏み分けるような制御の特性をもつことが示唆された.
kinesin-5は微小管がおもに平行にならんだ紡錘体極の付近にも強く局在する1,2).反平行に相互作用するときと相互作用の向きが反対の微小管をkinesin-5がどのように架橋して力を伝達するかを調べるため,kinesin-5により架橋された平行に相互作用する微小管の対のあいだで発生する力を計測した.その結果,微小管の対は光ピンセットにより捕捉されたマイクロビーズを押したり引いたりするゆらぎ的な力を発生することがわかった.このゆらぎは低速で加水分解するATPのアナログであるAMPPNPの添加により消失したことから,kinesin-5の活性を反映したものであることがわかった.このとき発生する力の大きさは微小管の重なりの量にもkinesin-5の数にも依存せず,1~2分子のkinesin-5が発生する力とつねに同じ程度であった.
kinesin-5の集団が平行に相互作用する微小管の対において抵抗力を発生することができるかどうかを検証するため,反平行に相互作用する微小管の対と同様に,一方の微小管を一定の速度で運動させたときに生じる力を計測した.その結果,kinesin-5は有意な抵抗力を発生し,また,その大きさは微小管のあいだのスライド運動が速くなるにつれて顕著に増大した.さらに,この抵抗力の大きさは微小管の重なりの大きさに応じて増加した.以上の結果から,kinesin-5の集団が発生する力は,架橋する微小管の重なりの量,相対的な極性,微小管のあいだの運動速度に依存して制御されることが明らかにされた.
kinesin-5の集団が多様な力を発生する機能がそのいかなる分子特性に依存するかを理解するため数値モデルシミュレーションを行った.モデルは,力に感受的な酵素活性をもつ二量体からなるモータータンパク質を線形バネで結合することにより四量体のキネシンを構成し,それらを2本の微小管をとおして力学的に相互作用させるというシンプルなものにした.その結果,平行あるいは反平行に相互作用する微小管の対において観察されたkinesin-5の力の発生の特性を,共通する単一セットのパラメーターにより再現できることがわかった.これは,微小管の方向によらずkinesin-5の活性が保存されていることを示唆した.kinesin-5が架橋する2本の微小管の相互作用の向きが反対であると,kinesin-5のどこかに必ずねじれが発生する.そのような状況にもかかわらず,kinesin-5は活性を一定に保つロバスト性を保持しており,微小管のうえで発生する力は集団のあいだで個々の力を積算あるいは相殺することにより制御されていると考えられた.
in vitro再構成系および分子レベルの力計測系を組み合わせることにより,紡錘体の形成に必須のkinesin-5が微小管の相互作用の幾何学的な特徴および運動の特性に応じて集団で発生する力を制御していることがわかった(図2).とくに,反平行に相互作用する微小管の重なりの量に応じて制御される力の発生は,長年にわたり提唱されてきた紡錘体の極のあいだの距離を制御するしくみが3,9),kinesin-5の特性により説明できることを実証したものである.また,平行あるいは反平行に相互作用する微小管の対における抵抗力の発生は,kinesin-5の紡錘体極の形成への関与,細胞分裂の後期における紡錘体の伸長速度の制御など,多様な機能をもちあわせていることを示唆した.これらの機能は隣接する微小管の幾何および運動により制御される.このような機械的な制御のしくみは,生化学的な制御とならんで,アクチンからDNAにいたるあらゆる生体高分子に共通の性質であることが期待される.
略歴:2007年 早稲田大学大学院理工学研究科 修了,2008年 米国Rockefeller大学 博士研究員を経て,2014年より国立遺伝学研究所 テニュアトラック准教授.
研究テーマ:細胞の物理的な特性および機械受容の分子機構.
関心事:有糸分裂は細胞の状態がちがっていても,なぜいつもうまくいくのか.
© 2015 島本 勇太 Licensed under CC 表示 2.1 日本
(米国Rockefeller大学Laboratory of Chemistry and Cell Biology)
email:島本勇太
DOI: 10.7875/first.author.2015.110
Measuring pushing and braking forces generated by ensembles of kinesin-5 crosslinking two microtubules.
Yuta Shimamoto, Scott Forth, Tarun M. Kapoor
Developmental Cell, 34, 669-681 (2015)
要 約
紡錘体は微小管を基礎とした染色体の分配装置である.この装置の集合と機能においては,微小管を架橋して運動するモータータンパク質が力の発生の方向や大きさを紡錘体の構造的な特徴に応じて制御することが必要だと考えられている.しかしながら,いかなるモータータンパク質がこのような方式により力を制御するかについては不明であった.筆者らは,光ピンセット法および蛍光1分子計測法を基礎としたin vitro力計測系により,真核生物に高度に保存された四量体からなるモータータンパク質であるkinesin-5が,反平行に相互作用する微小管の重なりの大きさに応じて集団で発生する力を増減させることを明らかにした.さらに,kinesin-5は平行あるいは反平行に相互作用する微小管のあいだで起こるスライド運動に対して抵抗力を発生することがわかった.これらの実験的な観察および数値シミュレーションにより,kinesin-5が細胞骨格の構造および運動のダイナミクスに応じて発生する力をいかに制御しているのかが明らかにされた.
はじめに
有糸分裂は紡錘体とよばれる微小管を基礎とした双極構造の細胞骨格装置により駆動される1).kinesin-5は微小管のうえを運動する四量体からなるモータータンパク質であり,長さ60 nmほどのダンベル状の構造の両端に,微小管と結合する1対の二量体からなるモータードメインをもつ2).kinesin-5は紡錘体の赤道面の付近に局在し,外向きの力を発生することにより双極構造の形成および維持に本質的な役割をはたすと考えられている1,3)(図1a).また,紡錘体極の付近にも強く局在することから極の形成において力学的な役割を担うこと,細胞分裂の後期には紡錘体の伸長を減速させる抵抗力としてはたらくことなど,ほかの機能も多く示唆されている1,3,4).紡錘体を形成する微小管は,赤道面の付近ではおもに反平行,極の付近ではおもに平行に相互作用する5).隣接する微小管の重なりの領域には多数のkinesin-5が局在し微小管を架橋する.kinesin-1などの単一の微小管のうえを運動するモータータンパク質に比べ,2本の微小管のあいだで力を発生するkinesin-5が多分子の集団としていかに協調的に運動し,発生する力の大きさや方向を決めているのかについてはこれまで調べられていなかった.したがって,kinesin-5は細胞生物学的な観察から示唆された機能をはたすことができるのか,また,そうであるならば,どのような力の発生および制御のしくみにより動いているのかは明らかでなかった.
1.in vitro再構成法を用いた力計測系の構築
精製した微小管およびkinesin-5を用いin vitroにおいて“小さな紡錘体”を再構成し,光ピンセット法および蛍光1分子計測法を用いてこの構造体が発生する力を直接的に計測した(図1b).この力計測系は,フローセルの内部にアビジンとビオチンを介して固定された微小管と,マイクロビーズを介して光ピンセットにより捕捉された微小管を基礎とする.これら2本の微小管は重なりの領域において溶液に含まれるkinesin-5により架橋され,kinesin-5による力の発生にともない運動する.力の大きさは光ピンセットのバネ定数とマイクロビーズの変位とを掛け算することにより決定される.微小管とkinesin-5はそれぞれローダミンとGFPにより標識されているため,微小管の重なりの大きさおよび局在するkinesin-5の数を見積もることができる.この力計測系を用いて,kinesin-5の集団が2本の微小管のあいだの重なりの大きさおよび相対的な極性あるいは運動の速度に応じていかに発生する力を制御しているかを定量的に計測した.
2.kinesin-5を介して反平行に相互作用する微小管の対は重なりの大きさに応じた力を発生する
kinesin-5を介して反平行に相互作用する微小管のあいだに生じた力を計測したところ,微小管の対はそれぞれのマイナス端の位置が離れる方向に運動し,その力の大きさは微小管の重なりの増加とともに大きくなった.これと相関して,この領域に局在するGFPの蛍光シグナルの強度も増加した.このことから,反平行に相互作用する微小管に生じる力は,その重なりの大きさに応じて増減するkinesin-5の量により制御されることが示唆された.
微小管の重なりの領域に局在するkinesin-5は,そのすべてが隣接する2本の微小管と同時に相互作用しているとはかぎらない(図1b).そこで,光ピンセットを用いて一方の微小管を端から強制的に引きはがし,それにともない生じる破断の数から架橋を形成するkinesin-5の数を見積もった.その結果,架橋を形成していたkinesin-5の数はGFPの蛍光シグナルの強度から見積もった数の約1/3であったが,微小管の重なりの量と相関して増加することがわかった.kinesin-1をはじめとする代表的なモータータンパク質は多数の集団で運動するときしばしば非加算的な力の発生を示す6,7).kinesin-5が架橋する反平行に相互作用する微小管のあいだに生じた力は,おのおののkinesin-5が集団のなかで発生する力の加算的な結果であり,重なりの領域において発生した力が数μm離れた微小管の端まで効率よく伝達していることが示された.
3.kinesin-5は微小管のあいだに生じるスライド運動に対してブレーキとしても機能する
紡錘体を形成する微小管は連続的にスライド運動していることが知られている.とくに赤道面の付近では平均速度30~50 nm/secの極方向の定常的な運動を示す8).また,細胞分裂の後期において紡錘体は数百nm/secの速度で伸長する3,4).kinesin-5のもつ力の加算性がこのような状況においても保存されているかどうかを確かめるため,顕微鏡の試料ステージを一定の速度で動かすことにより微小管に外から強制的にスライド運動をあたえ,そのとき発生する力を計測した.その結果,kinesin-5は微小管の運動速度が遅い(20 nm/s以下)ときにはそのマイナス端を押し離す方向に加速する力を発生し,一方で,微小管の運動速度が非常に速くなると(200 nm/s以上)それに対し抵抗力を発生することが明らかにされた.どちらの速度においても微小管の重なりの量に依存した力の加算性は保存されていた.また,この力は微小管の運動速度が約50 nm/sのときほぼゼロになり,どちらの方向にも力を発生せず微小管の一方向性の運動を許容することがわかった.この速度はkinesin-5が最大の酵素活性速度で微小管のうえを運動するときの値とよく一致した.したがって,kinesin-5は微小管の相対的な運動の速度がkinesin-5自体の内在的な速度よりも遅いか速いかによりアクセルとブレーキを踏み分けるような制御の特性をもつことが示唆された.
4.kinesin-5の集団は平行に相互作用する微小管あいだでも重なりの量に依存した抵抗力を発生する
kinesin-5は微小管がおもに平行にならんだ紡錘体極の付近にも強く局在する1,2).反平行に相互作用するときと相互作用の向きが反対の微小管をkinesin-5がどのように架橋して力を伝達するかを調べるため,kinesin-5により架橋された平行に相互作用する微小管の対のあいだで発生する力を計測した.その結果,微小管の対は光ピンセットにより捕捉されたマイクロビーズを押したり引いたりするゆらぎ的な力を発生することがわかった.このゆらぎは低速で加水分解するATPのアナログであるAMPPNPの添加により消失したことから,kinesin-5の活性を反映したものであることがわかった.このとき発生する力の大きさは微小管の重なりの量にもkinesin-5の数にも依存せず,1~2分子のkinesin-5が発生する力とつねに同じ程度であった.
kinesin-5の集団が平行に相互作用する微小管の対において抵抗力を発生することができるかどうかを検証するため,反平行に相互作用する微小管の対と同様に,一方の微小管を一定の速度で運動させたときに生じる力を計測した.その結果,kinesin-5は有意な抵抗力を発生し,また,その大きさは微小管のあいだのスライド運動が速くなるにつれて顕著に増大した.さらに,この抵抗力の大きさは微小管の重なりの大きさに応じて増加した.以上の結果から,kinesin-5の集団が発生する力は,架橋する微小管の重なりの量,相対的な極性,微小管のあいだの運動速度に依存して制御されることが明らかにされた.
5.数値シミュレーションによる分子機構の推定
kinesin-5の集団が多様な力を発生する機能がそのいかなる分子特性に依存するかを理解するため数値モデルシミュレーションを行った.モデルは,力に感受的な酵素活性をもつ二量体からなるモータータンパク質を線形バネで結合することにより四量体のキネシンを構成し,それらを2本の微小管をとおして力学的に相互作用させるというシンプルなものにした.その結果,平行あるいは反平行に相互作用する微小管の対において観察されたkinesin-5の力の発生の特性を,共通する単一セットのパラメーターにより再現できることがわかった.これは,微小管の方向によらずkinesin-5の活性が保存されていることを示唆した.kinesin-5が架橋する2本の微小管の相互作用の向きが反対であると,kinesin-5のどこかに必ずねじれが発生する.そのような状況にもかかわらず,kinesin-5は活性を一定に保つロバスト性を保持しており,微小管のうえで発生する力は集団のあいだで個々の力を積算あるいは相殺することにより制御されていると考えられた.
おわりに
in vitro再構成系および分子レベルの力計測系を組み合わせることにより,紡錘体の形成に必須のkinesin-5が微小管の相互作用の幾何学的な特徴および運動の特性に応じて集団で発生する力を制御していることがわかった(図2).とくに,反平行に相互作用する微小管の重なりの量に応じて制御される力の発生は,長年にわたり提唱されてきた紡錘体の極のあいだの距離を制御するしくみが3,9),kinesin-5の特性により説明できることを実証したものである.また,平行あるいは反平行に相互作用する微小管の対における抵抗力の発生は,kinesin-5の紡錘体極の形成への関与,細胞分裂の後期における紡錘体の伸長速度の制御など,多様な機能をもちあわせていることを示唆した.これらの機能は隣接する微小管の幾何および運動により制御される.このような機械的な制御のしくみは,生化学的な制御とならんで,アクチンからDNAにいたるあらゆる生体高分子に共通の性質であることが期待される.
文 献
- Compton, D. A.: Spindle assembly in animal cells. Annu. Rev. Biochem., 69, 95-114 (2000)[PubMed]
- Kashina, A. S., Baskin, R. J., Cole, D. G. et al.: A bipolar kinesin. Nature, 379, 270-272 (1996)[PubMed]
- Goshima, G. & Scholey, J. M.: Control of mitotic spindle length. Annu. Rev. Cell Dev. Biol., 26, 21-57 (2010)[PubMed]
- Civelekoglu-Scholey, G. & Scholey, J. M.: Motitic motors: kinesin-5 takes a brake. Curr. Biol., 17, R544-R547 (2007)[PubMed]
- McIntosh, J. R. & Landis, S. C.: The distribution of spindle microtubules during mitosis in cultured human cells. J. Cell Biol., 49, 468-497 (1971)[PubMed]
- Furuta, K., Furuta, A., Toyoshima, Y. Y. et al.: Measuring collective transport by defined numbers of processive and nonprocessive kinesin motors. Proc. Natl. Acad. Sci. USA, 110, 501-506 (2013)[PubMed]
- Shubeita, G. T., Tran, S. L., Xu, J. et al.: Consequence of motor copy number on the intracellular transport of kinesin-1-driven lipid droplets. Cell, 135, 1098-1107 (2008)[PubMed]
- Sawin, K. E. & Mitchison, T. J.: Poleward microtubule flux in mitotic spindles assembled in vitro. J. Cell Biol., 112, 941-954 (1991)[PubMed]
- McIntosh, J. R., Hepler, D. G. & Van Wie, D. G.: Model for mitosis. Nature, 224, 659-663 (1969)
著者プロフィール
略歴:2007年 早稲田大学大学院理工学研究科 修了,2008年 米国Rockefeller大学 博士研究員を経て,2014年より国立遺伝学研究所 テニュアトラック准教授.
研究テーマ:細胞の物理的な特性および機械受容の分子機構.
関心事:有糸分裂は細胞の状態がちがっていても,なぜいつもうまくいくのか.
© 2015 島本 勇太 Licensed under CC 表示 2.1 日本