シロイヌナズナ根端の幹細胞ニッチの維持に必要な分泌型ペプチドシグナル
松林 嘉克
(名古屋大学大学院生命農学研究科 応用分子生命科学専攻生理活性物質化学研究室)
email:松林嘉克
DOI: 10.7875/first.author.2010.033
Secreted peptide signals required for maintenance of root stem cell niche in Arabidopsis.
Yo Matsuzaki, Mari Ogawa-Ohnishi, Ayaka Mori, Yoshikatsu Matsubayashi
Science, 329, 1065-1067 (2010)
幹細胞の維持には複雑な細胞間相互作用やシグナル伝達ネットワークが関与しているが,とくに,ニッチとよばれる特異的な細胞外環境が重要である.筆者らは,ペプチドホルモンの翻訳後修飾酵素のひとつであるチロシン硫酸化酵素の欠損株では根端において未分化な幹細胞が失われ根端分裂組織の活性が顕著に低下することに着目して,幹細胞ニッチの維持に関与するチロシン硫酸化ペプチドの探索を行なった.ゲノムデータベースを用いたin silico遺伝子スクリーニング,および,化学合成ペプチドをこの欠損株にあたえるアッセイにより,13アミノ酸残基からなる新規なチロシン硫酸化ペプチドを見い出し,RGFと名づけた.RGFペプチドファミリーは根端の静止中心細胞やコルメラ細胞で特異的に発現しており,幹細胞の維持に関与する転写因子PLETHORAの発現を制御していた.これらのペプチドはニッチシグナルとして根の形態形成に重要な役割をはたしているものと考えられた.
近年,高等植物において,短鎖(数アミノ酸残基から数十アミノ酸残基)の分泌型ペプチドを介した細胞間シグナル伝達がつぎつぎと明らかになっている1,2).オーキシンやサイトカイニンなどの古典的な植物ホルモンは多くの組織に存在してさまざまなクロストークにより多様な生理機能を発揮するのに対して,分泌型ペプチドホルモンは局所的な発現パターンを示し組織特異的な機能を担っているものが多い.
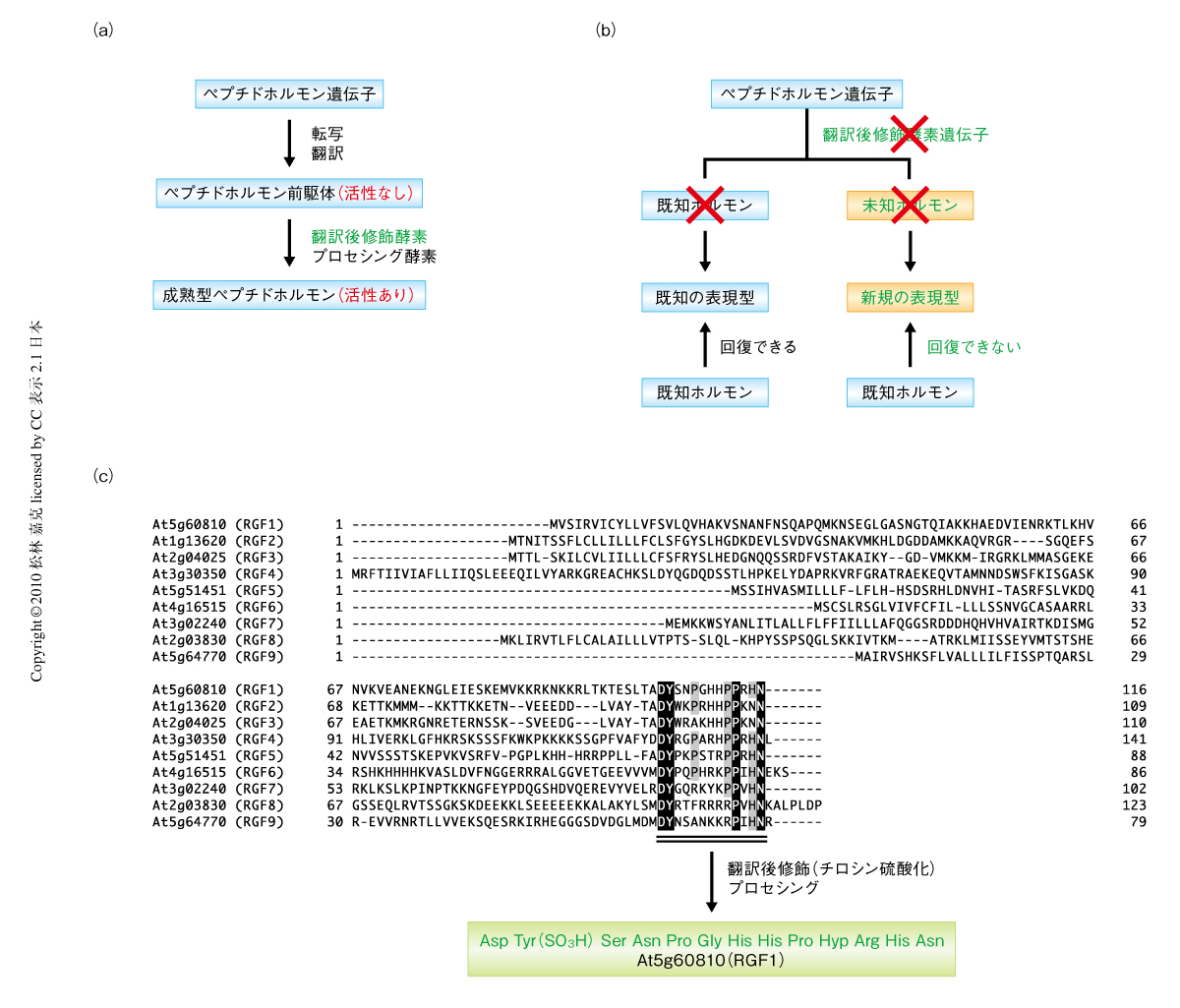
ペプチドホルモンのなかには翻訳後修飾やプロセシング(限定分解)をうけることではじめて本来の機能を示すものが少なくない(図1a).そのため,翻訳後修飾酵素の遺伝子を破壊するとその支配下にあるすべての修飾ペプチドホルモンが活性を失い,結果的にその総和が表現型として現れる(図1b).したがって,翻訳後修飾酵素の欠損株の表現型を詳細に解析すれば未知のホルモンの存在に気づく可能性がある.
2009年に筆者らは,モデル植物であるシロイヌナズナにおいて翻訳後修飾酵素のひとつであるチロシン硫酸化酵素(tyrosylprotein sulfotransferase:TPST)を精製および同定することに成功していた3).このチロシン硫酸化酵素はゴルジ体に局在する1回膜貫通型酵素であり,その遺伝子はシロイヌナズナでは1コピーのみ存在する.動物にもチロシン硫酸化酵素は存在するが4),アミノ酸レベルでの類似性はまったくないことから植物と動物は進化の過程で独立してチロシン硫酸化酵素を獲得したものと考えられる.
この研究の過程で,チロシン硫酸化酵素遺伝子を破壊したシロイヌナズナ植物体tpst-1変異株では根端において未分化な幹細胞が失われ,根端分裂組織の活性も顕著に低下するため根が極端に短くなることに気づいた.一般的に,幹細胞の維持には特異的な細胞外環境(ニッチとよばれる)が必要と考えられている.tpst-1変異株の表現型は既知のチロシン硫酸化ペプチドホルモンであるPSK 5) あるいはPSY1 6) の培地への添加では回復できなかったことから,幹細胞ニッチの維持に関与する未知の硫酸化ペプチドホルモンの存在が強く示唆された.
分泌型ペプチドをコードする遺伝子はシロイヌナズナゲノムに多く見い出され,ORF(open reading frame)が50アミノ酸残基から150アミノ酸残基のものだけでも979個が存在する.このなかから,細胞外分泌シグナルや硫酸化モチーフ配列の有無,ORFの大きさなどを指標として硫酸化ペプチドホルモンの候補を絞り込んだ.PSKやPSY1などの既知の硫酸化ペプチドホルモンでは典型的なORFの大きさは70~110アミノ酸残基で,システイン残基が5個以下であり,硫酸化に必要な最低限のモチーフとして必ずAsp-Tyr配列を含んでいる.この基準でin silicoスクリーニングを行なうと34個にまで絞り込むことができた.さらに,短鎖翻訳後修飾ペプチドホルモンの遺伝子は遺伝子重複によりホモログの存在していることが多いため,個々の候補について全ゲノムを対象にしたBLAST検索を行ない,ファミリーを形成しているペプチドを抽出した.
こうした解析をへて9遺伝子からなる新しいペプチド遺伝子ファミリーに注目した(図1c).この9遺伝子のなかには,公開されているマイクロアレイデータにおいて根端での特異的な発現がみられる複数の遺伝子が含まれていた.さらに,選び出された遺伝子が実際に硫酸化ペプチドをコードするかどうかを実験的に確かめるため,候補のひとつAt5g60810を過剰発現させた形質転換シロイヌナズナを液体培地で培養し,培地に分泌されてくるペプチドの構造をナノ液体クロマトグラフィー-タンデム質量分析計(nano LC-MS/MS)で解析した.その結果,At5g60810に由来する成熟型ペプチドの構造は1残基の硫酸化チロシンを含む13アミノ酸残基からなるペプチドであることが確かめられた(図1c).
この13アミノ酸残基の硫酸化ペプチドを化学合成し,これを添加した培地でtpst-1変異株を生育させた結果,根端に未分化な幹細胞が回復するともに,根端分裂組織の活性も上昇することが明らかとなった.ほかのホモログについても合成ペプチドを用いたアッセイを行った結果,全部で9種類のうち8種類に活性が認められた.こうした実験結果にもとづき,これらのペプチドをRGF(root meristem growth factor)と名づけた.RGFファミリー遺伝子のうち3種類(RGF1,RGF2,RGF3)は根の幹細胞に隣接する静止中心やコルメラ細胞で特異的に発現しており(図2a),RGF4遺伝子は幹細胞の周辺のいくつかの細胞層でやや広がった発現を示した.ほかのホモログ遺伝子の多くも弱いながら根端部での発現が認められた.また,免疫染色の結果,分泌されたペプチドは発現部位から根端分裂組織の全体へ組織内を拡散しているようすが観察された(図2b).
RGF1の培地への添加によってtpst-1変異株の幹細胞は回復し,根端分裂組織の活性も野生株の70%程度まで上昇したが,培地にさらに2種類の硫酸化ペプチド,PSKとPSY1を添加すると根の成長は野生株と匹敵するレベルにまで回復した.このことは,幹細胞の回復にはRGF1単独で十分であるが,根端分裂組織の活性の完全な回復にはPSKとPSY1の共存が必要であることを意味していた.実際,PSKとPSY1は細胞増殖の促進をはじめとした多面的な生理機能を示すことが知られている.RGF1をtpst-1変異株にあたえた場合,その活性は1 nMレベルの低濃度でも検出され,根端の最初の形態的な変化は6時間から12時間後のあいだに観察された.これはホルモン依存的な形態変化としてはきわめて速い反応である.一方,硫酸基を欠くRGF1類縁体はほとんど活性を示さなかった.
さらに,RGF遺伝子の遺伝子レベルにおける機能を明らかにするため,RGF1遺伝子,RGF2遺伝子,RGF3遺伝子の破壊株の表現型を観察した.その結果,単独の遺伝子破壊株では表現型が現れないものの,三重破壊株では根端分裂組織の活性がかなり低下することが確かめられた.
つぎに,RGFがどのように根端の幹細胞の維持や根端分裂組織の活性を制御しているのか解析を行なった.根端におけるRGF応答はかなり短時間で観察されることから,RGFが細胞膜上の受容体に認識されたのち,早い段階でなんらかの転写因子を活性化している可能性があった.そこで,根の形態形成に関与する3種類の主要な転写因子SCARECROW,SHORT ROOT,PLETHORAについて,RGF応答への関与をそれぞれの変異株を用いて解析した.その結果,PLETHORA(PLT)遺伝子ファミリーを欠損するシロイヌナズナの根ではRGFに対する感受性が顕著に低下していることが明らかになった.PLTは根形成のマスター転写因子と考えられており,全部で4種類あるPLTファミリー遺伝子をすべて欠損する植物では根がまったく形成されない7,8).また,PLTタンパク質は根端の幹細胞の領域を最大としてそこから基部側にゆるやかに減少する発現パターンを示すが,この濃度勾配が根のパターン化に重要な役割をはたしている(図2c).すなわち,PLTの発現レベルが高いところでは幹細胞が維持されるが,中程度の領域では細胞分裂が活性化され,発現レベルが下がるにしたがって細胞分化が促進される.
そこで,RGFとPLTの関連性をさらに調べるため,GFPを融合させたPLTをそれ自体のプロモーターの制御下で野生株およびtpst-1変異株に導入して発現パターンを観察した.その結果,野生株におけるPLTの発現は根端の幹細胞の領域を最大として基部側にかけて発現レベルがゆるやかに減少する濃度勾配パターンを示していたのに対し,tpst-1変異株では幹細胞の領域での発現レベルが顕著に低下するとともに基部側で発現がすみやかに消失するというパターンを示した.一方,tpst-1変異株においても,培地にRGFをくわえるとPLTの発現レベルは24時間以内に回復した.また,野生株にRGFをあたえた場合にはPLTの発現領域が基部側に顕著に拡大した.培地からRGFを除けば本来の根端部における濃度勾配は回復したので,PLTのRGFに対する応答は可逆的であると考えられた.興味深いことに,PLT遺伝子の発現領域はRGFをあたえても大きく変化することはなかったことから,RGF依存的なPLTの発現パターンの変化は転写後レベル,おそらく,タンパク質の安定化によるものと考えられた.
以上を総合して考えられるモデルは以下のようなものである(図2).幹細胞に隣接する静止中心細胞やコルメラ細胞から分泌されたRGFは組織内を拡散して幹細胞周辺を最大とした濃度勾配を形成している.RGFは細胞膜上に存在すると想定される受容体を介して根形成のマスター転写因子であるPLTを安定化させる.その結果,PLTの発現はRGFの濃度勾配に従った濃度勾配となる.根端の細胞はPLTの発現レベルに応じて,幹細胞状態の維持,細胞分裂の活性化,細胞分化へと連続的に形態形成が進んでいく.tpst-1変異株では機能的なRGFがつくられずPLTがすぐに分解されるため,幹細胞が維持されず細胞分化のみが進行して根が極端に短くなる.
これまで,根の形態形成は極性輸送によって形成される根端のオーキシンの濃度勾配を中心として説明されてきたが,筆者らの発見により,拡散性の分泌型ペプチドホルモンがいわゆるニッチシグナルとして根の形成に重要な役割を担っていることが明らかとなった.興味深いことに,RGF遺伝子の発現はオーキシンの影響をあまりうけず,機能的なRGFを生産できないtpst-1変異株の根端におけるオーキシン分布も野生株とあまり変わらない.このことは,RGFはオーキシンとは独立して(少なくとも,ある程度の距離をおいて)機能していることを意味している.RGFペプチドの受容機構とPLTまでのシグナル伝達,そして,RGFの細胞特異的な発現制御にかかわる上流因子の解明がつぎなる課題である.
略歴:1997年 名古屋大学大学院生命農学研究科 修了,1999年 同 助手を経て,2002年より同 准教授.
研究テーマ:リガンド-受容体ペアの同定から探る植物のかたちづくり.
抱負:研究の過程で自分だけが知りえた新しい知見のうえに,さらに自分たち独自のアプローチを積み重ねるくり返しのなかで,これまで見過ごされていたところに広がっている未知の世界をこっそりとみてみたい.
© 2010 松林 嘉克 Licensed under CC 表示 2.1 日本
(名古屋大学大学院生命農学研究科 応用分子生命科学専攻生理活性物質化学研究室)
email:松林嘉克
DOI: 10.7875/first.author.2010.033
Secreted peptide signals required for maintenance of root stem cell niche in Arabidopsis.
Yo Matsuzaki, Mari Ogawa-Ohnishi, Ayaka Mori, Yoshikatsu Matsubayashi
Science, 329, 1065-1067 (2010)
要 約
幹細胞の維持には複雑な細胞間相互作用やシグナル伝達ネットワークが関与しているが,とくに,ニッチとよばれる特異的な細胞外環境が重要である.筆者らは,ペプチドホルモンの翻訳後修飾酵素のひとつであるチロシン硫酸化酵素の欠損株では根端において未分化な幹細胞が失われ根端分裂組織の活性が顕著に低下することに着目して,幹細胞ニッチの維持に関与するチロシン硫酸化ペプチドの探索を行なった.ゲノムデータベースを用いたin silico遺伝子スクリーニング,および,化学合成ペプチドをこの欠損株にあたえるアッセイにより,13アミノ酸残基からなる新規なチロシン硫酸化ペプチドを見い出し,RGFと名づけた.RGFペプチドファミリーは根端の静止中心細胞やコルメラ細胞で特異的に発現しており,幹細胞の維持に関与する転写因子PLETHORAの発現を制御していた.これらのペプチドはニッチシグナルとして根の形態形成に重要な役割をはたしているものと考えられた.
はじめに
近年,高等植物において,短鎖(数アミノ酸残基から数十アミノ酸残基)の分泌型ペプチドを介した細胞間シグナル伝達がつぎつぎと明らかになっている1,2).オーキシンやサイトカイニンなどの古典的な植物ホルモンは多くの組織に存在してさまざまなクロストークにより多様な生理機能を発揮するのに対して,分泌型ペプチドホルモンは局所的な発現パターンを示し組織特異的な機能を担っているものが多い.
ペプチドホルモンのなかには翻訳後修飾やプロセシング(限定分解)をうけることではじめて本来の機能を示すものが少なくない(図1a).そのため,翻訳後修飾酵素の遺伝子を破壊するとその支配下にあるすべての修飾ペプチドホルモンが活性を失い,結果的にその総和が表現型として現れる(図1b).したがって,翻訳後修飾酵素の欠損株の表現型を詳細に解析すれば未知のホルモンの存在に気づく可能性がある.
1.チロシン硫酸化酵素は根端の幹細胞の維持に必要である
2009年に筆者らは,モデル植物であるシロイヌナズナにおいて翻訳後修飾酵素のひとつであるチロシン硫酸化酵素(tyrosylprotein sulfotransferase:TPST)を精製および同定することに成功していた3).このチロシン硫酸化酵素はゴルジ体に局在する1回膜貫通型酵素であり,その遺伝子はシロイヌナズナでは1コピーのみ存在する.動物にもチロシン硫酸化酵素は存在するが4),アミノ酸レベルでの類似性はまったくないことから植物と動物は進化の過程で独立してチロシン硫酸化酵素を獲得したものと考えられる.
この研究の過程で,チロシン硫酸化酵素遺伝子を破壊したシロイヌナズナ植物体tpst-1変異株では根端において未分化な幹細胞が失われ,根端分裂組織の活性も顕著に低下するため根が極端に短くなることに気づいた.一般的に,幹細胞の維持には特異的な細胞外環境(ニッチとよばれる)が必要と考えられている.tpst-1変異株の表現型は既知のチロシン硫酸化ペプチドホルモンであるPSK 5) あるいはPSY1 6) の培地への添加では回復できなかったことから,幹細胞ニッチの維持に関与する未知の硫酸化ペプチドホルモンの存在が強く示唆された.
2.新規の硫酸化ペプチドのin silico探索
分泌型ペプチドをコードする遺伝子はシロイヌナズナゲノムに多く見い出され,ORF(open reading frame)が50アミノ酸残基から150アミノ酸残基のものだけでも979個が存在する.このなかから,細胞外分泌シグナルや硫酸化モチーフ配列の有無,ORFの大きさなどを指標として硫酸化ペプチドホルモンの候補を絞り込んだ.PSKやPSY1などの既知の硫酸化ペプチドホルモンでは典型的なORFの大きさは70~110アミノ酸残基で,システイン残基が5個以下であり,硫酸化に必要な最低限のモチーフとして必ずAsp-Tyr配列を含んでいる.この基準でin silicoスクリーニングを行なうと34個にまで絞り込むことができた.さらに,短鎖翻訳後修飾ペプチドホルモンの遺伝子は遺伝子重複によりホモログの存在していることが多いため,個々の候補について全ゲノムを対象にしたBLAST検索を行ない,ファミリーを形成しているペプチドを抽出した.
こうした解析をへて9遺伝子からなる新しいペプチド遺伝子ファミリーに注目した(図1c).この9遺伝子のなかには,公開されているマイクロアレイデータにおいて根端での特異的な発現がみられる複数の遺伝子が含まれていた.さらに,選び出された遺伝子が実際に硫酸化ペプチドをコードするかどうかを実験的に確かめるため,候補のひとつAt5g60810を過剰発現させた形質転換シロイヌナズナを液体培地で培養し,培地に分泌されてくるペプチドの構造をナノ液体クロマトグラフィー-タンデム質量分析計(nano LC-MS/MS)で解析した.その結果,At5g60810に由来する成熟型ペプチドの構造は1残基の硫酸化チロシンを含む13アミノ酸残基からなるペプチドであることが確かめられた(図1c).
3.RGFの発見
この13アミノ酸残基の硫酸化ペプチドを化学合成し,これを添加した培地でtpst-1変異株を生育させた結果,根端に未分化な幹細胞が回復するともに,根端分裂組織の活性も上昇することが明らかとなった.ほかのホモログについても合成ペプチドを用いたアッセイを行った結果,全部で9種類のうち8種類に活性が認められた.こうした実験結果にもとづき,これらのペプチドをRGF(root meristem growth factor)と名づけた.RGFファミリー遺伝子のうち3種類(RGF1,RGF2,RGF3)は根の幹細胞に隣接する静止中心やコルメラ細胞で特異的に発現しており(図2a),RGF4遺伝子は幹細胞の周辺のいくつかの細胞層でやや広がった発現を示した.ほかのホモログ遺伝子の多くも弱いながら根端部での発現が認められた.また,免疫染色の結果,分泌されたペプチドは発現部位から根端分裂組織の全体へ組織内を拡散しているようすが観察された(図2b).
4.RGFの機能
RGF1の培地への添加によってtpst-1変異株の幹細胞は回復し,根端分裂組織の活性も野生株の70%程度まで上昇したが,培地にさらに2種類の硫酸化ペプチド,PSKとPSY1を添加すると根の成長は野生株と匹敵するレベルにまで回復した.このことは,幹細胞の回復にはRGF1単独で十分であるが,根端分裂組織の活性の完全な回復にはPSKとPSY1の共存が必要であることを意味していた.実際,PSKとPSY1は細胞増殖の促進をはじめとした多面的な生理機能を示すことが知られている.RGF1をtpst-1変異株にあたえた場合,その活性は1 nMレベルの低濃度でも検出され,根端の最初の形態的な変化は6時間から12時間後のあいだに観察された.これはホルモン依存的な形態変化としてはきわめて速い反応である.一方,硫酸基を欠くRGF1類縁体はほとんど活性を示さなかった.
さらに,RGF遺伝子の遺伝子レベルにおける機能を明らかにするため,RGF1遺伝子,RGF2遺伝子,RGF3遺伝子の破壊株の表現型を観察した.その結果,単独の遺伝子破壊株では表現型が現れないものの,三重破壊株では根端分裂組織の活性がかなり低下することが確かめられた.
5.RGFのターゲットは根形成のマスター転写因子PLETHORAである
つぎに,RGFがどのように根端の幹細胞の維持や根端分裂組織の活性を制御しているのか解析を行なった.根端におけるRGF応答はかなり短時間で観察されることから,RGFが細胞膜上の受容体に認識されたのち,早い段階でなんらかの転写因子を活性化している可能性があった.そこで,根の形態形成に関与する3種類の主要な転写因子SCARECROW,SHORT ROOT,PLETHORAについて,RGF応答への関与をそれぞれの変異株を用いて解析した.その結果,PLETHORA(PLT)遺伝子ファミリーを欠損するシロイヌナズナの根ではRGFに対する感受性が顕著に低下していることが明らかになった.PLTは根形成のマスター転写因子と考えられており,全部で4種類あるPLTファミリー遺伝子をすべて欠損する植物では根がまったく形成されない7,8).また,PLTタンパク質は根端の幹細胞の領域を最大としてそこから基部側にゆるやかに減少する発現パターンを示すが,この濃度勾配が根のパターン化に重要な役割をはたしている(図2c).すなわち,PLTの発現レベルが高いところでは幹細胞が維持されるが,中程度の領域では細胞分裂が活性化され,発現レベルが下がるにしたがって細胞分化が促進される.
6.RGFはPLETHORAの発現を制御する
そこで,RGFとPLTの関連性をさらに調べるため,GFPを融合させたPLTをそれ自体のプロモーターの制御下で野生株およびtpst-1変異株に導入して発現パターンを観察した.その結果,野生株におけるPLTの発現は根端の幹細胞の領域を最大として基部側にかけて発現レベルがゆるやかに減少する濃度勾配パターンを示していたのに対し,tpst-1変異株では幹細胞の領域での発現レベルが顕著に低下するとともに基部側で発現がすみやかに消失するというパターンを示した.一方,tpst-1変異株においても,培地にRGFをくわえるとPLTの発現レベルは24時間以内に回復した.また,野生株にRGFをあたえた場合にはPLTの発現領域が基部側に顕著に拡大した.培地からRGFを除けば本来の根端部における濃度勾配は回復したので,PLTのRGFに対する応答は可逆的であると考えられた.興味深いことに,PLT遺伝子の発現領域はRGFをあたえても大きく変化することはなかったことから,RGF依存的なPLTの発現パターンの変化は転写後レベル,おそらく,タンパク質の安定化によるものと考えられた.
7.RGFの作用モデル
以上を総合して考えられるモデルは以下のようなものである(図2).幹細胞に隣接する静止中心細胞やコルメラ細胞から分泌されたRGFは組織内を拡散して幹細胞周辺を最大とした濃度勾配を形成している.RGFは細胞膜上に存在すると想定される受容体を介して根形成のマスター転写因子であるPLTを安定化させる.その結果,PLTの発現はRGFの濃度勾配に従った濃度勾配となる.根端の細胞はPLTの発現レベルに応じて,幹細胞状態の維持,細胞分裂の活性化,細胞分化へと連続的に形態形成が進んでいく.tpst-1変異株では機能的なRGFがつくられずPLTがすぐに分解されるため,幹細胞が維持されず細胞分化のみが進行して根が極端に短くなる.
おわりに
これまで,根の形態形成は極性輸送によって形成される根端のオーキシンの濃度勾配を中心として説明されてきたが,筆者らの発見により,拡散性の分泌型ペプチドホルモンがいわゆるニッチシグナルとして根の形成に重要な役割を担っていることが明らかとなった.興味深いことに,RGF遺伝子の発現はオーキシンの影響をあまりうけず,機能的なRGFを生産できないtpst-1変異株の根端におけるオーキシン分布も野生株とあまり変わらない.このことは,RGFはオーキシンとは独立して(少なくとも,ある程度の距離をおいて)機能していることを意味している.RGFペプチドの受容機構とPLTまでのシグナル伝達,そして,RGFの細胞特異的な発現制御にかかわる上流因子の解明がつぎなる課題である.
文 献
- Matsubayashi, Y. & Sakagami, Y.: Peptide hormones in plants. Annu. Rev. Plant Biol., 57, 649-674 (2006)[PubMed]
- Butenko, M. A., Vie, A. K., Brembu, T. et al.: Plant peptides in signalling: looking for new partners. Trends Plant Sci., 14, 255-263 (2009)[PubMed]
- Komori, R., Amano, Y., Ogawa-Ohnishi, M. et al.: Identification of tyrosylprotein sulfotransferase in Arabidopsis. Proc. Natl. Acad. Sci. USA, 106, 15067-15072 (2009)[PubMed]
- Moore, K. L.: The biology and enzymology of protein tyrosine O-sulfation. J. Biol. Chem., 278, 24243-24246 (2003)[PubMed]
- Matsubayashi, Y. & Sakagami, Y.: Phytosulfokine, sulfated peptides that induce the proliferation of single mesophyll cells of Asparagus officinalis L. Proc. Natl. Acad. Sci. USA, 93, 7623-7627 (1996)[PubMed]
- Amano, Y., Tsubouchi, H., Shinohara, H. et al.: Tyrosine-sulfated glycopeptide involved in cellular proliferation and expansion in Arabidopsis. Proc. Natl. Acad. Sci. USA, 104, 18333-18338 (2007)[PubMed]
- Aida, M., Beis, D., Heidstra, R. et al.: The PLETHORA genes mediate patterning of the Arabidopsis root stem cell niche. Cell, 119, 109-120 (2004)[PubMed]
- Galinha, C., Hofhuis, H., Luijten, M. et al.: PLETHORA proteins as dose-dependent master regulators of Arabidopsis root development. Nature, 449, 1053-1057 (2007)[PubMed]
著者プロフィール
略歴:1997年 名古屋大学大学院生命農学研究科 修了,1999年 同 助手を経て,2002年より同 准教授.
研究テーマ:リガンド-受容体ペアの同定から探る植物のかたちづくり.
抱負:研究の過程で自分だけが知りえた新しい知見のうえに,さらに自分たち独自のアプローチを積み重ねるくり返しのなかで,これまで見過ごされていたところに広がっている未知の世界をこっそりとみてみたい.
© 2010 松林 嘉克 Licensed under CC 表示 2.1 日本