リジルtRNA合成酵素パラログGenXおよびYjeKによる翻訳因子EF-Pのアミノアシル化修飾
柳沢達男・横山茂之
(理化学研究所生命分子システム基盤研究領域)
email:横山茂之
DOI: 10.7875/first.author.2010.036
A paralog of lysyl-tRNA synthetase aminoacylates a conserved lysine residue in translation elongation factor P.
Tatsuo Yanagisawa, Tomomi Sumida, Ryohei Ishii, Chie Takemoto, Shigeyuki Yokoyama
Nature Structural & Molecular Biology, 17, 1136-1143 (2010)
生物のゲノムにはアミノアシルtRNA合成酵素のパラログをコードする遺伝子が数多く存在する.今回,筆者らは,長らくその機能が不明であったリジルtRNA合成酵素のパラログGenXやその複合体の立体構造を解析することで,tRNAに似たL字型構造をとる翻訳因子EF-Pがリジル化(アミノアシル化)修飾されることを見い出すとともに,GenX-EF-P複合体の構造がアミノアシルtRNA合成酵素-tRNA複合体の構造と酷似していることを明らかにした.また,GenXによるEF-Pのアミノアシル化が大腸菌の増殖に欠かせないことも判明した.EF-Pのアミノアシル化はtRNAのアミノアシル化をよく模倣しており,核酸とタンパク質というまったく異なる分子において形だけでなく反応までが酷似していることから,起源が異なるものが同じような形と機能をもつよう収斂進化していく現象が,タンパク質や核酸などの分子レベルでも起こっていたものと推察された.
DNAの遺伝暗号からmRNAが合成され(転写),mRNAの情報に従ってtRNAが運ぶアミノ酸がリボソームで正しくつながり(翻訳),タンパク質が合成されるという流れが,Crickによって提唱された生物学の基本原理“セントラルドグマ”である.そのうち,遺伝暗号の情報に従ってタンパク質が合成されていく翻訳段階はきわめて正確で,それに重要な役割をはたしているのがtRNAに特定のアミノ酸を受け渡す(アミノアシル化する)アミノアシルtRNA合成酵素である.生物の全ゲノム解析時代をむかえて,アミノアシルtRNA合成酵素としての活性をもたないアミノアシルtRNA合成酵素に似たタンパク質(アミノアシルtRNA合成酵素パラログ)が多くの生物に存在することが知られるようになってきており1,2),その代表的なものには,ヒスチジン生合成にかかわるHisZ,アスパラギン生合成にかかわるAsnA,ビオチン生合成にかかわるBirA,tRNAの塩基修飾にかかわるYadBなどがある.アミノアシルtRNA合成酵素パラログは進化的にはアミノアシルtRNA合成酵素と近縁でありながらtRNAをアミノアシル化する活性をもたず,その多くについて機能はよくわかっていない.このようなタンパク質がなぜ数多く存在するのか,機能未知のアミノアシルtRNA合成酵素パラログの構造と機能を明らかにしていくことは,遺伝暗号翻訳系の分子機構のみならず生物の進化を知るうえでも重要だと考えられる.
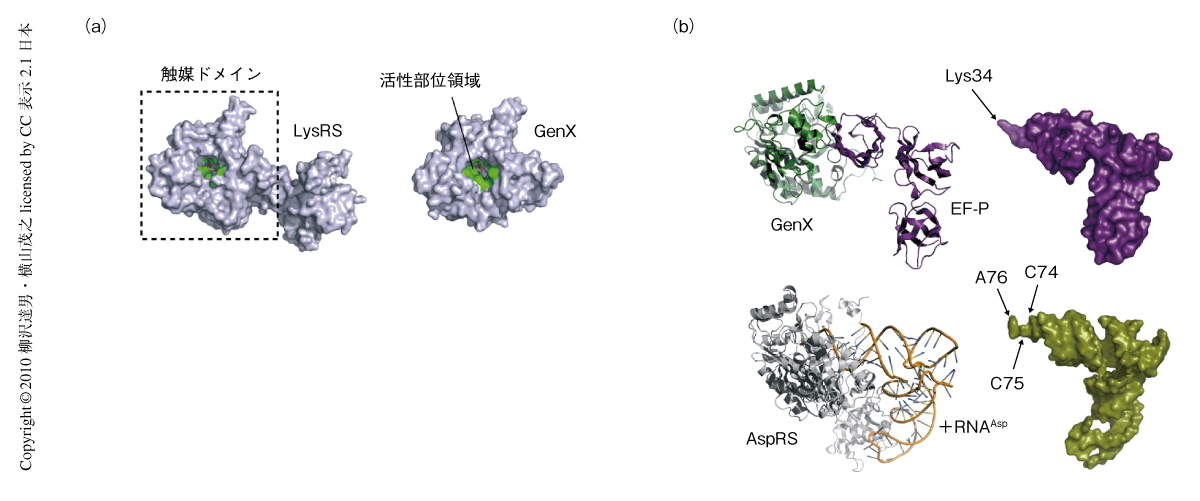
筆者らは,まだ機能が不明であったリジルtRNA合成酵素パラログのGenX(PoxA,YjeA)を選択しその構造と機能の解明を目的とした.GenXはリジルtRNA合成酵素のC末端側の触媒ドメインと相同性をもつが3-5),tRNA結合ドメインをもっていない.サルモネラ菌においてGenXの欠損変異は,ピルビン酸オキシダーゼ活性を下げること,さまざまな抗生物質に感受性になること,感染能を弱めるなど,多面的な表現型を示す4).リジルtRNA合成酵素の反応中間体阻害剤であるLysAMSがリジルtRNA合成酵素と同様にGenXにも強く結合すること,また,GenXはLysAMSの存在下で結晶化が可能であることを見い出し,1.9Åの分解能でGenXの立体構造を決定した.X線結晶構造解析から得られたGenXの構造はリジルtRNA合成酵素の触媒ドメインと似ており,とくに,活性部位領域内のアミノ酸残基はきわめてよく保存されていた(図1a).
GenXの活性部位ポケットはリジルtRNA合成酵素のポケットよりも広くtRNAを収容するスペースは十分にあるようにみえたが,GenXは大腸菌tRNAをアミノアシル化することができなかった.では,GenXの基質はなんであろうか? GenXとリジルtRNA合成酵素とで活性部位のアミノ酸残基はとくに相同性が高いので,GenXはリジルtRNA合成酵素のようにtRNAにリジンを受け渡すのではなく,なにか別の分子にリジンを受け渡すような反応を触媒するのではないかと予測し,大腸菌の全遺伝子からtRNAのような分子という観点でGenXの基質分子を探索したところ,筆者らの研究グループが2004年に構造を決定していた翻訳因子EF-Pが候補としてあがってきた6).
L字型のtRNAの構造を擬態するEF-PはリボソームのEサイトとPサイトとのあいだに結合し7),翻訳開始反応を促進するといわれている翻訳因子である8-10).最初にその活性が報告されてからすでに35年がたつ歴史の古いタンパク質であるが,専門とする研究者が少なく解析があまり進まなかったため詳細なはたらきはよくわかっていない.そこで,GenXの基質がEF-Pであるならこれらは複合体をつくるかもしれないと考え,GenX-EF-P複合体の結晶の作製を試みたところ,LysAMSの存在下でGenXおよびEF-Pを1:1で混合したときにX線結晶構造解析に適した複合体の結晶が作製できることを見い出し,2.5Åの分解能でGenX-EF-P複合体の立体構造を決定することができた.
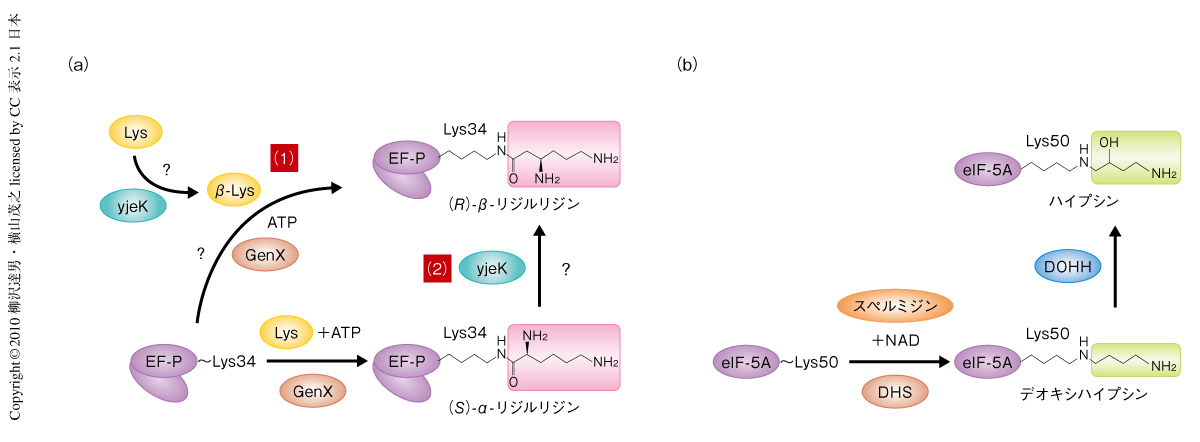
興味深いことに,GenX-EF-P複合体はアスパルチル-tRNA合成酵素-tRNAAsp複合体の構造と酷似していた(図1b).GenX-EF-P複合体の構造にもとづいて生化学的な解析を行ったところ,リジルtRNA合成酵素パラログGenXはEF-Pにリジンを受け渡す(アミノアシル化)することが判明した(図2a).GenXはATPの存在下でリジルtRNA合成酵素と同じようにアミノ酸のリジンを活性化してリジル-AMPにしたのち,EF-Pの特定のリジン側鎖(Lys34)にリジンを転移する.その位置はtRNAにおいてアミノアシル化されるA76の位置に相当することから,EF-Pのアミノアシル化はtRNAのアミノアシル化を模倣しているようにもみえ,GenX-EF-P複合体はアミノアシルtRNA合成酵素-tRNA複合体の擬態であることが強く示唆された.
EF-Pの真核生物オルソログである翻訳開始因子eIF5Aは,特定の保存されたリジン残基(ヒトでは,Lys50)がスペルミジンとNADとを基質とし,デオキシハイプシンシンターゼによる4-アミノブチル基のLys50側鎖への付加,つづいて,デオキシハイプシンヒドロキシラーゼによる水酸化の2段階のステップで特異な修飾をうけ,ハイプシンとよばれるアミノ酸残基に変換される11)(図2b).eIF5Aの修飾にかかわるデオキシハイプシンシンターゼとデオキシハイプシンヒドロキシラーゼはEF-Pの修飾酵素GenXとは進化的に無関係で,また,eIF5Aの修飾はEF-Pの修飾とは異なりアミノアシル化ではないが,EF-Pのアミノアシル化されたリジン(リジルリジン)とeIF5Aのハイプシンは長いアルキル鎖および末端アミノ基をもつ点でよく似ている.EF-Pのアミノアシル化は真正細菌の増殖に必須でありeIF5Aのハイプシン化は真核生物の生存に必須であるので,機能的な選択圧により両方のタンパク質の修飾されるべきリジン側鎖の先端がさらに修飾をうけるよう進化してきたのではないかと予想された.
つぎに,GenXによるEF-Pのアミノアシル化を促進するタンパク質YjeKを発見し,大腸菌でのEF-Pの最終修飾型とその役割について考察した.比較ゲノム学によって,大腸菌ゲノムでその遺伝子がEF-P遺伝子に隣接するYjeKは,GenXおよびEF-Pと機能的な相関性のあることが推定されていた5,12).YjeKがGenXによるEF-Pのアミノアシル化に影響をあたえるかどうか調べるため,EF-P,GenX,YjeKを共発現するプラスミドを構築して大腸菌で発現させ,そこからEF-Pを精製しその質量スペクトルを測定することでEF-Pのアミノアシル化状態を調べた.EF-Pのみを発現させた大腸菌より得られたEF-Pは完全に未修飾であり,EF-PとGenXを共発現させた場合には半分以上のEF-Pがアミノアシル化されなかったのに対し,EF-P,GenX,YjeKの共発現系の場合にはほぼすべてのEF-Pがアミノアシル化された.すなわち,YjeKはEF-Pのアミノアシル化を促進することが明らかとなった.YjeKはαリジン(リジン)をβリジンに変換するリジン-2,3-アミノムターゼという酵素のホモログであるが,YjeKのリジンに対する活性はリジン-2,3-アミノムターゼと比較すると著しく低く,おそらく,リジンがYjeKの本来の基質ではない13).また,YjeKによるアミノアシル化の促進は,リジルEF-PをβリジルEF-Pにすみやかに変換することでGenXの産物阻害を解消することによるものと思われる.したがって,YjeKの基質はαリジルEF-P(リジルEF-P)であり,YjeKによってリジルEF-PがβリジルEF-Pに変換される経路の可能性が高いのではないかと考えている(図2a).
EF-Pの遺伝子を欠損させた大腸菌株およびGenXの遺伝子を欠損させた大腸菌株を利用してEF-P修飾の役割を詳細に調べた.EF-P欠損株およびGenX欠損株は野生株よりも増殖が遅いが,野生型EF-PとともにGenXおよびYjeKを発現させたときにはその増殖は完全に回復した.一方,アミノアシル化されない変異型であるEF-P(K34A)またはEF-P(G33K)とともにGenXおよびYjeKを発現させたときにはEF-P欠損株の増殖は回復しなかった.このことから,リジルEF-Pが細胞内で機能する形であること,EF-Pのアミノアシル化が細胞内でのEF-Pの機能,および,大腸菌の増殖に必須であることが明らかとなった.
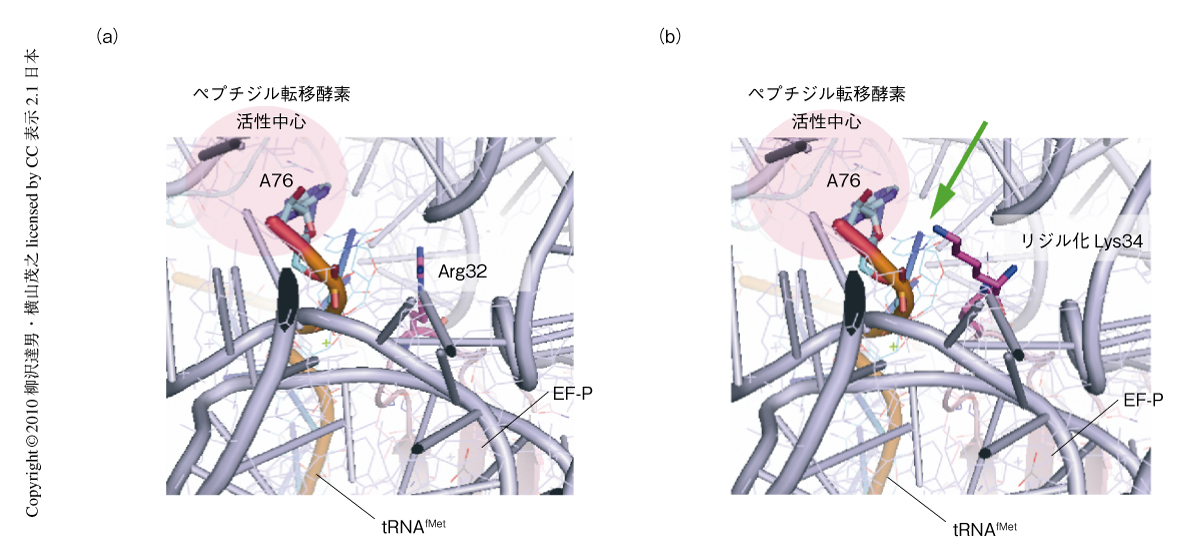
また,Thermus thermophilusに由来するEF-P-リボソーム複合体の結晶構造をもとに7),大腸菌EF-Pのリジル化Lys34とリボソームとのドッキングモデルを構築したところ,T. thermophilusに由来するEF-PのArg32(大腸菌では,Lys34)はリボソームのペプチジル転移酵素活性中心にまで側鎖の末端が届かないのに対し,リジル化Lys34のεアミノ基末端は活性中心にあるtRNAMetのA76にまで届くことが判明した(図3).このことは,増殖に必須ななんらかの遺伝子の翻訳開始にリジルEF-Pが直接に関与することを示唆する結果であった.リボソームに結合したEF-PはPサイトの開始tRNAMetを安定化しているようにもみえるので,EF-Pのアミノアシル化は開始tRNAMetの安定化を促進するはたらきがあるのかもしれない.
先日,サルモネラ菌においてGenXによるEF-Pのアミノアシル化が宿主への感染能やストレス応答,ある種の抗生物質に対する感受性などに影響をあたえることが報告された14).彼らが行ったプロテオミクス解析によると,サルモネラ菌の全タンパク質のうち,GenXあるいはYjeKを欠損させたときに発現量に影響をうけるのは85個のタンパク質であり,そのうち,Salmonella pathogenicity island SPI-1にコードされる宿主への感染侵入にかかわるタンパク質,糖の取り込みやATP生産などにかかわるタンパク質など25個のタンパク質を同定している.彼らは,宿主細胞で栄養源が限られているときエネルギー源を適切に活用するためEF-Pのリジル化修飾が不可欠であると述べている.一方で,リジルEF-Pがどのような分子機構でこれらの遺伝子の発現を調節しているのか,どのような遺伝子の翻訳開始に寄与するのかは未解明であり,翻訳因子としてのEF-Pの機能にはまだわからないことが多い.筆者らも,大腸菌に由来する11個を含む15個の構造遺伝子についてEF-P欠損株の粗抽出液を用いて無細胞タンパク質合成を行ったが,リジルEF-Pのありなしでタンパク質合成量に影響はみられなかった.したがって,リジルEF-Pがすべての遺伝子の翻訳開始に関与しているとは考えにくく,通常とは異なる特殊なケースの翻訳に関与しているのではないかと予想している.
先日,セリルtRNA合成酵素パラログがATPのエネルギーを使ってグリシンまたはアラニンを活性化しアシルキャリアータンパク質をアミノアシル化する機能をもつ非リボソーム型ペプチドの合成酵素としてはたらくことが報告された15).この研究のGenXを含め,このようなアミノアシルtRNA合成酵素の触媒ドメインを起源とするアミノアシルtRNA合成酵素パラログはアミノ酸やATPに対する高い特異性や結合性という有用な性質をもつことから,アミノ酸生合成,補酵素生合成,tRNA修飾,非リボソームペプチド生合成,タンパク質修飾など,生命反応のさまざまな場面において進化の過程で採用されてきたのであろう.筆者らは,今回,リジルtRNA合成酵素パラログGenXの解析に取り組み,tRNAに似たL字型構造をとる翻訳因子EF-Pをアミノアシル化することを明らかにした.近年,翻訳因子だけでなくさまざまなタンパク質が核酸の構造を擬態するような現象が報告されているが,核酸の形をまねるタンパク質がその機能までまねることを解明した例はいままでになかった.今回の成果は,類縁関係の遠いモグラとケラの前足が同じような形と機能をもつという収斂進化を類推させることから,生物の個体レベルだけでなくタンパク質や核酸などの分子レベルでも同様の進化が起こっていたものと考えられ,遺伝暗号翻訳系の分子機構を通じた生物の進化を知るうえでも重要である.
GenXは大腸菌,サルモネラ菌,腸炎ビブリオ菌,コレラ菌など真正細菌のみに存在し,ヒトなどの真核生物にはない.したがって,GenXを特異的に阻害する低分子化合物は感染症をひき起こす病原菌や薬剤耐性菌に対して副作用のない有効な抗菌薬となる可能性がある.GenX-YjeK系によるEF-Pの翻訳後修飾にかかわる構造および機能の解明は,学術的な貢献だけでなく創薬開発にも大きく貢献することが期待される.
略歴:2002年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 リサーチアソシエイトを経て,2006年より同 研究員.
研究テーマ:タンパク質合成系,遺伝子翻訳システムの化学生物学.
抱負:化学の視点で生命現象を解明し,得られた知見を有用な技術として応用したい.
横山茂之(Shigeyuki Yokoyama)
理化学研究所生命分子システム基盤研究領域 領域長,東京大学大学院理学系研究科 兼任教授.
© 2010 柳沢達男・横山茂之 Licensed under CC 表示 2.1 日本
(理化学研究所生命分子システム基盤研究領域)
email:横山茂之
DOI: 10.7875/first.author.2010.036
A paralog of lysyl-tRNA synthetase aminoacylates a conserved lysine residue in translation elongation factor P.
Tatsuo Yanagisawa, Tomomi Sumida, Ryohei Ishii, Chie Takemoto, Shigeyuki Yokoyama
Nature Structural & Molecular Biology, 17, 1136-1143 (2010)
要 約
生物のゲノムにはアミノアシルtRNA合成酵素のパラログをコードする遺伝子が数多く存在する.今回,筆者らは,長らくその機能が不明であったリジルtRNA合成酵素のパラログGenXやその複合体の立体構造を解析することで,tRNAに似たL字型構造をとる翻訳因子EF-Pがリジル化(アミノアシル化)修飾されることを見い出すとともに,GenX-EF-P複合体の構造がアミノアシルtRNA合成酵素-tRNA複合体の構造と酷似していることを明らかにした.また,GenXによるEF-Pのアミノアシル化が大腸菌の増殖に欠かせないことも判明した.EF-Pのアミノアシル化はtRNAのアミノアシル化をよく模倣しており,核酸とタンパク質というまったく異なる分子において形だけでなく反応までが酷似していることから,起源が異なるものが同じような形と機能をもつよう収斂進化していく現象が,タンパク質や核酸などの分子レベルでも起こっていたものと推察された.
はじめに
DNAの遺伝暗号からmRNAが合成され(転写),mRNAの情報に従ってtRNAが運ぶアミノ酸がリボソームで正しくつながり(翻訳),タンパク質が合成されるという流れが,Crickによって提唱された生物学の基本原理“セントラルドグマ”である.そのうち,遺伝暗号の情報に従ってタンパク質が合成されていく翻訳段階はきわめて正確で,それに重要な役割をはたしているのがtRNAに特定のアミノ酸を受け渡す(アミノアシル化する)アミノアシルtRNA合成酵素である.生物の全ゲノム解析時代をむかえて,アミノアシルtRNA合成酵素としての活性をもたないアミノアシルtRNA合成酵素に似たタンパク質(アミノアシルtRNA合成酵素パラログ)が多くの生物に存在することが知られるようになってきており1,2),その代表的なものには,ヒスチジン生合成にかかわるHisZ,アスパラギン生合成にかかわるAsnA,ビオチン生合成にかかわるBirA,tRNAの塩基修飾にかかわるYadBなどがある.アミノアシルtRNA合成酵素パラログは進化的にはアミノアシルtRNA合成酵素と近縁でありながらtRNAをアミノアシル化する活性をもたず,その多くについて機能はよくわかっていない.このようなタンパク質がなぜ数多く存在するのか,機能未知のアミノアシルtRNA合成酵素パラログの構造と機能を明らかにしていくことは,遺伝暗号翻訳系の分子機構のみならず生物の進化を知るうえでも重要だと考えられる.
1.リジルtRNA合成酵素パラログGenXの構造と機能
筆者らは,まだ機能が不明であったリジルtRNA合成酵素パラログのGenX(PoxA,YjeA)を選択しその構造と機能の解明を目的とした.GenXはリジルtRNA合成酵素のC末端側の触媒ドメインと相同性をもつが3-5),tRNA結合ドメインをもっていない.サルモネラ菌においてGenXの欠損変異は,ピルビン酸オキシダーゼ活性を下げること,さまざまな抗生物質に感受性になること,感染能を弱めるなど,多面的な表現型を示す4).リジルtRNA合成酵素の反応中間体阻害剤であるLysAMSがリジルtRNA合成酵素と同様にGenXにも強く結合すること,また,GenXはLysAMSの存在下で結晶化が可能であることを見い出し,1.9Åの分解能でGenXの立体構造を決定した.X線結晶構造解析から得られたGenXの構造はリジルtRNA合成酵素の触媒ドメインと似ており,とくに,活性部位領域内のアミノ酸残基はきわめてよく保存されていた(図1a).
GenXの活性部位ポケットはリジルtRNA合成酵素のポケットよりも広くtRNAを収容するスペースは十分にあるようにみえたが,GenXは大腸菌tRNAをアミノアシル化することができなかった.では,GenXの基質はなんであろうか? GenXとリジルtRNA合成酵素とで活性部位のアミノ酸残基はとくに相同性が高いので,GenXはリジルtRNA合成酵素のようにtRNAにリジンを受け渡すのではなく,なにか別の分子にリジンを受け渡すような反応を触媒するのではないかと予測し,大腸菌の全遺伝子からtRNAのような分子という観点でGenXの基質分子を探索したところ,筆者らの研究グループが2004年に構造を決定していた翻訳因子EF-Pが候補としてあがってきた6).
2.翻訳因子EF-PはGenXによってアミノアシル化される
L字型のtRNAの構造を擬態するEF-PはリボソームのEサイトとPサイトとのあいだに結合し7),翻訳開始反応を促進するといわれている翻訳因子である8-10).最初にその活性が報告されてからすでに35年がたつ歴史の古いタンパク質であるが,専門とする研究者が少なく解析があまり進まなかったため詳細なはたらきはよくわかっていない.そこで,GenXの基質がEF-Pであるならこれらは複合体をつくるかもしれないと考え,GenX-EF-P複合体の結晶の作製を試みたところ,LysAMSの存在下でGenXおよびEF-Pを1:1で混合したときにX線結晶構造解析に適した複合体の結晶が作製できることを見い出し,2.5Åの分解能でGenX-EF-P複合体の立体構造を決定することができた.
興味深いことに,GenX-EF-P複合体はアスパルチル-tRNA合成酵素-tRNAAsp複合体の構造と酷似していた(図1b).GenX-EF-P複合体の構造にもとづいて生化学的な解析を行ったところ,リジルtRNA合成酵素パラログGenXはEF-Pにリジンを受け渡す(アミノアシル化)することが判明した(図2a).GenXはATPの存在下でリジルtRNA合成酵素と同じようにアミノ酸のリジンを活性化してリジル-AMPにしたのち,EF-Pの特定のリジン側鎖(Lys34)にリジンを転移する.その位置はtRNAにおいてアミノアシル化されるA76の位置に相当することから,EF-Pのアミノアシル化はtRNAのアミノアシル化を模倣しているようにもみえ,GenX-EF-P複合体はアミノアシルtRNA合成酵素-tRNA複合体の擬態であることが強く示唆された.
3.EF-PとeIF5Aの翻訳後修飾
EF-Pの真核生物オルソログである翻訳開始因子eIF5Aは,特定の保存されたリジン残基(ヒトでは,Lys50)がスペルミジンとNADとを基質とし,デオキシハイプシンシンターゼによる4-アミノブチル基のLys50側鎖への付加,つづいて,デオキシハイプシンヒドロキシラーゼによる水酸化の2段階のステップで特異な修飾をうけ,ハイプシンとよばれるアミノ酸残基に変換される11)(図2b).eIF5Aの修飾にかかわるデオキシハイプシンシンターゼとデオキシハイプシンヒドロキシラーゼはEF-Pの修飾酵素GenXとは進化的に無関係で,また,eIF5Aの修飾はEF-Pの修飾とは異なりアミノアシル化ではないが,EF-Pのアミノアシル化されたリジン(リジルリジン)とeIF5Aのハイプシンは長いアルキル鎖および末端アミノ基をもつ点でよく似ている.EF-Pのアミノアシル化は真正細菌の増殖に必須でありeIF5Aのハイプシン化は真核生物の生存に必須であるので,機能的な選択圧により両方のタンパク質の修飾されるべきリジン側鎖の先端がさらに修飾をうけるよう進化してきたのではないかと予想された.
4.EF-Pのアミノアシル化を促進するタンパク質YjeK
つぎに,GenXによるEF-Pのアミノアシル化を促進するタンパク質YjeKを発見し,大腸菌でのEF-Pの最終修飾型とその役割について考察した.比較ゲノム学によって,大腸菌ゲノムでその遺伝子がEF-P遺伝子に隣接するYjeKは,GenXおよびEF-Pと機能的な相関性のあることが推定されていた5,12).YjeKがGenXによるEF-Pのアミノアシル化に影響をあたえるかどうか調べるため,EF-P,GenX,YjeKを共発現するプラスミドを構築して大腸菌で発現させ,そこからEF-Pを精製しその質量スペクトルを測定することでEF-Pのアミノアシル化状態を調べた.EF-Pのみを発現させた大腸菌より得られたEF-Pは完全に未修飾であり,EF-PとGenXを共発現させた場合には半分以上のEF-Pがアミノアシル化されなかったのに対し,EF-P,GenX,YjeKの共発現系の場合にはほぼすべてのEF-Pがアミノアシル化された.すなわち,YjeKはEF-Pのアミノアシル化を促進することが明らかとなった.YjeKはαリジン(リジン)をβリジンに変換するリジン-2,3-アミノムターゼという酵素のホモログであるが,YjeKのリジンに対する活性はリジン-2,3-アミノムターゼと比較すると著しく低く,おそらく,リジンがYjeKの本来の基質ではない13).また,YjeKによるアミノアシル化の促進は,リジルEF-PをβリジルEF-Pにすみやかに変換することでGenXの産物阻害を解消することによるものと思われる.したがって,YjeKの基質はαリジルEF-P(リジルEF-P)であり,YjeKによってリジルEF-PがβリジルEF-Pに変換される経路の可能性が高いのではないかと考えている(図2a).
5.EF-Pのアミノアシル化は大腸菌の増殖に必須である
EF-Pの遺伝子を欠損させた大腸菌株およびGenXの遺伝子を欠損させた大腸菌株を利用してEF-P修飾の役割を詳細に調べた.EF-P欠損株およびGenX欠損株は野生株よりも増殖が遅いが,野生型EF-PとともにGenXおよびYjeKを発現させたときにはその増殖は完全に回復した.一方,アミノアシル化されない変異型であるEF-P(K34A)またはEF-P(G33K)とともにGenXおよびYjeKを発現させたときにはEF-P欠損株の増殖は回復しなかった.このことから,リジルEF-Pが細胞内で機能する形であること,EF-Pのアミノアシル化が細胞内でのEF-Pの機能,および,大腸菌の増殖に必須であることが明らかとなった.
また,Thermus thermophilusに由来するEF-P-リボソーム複合体の結晶構造をもとに7),大腸菌EF-Pのリジル化Lys34とリボソームとのドッキングモデルを構築したところ,T. thermophilusに由来するEF-PのArg32(大腸菌では,Lys34)はリボソームのペプチジル転移酵素活性中心にまで側鎖の末端が届かないのに対し,リジル化Lys34のεアミノ基末端は活性中心にあるtRNAMetのA76にまで届くことが判明した(図3).このことは,増殖に必須ななんらかの遺伝子の翻訳開始にリジルEF-Pが直接に関与することを示唆する結果であった.リボソームに結合したEF-PはPサイトの開始tRNAMetを安定化しているようにもみえるので,EF-Pのアミノアシル化は開始tRNAMetの安定化を促進するはたらきがあるのかもしれない.
6.今後の課題
先日,サルモネラ菌においてGenXによるEF-Pのアミノアシル化が宿主への感染能やストレス応答,ある種の抗生物質に対する感受性などに影響をあたえることが報告された14).彼らが行ったプロテオミクス解析によると,サルモネラ菌の全タンパク質のうち,GenXあるいはYjeKを欠損させたときに発現量に影響をうけるのは85個のタンパク質であり,そのうち,Salmonella pathogenicity island SPI-1にコードされる宿主への感染侵入にかかわるタンパク質,糖の取り込みやATP生産などにかかわるタンパク質など25個のタンパク質を同定している.彼らは,宿主細胞で栄養源が限られているときエネルギー源を適切に活用するためEF-Pのリジル化修飾が不可欠であると述べている.一方で,リジルEF-Pがどのような分子機構でこれらの遺伝子の発現を調節しているのか,どのような遺伝子の翻訳開始に寄与するのかは未解明であり,翻訳因子としてのEF-Pの機能にはまだわからないことが多い.筆者らも,大腸菌に由来する11個を含む15個の構造遺伝子についてEF-P欠損株の粗抽出液を用いて無細胞タンパク質合成を行ったが,リジルEF-Pのありなしでタンパク質合成量に影響はみられなかった.したがって,リジルEF-Pがすべての遺伝子の翻訳開始に関与しているとは考えにくく,通常とは異なる特殊なケースの翻訳に関与しているのではないかと予想している.
おわりに
先日,セリルtRNA合成酵素パラログがATPのエネルギーを使ってグリシンまたはアラニンを活性化しアシルキャリアータンパク質をアミノアシル化する機能をもつ非リボソーム型ペプチドの合成酵素としてはたらくことが報告された15).この研究のGenXを含め,このようなアミノアシルtRNA合成酵素の触媒ドメインを起源とするアミノアシルtRNA合成酵素パラログはアミノ酸やATPに対する高い特異性や結合性という有用な性質をもつことから,アミノ酸生合成,補酵素生合成,tRNA修飾,非リボソームペプチド生合成,タンパク質修飾など,生命反応のさまざまな場面において進化の過程で採用されてきたのであろう.筆者らは,今回,リジルtRNA合成酵素パラログGenXの解析に取り組み,tRNAに似たL字型構造をとる翻訳因子EF-Pをアミノアシル化することを明らかにした.近年,翻訳因子だけでなくさまざまなタンパク質が核酸の構造を擬態するような現象が報告されているが,核酸の形をまねるタンパク質がその機能までまねることを解明した例はいままでになかった.今回の成果は,類縁関係の遠いモグラとケラの前足が同じような形と機能をもつという収斂進化を類推させることから,生物の個体レベルだけでなくタンパク質や核酸などの分子レベルでも同様の進化が起こっていたものと考えられ,遺伝暗号翻訳系の分子機構を通じた生物の進化を知るうえでも重要である.
GenXは大腸菌,サルモネラ菌,腸炎ビブリオ菌,コレラ菌など真正細菌のみに存在し,ヒトなどの真核生物にはない.したがって,GenXを特異的に阻害する低分子化合物は感染症をひき起こす病原菌や薬剤耐性菌に対して副作用のない有効な抗菌薬となる可能性がある.GenX-YjeK系によるEF-Pの翻訳後修飾にかかわる構造および機能の解明は,学術的な貢献だけでなく創薬開発にも大きく貢献することが期待される.
文 献
- Novoa, E. M., Castro de Moura, M., Orozco, M. et al.: A genomics method to identify pathogenicity-related proteins. Application to aminoacyl-tRNA synthetase-like proteins. FEBS Lett., 584, 460-466 (2010)[PubMed]
- Roy, H. & Ibba, M.: Bridging the gap between ribosomal and nonribosomal protein synthesis. Proc. Natl. Acad. Sci. USA, 107, 14517-14549 (2010)[PubMed]
- Kong, L., Fromant, M., Blanquet, S. et al.: Evidence for a new Escherichia coli protein resembling a lysyl-tRNA synthetase. Gene, 108, 163-164 (1991)[PubMed]
- Kaniga, K., Compton, M. S., Curtiss, R. 3rd et al.: Molecular and functional characterization of Salmonella enterica serovar typhimurium poxA gene: effect on attenuation of virulence and protection. Infect. Immnol., 66, 5599-5606 (1998)[PubMed]
- Bailly, M. & de Crecy-Lagard, V.: Predicting the pathway involved in post-translational modification of elongation factor P in a subset of bacterial species. Biol. Direct., 5, 3 (2010)[PubMed]
- Hanawa-Suetsugu, K., Sekine, S., Sakai, H. et al.: Crystal structure of elongation factor P from Thermus thermophilus HB8. Proc. Natl. Acad. Sci. USA, 101, 9595-9600 (2004)[PubMed]
- Blaha, G., Stanley, R. E. & Steitz, T. A.: Formation of the first peptide bond: the structure of EF-P bound to the 70S ribosome. Science, 325, 966-970 (2009)[PubMed]
- Glick, B. R. & Ganoza, M. C.: Identification of a soluble protein that stimulates peptide bond synthesis. Proc. Natl. Acad. Sci. USA, 72, 4257-4260 (1975)[PubMed]
- Glick, B. R. & Ganoza, M. C.: Peptide bond formation stimulated by protein synthesis factor EF-P depends on the aminoacyl moiety of the acceptor. Eur. J. Biochem., 97, 23-28 (1979)[PubMed]
- Ganoza, M. C., Kiel, M. C. & Aoki, H.: Evolutionary conservation of reactions in translation. Microbiol. Mol. Biol. Rev., 66, 460-485 (2002)[PubMed]
- Wolff, E. C., Kang, K. R., Kim, Y. S. et al.: Posttranslational synthesis of hypusine: evolutionary progression and specificity of the hypusine modification. Amino Acids, 33, 341-350 (2007)[PubMed]
- von Mering, C., Jensen, L. J., Snel, B. et al.: STRING: known and predicted protein-protein associations, integrated and transferred across organisms. Nucleic Acids Res., 33, D433-D437 (2005)[PubMed]
- Behshad, E., Ruzicka, F. J., Mansoorabadi, S. O. et al.: Enantiomeric free radicals and enzymatic control of stereochemistry in a radical mechanism: the case of lysine 2,3-aminomutases. Biochemistry, 45, 12639-12646 (2006)[PubMed]
- Navarre, W. W, Zou, S. B., Roy, H. et al.: PoxA, YjeK, and elongation factor P coordinately modulate virulence and drug resistance in Salmonella enterica. Mol. Cell, 39, 209-221 (2010)[PubMed]
- Mocibob, M., Ivic, N., Bilokapic, S. et al.: Homologs of aminoacyl-tRNA synthetases acylate carrier proteins and provide a link between ribosomal and nonribosomal peptide synthesis. Proc. Natl. Acad. Sci. USA, 107, 14585-14590 (2010)[PubMed]
著者プロフィール
略歴:2002年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 リサーチアソシエイトを経て,2006年より同 研究員.
研究テーマ:タンパク質合成系,遺伝子翻訳システムの化学生物学.
抱負:化学の視点で生命現象を解明し,得られた知見を有用な技術として応用したい.
横山茂之(Shigeyuki Yokoyama)
理化学研究所生命分子システム基盤研究領域 領域長,東京大学大学院理学系研究科 兼任教授.
© 2010 柳沢達男・横山茂之 Licensed under CC 表示 2.1 日本