サイクリン依存性キナーゼにより司令される間期の核膜孔複合体の形成
今本 尚子
(理化学研究所基幹研究所 今本細胞核機能研究室)
email:今本尚子
DOI: 10.7875/first.author.2010.030
Nuclear pore formation but not nuclear growth is governed by cyclin-dependent kinases (Cdks) during interphase.
Kazuhiro Maeshima, Haruki Iino, Saera Hihara, Tomoko Funakoshi, Ai Watanabe, Masaomi Nishimura, Reiko Nakatomi, Kazuhide Yahata, Fumio Imamoto, Tsutomu Hashikawa, Hideo Yokota, Naoko Imamoto
Nature Structural & Molecular Biology, 17, 1065-1071 (2010)
核膜孔複合体は核と細胞質とを往来するすべての物質の唯一の通り道である.核膜孔複合体は酵母からヒトまで保存された8角対称の幾何学的な構造をもち,総質量100 MDaにも及ぶ巨大なタンパク質複合体である。この大きな構造体が2層の脂質膜からなる核膜上に形成される“間期の核膜孔複合体の形成”過程を解析することは,これまで,技術的に困難であった.筆者らは,生細胞で核膜孔複合体を可視化することで,細胞融合法で作製したヘテロカリオンのなかで間期の核膜孔複合体の形成を可視化できる実験系の樹立に成功した.光ブリーチ法を併用することで,間期に起こる核膜孔複合体の形成が細胞周期のエンジンとして知られるサイクリン依存性キナーゼの司令で厳密に制御されていることを明らかにした.その生物学的な意義とともに,間期と細胞分裂終期の核膜孔複合体の形成に重要な違いがあることや,この研究でとらえた核膜孔複合体の形成中間体について議論する.
真核生物では核と細胞質とが2層の脂質膜からなる核膜によって隔てられている.核は遺伝子をもち転写や複製などの場である.一方,細胞質はタンパク質合成の場であるとともに,外界のシグナルを最初に受け取る場である.こうした核と細胞質のあいだを,タンパク質や種々のRNAはもちろんのこと,イオンなどの低分子からリボソームやウイルスなどの大きな粒子にいたるまでさまざまな物質が往来する.これらすべての物質の唯一の通り道となっているのが核膜に存在する核膜孔複合体(nuclear pore complex:NPC)である.
核膜孔複合体は8角対称の美しい幾何学的な構造をもち1),総質量およそ100 MDa(リボソームの38倍の大きさに相当)にも及ぶ,酵母からヒトまで保存された巨大なタンパク質複合体である2).ヒトをはじめとする高等真核生物の増殖細胞では,核膜孔複合体は細胞周期が進行するあいだに2回,形成される.1回は細胞分裂終期(post-mitotic NPC assembly),もう1回は間期(interphase NPC assembly)である.前者は細胞分裂期に核膜とともに崩壊した核膜孔複合体が分裂終期において姉妹染色体の周囲に核膜とともに再形成される過程であり,後者はつぎの細胞分裂にむけた準備のひとつとして核膜孔複合体の総数が核膜上で倍増する過程である.細胞分裂期に核膜が崩壊しない酵母では前者の細胞分裂終期の核膜孔複合体の形成は起こらない.しかし,核膜上に核膜孔複合体が形成される後者の反応はその生存に必須である.つまり,細胞分裂終期の核膜孔複合体の形成に比べて,核膜上で形成される間期の核膜孔複合体の形成が進化的には保存されているものと考えられる.しかし,高等真核生物にみられる細胞分裂終期で進む核膜孔複合体の形成の解析が先行しているのに対し,間期で進む核膜上の核膜孔複合体の形成の解析はこれまで進んでいない.その理由のひとつに,間期の核膜孔複合体の形成の解析がむずかしいことがあげられる.細胞分裂終期に進む核膜孔複合体は構造のまったく“ない”ところに形成されるのに対し,間期ではすでに核膜孔複合体が形成されている核膜上に同じ複合体が形成されるからである.つまり,細胞分裂終期で形成された核膜孔複合体は比較的容易に“観る”ことができるのに対し3),間期で新たに形成された核膜孔複合体は,単に“観る”だけでは既存の核膜孔複合体と区別することができず,この点が解析を困難にしている大きな理由であった.
筆者らは,間期の核膜孔複合体の形成を調べるにあたって,まず,核膜孔に安定に存在する核膜孔複合体因子“scaffold Nup”に注目した4).scaffoldには“土台”の意味があり,Nupは核膜孔複合体構成因子(nucleoporin)の略称である.核膜孔複合体を形成するうえで“土台”となる構成因子はすでに同定されており,これらがscaffold-Nupとよばれている.これら複合体構成因子は核膜孔複合体がいったん形成されると崩壊するまで複合体に安定に存在するものと考えられている.そのscaffold NupのひとつであるNup133またはNup107(数字は分子量を表す)に蛍光タンパク質Venus(YFP)をつなぎ,それを安定に発現する細胞株を取得することで核膜孔複合体を生細胞で可視化できるようにした.ひとつひとつの核膜孔複合体を数えると,細胞分裂終了後の初期G1からS期にかけてその数が急速に増えることがわかった.間期におけるこの核膜孔複合体の増加は,DNA合成阻害剤アフィディコリン(aphidicolin)では阻害されないが,細胞周期エンジンとして知られているサイクリン依存性キナーゼ(cyclin-dependent kinase:CDK)の阻害剤であるロスコビチン(roscovitine)で阻害されることがわかった.
“ひとつひとつの核膜孔複合体を数える”という作業は骨が折れるだけでなく,核の形や体積が不均一なことを考慮すると,核膜上に存在する核膜孔複合体の総数を定量するときに大きな誤差をもたらす可能性がある.つまり,数の増加を根拠に核膜孔複合体が形成されたと判断するのは正確性を欠くことになる.さらに問題なのは,数が増えることから形成されたことはわかっても,形成過程そのものを調べることができたわけではないことである.そこで,生細胞で核膜孔複合体の形成を可視化できる実験系の樹立を試みた.異なる細胞を融合させることにより雑種細胞(ヘテロカリオン)をつくることができる.この細胞融合現象は,1957年,岡田善雄博士が発見し,のちに“細胞工学”という学問分野が国内に創成される基盤ともなった,わが国で誕生した生きた細胞の解析系でもある.まずひとつは,この細胞融合法を利用して作製したヘテロカリオンを利用する実験系を考えた(図1a).CFP標識したヒストンを発現する細胞株(アクセプター細胞)と,YFP標識したscaffold-Nupを発現した細胞株(ドナー細胞)のそれぞれを初期G1に同調させて細胞融合すると,融合直後にはみられなかったアクセプター細胞の核表面のYFPのシグナルが,時間経過とともにアクセプター細胞の核表面の輝点として出現しその数が増えていく(図1b).こうした輝点の増加はアフィディコリンでは阻害されないがロスコビチンで阻害されることから(図1c),新たに形成された核膜孔複合体であると判断することができた.
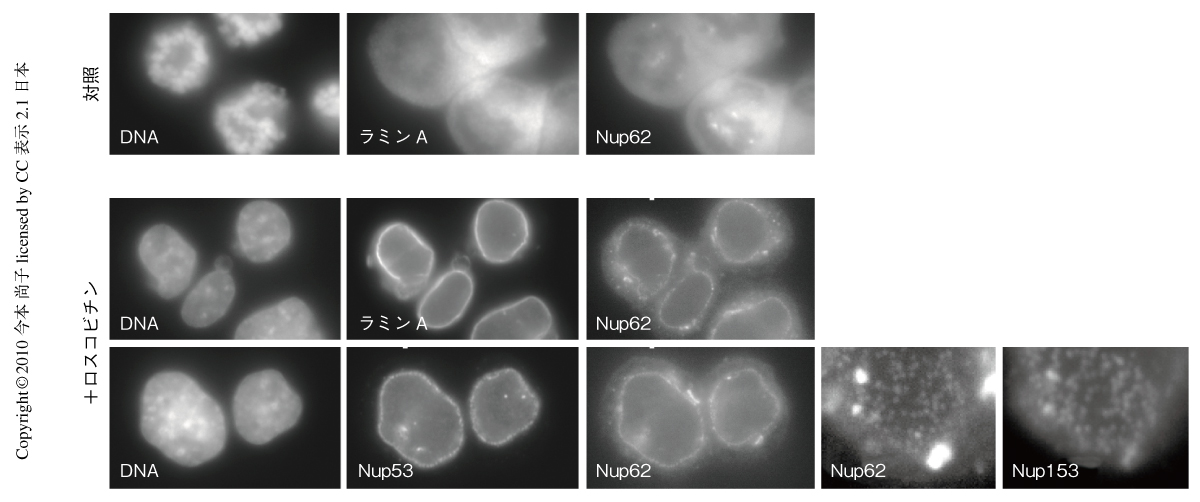
つぎに,細胞融合法のほか,光ブリーチ法を利用して5),間期における核膜孔複合体の形成がCDKの活性が阻害されるためにロスコビチンで阻害されるのかどうかを確認した.YFP標識したNup107を発現した細胞の細胞核の表面を光ブリーチしてYFPの蛍光を退色させると,退色した場所に新たに核膜孔複合体が形成された場合にはYFPの蛍光シグナルが再び現れる.それに対して,ロスコビチンで処理した細胞においては核表面の蛍光を退色させた場所には核膜孔複合体が新たに形成されないため蛍光は戻らない.また,CDKの別の阻害剤であるプルバラノール(purvalanol)で処理しても,ロスコビチンと同様に退色した核表面の蛍光が戻らない.このことから,核膜孔複合体の形成の阻害がロスコビチンに特有の作用ではなく,CDK活性の阻害によることが強く示唆された.さらに,CDK1とCDK2をsiRNAでノックダウンすると,やはり,光ブリーチ法で蛍光を退色させた場所にはYFPシグナルが戻らない.これらの結果から,核膜孔複合体の形成がロスコビチンで阻害されるのはCDK1とCDK2の活性を阻害したためであることが確認された.
クライオ走査電子顕微鏡を用いて,核膜孔複合体がさかんにつくられているG1/S期の細胞核の表面を観察した.すると,成熟した核膜孔複合体以外に成熟核膜孔複合体の1/2から1/3の大きさの構造体がしばしばみられた(図1d).この構造体はロスコビチンで処理した細胞の核表面にはみられないことから,核膜孔複合体が形成される際の形成中間体であると考えられた.筆者らは,この形成中間体を“nascent pore”と名づけた.興味深いことに,拡大したnascent poreは8角対称の成熟核膜孔複合体と異なり4角対称にみえた.nascent pore以外の形成中間体と考えられるほかの構造がクライオ走査電子顕微鏡による観察ではみられないことから,nascent poreが核膜孔複合体の形成過程の律速段階のひとつと考えられた.このnascent poreに含まれる核膜孔複合体の構成因子やその構造を詳細に明らかにしていくことは,核膜孔複合体の形成の原理を理解するうえで興味深い.また,ロスコビチンがnascent poreの形成をも阻害することから,CDK1とCDK2の活性は間期の核膜孔複合体の形成の初期段階,おそらくは,形成の開始反応に必要だろうと考える.
興味深いことに,CDK1とCDK2の活性は間期の核膜孔形成に必須であるが,分裂期終期の核膜孔複合体の形成には必要でないことがわかった(図2).
さきに述べたように,この論文は,1)間期の核膜孔複合体の形成を生細胞で可視化する実験系を樹立したこと,2)間期の核膜孔複合体の形成が細胞周期エンジンとして知られるCDKの司令で開始すること,の2点を示したことに意義がある.1)のヘテロカリオンを利用して形成を可視化する実験系では,蛍光のバックグラウンドがないところに新たに形成された核膜孔複合体が蛍光輝点として出現するため定量的な解析にも利用できる.この実験系は,今後,より高感度の顕微鏡を用いることで,核膜孔複合体の形成の全過程を生細胞ではじめてモニターできる解析系へと発展させることができるものと期待する.では,2)のCDKで制御されることをみつけたことの生物学的な意義が何であるかについて,以下で少し議論したい.
間期の核膜孔複合体の形成は,これまで制御されたイベントであるとは考えられていなかった6).細胞分裂終期の核膜孔複合体の形成が細胞分裂をへた細胞のなかで起こる事象であることから,増殖細胞に特異的なものであり,増殖しない細胞では起こらないことが容易に想像できたからであろう.一方,間期の核膜孔複合体の形成はどうであろうか.最近の研究から,高等真核生物の増殖細胞では細胞周期が進行するあいだに2回も形成される核膜孔複合体が,増殖能をもたない終末分化した細胞では新生されないことが明らかにされてきている.たとえば,神経細胞では数十年にも及ぶ長い細胞のライフスパンのあいだ,核膜孔複合体は壊されず新生もされず,いちど形成されたものが安定に存在するものと考えられる.このことから核膜孔複合体は“老化”すると考えるのが自然である.近年,核膜孔複合体構成因子がさまざまなヒト疾患の病因になると報告する論文数が増えているが7),これは,核膜孔複合体が老化することと決して無関係ではないと考えられる.間期の核膜孔複合体の形成の開始が増殖細胞のなかではたらくCDK1とCDK2の司令ではじめて起こるのであれば,増殖能をもたない細胞のなかで核膜孔複合体が新生されない理由のひとつは,そうした細胞のなかにはCDK1とCDK2の活性がないからであると説明できる.
つぎに,間期の核膜孔複合体の形成に必要なCDKが,細胞分裂終期の核膜孔複合体の形成には必要でないという筆者らの結果は興味深い示唆をもつ.核膜孔複合体は分裂終期と間期のどちらに形成されても同じ構成因子から同じ構造体が構築されるため,その構築過程と分子機構は“同じ”とであると考えられがちである.しかし,この2つの過程には大きな違いがある.細胞分裂終期では核膜孔複合体は染色体を足場にして形成される.その形成のトリガーは,ELYS/Mel28とよばれるAT-hook構造をもつDNAに結合する核膜孔複合体構成因子が,分裂終期の姉妹染色体にローディングされることである.ELYS/Mel28がローディングされるとscaffold-Nupがつぎつぎに染色体にリクルートされてくる8).ELYS/Mel28を細胞から除去すると細胞分裂終期の核膜孔複合体の形成が完全に阻害される.染色体を足場にして形成される細胞分裂終期の核膜孔複合体の形成に対し,間期で形成される核膜孔複合体は,まず,2層の脂質膜に挿入されなければならない.間期の核膜孔複合体の形成にはCDKが必要であるが,細胞分裂終期の核膜孔複合体の形成には必要でないことが,“染色体”を足場にして開始する細胞分裂終期の核膜孔複合体の形成と,2層の脂質膜である“核膜”を足場にして形成される間期の核膜孔複合体の形成の,とりわけ初期反応の違いを示しているのではないかと考えている.
筆者らの結果と一致して,ごく最近,ELYS/Mel28を細胞から除去しても間期の核膜孔複合体の形成が阻害されないことが報告され,細胞分裂終期の核膜孔複合体の形成の初期反応と,間期の核膜孔複合体の形成の初期反応とに違いのあることが指摘された9).2層の脂質膜に挿入される間期の核膜孔複合体の形成の最初の反応はいまだ明らかにされていない.間期の核膜孔複合体の形成の開始を誘引するCDKのターゲット因子が明らかになれば,その初期反応の分子機構を明らかにしていくうえで重要な情報を提供することになると考える.
筆者らの研究グループでは,数年前から,ヒト細胞の核膜孔複合体の挙動と,核内膜の裏打ちタンパク質であるラミンの結合因子とが密接な関連をもつことに注目している.ラミンは核内膜の裏打ちをする繊維状構造の構成タンパク質で,大きく分けてA型ラミンとB型ラミンとが存在する.その変異は早老症をはじめとする“ラミン病”と総称される多くの遺伝子疾患の原因となることで注目が集まっている.近年,ラミンは核内クロマチンの活性制御との関係でも注目されている.核膜孔複合体の細胞核表面の分布は細胞分裂をおえた初期G1の細胞では不均一であるが,細胞周期の進行にともなって分布が均一になる10).核膜孔複合体のこうした分布の変化は核内膜因子やラミンと密接であり,また,間期の核膜孔複合体の形成とも共役する現象である.実際,核膜孔複合体の分布とラミン(ならびに,その結合タンパク質)の分布に対するロスコビチンの作用を調べると,CDKは核膜孔複合体の形成の開始を司令するだけでなく,核膜孔複合体の分布とともに,B型ラミンならびにその結合タンパク質LBR(Lamin B binding protein)の分布の制御にも必須である.少なくとも,ヒト細胞においては核膜を足場にする間期の核膜孔複合体の形成に,核内膜因子とその裏打ちタンパク質とが重要な役割をはたす可能性が強いと考えている.
核膜孔複合体は,多くの種類の分子を選択的かつ効率的に通過させることのできる,細胞がつくりあげた“ナノマシン”ともいえる精緻な分子機械である.その構造構築にはタンパク質間の相互作用だけでなく,筆者らが今回みつけた細胞周期シグナルのほか,核内膜とその裏打ちタンパク質,染色体,脂質のダイナミクス(核膜孔複合体が形成される場所では平坦な脂質が湾曲しなければならない)など,細胞内のさまざまな異なる事象が互いに密接にからんでおり,それら事象の理解なくしてその形成過程を理解していくことは不可能である.核膜孔複合体の形成を明らかにしていくことは,細胞のさまざまな営みを学ぶことにもなるのである.
略歴:1988年 大阪大学大学院医学研究科 修了,同年 日本学術振興会 特別研究員, 1992年 大阪大学細胞工学センター 助手,1993年 大阪大学医学部 助手,2000年 国立遺伝学研究所 助教授を経て,2002年より理化学研究所 主任研究員.
研究テーマ:核-細胞質間分子輸送,細胞核の機能的構造構築.
抱負:オリジナリティーのある研究をしたい.
© 2010 今本 尚子 Licensed under CC 表示 2.1 日本
(理化学研究所基幹研究所 今本細胞核機能研究室)
email:今本尚子
DOI: 10.7875/first.author.2010.030
Nuclear pore formation but not nuclear growth is governed by cyclin-dependent kinases (Cdks) during interphase.
Kazuhiro Maeshima, Haruki Iino, Saera Hihara, Tomoko Funakoshi, Ai Watanabe, Masaomi Nishimura, Reiko Nakatomi, Kazuhide Yahata, Fumio Imamoto, Tsutomu Hashikawa, Hideo Yokota, Naoko Imamoto
Nature Structural & Molecular Biology, 17, 1065-1071 (2010)
要 約
核膜孔複合体は核と細胞質とを往来するすべての物質の唯一の通り道である.核膜孔複合体は酵母からヒトまで保存された8角対称の幾何学的な構造をもち,総質量100 MDaにも及ぶ巨大なタンパク質複合体である。この大きな構造体が2層の脂質膜からなる核膜上に形成される“間期の核膜孔複合体の形成”過程を解析することは,これまで,技術的に困難であった.筆者らは,生細胞で核膜孔複合体を可視化することで,細胞融合法で作製したヘテロカリオンのなかで間期の核膜孔複合体の形成を可視化できる実験系の樹立に成功した.光ブリーチ法を併用することで,間期に起こる核膜孔複合体の形成が細胞周期のエンジンとして知られるサイクリン依存性キナーゼの司令で厳密に制御されていることを明らかにした.その生物学的な意義とともに,間期と細胞分裂終期の核膜孔複合体の形成に重要な違いがあることや,この研究でとらえた核膜孔複合体の形成中間体について議論する.
はじめに
真核生物では核と細胞質とが2層の脂質膜からなる核膜によって隔てられている.核は遺伝子をもち転写や複製などの場である.一方,細胞質はタンパク質合成の場であるとともに,外界のシグナルを最初に受け取る場である.こうした核と細胞質のあいだを,タンパク質や種々のRNAはもちろんのこと,イオンなどの低分子からリボソームやウイルスなどの大きな粒子にいたるまでさまざまな物質が往来する.これらすべての物質の唯一の通り道となっているのが核膜に存在する核膜孔複合体(nuclear pore complex:NPC)である.
核膜孔複合体は8角対称の美しい幾何学的な構造をもち1),総質量およそ100 MDa(リボソームの38倍の大きさに相当)にも及ぶ,酵母からヒトまで保存された巨大なタンパク質複合体である2).ヒトをはじめとする高等真核生物の増殖細胞では,核膜孔複合体は細胞周期が進行するあいだに2回,形成される.1回は細胞分裂終期(post-mitotic NPC assembly),もう1回は間期(interphase NPC assembly)である.前者は細胞分裂期に核膜とともに崩壊した核膜孔複合体が分裂終期において姉妹染色体の周囲に核膜とともに再形成される過程であり,後者はつぎの細胞分裂にむけた準備のひとつとして核膜孔複合体の総数が核膜上で倍増する過程である.細胞分裂期に核膜が崩壊しない酵母では前者の細胞分裂終期の核膜孔複合体の形成は起こらない.しかし,核膜上に核膜孔複合体が形成される後者の反応はその生存に必須である.つまり,細胞分裂終期の核膜孔複合体の形成に比べて,核膜上で形成される間期の核膜孔複合体の形成が進化的には保存されているものと考えられる.しかし,高等真核生物にみられる細胞分裂終期で進む核膜孔複合体の形成の解析が先行しているのに対し,間期で進む核膜上の核膜孔複合体の形成の解析はこれまで進んでいない.その理由のひとつに,間期の核膜孔複合体の形成の解析がむずかしいことがあげられる.細胞分裂終期に進む核膜孔複合体は構造のまったく“ない”ところに形成されるのに対し,間期ではすでに核膜孔複合体が形成されている核膜上に同じ複合体が形成されるからである.つまり,細胞分裂終期で形成された核膜孔複合体は比較的容易に“観る”ことができるのに対し3),間期で新たに形成された核膜孔複合体は,単に“観る”だけでは既存の核膜孔複合体と区別することができず,この点が解析を困難にしている大きな理由であった.
1.この論文のおもな研究成果
筆者らは,間期の核膜孔複合体の形成を調べるにあたって,まず,核膜孔に安定に存在する核膜孔複合体因子“scaffold Nup”に注目した4).scaffoldには“土台”の意味があり,Nupは核膜孔複合体構成因子(nucleoporin)の略称である.核膜孔複合体を形成するうえで“土台”となる構成因子はすでに同定されており,これらがscaffold-Nupとよばれている.これら複合体構成因子は核膜孔複合体がいったん形成されると崩壊するまで複合体に安定に存在するものと考えられている.そのscaffold NupのひとつであるNup133またはNup107(数字は分子量を表す)に蛍光タンパク質Venus(YFP)をつなぎ,それを安定に発現する細胞株を取得することで核膜孔複合体を生細胞で可視化できるようにした.ひとつひとつの核膜孔複合体を数えると,細胞分裂終了後の初期G1からS期にかけてその数が急速に増えることがわかった.間期におけるこの核膜孔複合体の増加は,DNA合成阻害剤アフィディコリン(aphidicolin)では阻害されないが,細胞周期エンジンとして知られているサイクリン依存性キナーゼ(cyclin-dependent kinase:CDK)の阻害剤であるロスコビチン(roscovitine)で阻害されることがわかった.
“ひとつひとつの核膜孔複合体を数える”という作業は骨が折れるだけでなく,核の形や体積が不均一なことを考慮すると,核膜上に存在する核膜孔複合体の総数を定量するときに大きな誤差をもたらす可能性がある.つまり,数の増加を根拠に核膜孔複合体が形成されたと判断するのは正確性を欠くことになる.さらに問題なのは,数が増えることから形成されたことはわかっても,形成過程そのものを調べることができたわけではないことである.そこで,生細胞で核膜孔複合体の形成を可視化できる実験系の樹立を試みた.異なる細胞を融合させることにより雑種細胞(ヘテロカリオン)をつくることができる.この細胞融合現象は,1957年,岡田善雄博士が発見し,のちに“細胞工学”という学問分野が国内に創成される基盤ともなった,わが国で誕生した生きた細胞の解析系でもある.まずひとつは,この細胞融合法を利用して作製したヘテロカリオンを利用する実験系を考えた(図1a).CFP標識したヒストンを発現する細胞株(アクセプター細胞)と,YFP標識したscaffold-Nupを発現した細胞株(ドナー細胞)のそれぞれを初期G1に同調させて細胞融合すると,融合直後にはみられなかったアクセプター細胞の核表面のYFPのシグナルが,時間経過とともにアクセプター細胞の核表面の輝点として出現しその数が増えていく(図1b).こうした輝点の増加はアフィディコリンでは阻害されないがロスコビチンで阻害されることから(図1c),新たに形成された核膜孔複合体であると判断することができた.
つぎに,細胞融合法のほか,光ブリーチ法を利用して5),間期における核膜孔複合体の形成がCDKの活性が阻害されるためにロスコビチンで阻害されるのかどうかを確認した.YFP標識したNup107を発現した細胞の細胞核の表面を光ブリーチしてYFPの蛍光を退色させると,退色した場所に新たに核膜孔複合体が形成された場合にはYFPの蛍光シグナルが再び現れる.それに対して,ロスコビチンで処理した細胞においては核表面の蛍光を退色させた場所には核膜孔複合体が新たに形成されないため蛍光は戻らない.また,CDKの別の阻害剤であるプルバラノール(purvalanol)で処理しても,ロスコビチンと同様に退色した核表面の蛍光が戻らない.このことから,核膜孔複合体の形成の阻害がロスコビチンに特有の作用ではなく,CDK活性の阻害によることが強く示唆された.さらに,CDK1とCDK2をsiRNAでノックダウンすると,やはり,光ブリーチ法で蛍光を退色させた場所にはYFPシグナルが戻らない.これらの結果から,核膜孔複合体の形成がロスコビチンで阻害されるのはCDK1とCDK2の活性を阻害したためであることが確認された.
クライオ走査電子顕微鏡を用いて,核膜孔複合体がさかんにつくられているG1/S期の細胞核の表面を観察した.すると,成熟した核膜孔複合体以外に成熟核膜孔複合体の1/2から1/3の大きさの構造体がしばしばみられた(図1d).この構造体はロスコビチンで処理した細胞の核表面にはみられないことから,核膜孔複合体が形成される際の形成中間体であると考えられた.筆者らは,この形成中間体を“nascent pore”と名づけた.興味深いことに,拡大したnascent poreは8角対称の成熟核膜孔複合体と異なり4角対称にみえた.nascent pore以外の形成中間体と考えられるほかの構造がクライオ走査電子顕微鏡による観察ではみられないことから,nascent poreが核膜孔複合体の形成過程の律速段階のひとつと考えられた.このnascent poreに含まれる核膜孔複合体の構成因子やその構造を詳細に明らかにしていくことは,核膜孔複合体の形成の原理を理解するうえで興味深い.また,ロスコビチンがnascent poreの形成をも阻害することから,CDK1とCDK2の活性は間期の核膜孔複合体の形成の初期段階,おそらくは,形成の開始反応に必要だろうと考える.
興味深いことに,CDK1とCDK2の活性は間期の核膜孔形成に必須であるが,分裂期終期の核膜孔複合体の形成には必要でないことがわかった(図2).
2.研究成果からみえてくること
さきに述べたように,この論文は,1)間期の核膜孔複合体の形成を生細胞で可視化する実験系を樹立したこと,2)間期の核膜孔複合体の形成が細胞周期エンジンとして知られるCDKの司令で開始すること,の2点を示したことに意義がある.1)のヘテロカリオンを利用して形成を可視化する実験系では,蛍光のバックグラウンドがないところに新たに形成された核膜孔複合体が蛍光輝点として出現するため定量的な解析にも利用できる.この実験系は,今後,より高感度の顕微鏡を用いることで,核膜孔複合体の形成の全過程を生細胞ではじめてモニターできる解析系へと発展させることができるものと期待する.では,2)のCDKで制御されることをみつけたことの生物学的な意義が何であるかについて,以下で少し議論したい.
間期の核膜孔複合体の形成は,これまで制御されたイベントであるとは考えられていなかった6).細胞分裂終期の核膜孔複合体の形成が細胞分裂をへた細胞のなかで起こる事象であることから,増殖細胞に特異的なものであり,増殖しない細胞では起こらないことが容易に想像できたからであろう.一方,間期の核膜孔複合体の形成はどうであろうか.最近の研究から,高等真核生物の増殖細胞では細胞周期が進行するあいだに2回も形成される核膜孔複合体が,増殖能をもたない終末分化した細胞では新生されないことが明らかにされてきている.たとえば,神経細胞では数十年にも及ぶ長い細胞のライフスパンのあいだ,核膜孔複合体は壊されず新生もされず,いちど形成されたものが安定に存在するものと考えられる.このことから核膜孔複合体は“老化”すると考えるのが自然である.近年,核膜孔複合体構成因子がさまざまなヒト疾患の病因になると報告する論文数が増えているが7),これは,核膜孔複合体が老化することと決して無関係ではないと考えられる.間期の核膜孔複合体の形成の開始が増殖細胞のなかではたらくCDK1とCDK2の司令ではじめて起こるのであれば,増殖能をもたない細胞のなかで核膜孔複合体が新生されない理由のひとつは,そうした細胞のなかにはCDK1とCDK2の活性がないからであると説明できる.
つぎに,間期の核膜孔複合体の形成に必要なCDKが,細胞分裂終期の核膜孔複合体の形成には必要でないという筆者らの結果は興味深い示唆をもつ.核膜孔複合体は分裂終期と間期のどちらに形成されても同じ構成因子から同じ構造体が構築されるため,その構築過程と分子機構は“同じ”とであると考えられがちである.しかし,この2つの過程には大きな違いがある.細胞分裂終期では核膜孔複合体は染色体を足場にして形成される.その形成のトリガーは,ELYS/Mel28とよばれるAT-hook構造をもつDNAに結合する核膜孔複合体構成因子が,分裂終期の姉妹染色体にローディングされることである.ELYS/Mel28がローディングされるとscaffold-Nupがつぎつぎに染色体にリクルートされてくる8).ELYS/Mel28を細胞から除去すると細胞分裂終期の核膜孔複合体の形成が完全に阻害される.染色体を足場にして形成される細胞分裂終期の核膜孔複合体の形成に対し,間期で形成される核膜孔複合体は,まず,2層の脂質膜に挿入されなければならない.間期の核膜孔複合体の形成にはCDKが必要であるが,細胞分裂終期の核膜孔複合体の形成には必要でないことが,“染色体”を足場にして開始する細胞分裂終期の核膜孔複合体の形成と,2層の脂質膜である“核膜”を足場にして形成される間期の核膜孔複合体の形成の,とりわけ初期反応の違いを示しているのではないかと考えている.
筆者らの結果と一致して,ごく最近,ELYS/Mel28を細胞から除去しても間期の核膜孔複合体の形成が阻害されないことが報告され,細胞分裂終期の核膜孔複合体の形成の初期反応と,間期の核膜孔複合体の形成の初期反応とに違いのあることが指摘された9).2層の脂質膜に挿入される間期の核膜孔複合体の形成の最初の反応はいまだ明らかにされていない.間期の核膜孔複合体の形成の開始を誘引するCDKのターゲット因子が明らかになれば,その初期反応の分子機構を明らかにしていくうえで重要な情報を提供することになると考える.
筆者らの研究グループでは,数年前から,ヒト細胞の核膜孔複合体の挙動と,核内膜の裏打ちタンパク質であるラミンの結合因子とが密接な関連をもつことに注目している.ラミンは核内膜の裏打ちをする繊維状構造の構成タンパク質で,大きく分けてA型ラミンとB型ラミンとが存在する.その変異は早老症をはじめとする“ラミン病”と総称される多くの遺伝子疾患の原因となることで注目が集まっている.近年,ラミンは核内クロマチンの活性制御との関係でも注目されている.核膜孔複合体の細胞核表面の分布は細胞分裂をおえた初期G1の細胞では不均一であるが,細胞周期の進行にともなって分布が均一になる10).核膜孔複合体のこうした分布の変化は核内膜因子やラミンと密接であり,また,間期の核膜孔複合体の形成とも共役する現象である.実際,核膜孔複合体の分布とラミン(ならびに,その結合タンパク質)の分布に対するロスコビチンの作用を調べると,CDKは核膜孔複合体の形成の開始を司令するだけでなく,核膜孔複合体の分布とともに,B型ラミンならびにその結合タンパク質LBR(Lamin B binding protein)の分布の制御にも必須である.少なくとも,ヒト細胞においては核膜を足場にする間期の核膜孔複合体の形成に,核内膜因子とその裏打ちタンパク質とが重要な役割をはたす可能性が強いと考えている.
おわりに
核膜孔複合体は,多くの種類の分子を選択的かつ効率的に通過させることのできる,細胞がつくりあげた“ナノマシン”ともいえる精緻な分子機械である.その構造構築にはタンパク質間の相互作用だけでなく,筆者らが今回みつけた細胞周期シグナルのほか,核内膜とその裏打ちタンパク質,染色体,脂質のダイナミクス(核膜孔複合体が形成される場所では平坦な脂質が湾曲しなければならない)など,細胞内のさまざまな異なる事象が互いに密接にからんでおり,それら事象の理解なくしてその形成過程を理解していくことは不可能である.核膜孔複合体の形成を明らかにしていくことは,細胞のさまざまな営みを学ぶことにもなるのである.
文 献
- Beck, M., Lucic, V., Forster, F. et al.: Snapshots of nuclear pore complexes in action captured by cryo-electron tomography. Nature, 449, 611-615 (2007)[PubMed]
- Fahrenkrog, B. & Aebi, U.: The nuclear pore complex: nucleocytoplasmic transport and beyond. Nat. Rev. Mol. Cell Biol., 4, 757-766 (2003)[PubMed]
- Dultz, E., Zanin, E., Wurzenberger, C. et al.: Systematic kinetic analysis of mitotic dis- and reassembly of the nuclear pore in living cells. J. Cell Biol., 180, 857-865 (2008)[PubMed]
- Rabut, G., Doye, V. & Ellenberg J.: Mapping the dynamic organization of the nuclear pore complex inside single living cells. Nat. Cell Biol., 6, 1114-1121 (2004)[PubMed]
- Iino, H., Maeshima, K., Nakatomi, R. et al.: Live imaging system for visualizing nuclear pore complex (NPC) formation during interphase in mammalian cells. Genes Cells, 15, 647-660 (2010)[PubMed]
- Fernandez-Martinez, J. & Rout, M. P.: Nuclear pore complex biogenesis. Curr. Opin. Cell Biol., 21, 603-612 (2009)[PubMed]
- Capelson, M. & Hetzer, M. W.: The role of nuclear pores in gene regulation, development and disease. EMBO Rep., 10, 697-705 (2009)[PubMed]
- Antonin, W., Ellenberg, J. & Dultz, E.: Nuclear pore complex assembly through the cell cycle: regulation and membrane organization. FEBS Lett., 14, 2004-2016 (2008)[PubMed]
- Doucet, C. M., Talamas, J. A. & Hetzer, M. W.: Cell cycle-dependent differences in nuclear pore complex assembly in metazoa. Cell, 141, 1030-1041 (2010)[PubMed]
- Maeshima, K., Yahata, K., Sasaki, Y. et al.: Cell-cycle-dependent dynamics of nuclear pores: pore-free islands and lamins. J. Cell Sci., 119, 4442-4451 (2006)[PubMed]
著者プロフィール
略歴:1988年 大阪大学大学院医学研究科 修了,同年 日本学術振興会 特別研究員, 1992年 大阪大学細胞工学センター 助手,1993年 大阪大学医学部 助手,2000年 国立遺伝学研究所 助教授を経て,2002年より理化学研究所 主任研究員.
研究テーマ:核-細胞質間分子輸送,細胞核の機能的構造構築.
抱負:オリジナリティーのある研究をしたい.
© 2010 今本 尚子 Licensed under CC 表示 2.1 日本