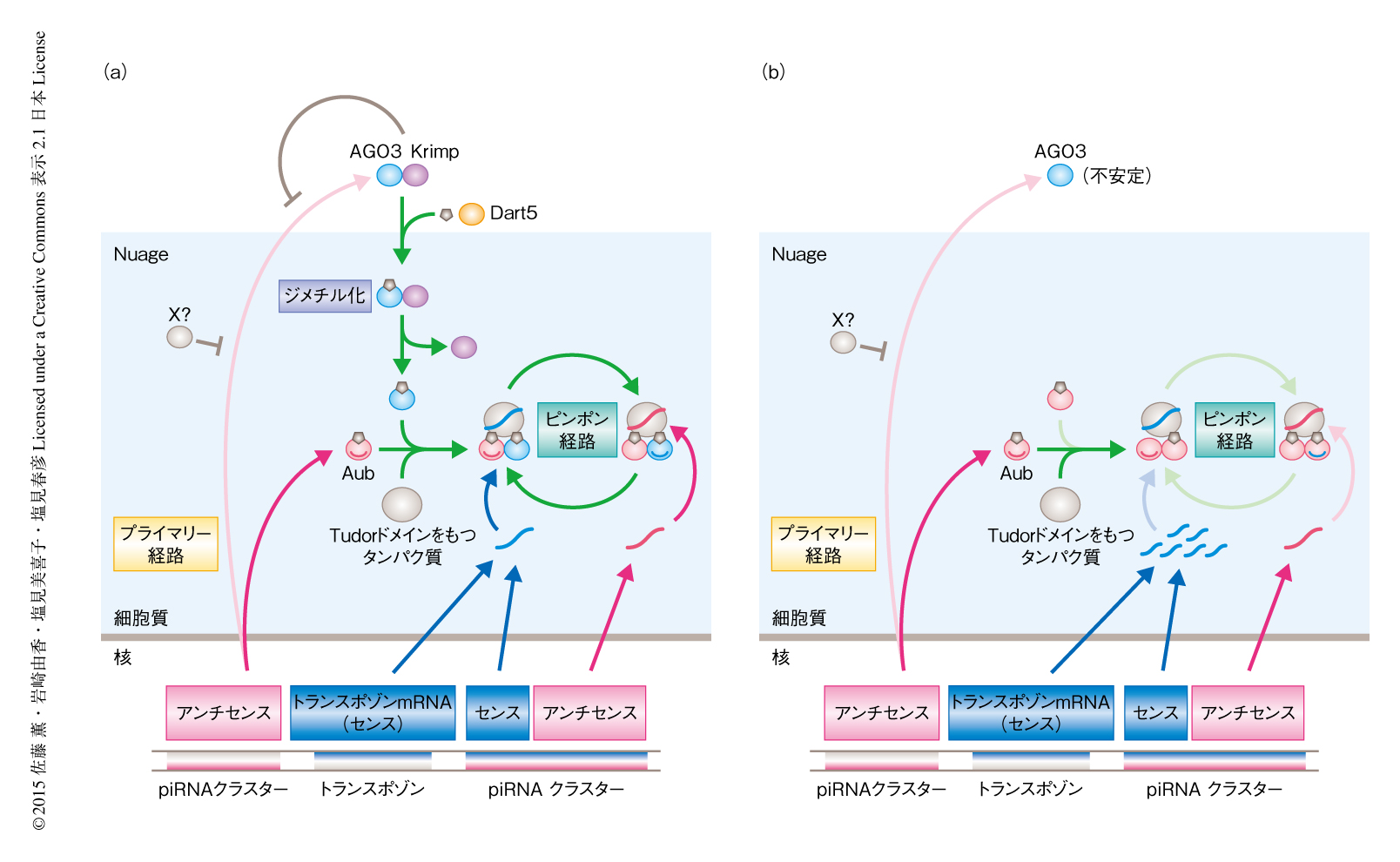
KrimpはAGO3とセンスpiRNAとの相互作用を制御することによりアンチセンスpiRNAの産生を促進する
佐藤 薫1・岩崎由香2・塩見美喜子1・塩見春彦2
(1東京大学大学院理学系研究科 生物科学専攻生物化学講座RNA生物学研究室,2慶應義塾大学医学部 分子生物学教室)
email:佐藤 薫,岩崎由香,塩見美喜子,塩見春彦
DOI: 10.7875/first.author.2015.099
Krimper enforces an antisense bias on piRNA pools by binding AGO3 in the Drosophila germline.
Kaoru Sato, Yuka W. Iwasaki, Aoi Shibuya, Piero Carninci, Yuuta Tsuchizawa, Hirotsugu Ishizu, Mikiko C. Siomi, Haruhiko Siomi
Molecular Cell, 59, 553-563 (2015)
piRNAは動物の生殖細胞に特異的に産生される小分子RNAであり,PIWIタンパク質と特異的に相互作用することによりトランスポゾンの発現を抑制する.piRNAはプライマリー経路およびピンポン経路により産生され,ショウジョウバエの卵巣においては,プライマリー経路を介してアンチセンスpiRNAがPIWIタンパク質のひとつAubと結合し,Aubにより開始されたピンポン経路を介してセンスpiRNAが同じくPIWIタンパク質のひとつAGO3と結合する.Aubと結合したアンチセンスpiRNAはトランスポゾンと相補的な配列をもつため,トランスポゾンのmRNAを標的として認識する.一方,センスpiRNAと結合したAGO3はピンポン経路を介してAubと結合するアンチセンスpiRNAの産生を促進することにより,間接的にトランスポゾンの発現の抑制に寄与する.筆者らは,この研究において,ショウジョウバエのpiRNA因子であるKrimpはセンスpiRNAと結合するまえのAGO3と特異的に相互作用することにより,AGO3とセンスpiRNAとの結合を促進すること,さらには,AGO3はアンチセンスpiRNAと結合する能力をもつが,Krimpはこの結合を抑制する機能をもつことを明らかにした.以上のことから,KrimpはAGO3のセンスpiRNAとの相互作用を促進するタンパク質であり,この機能によりピンポン経路は安定化しAubと結合するアンチセンスpiRNAの産生が促進されるという新たなモデルが提唱された.
piRNA(Piwi-interacting RNA)は動物の生殖細胞に特異的に産生される小分子RNAであり,Argonauteファミリータンパク質に属するPIWIサブファミリータンパク質と機能的な複合体であるpiRISC(piRNA-induced silencing complex)を形成することにより,トランスポゾンの発現を抑制しそれらの宿主ゲノムへの侵入をふせぐ1).このpiRNAによるトランスポゾンの発現の抑制はpiRNAの配列に依存的に起こり,トランスポゾンのmRNAと相補的な配列をもつアンチセンスpiRNAがトランスポゾンの配列を認識することによる.ショウジョウバエはPiwi,Aubergine(Aub),Argonaute 3(AGO3)の3種類のPIWIタンパク質をもち,Piwiは核に局在する一方,AubおよびAGO3は細胞質の核の周辺にNuage(フランス語で雲の意味)とよばれる顆粒体として局在する1).
piRNAの産生経路に関してはおもに2つのモデル,プライマリー経路およびピンポン経路が提唱されている.ショウジョウバエの卵巣の生殖細胞においては,piRNAクラスターとよばれるトランスポゾンの残骸の蓄積したゲノム領域から転写されたアンチセンスpiRNA前駆体(トランスポゾンのアンチセンス鎖に由来する配列をもつ)が,プライマリー経路を介して短くプロセシングされ,PiwiおよびAubと結合する2,3).そののち,アンチセンスpiRNAと結合したPiwiは核へと移行しトランスポゾンの転写を抑制する.一方,アンチセンスpiRNAと結合したAubは相補的な配列をもつトランスポゾンのmRNA(センス鎖)を切断し,これによりピンポン経路が開始される2,3)(図1a).切断されたトランスポゾンのmRNAの一部はセンスpiRNAとなりAGO3と結合する.つづいて,センスpiRNAと結合したAGO3は相補的な配列をもつアンチセンスpiRNA前駆体を切断し,その一部がアンチセンスpiRNAとなりAubと結合する2,3).このように,ピンポン経路はAubとAGO3のあいだで起こり,センスpiRNAと結合したAGO3はピンポン経路を介してAubと結合するアンチセンスpiRNAの産生を促進することにより,間接的にトランスポゾンの発現を抑制する(図1a).
また,PIWIタンパク質はN末端側にGly(あるいは,Ala)とArgからなるリピート配列をもち,このリピート配列のArgはメチル基転移酵素Dart5により対称型ジメチル化修飾をうけ,この修飾がpiRNAの産生および局在を制御すると考えられている4-6).これまで,ショウジョウバエやマウスにおける遺伝学的な解析により,piRNAの産生やpiRISCによるトランスポゾンの発現の抑制に関与するタンパク質(piRNA因子)がいくつか報告されている1,7).これらのpiRNA因子の多くはTudorドメインとよばれる対称型ジメチル化修飾部位との相互作用ドメインをもち,この相互作用を介してPIWIタンパク質の細胞における局在やpiRNAの産生に関与するpiRNA因子もある1,7).
Krimper(Krimp)はTudorドメインをもつpiRNA因子のひとつであり,Nuageに局在する8).krimp変異体の卵巣はpiRNAの産生量が減少しトランスポゾンの発現が上昇(脱抑制)するといった典型的なpiRNA因子欠損の表現型を示し,さらに,PiwiやAubの局在パターンは変化しないがAGO3のNuageへの局在がみられなくなることから,ピンポン経路のなかでもとくにAGO3によるアンチセンスpiRNAの産生に関与することが示唆されていた8,9).
piRNAの産生におけるKrimpの詳細な分子機能について明らかにするため,抗Krimp抗体を用いた免疫沈降法によりPIWIタンパク質との相互作用について調べたところ,AGO3との特異的な相互作用がみられた.Krimpが相互作用しているAGO3の状態を調べていけばpiRNAの産生におけるKrimpの分子的な役割が明らかにされると考え,AGO3の対称型ジメチル化修飾の状態について調べた.そのために,対称型ジメチル化修飾をもつAGO3を特異的に認識するモノクローナル抗体を作製し,この抗体を用いてKrimpが相互作用しているAGO3を調べた結果,その多くは対称型ジメチル化修飾をもたなかった.さらに,dart5変異体の卵巣においてもKrimpとAGO3との相互作用がみられたこと,Krimpと大腸菌において発現させた対称型ジメチル化修飾をもたない組換えAGO3との相互作用もみられたことから,Krimpは対称型ジメチル化修飾をうけるまえのAGO3を認識していることが示唆された(図1a).また,それぞれの相互作用部位をドメインマッピングした結果,KrimpのTudorドメインとAGO3のN末端側の対称型ジメチル化修飾部位とが相互作用していることが明らかにされた.これはいっけん,Tudorドメインと対称型ジメチル化修飾部位とのあいだの典型的な相互作用のようであったが,KrimpのTudorドメインは対称型ジメチル化修飾をもたないPIWIタンパク質を認識する点が,ほかのTudorドメインとは明らかに異なっていた.
Krimpの相互作用しているAGO3はpiRNAと結合しているかどうかを調べた.AGO3と特異的に結合することの知られているpiRNAに対するプローブを用いてノーザンブロット法により解析したところ,Krimpと相互作用しているAGO3からはシグナルは検出されなかった.さらに,定量PCR法を用いてほかのpiRNAについて解析したところ,やはり,Krimpと相互作用しているAGO3からはシグナルは検出されなかった.これらの結果から,KrimpはAGO3と特異的に相互作用するが,そのAGO3は対称型ジメチル化修飾をうけるまえ,かつ,センスpiRNAと結合するまえの状態であることが示唆された(図1a).
さきに述べたとおり,Krimpは対称型ジメチル化修飾をうけていないAGO3と相互作用する.krimp変異体の卵巣において,AGO3は対称型ジメチル化修飾をうけていなかった.また,krimp変異体の卵巣においてそれぞれのPIWIタンパク質と結合しているpiRNAの量について調べたところ,AGO3はpiRNAとはまったく結合しておらず,Aubと結合しているpiRNAも約半分に減少していた.一方で,Piwiと結合しているpiRNAの量にはほとんど変化はみられなかった.さらに,piRNAプロファイルを解析したところ,AGO3と結合するセンスpiRNAの産生が起こらないため,本来は起こるべきAubとAGO3とのあいだのピンポン経路が作動していないことが明らかにされた.また,krimp変異体の卵巣においてはAubとAubとのあいだのピンポン経路によるアンチセンスpiRNAの産生が若干みられたが,AubとAGO3とのあいだのピンポン経路に比べ効率が低いためか,十分な量のアンチセンスpiRNAの産生は起こらず,このため,トランスポゾンを抑制できていないと考えられた(図1b).
aub変異体の卵巣ではピンポン経路が作動しないため,プライマリー経路のみが作動している9).そのため,aub変異体の卵巣においてはAGO3と結合するpiRNAはほとんど産生されないと考えられたが,実際にAGO3と結合するpiRNAの量を調べてみたところ,減少はみられたものの検出された.さらに,piRNAプロファイルを解析したところ,プライマリー経路により産生されたと考えられたアンチセンスpiRNAがAGO3と結合することが明らかにされた.この結果から,AGO3はピンポン経路だけでなく,プライマリー経路により産生されたpiRNAとも結合することが示唆された(図1a).
ショウジョウバエの卵巣では生殖細胞のほか,卵巣性体細胞においてもpiRNAが産生されているが,生殖細胞と異なりPiwiのみが発現し,プライマリー経路によりPiwiと結合するアンチセンスpiRNAのみが産生されている10).卵巣性体細胞においてもKrimpは発現しているが,体細胞におけるプライマリー経路においては機能をもたない11).また,Krimpは卵巣性体細胞においてKrimp顆粒とよばれる細胞質顆粒体を形成することが報告されている11).
卵巣性体細胞においてAubを異所的に発現させると,体細胞性のプライマリー経路により産生されるアンチセンスpiRNAと結合するが,AGO3を異所的に発現させてもAubのようにアンチセンスpiRNAとの結合はみられなかった.それぞれの細胞における局在について調べてみると,Aubは細胞質の全体に分布していたのに対し,AGO3はKrimp顆粒に局在していることが明らかにされた.さらに,RNAi法によりKrimpをノックダウンしたところ,Aubと同様にAGO3が細胞質の全体へ拡散し,さらに,体細胞性のプライマリー経路により産生されたアンチセンスpiRNAと結合した.これらの結果から,AGO3はプライマリー経路により産生されたアンチセンスpiRNAともと結合しうるが,これはKrimpにより抑制されていることが示唆された(図1).
ピンポン経路においてKrimpはAGO3と相互作用し,対称型ジメチル化修飾やNuageへの局在を促進することによりセンスpiRNAとの結合を促進し,AubとAGO3とのあいだの安定したピンポン経路をささえることにより間接的にアンチセンスpiRNAの産生を促進し,トランスポゾンの抑制に貢献していた.また,AGO3はプライマリー経路を介してアンチセンスpiRNAと結合しうるが,これはKrimpにより抑制されていた.このように,KrimpによりAGO3とpiRNAとの結合が管理されることにより,Aubと結合するアンチセンスpiRNAの産生が促進され,ピンポン経路の開始およびトランスポゾンの抑制がされるようになっていた(図1).
AGO3はKrimpによりプライマリー経路によるアンチセンスpiRNAとの結合が抑制されていたわけだが,krimp変異体の卵巣においてはAGO3と結合したアンチセンスpiRNAはまったく検出されず,プライマリー経路によるアンチセンスpiRNA自体もみられなかった.これは,Krimpのような機能をもつほかのpiRNA因子がプライマリー経路を介したAGO3とアンチセンスpiRNAとの結合を抑制しているためであると考えられた.では,どうしてAGO3はアンチセンスpiRNAと結合しないようになっているのだろうか? AGO3とは異なり,AubやPiwiは卵母細胞の生殖質とよばれる領域に局在し,次世代の生殖細胞へと母性遺伝する3).さらに,母性遺伝したアンチセンスpiRNAはピンポン経路の開始に重要であることが報告されている12).プライマリー経路においてAGO3もアンチセンスpiRNAと結合すると,その分,Aubと結合するアンチセンスpiRNAの量が減少し,結果として母性遺伝するAubとそのアンチセンスpiRNAが減少してしまうと考えられた.これをふせぐため,AGO3とアンチセンスpiRNAとの結合をふせぐ分子機構が存在するのではないかと考えられた.
いずれのPIWIタンパク質もプライマリー経路およびピンポン経路を介してpiRNAと結合しうるが,KrimpをはじめとしたさまざまなpiRNA因子によりそれぞれの経路が制御され,決まったpiRNAが決まった経路によりPIWIタンパク質と結合するよう管理されていた.今後,piRNA因子ひとつひとつの分子機能を調べ,生殖細胞におけるpiRNAの産生経路やトランスポゾンの発現抑制の機構の全体像を明らかにしたい.
略歴:2009年 東京大学大学院新領域創成科学研究科 修了,同年 慶應義塾大学医学部 特任助教を経て,2013年より東京大学大学院理学系研究科 助教.
研究テーマ:piRNAの産生およびトランスポゾンの発現の制御機構.
岩崎 由香(Yuka W. Iwasaki)
略歴:2011年 慶應義塾大学大学院政策・メディア研究科後期博士課程 修了,同年より 慶應義塾大学医学部 特任助教(現 助教).
研究テーマ:小分子RNAの関与する生命現象の分子機構の解明および俯瞰的な理解.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
研究室URL:http://www-siomilab.biochem.s.u-tokyo.ac.jp/index.html
塩見 春彦(Haruhiko Siomi)
慶應義塾大学医学部 教授.
研究室URL:http://siomilab.med.keio.ac.jp/
© 2015 佐藤 薫・岩崎由香・塩見美喜子・塩見春彦 Licensed under CC 表示 2.1 日本
(1東京大学大学院理学系研究科 生物科学専攻生物化学講座RNA生物学研究室,2慶應義塾大学医学部 分子生物学教室)
email:佐藤 薫,岩崎由香,塩見美喜子,塩見春彦
DOI: 10.7875/first.author.2015.099
Krimper enforces an antisense bias on piRNA pools by binding AGO3 in the Drosophila germline.
Kaoru Sato, Yuka W. Iwasaki, Aoi Shibuya, Piero Carninci, Yuuta Tsuchizawa, Hirotsugu Ishizu, Mikiko C. Siomi, Haruhiko Siomi
Molecular Cell, 59, 553-563 (2015)
要 約
piRNAは動物の生殖細胞に特異的に産生される小分子RNAであり,PIWIタンパク質と特異的に相互作用することによりトランスポゾンの発現を抑制する.piRNAはプライマリー経路およびピンポン経路により産生され,ショウジョウバエの卵巣においては,プライマリー経路を介してアンチセンスpiRNAがPIWIタンパク質のひとつAubと結合し,Aubにより開始されたピンポン経路を介してセンスpiRNAが同じくPIWIタンパク質のひとつAGO3と結合する.Aubと結合したアンチセンスpiRNAはトランスポゾンと相補的な配列をもつため,トランスポゾンのmRNAを標的として認識する.一方,センスpiRNAと結合したAGO3はピンポン経路を介してAubと結合するアンチセンスpiRNAの産生を促進することにより,間接的にトランスポゾンの発現の抑制に寄与する.筆者らは,この研究において,ショウジョウバエのpiRNA因子であるKrimpはセンスpiRNAと結合するまえのAGO3と特異的に相互作用することにより,AGO3とセンスpiRNAとの結合を促進すること,さらには,AGO3はアンチセンスpiRNAと結合する能力をもつが,Krimpはこの結合を抑制する機能をもつことを明らかにした.以上のことから,KrimpはAGO3のセンスpiRNAとの相互作用を促進するタンパク質であり,この機能によりピンポン経路は安定化しAubと結合するアンチセンスpiRNAの産生が促進されるという新たなモデルが提唱された.
はじめに
piRNA(Piwi-interacting RNA)は動物の生殖細胞に特異的に産生される小分子RNAであり,Argonauteファミリータンパク質に属するPIWIサブファミリータンパク質と機能的な複合体であるpiRISC(piRNA-induced silencing complex)を形成することにより,トランスポゾンの発現を抑制しそれらの宿主ゲノムへの侵入をふせぐ1).このpiRNAによるトランスポゾンの発現の抑制はpiRNAの配列に依存的に起こり,トランスポゾンのmRNAと相補的な配列をもつアンチセンスpiRNAがトランスポゾンの配列を認識することによる.ショウジョウバエはPiwi,Aubergine(Aub),Argonaute 3(AGO3)の3種類のPIWIタンパク質をもち,Piwiは核に局在する一方,AubおよびAGO3は細胞質の核の周辺にNuage(フランス語で雲の意味)とよばれる顆粒体として局在する1).
piRNAの産生経路に関してはおもに2つのモデル,プライマリー経路およびピンポン経路が提唱されている.ショウジョウバエの卵巣の生殖細胞においては,piRNAクラスターとよばれるトランスポゾンの残骸の蓄積したゲノム領域から転写されたアンチセンスpiRNA前駆体(トランスポゾンのアンチセンス鎖に由来する配列をもつ)が,プライマリー経路を介して短くプロセシングされ,PiwiおよびAubと結合する2,3).そののち,アンチセンスpiRNAと結合したPiwiは核へと移行しトランスポゾンの転写を抑制する.一方,アンチセンスpiRNAと結合したAubは相補的な配列をもつトランスポゾンのmRNA(センス鎖)を切断し,これによりピンポン経路が開始される2,3)(図1a).切断されたトランスポゾンのmRNAの一部はセンスpiRNAとなりAGO3と結合する.つづいて,センスpiRNAと結合したAGO3は相補的な配列をもつアンチセンスpiRNA前駆体を切断し,その一部がアンチセンスpiRNAとなりAubと結合する2,3).このように,ピンポン経路はAubとAGO3のあいだで起こり,センスpiRNAと結合したAGO3はピンポン経路を介してAubと結合するアンチセンスpiRNAの産生を促進することにより,間接的にトランスポゾンの発現を抑制する(図1a).
また,PIWIタンパク質はN末端側にGly(あるいは,Ala)とArgからなるリピート配列をもち,このリピート配列のArgはメチル基転移酵素Dart5により対称型ジメチル化修飾をうけ,この修飾がpiRNAの産生および局在を制御すると考えられている4-6).これまで,ショウジョウバエやマウスにおける遺伝学的な解析により,piRNAの産生やpiRISCによるトランスポゾンの発現の抑制に関与するタンパク質(piRNA因子)がいくつか報告されている1,7).これらのpiRNA因子の多くはTudorドメインとよばれる対称型ジメチル化修飾部位との相互作用ドメインをもち,この相互作用を介してPIWIタンパク質の細胞における局在やpiRNAの産生に関与するpiRNA因子もある1,7).
Krimper(Krimp)はTudorドメインをもつpiRNA因子のひとつであり,Nuageに局在する8).krimp変異体の卵巣はpiRNAの産生量が減少しトランスポゾンの発現が上昇(脱抑制)するといった典型的なpiRNA因子欠損の表現型を示し,さらに,PiwiやAubの局在パターンは変化しないがAGO3のNuageへの局在がみられなくなることから,ピンポン経路のなかでもとくにAGO3によるアンチセンスpiRNAの産生に関与することが示唆されていた8,9).
1.Krimpは対称型ジメチル化修飾をうけていないAGO3と相互作用する
piRNAの産生におけるKrimpの詳細な分子機能について明らかにするため,抗Krimp抗体を用いた免疫沈降法によりPIWIタンパク質との相互作用について調べたところ,AGO3との特異的な相互作用がみられた.Krimpが相互作用しているAGO3の状態を調べていけばpiRNAの産生におけるKrimpの分子的な役割が明らかにされると考え,AGO3の対称型ジメチル化修飾の状態について調べた.そのために,対称型ジメチル化修飾をもつAGO3を特異的に認識するモノクローナル抗体を作製し,この抗体を用いてKrimpが相互作用しているAGO3を調べた結果,その多くは対称型ジメチル化修飾をもたなかった.さらに,dart5変異体の卵巣においてもKrimpとAGO3との相互作用がみられたこと,Krimpと大腸菌において発現させた対称型ジメチル化修飾をもたない組換えAGO3との相互作用もみられたことから,Krimpは対称型ジメチル化修飾をうけるまえのAGO3を認識していることが示唆された(図1a).また,それぞれの相互作用部位をドメインマッピングした結果,KrimpのTudorドメインとAGO3のN末端側の対称型ジメチル化修飾部位とが相互作用していることが明らかにされた.これはいっけん,Tudorドメインと対称型ジメチル化修飾部位とのあいだの典型的な相互作用のようであったが,KrimpのTudorドメインは対称型ジメチル化修飾をもたないPIWIタンパク質を認識する点が,ほかのTudorドメインとは明らかに異なっていた.
2.Krimpと相互作用しているAGO3はpiRNAと結合していない
Krimpの相互作用しているAGO3はpiRNAと結合しているかどうかを調べた.AGO3と特異的に結合することの知られているpiRNAに対するプローブを用いてノーザンブロット法により解析したところ,Krimpと相互作用しているAGO3からはシグナルは検出されなかった.さらに,定量PCR法を用いてほかのpiRNAについて解析したところ,やはり,Krimpと相互作用しているAGO3からはシグナルは検出されなかった.これらの結果から,KrimpはAGO3と特異的に相互作用するが,そのAGO3は対称型ジメチル化修飾をうけるまえ,かつ,センスpiRNAと結合するまえの状態であることが示唆された(図1a).
3.Krimpはピンポン経路においてAGO3と結合するセンスpiRNAの産生を促進する
さきに述べたとおり,Krimpは対称型ジメチル化修飾をうけていないAGO3と相互作用する.krimp変異体の卵巣において,AGO3は対称型ジメチル化修飾をうけていなかった.また,krimp変異体の卵巣においてそれぞれのPIWIタンパク質と結合しているpiRNAの量について調べたところ,AGO3はpiRNAとはまったく結合しておらず,Aubと結合しているpiRNAも約半分に減少していた.一方で,Piwiと結合しているpiRNAの量にはほとんど変化はみられなかった.さらに,piRNAプロファイルを解析したところ,AGO3と結合するセンスpiRNAの産生が起こらないため,本来は起こるべきAubとAGO3とのあいだのピンポン経路が作動していないことが明らかにされた.また,krimp変異体の卵巣においてはAubとAubとのあいだのピンポン経路によるアンチセンスpiRNAの産生が若干みられたが,AubとAGO3とのあいだのピンポン経路に比べ効率が低いためか,十分な量のアンチセンスpiRNAの産生は起こらず,このため,トランスポゾンを抑制できていないと考えられた(図1b).
4.AGO3とpiRNAとの結合はピンポン経路だけでなくプライマリー経路によっても起こる
aub変異体の卵巣ではピンポン経路が作動しないため,プライマリー経路のみが作動している9).そのため,aub変異体の卵巣においてはAGO3と結合するpiRNAはほとんど産生されないと考えられたが,実際にAGO3と結合するpiRNAの量を調べてみたところ,減少はみられたものの検出された.さらに,piRNAプロファイルを解析したところ,プライマリー経路により産生されたと考えられたアンチセンスpiRNAがAGO3と結合することが明らかにされた.この結果から,AGO3はピンポン経路だけでなく,プライマリー経路により産生されたpiRNAとも結合することが示唆された(図1a).
5.Krimpはプライマリー経路を介したAGO3とアンチセンスpiRNAとの結合を抑制する
ショウジョウバエの卵巣では生殖細胞のほか,卵巣性体細胞においてもpiRNAが産生されているが,生殖細胞と異なりPiwiのみが発現し,プライマリー経路によりPiwiと結合するアンチセンスpiRNAのみが産生されている10).卵巣性体細胞においてもKrimpは発現しているが,体細胞におけるプライマリー経路においては機能をもたない11).また,Krimpは卵巣性体細胞においてKrimp顆粒とよばれる細胞質顆粒体を形成することが報告されている11).
卵巣性体細胞においてAubを異所的に発現させると,体細胞性のプライマリー経路により産生されるアンチセンスpiRNAと結合するが,AGO3を異所的に発現させてもAubのようにアンチセンスpiRNAとの結合はみられなかった.それぞれの細胞における局在について調べてみると,Aubは細胞質の全体に分布していたのに対し,AGO3はKrimp顆粒に局在していることが明らかにされた.さらに,RNAi法によりKrimpをノックダウンしたところ,Aubと同様にAGO3が細胞質の全体へ拡散し,さらに,体細胞性のプライマリー経路により産生されたアンチセンスpiRNAと結合した.これらの結果から,AGO3はプライマリー経路により産生されたアンチセンスpiRNAともと結合しうるが,これはKrimpにより抑制されていることが示唆された(図1).
おわりに
ピンポン経路においてKrimpはAGO3と相互作用し,対称型ジメチル化修飾やNuageへの局在を促進することによりセンスpiRNAとの結合を促進し,AubとAGO3とのあいだの安定したピンポン経路をささえることにより間接的にアンチセンスpiRNAの産生を促進し,トランスポゾンの抑制に貢献していた.また,AGO3はプライマリー経路を介してアンチセンスpiRNAと結合しうるが,これはKrimpにより抑制されていた.このように,KrimpによりAGO3とpiRNAとの結合が管理されることにより,Aubと結合するアンチセンスpiRNAの産生が促進され,ピンポン経路の開始およびトランスポゾンの抑制がされるようになっていた(図1).
AGO3はKrimpによりプライマリー経路によるアンチセンスpiRNAとの結合が抑制されていたわけだが,krimp変異体の卵巣においてはAGO3と結合したアンチセンスpiRNAはまったく検出されず,プライマリー経路によるアンチセンスpiRNA自体もみられなかった.これは,Krimpのような機能をもつほかのpiRNA因子がプライマリー経路を介したAGO3とアンチセンスpiRNAとの結合を抑制しているためであると考えられた.では,どうしてAGO3はアンチセンスpiRNAと結合しないようになっているのだろうか? AGO3とは異なり,AubやPiwiは卵母細胞の生殖質とよばれる領域に局在し,次世代の生殖細胞へと母性遺伝する3).さらに,母性遺伝したアンチセンスpiRNAはピンポン経路の開始に重要であることが報告されている12).プライマリー経路においてAGO3もアンチセンスpiRNAと結合すると,その分,Aubと結合するアンチセンスpiRNAの量が減少し,結果として母性遺伝するAubとそのアンチセンスpiRNAが減少してしまうと考えられた.これをふせぐため,AGO3とアンチセンスpiRNAとの結合をふせぐ分子機構が存在するのではないかと考えられた.
いずれのPIWIタンパク質もプライマリー経路およびピンポン経路を介してpiRNAと結合しうるが,KrimpをはじめとしたさまざまなpiRNA因子によりそれぞれの経路が制御され,決まったpiRNAが決まった経路によりPIWIタンパク質と結合するよう管理されていた.今後,piRNA因子ひとつひとつの分子機能を調べ,生殖細胞におけるpiRNAの産生経路やトランスポゾンの発現抑制の機構の全体像を明らかにしたい.
文 献
- Siomi, M. C., Sato, K., Pezic, C. et al.: PIWI-interacting small RNAs: the vanguard of genome defence. Nat. Rev. Mol. Cell Biol., 12, 246-258 (2011)[PubMed]
- Gunawardane, L. S., Saito, K., Nishida, K. M. et al.: A slicer-mediated mechanism for repeat-associated siRNA 5’ end formation in Drosophila. Science, 315, 1587-1590 (2007)[PubMed]
- Brennecke, J., Aravin, A. A., Stark, A. et al.: Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila. Cell, 128, 1089-1103 (2007)[PubMed]
- Kirino, Y., Kim, N., de Planell-Saguer, M. et al.: Arginine methylation of Piwi proteins catalysed by dPRMT5 is required for Ago3 and Aub stability. Nat. Cell Biol., 11, 652-658 (2009)[PubMed]
- Nishida, K. M., Okada, T. N., Kawamura, T. et al.: Functional involvement of Tudor and dPRMT5 in the piRNA processing pathway in Drosophila germlines. EMBO J., 28, 3820-3831 (2009)[PubMed]
- Kirino, Y., Vourekas, A., Sayed, N. et al.: Arginine methylation of Aubergine mediates Tudor binding and germ plasm localization. RNA, 16, 70-78 (2010)[PubMed]
- Ishizu, H., Siomi, H. & Siomi, M. C.: Biology of PIWI-interacting RNAs: new insights into biogenesis and function inside and outside of germlines. Genes Dev., 26, 2361-2373 (2012)[PubMed]
- Lim, A. K. & Kai, T.: Unique germ-line organelle, nuage, functions to repress selfish genetic elements in Drosophila melanogaster. Proc. Natl. Acad. Sci. USA, 104, 6714-6719 (2007)[PubMed]
- Malone, C. D., Brennecke, J., Dus, M. et al.: Specialized piRNA pathways act in germline and somatic tissues of the Drosophila ovary. Cell, 137, 522-535 (2009)[PubMed]
- Saito, K., Inagaki, S., Mituyama, T. et al.: A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature, 461, 1296-1299 (2009)[PubMed]
- Olivieri, D., Senti, K. A., Subramanian, S. et al.: The cochaperone shutdown defines a group of biogenesis factors essential for all piRNA populations in Drosophila. Mol. Cell, 47, 954-969 (2012)[PubMed]
- Le Thomas, A., Stuwe, E., Li, S. et al.: Transgenerationally inherited piRNAs trigger piRNA biogenesis by changing the chromatin of piRNA clusters and inducing precursor processing. Genes Dev., 28, 1667-1680 (2014)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院新領域創成科学研究科 修了,同年 慶應義塾大学医学部 特任助教を経て,2013年より東京大学大学院理学系研究科 助教.
研究テーマ:piRNAの産生およびトランスポゾンの発現の制御機構.
岩崎 由香(Yuka W. Iwasaki)
略歴:2011年 慶應義塾大学大学院政策・メディア研究科後期博士課程 修了,同年より 慶應義塾大学医学部 特任助教(現 助教).
研究テーマ:小分子RNAの関与する生命現象の分子機構の解明および俯瞰的な理解.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
研究室URL:http://www-siomilab.biochem.s.u-tokyo.ac.jp/index.html
塩見 春彦(Haruhiko Siomi)
慶應義塾大学医学部 教授.
研究室URL:http://siomilab.med.keio.ac.jp/
© 2015 佐藤 薫・岩崎由香・塩見美喜子・塩見春彦 Licensed under CC 表示 2.1 日本