Jmjd3はIRF4を介してM2型マクロファージへの分化および寄生虫感染に対する生体防御応答を制御している
佐藤 荘・竹内 理・審良静男
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:佐藤 荘,審良静男
DOI: 10.7875/first.author.2010.027
The Jmjd3-Irf4 axis regulates M2 macrophage polarization and host responses against helminth infection.
Takashi Satoh, Osamu Takeuchi, Alexis Vandenbon, Koubun Yasuda, Yoshiaki Tanaka, Yutaro Kumagai, Tohru Miyake, Kazufumi Matsushita, Toshihiko Okazaki, Tatsuya Saitoh, Kiri Honma, Toshifumi Matsuyama, Katsuyuki Yui, Tohru Tsujimura, Daron M Standley, Kenji Nakanishi, Kenta Nakai, Shizuo Akira
Nature Immunology, 11, 936-944 (2010)
自然免疫を担当するマクロファージには機能的に少なくともM1型とM2型の2種類のあることが知られている.M1型マクロファージはToll様受容体に対するリガンドによって,また,細菌,ウイルス,真菌類の感染時に活性化し,それら病原体の排除に重要なサイトカインなどを産生する.一方で,M2型マクロファージは寄生虫感染,アレルギー応答,脂肪代謝,創傷治癒,がん転移などに関与しており,いくつかの遺伝子をマーカーとして発現する.この研究では,寄生虫感染の際のM2型マクロファージへの分化の分子機構とエピジェネティックな遺伝子制御との関係性に焦点をあてた.その結果,ヒストンH3の27番目のリジン残基の脱メチル化酵素であるJmjd3のノックアウトマウスではM2型マクロファージの誘導が起こらなくなっていた.このJmjd3による脱メチル化の直接のターゲットはIRF4遺伝子であった.IRF4は免疫応答,細胞の分化増殖、発がんなどに関係する転写因子である.Jmjd3はM1型マクロファージとM2型マクロファージとのバランスを傾けてM2型マクロファージへと分化させるために必要不可欠のはたらきをしていることが明らかになった.
自然免疫を担当する細胞であるマクロファージは,パターン認識受容体(pattern-recognition receptor:PRR)を介して感染をいち早く察知し,免疫系の活性化を惹起する.なかでも,Toll様受容体(Toll-like receptor:TLR)ファミリーはその代表的な受容体であり,これらを介して細菌,ウイルス,原虫や真菌類を認識するとマクロファージは活性化し,炎症性サイトカインやI型インターフェロンなどを産生して感染に対応する1).
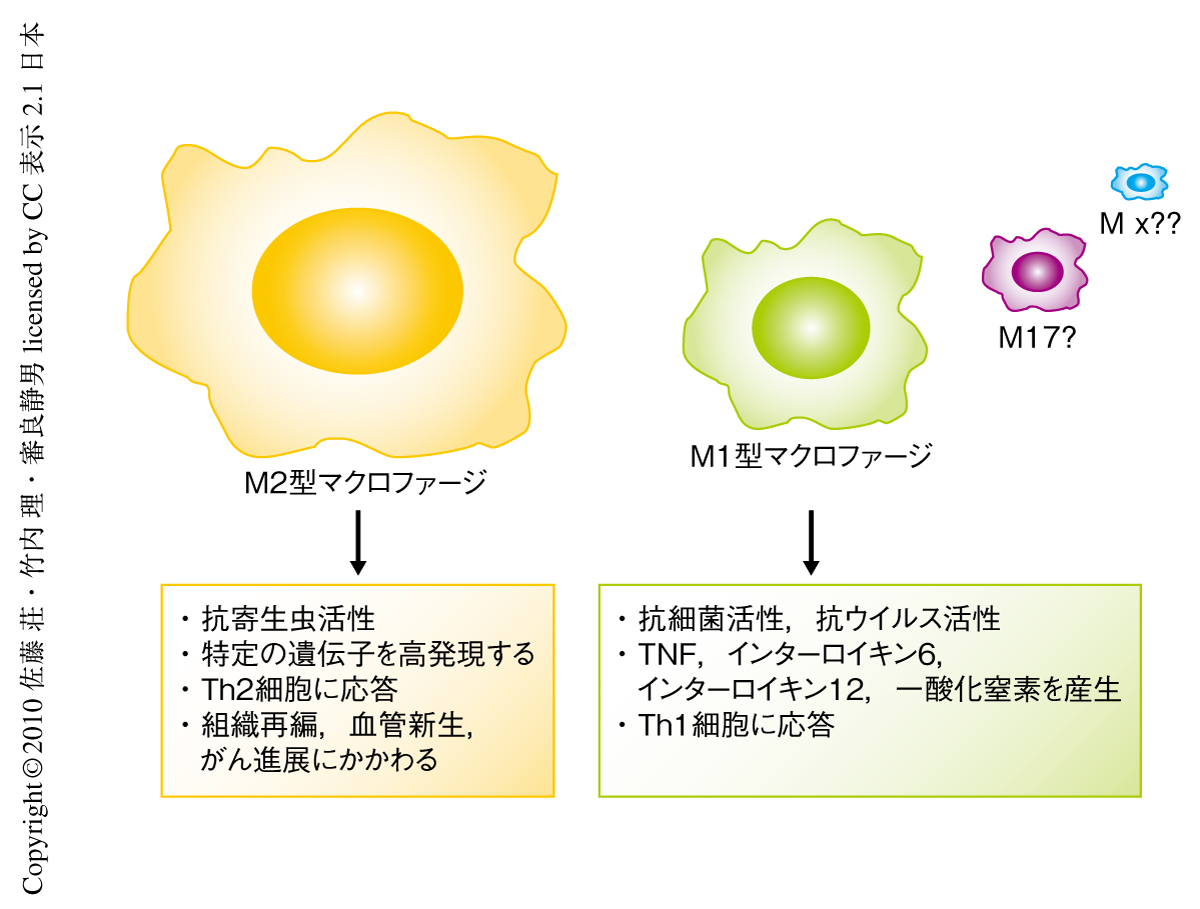
現在,マクロファージは機能的に少なくともM1型とM2型との2種類のあることが知られており,M1型マクロファージは細菌,ウイルスや真菌類の感染時に活性化し,それらの病原体の排除に重要な腫瘍壊死因子(tumor necrosis factor:TNF),一酸化窒素,また,インターロイキン6,インターフェロンやインターロイキン1βなどのサイトカインを産生する.一方で,ある種のマクロファージは寄生虫感染,アレルギー応答,脂肪代謝,創傷治癒,がん転移などに関与しており,これらのマクロファージはM2型マクロファージと呼称され,Arginase1遺伝子,Ym1遺伝子,Fizz1遺伝子などをマーカーとして発現する2-4)(図1).この研究では,寄生虫感染の際のエピジェネティックな遺伝子制御,M2型マクロファージへの分化の分子機構,および,宿主の感染応答に焦点をあてて研究を行われた.
Jmjd3はヒストンH3のトリメチル化された27番目のリジン残基の脱メチル化酵素である.このJmjd3のノックアウトマウスにチオグリコール酸を腹腔内投与したところ,誘導されるマクロファージの数は正常であり,さらに,それらのマクロファージがTLRリガンドによる刺激依存的に産生する炎症性サイトカインについて野生型マウスと同等の量が認められた.つぎに,Jmjd3ノックアウトマウスに細胞内寄生菌であるListeria monocytogenesを感染させたところ,野生型マウスと同等のサイトカインの産生を認めたほか,感染に応答して遊走してくる細胞集団についても野生型マウスとの差が確認されなかった.以上のことから,Jmjd3ノックアウトマウスにおいて誘導されるM1型マクロファージはTLRリガンドや細菌感染に対して正常な応答を示すことが明らかとなった.
キチンは寄生虫などの構成成分であり天然には豊富に存在していて,アレルギー応答を誘導する原因物質のひとつとして報告されている5).野生型マウスにキチンを投与するとM2型マクロファージが活性化され,それらが好塩基球や好酸球の遊走を誘導する.このキチンを野生型マウスとJmjd3ノックアウトマウスとに投与することによりキチンに対するアレルギー反応を調べた.
キチンの投与に対し,Jmjd3ノックアウトマウスは野生型マウスと比較してM2型マクロファージマーカーの発現が顕著に減少しており,さらには,好酸球の腹腔内への遊走がまったく起こらなかった.つづいて,Jmjd3ノックアウトマウスに対し寄生虫であるNippostrongylus brasiliensisの感染実験を行った.この寄生虫はマウスへの皮下での感染ののち肺へと移動する.そこで,感染後5日目で肺を回収し肺における免疫応答を調べた.キチン投与の際と同様に,Jmjd3ノックアウトマウスでは肺でのM2型マクロファージマーカーの発現が減少しており,さらには,感染中期での肺門リンパ節へのCD4陽性インターロイキン4産生細胞の集積がみられなかった.感染後期においては,野生型マウスでは肺への好酸球の遊走や泡沫化マクロファージが確認されたものの,Jmjd3ノックアウトマウスではそれらの細胞の遊走はみられず泡沫化マクロファージも確認されなかった.以上のことから,Jmjd3ノックアウトマウスでは寄生虫感染に対するM2型マクロファージへの分化は起こらず,さらに,その細胞が起点となって惹起する免疫応答もまったく起こっていないことが明らかになった.
骨髄細胞からマクロファージを誘導させるサイトカインの代表的なものとして,顆粒球マクロファージコロニー刺激因子(granulocyte-macrophage colony-stimulation factor:GM-CSF)やマクロファージコロニー刺激因子(macrophage colony-stimulation factor:M-CSF)などがあり,前者はM1様マクロファージを,後者はM2様マクロファージを誘導するという報告がある6,7).そこで,野生型マウスおよびJmjd3ノックアウトマウスに由来する骨髄細胞をこれらのサイトカインで培養して得られたマクロファージについて調べた.
GM-CSF誘導性のM1様マクロファージは,野生型マウスとJmjd3ノックアウトマウスとでほぼ同数の細胞が得られ,TLRリガンドに対する応答も正常であった.一方で,M-CSF誘導性のM2様マクロファージは,Jmjd3ノックアウトマウスから得られる細胞数は野生型マウスから得られる数と比較して非常に少なく,M2型マクロファージマーカーの発現も顕著に減弱していた.以上のことから,in vitroにおいても,Jmjd3ノックアウトマウスではM-CSF誘導性M2様マクロファージの誘導が起こらなくなっていることが明らかとなった.
そこで,Jmjd3のC末端側に位置しヒストンの脱メチル化活性に寄与しているJmjCドメインについて,野生型および変異体の両者をレトロウイルスベクターによりこのJmjd3ノックアウトマウスに由来するM-CSF誘導性のM2様マクロファージに発現させたところ,野生型JmjCドメインを発現させたときはM2型マクロファージマーカーの発現は回復したが,変異型JmjCドメインを発現させたときはマーカーの発現は低下したままであった.以上のことから,このJmjCドメインがM2型マクロファージへの分化に重要であることが明らかになった.
Jmjd3にはUTX,UTYというファミリータンパク質が存在しており,それらはヒストンH3のトリメチル化された27番目のリジン残基を脱メチル化するというエピジェネティックな遺伝子制御を行う役割をはたしている8-10).ヒストンH3のジメチル化された27番目のリジン残基のメチル化は遺伝子発現を抑制するはたらきをもつ一方で,逆にJmjd3によるトリメチル化された27番目のリジン残基の脱メチル化は遺伝子発現を促進することが報告されている.
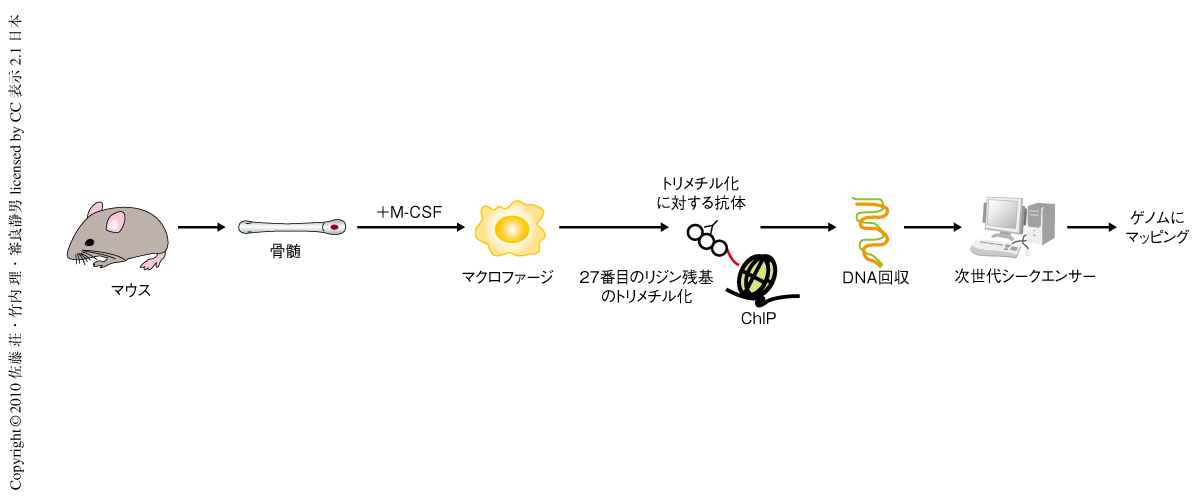
Jmjd3により直接に制御されているターゲット遺伝子を同定する目的で,クロマチン免疫沈降シークエンシング(chromatin immuno-precipitation on sequencing:ChIP-seq)解析を行った.ChIP-seq解析とは,任意の抗体を用いて免疫沈降を行い,回収したDNA断片からサンプルを調製し次世代シークエンサーを用いて高速シークエンシングを行うもので,ヒストンテイルのメチル化,アセチル化やリン酸化など,クロマチン構造変化のエピジェネティックな修飾や転写調節因子のゲノムでの結合部位を網羅的に解析することができる.ここでは,Jmjd3ノックアウトマウスではヒストンH3の27番目のリジン残基においてトリメチル化からジメチル化への脱メチル化が起こらず,Jmjd3によって直接的に制御されている遺伝子のプロモーター領域はトリメチル化状態のままになっているという仮定のもと,トリメチル化に対する抗体を用いて免疫沈降を行ったサンプルを使用した(図2).
その結果,M2型マクロファージのマーカー遺伝子のプロモーター領域におけるヒストンH3の27番目のリジン残基のトリメチル化は,野生型マウスとJmjd3ノックアウトマウスの両方でほとんど確認されず,さらに,Jmjd3によって制御されていると報告されていたいくつかのHOX系遺伝子のトリメチル化は野生型マウスとJmjd3ノックアウトマウスとで同程度が確認され,それらのあいだに差異は認められなかった.しかしながら,DNAマイクロアレイの結果から,これらの遺伝子において野生型マウスとJmjd3ノックアウトマウスとのあいだのmRNAの発現量に差があることから,Jmjd3はこれらの遺伝子を直接的ではなく間接的に制御していることが推測された.
そこで,Jmjd3の直接的なターゲットを同定するため,プロモーター領域について野生型マウスではトリメチル化の減少が確認されJmjd3ノックアウトマウスではトリメチル化されたままになっている遺伝子に着目して解析を行った結果,IRF4遺伝子のプロモーター領域においてヒストンH3の27番目のリジン残基のトリメチル化に野生型マウスとJmjd3ノックアウトマウスとのあいだに顕著な差異のあることを確認した.IRF4(interferon regulatory factor 4)は免疫応答,細胞の分化増殖、発がんなどに関係する転写因子である.このIRF4のノックアウトマウスにキチンを投与したところ,Jmjd3ノックアウトマウスの表現型と同様に,M2型マクロファージマーカーの発現は低下し,さらには,好酸球の遊走もみられなかった.つづいて,Jmjd3ノックアウトマウスに由来する骨髄細胞にレトロウイルスベクターによりIRF4を発現させ,M-CSFを用いてM2様マクロファージを分化させたところ,M2型マクロファージマーカーの発現が上昇していることが確認された.以上のことから,IRF4遺伝子がJmjd3の直接的なターゲット遺伝子であり,この遺伝子がM2型マクロファージへの分化に必要不可欠であることが明らかとなった.
この研究では,ヒストンH3の27番目のリジン残基の脱メチル化酵素であるJmjd3がM2型マクロファージへの分化に寄与しており,次世代シークエンサーを用いたChIP-Seqの技術を応用することによって,IRF4遺伝子がこのJmjd3の直接のターゲットであり,M1型マクロファージとM2型マクロファージとのバランスを傾けてM2型マクロファージへと分化させるために必要不可欠であることを突き止めることができた(図3).
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,同年より大阪大学免疫学フロンティア研究センター 博士研究員.
研究テーマ:自然免疫におけるマクロファージの機能の解析.
抱負:近年,マクロファージはこれまで考えられてきた機能を超えて,感染症だけでなく,アレルギー,メタボリックシンドローム,そして,がん浸潤にいたるまで,われわれの生活のさまざまなところに関与していることが明らかとなってきました.このマクロファージの機能解析を足掛かりに自然免疫系の未解明な部分を紐解き,病態・疾患の解明に役立つような,人のためになる研究を行いたいと思っています.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2010 佐藤 荘・竹内 理・審良静男 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:佐藤 荘,審良静男
DOI: 10.7875/first.author.2010.027
The Jmjd3-Irf4 axis regulates M2 macrophage polarization and host responses against helminth infection.
Takashi Satoh, Osamu Takeuchi, Alexis Vandenbon, Koubun Yasuda, Yoshiaki Tanaka, Yutaro Kumagai, Tohru Miyake, Kazufumi Matsushita, Toshihiko Okazaki, Tatsuya Saitoh, Kiri Honma, Toshifumi Matsuyama, Katsuyuki Yui, Tohru Tsujimura, Daron M Standley, Kenji Nakanishi, Kenta Nakai, Shizuo Akira
Nature Immunology, 11, 936-944 (2010)
要 約
自然免疫を担当するマクロファージには機能的に少なくともM1型とM2型の2種類のあることが知られている.M1型マクロファージはToll様受容体に対するリガンドによって,また,細菌,ウイルス,真菌類の感染時に活性化し,それら病原体の排除に重要なサイトカインなどを産生する.一方で,M2型マクロファージは寄生虫感染,アレルギー応答,脂肪代謝,創傷治癒,がん転移などに関与しており,いくつかの遺伝子をマーカーとして発現する.この研究では,寄生虫感染の際のM2型マクロファージへの分化の分子機構とエピジェネティックな遺伝子制御との関係性に焦点をあてた.その結果,ヒストンH3の27番目のリジン残基の脱メチル化酵素であるJmjd3のノックアウトマウスではM2型マクロファージの誘導が起こらなくなっていた.このJmjd3による脱メチル化の直接のターゲットはIRF4遺伝子であった.IRF4は免疫応答,細胞の分化増殖、発がんなどに関係する転写因子である.Jmjd3はM1型マクロファージとM2型マクロファージとのバランスを傾けてM2型マクロファージへと分化させるために必要不可欠のはたらきをしていることが明らかになった.
はじめに
自然免疫を担当する細胞であるマクロファージは,パターン認識受容体(pattern-recognition receptor:PRR)を介して感染をいち早く察知し,免疫系の活性化を惹起する.なかでも,Toll様受容体(Toll-like receptor:TLR)ファミリーはその代表的な受容体であり,これらを介して細菌,ウイルス,原虫や真菌類を認識するとマクロファージは活性化し,炎症性サイトカインやI型インターフェロンなどを産生して感染に対応する1).
現在,マクロファージは機能的に少なくともM1型とM2型との2種類のあることが知られており,M1型マクロファージは細菌,ウイルスや真菌類の感染時に活性化し,それらの病原体の排除に重要な腫瘍壊死因子(tumor necrosis factor:TNF),一酸化窒素,また,インターロイキン6,インターフェロンやインターロイキン1βなどのサイトカインを産生する.一方で,ある種のマクロファージは寄生虫感染,アレルギー応答,脂肪代謝,創傷治癒,がん転移などに関与しており,これらのマクロファージはM2型マクロファージと呼称され,Arginase1遺伝子,Ym1遺伝子,Fizz1遺伝子などをマーカーとして発現する2-4)(図1).この研究では,寄生虫感染の際のエピジェネティックな遺伝子制御,M2型マクロファージへの分化の分子機構,および,宿主の感染応答に焦点をあてて研究を行われた.
1.Jmjd3ノックアウトマウスにおけるM1型マクロファージ
Jmjd3はヒストンH3のトリメチル化された27番目のリジン残基の脱メチル化酵素である.このJmjd3のノックアウトマウスにチオグリコール酸を腹腔内投与したところ,誘導されるマクロファージの数は正常であり,さらに,それらのマクロファージがTLRリガンドによる刺激依存的に産生する炎症性サイトカインについて野生型マウスと同等の量が認められた.つぎに,Jmjd3ノックアウトマウスに細胞内寄生菌であるListeria monocytogenesを感染させたところ,野生型マウスと同等のサイトカインの産生を認めたほか,感染に応答して遊走してくる細胞集団についても野生型マウスとの差が確認されなかった.以上のことから,Jmjd3ノックアウトマウスにおいて誘導されるM1型マクロファージはTLRリガンドや細菌感染に対して正常な応答を示すことが明らかとなった.
2.Jmjd3ノックアウトマウスにおけるM2型マクロファージ
キチンは寄生虫などの構成成分であり天然には豊富に存在していて,アレルギー応答を誘導する原因物質のひとつとして報告されている5).野生型マウスにキチンを投与するとM2型マクロファージが活性化され,それらが好塩基球や好酸球の遊走を誘導する.このキチンを野生型マウスとJmjd3ノックアウトマウスとに投与することによりキチンに対するアレルギー反応を調べた.
キチンの投与に対し,Jmjd3ノックアウトマウスは野生型マウスと比較してM2型マクロファージマーカーの発現が顕著に減少しており,さらには,好酸球の腹腔内への遊走がまったく起こらなかった.つづいて,Jmjd3ノックアウトマウスに対し寄生虫であるNippostrongylus brasiliensisの感染実験を行った.この寄生虫はマウスへの皮下での感染ののち肺へと移動する.そこで,感染後5日目で肺を回収し肺における免疫応答を調べた.キチン投与の際と同様に,Jmjd3ノックアウトマウスでは肺でのM2型マクロファージマーカーの発現が減少しており,さらには,感染中期での肺門リンパ節へのCD4陽性インターロイキン4産生細胞の集積がみられなかった.感染後期においては,野生型マウスでは肺への好酸球の遊走や泡沫化マクロファージが確認されたものの,Jmjd3ノックアウトマウスではそれらの細胞の遊走はみられず泡沫化マクロファージも確認されなかった.以上のことから,Jmjd3ノックアウトマウスでは寄生虫感染に対するM2型マクロファージへの分化は起こらず,さらに,その細胞が起点となって惹起する免疫応答もまったく起こっていないことが明らかになった.
3.Jmjd3ノックアウトマウスでのM-CSFによるM2様マクロファージの分化
骨髄細胞からマクロファージを誘導させるサイトカインの代表的なものとして,顆粒球マクロファージコロニー刺激因子(granulocyte-macrophage colony-stimulation factor:GM-CSF)やマクロファージコロニー刺激因子(macrophage colony-stimulation factor:M-CSF)などがあり,前者はM1様マクロファージを,後者はM2様マクロファージを誘導するという報告がある6,7).そこで,野生型マウスおよびJmjd3ノックアウトマウスに由来する骨髄細胞をこれらのサイトカインで培養して得られたマクロファージについて調べた.
GM-CSF誘導性のM1様マクロファージは,野生型マウスとJmjd3ノックアウトマウスとでほぼ同数の細胞が得られ,TLRリガンドに対する応答も正常であった.一方で,M-CSF誘導性のM2様マクロファージは,Jmjd3ノックアウトマウスから得られる細胞数は野生型マウスから得られる数と比較して非常に少なく,M2型マクロファージマーカーの発現も顕著に減弱していた.以上のことから,in vitroにおいても,Jmjd3ノックアウトマウスではM-CSF誘導性M2様マクロファージの誘導が起こらなくなっていることが明らかとなった.
そこで,Jmjd3のC末端側に位置しヒストンの脱メチル化活性に寄与しているJmjCドメインについて,野生型および変異体の両者をレトロウイルスベクターによりこのJmjd3ノックアウトマウスに由来するM-CSF誘導性のM2様マクロファージに発現させたところ,野生型JmjCドメインを発現させたときはM2型マクロファージマーカーの発現は回復したが,変異型JmjCドメインを発現させたときはマーカーの発現は低下したままであった.以上のことから,このJmjCドメインがM2型マクロファージへの分化に重要であることが明らかになった.
4.IRF4遺伝子はJmjd3の直接のターゲットである
Jmjd3にはUTX,UTYというファミリータンパク質が存在しており,それらはヒストンH3のトリメチル化された27番目のリジン残基を脱メチル化するというエピジェネティックな遺伝子制御を行う役割をはたしている8-10).ヒストンH3のジメチル化された27番目のリジン残基のメチル化は遺伝子発現を抑制するはたらきをもつ一方で,逆にJmjd3によるトリメチル化された27番目のリジン残基の脱メチル化は遺伝子発現を促進することが報告されている.
Jmjd3により直接に制御されているターゲット遺伝子を同定する目的で,クロマチン免疫沈降シークエンシング(chromatin immuno-precipitation on sequencing:ChIP-seq)解析を行った.ChIP-seq解析とは,任意の抗体を用いて免疫沈降を行い,回収したDNA断片からサンプルを調製し次世代シークエンサーを用いて高速シークエンシングを行うもので,ヒストンテイルのメチル化,アセチル化やリン酸化など,クロマチン構造変化のエピジェネティックな修飾や転写調節因子のゲノムでの結合部位を網羅的に解析することができる.ここでは,Jmjd3ノックアウトマウスではヒストンH3の27番目のリジン残基においてトリメチル化からジメチル化への脱メチル化が起こらず,Jmjd3によって直接的に制御されている遺伝子のプロモーター領域はトリメチル化状態のままになっているという仮定のもと,トリメチル化に対する抗体を用いて免疫沈降を行ったサンプルを使用した(図2).
その結果,M2型マクロファージのマーカー遺伝子のプロモーター領域におけるヒストンH3の27番目のリジン残基のトリメチル化は,野生型マウスとJmjd3ノックアウトマウスの両方でほとんど確認されず,さらに,Jmjd3によって制御されていると報告されていたいくつかのHOX系遺伝子のトリメチル化は野生型マウスとJmjd3ノックアウトマウスとで同程度が確認され,それらのあいだに差異は認められなかった.しかしながら,DNAマイクロアレイの結果から,これらの遺伝子において野生型マウスとJmjd3ノックアウトマウスとのあいだのmRNAの発現量に差があることから,Jmjd3はこれらの遺伝子を直接的ではなく間接的に制御していることが推測された.
そこで,Jmjd3の直接的なターゲットを同定するため,プロモーター領域について野生型マウスではトリメチル化の減少が確認されJmjd3ノックアウトマウスではトリメチル化されたままになっている遺伝子に着目して解析を行った結果,IRF4遺伝子のプロモーター領域においてヒストンH3の27番目のリジン残基のトリメチル化に野生型マウスとJmjd3ノックアウトマウスとのあいだに顕著な差異のあることを確認した.IRF4(interferon regulatory factor 4)は免疫応答,細胞の分化増殖、発がんなどに関係する転写因子である.このIRF4のノックアウトマウスにキチンを投与したところ,Jmjd3ノックアウトマウスの表現型と同様に,M2型マクロファージマーカーの発現は低下し,さらには,好酸球の遊走もみられなかった.つづいて,Jmjd3ノックアウトマウスに由来する骨髄細胞にレトロウイルスベクターによりIRF4を発現させ,M-CSFを用いてM2様マクロファージを分化させたところ,M2型マクロファージマーカーの発現が上昇していることが確認された.以上のことから,IRF4遺伝子がJmjd3の直接的なターゲット遺伝子であり,この遺伝子がM2型マクロファージへの分化に必要不可欠であることが明らかとなった.
おわりに
この研究では,ヒストンH3の27番目のリジン残基の脱メチル化酵素であるJmjd3がM2型マクロファージへの分化に寄与しており,次世代シークエンサーを用いたChIP-Seqの技術を応用することによって,IRF4遺伝子がこのJmjd3の直接のターゲットであり,M1型マクロファージとM2型マクロファージとのバランスを傾けてM2型マクロファージへと分化させるために必要不可欠であることを突き止めることができた(図3).
文 献
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
- Mantovani, A., Sozzani, S., Sica, A. et al.: Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol., 23, 549-555 (2002)[PubMed]
- Gordon, S.: Alternative activation of macrophages. Nat. Rev. Immunol., 3, 23-35 (2003)[PubMed]
- Stein, M., Gordon, S., Harris N. et al.: Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. J. Exp. Med., 176, 287-292 (1992)[PubMed]
- Reese, T. A., Liang, H. E., Tager, A. M. et al.: Chitin induces accumulation in tissue of innate immune cells associated with allergy. Nature, 447, 92-96 (2007)[PubMed]
- Fleetwood, A. J., Hamilton, J. A., Cook, A. D. et al.: Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. J. Immunol., 178, 5245-5252 (2007)[PubMed]
- Fleetwood, A. J., Hertzog, P. J., Hamilton, J. A. et al.: GM-CSF- and M-CSF-dependent macrophage phenotypes display differential dependence on type I interferon signaling. J. Leukoc. Biol., 86, 411-421 (2009)[PubMed]
- Lan, F., Bayliss, P. E., Rinn, J. L. et al.: A histone H3 lysine 27 demethylase regulates animal posterior development. Nature, 449, 689-694 (2007)[PubMed]
- De Santa, F., Totaro, M. G., Prosperini, E. et al.: The histone H3 lysine-27 demethylase Jmjd3 links inflammation to inhibition of polycomb-mediated gene silencing. Cell, 130, 1083-1094 (2007)[PubMed]
- De Santa, F., Narang, V., Yap, Z. H. et al.: Jmjd3 contributes to the control of gene expression in LPS-activated macrophages. EMBO J., 28, 3341-3352 (2009)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,同年より大阪大学免疫学フロンティア研究センター 博士研究員.
研究テーマ:自然免疫におけるマクロファージの機能の解析.
抱負:近年,マクロファージはこれまで考えられてきた機能を超えて,感染症だけでなく,アレルギー,メタボリックシンドローム,そして,がん浸潤にいたるまで,われわれの生活のさまざまなところに関与していることが明らかとなってきました.このマクロファージの機能解析を足掛かりに自然免疫系の未解明な部分を紐解き,病態・疾患の解明に役立つような,人のためになる研究を行いたいと思っています.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2010 佐藤 荘・竹内 理・審良静男 Licensed under CC 表示 2.1 日本