転写因子STAT3に依存的な脊髄後角におけるアストロサイトの活性化は慢性的なかゆみにおいて重要な役割をはたす
白鳥美穂・津田 誠
(九州大学大学院薬学研究院 ライフイノベーション分野)
email:白鳥美穂,津田 誠
DOI: 10.7875/first.author.2015.098
STAT3-dependent reactive astrogliosis in the spinal dorsal horn underlies chronic itch.
Miho Shiratori-Hayashi, Keisuke Koga, Hidetoshi Tozaki-Saitoh, Yuta Kohro, Honami Toyonaga, Chiharu Yamaguchi, Ayumi Hasegawa, Takeshi Nakahara, Junichi Hachisuka, Shizuo Akira, Hideyuki Okano, Masutaka Furue, Kazuhide Inoue, Makoto Tsuda
Nature Medicine, 21, 927-931 (2015)
慢性的なかゆみはアトピー性皮膚炎や接触性皮膚炎など炎症性の皮膚疾患における代表的な症状である.これまで,かゆみは弱い痛みと位置づけられ基礎的な研究が非常に遅れていたが,最近,かゆみに特異的な物質および神経伝達経路の存在が明らかになり,そのしくみが徐々に明らかにされてきた.しかしながら,慢性的なかゆみの機構はいまだ不明である.筆者らは,アトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスを用いて,慢性的なひっかき行動により炎症を起こした皮膚に対応する脊髄後角の領域においてグリア細胞の一種であるアストロサイトが長期にわたり活性化されていること,アストロサイトにおいて転写因子STAT3を抑制することによりこの活性化および慢性的なかゆみが抑制されることを見い出した.さらに,アストロサイトにおいてSTAT3に依存的に発現の上昇するLCN2が,脊髄後角におけるかゆみの誘発物質であるガストリン放出ペプチドの作用を増強することにより慢性的なかゆみに関与することを発見した.今回の研究成果は,アトピー性皮膚炎など炎症性の皮膚疾患における慢性的なかゆみの機構において,これまで注目されてなかった中枢神経系の変化およびグリア細胞が重要な役割を担うことを明らかにしたもので,慢性的なかゆみに対する新規の治療薬の開発への応用が期待される.
かゆみは皮膚や粘膜をひっかきたくなるような不快な感覚である.通常,かゆみは患部のひっかきにより軽減するが,アトピー性皮膚炎などに代表される病的なかゆみは慢性的で耐えがたく,過剰なひっかき行動をくり返してしまう.そのような長期的なひっかき行動は皮膚炎を悪化させさらにかゆみを増強する“かゆみと掻破の悪循環”を形成し,かゆみの慢性化および重症化をひき起こす1).慢性的なかゆみは睡眠障害,過度の肉体疲労,精神的ストレスをもたらしQOLをいちじるしく低下させる.現在,日本人の約1割がアトピー性皮膚炎を発症していると推定されており,かゆみの制御はきわめて重要な課題である.しかしながら,抗ヒスタミン薬など既存の治療薬が十分に奏功しないため,慢性的なかゆみの機構の解明および新規の治療薬の開発が強くもとめられている.
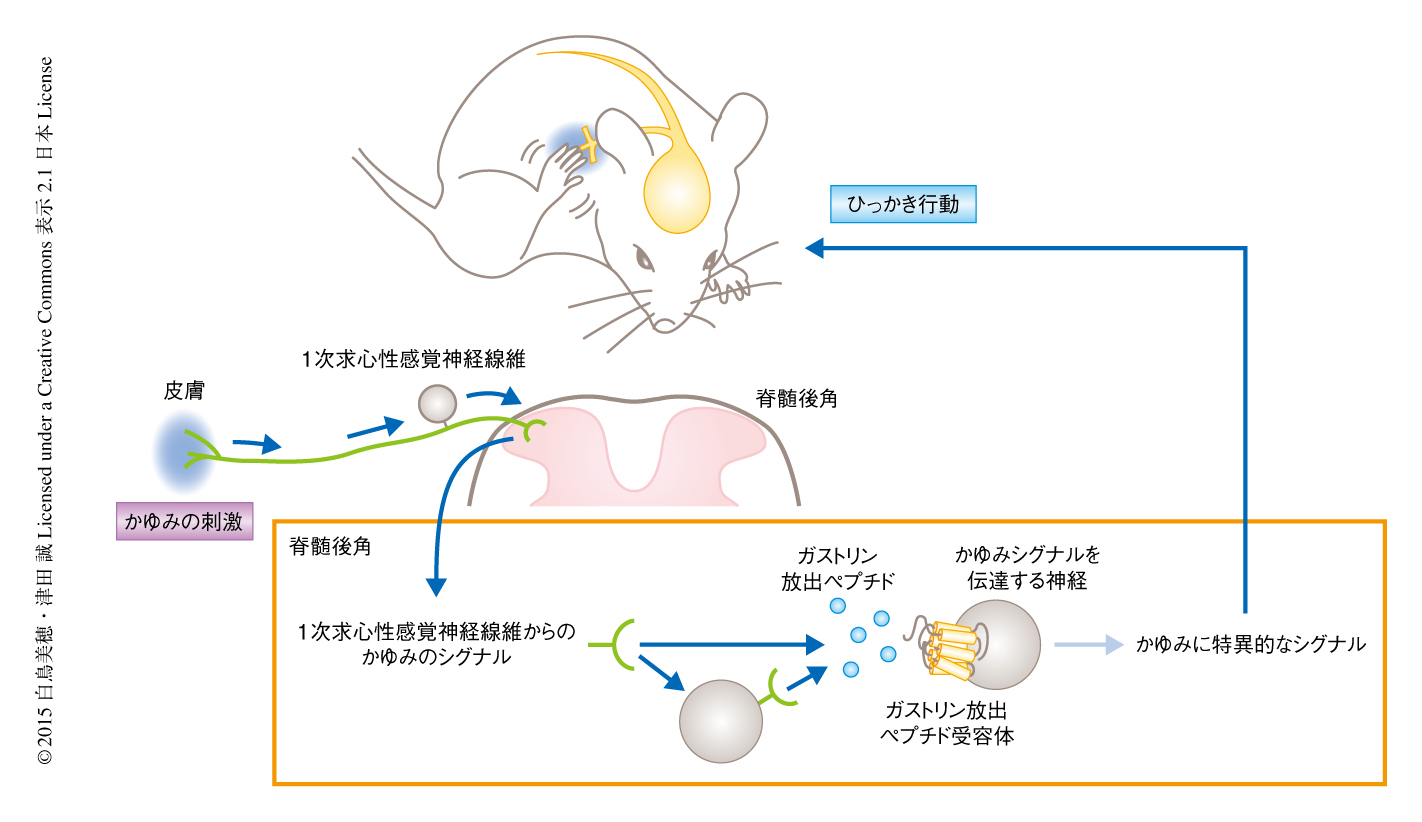
かゆみのシグナルは,皮膚に存在する1次求心性感覚神経線維の自由終末が刺激をうけ,神経線維を介して脊髄後角へと伝達され,その末端から放出される神経伝達物質によりニューロンにうけとられる.最近の研究により,脊髄後角におけるかゆみに特異的な物質としてガストリン放出ペプチドが特定され2),また,ガストリン放出ペプチドの受容体の発現するニューロンはかゆみに対し特異的であることが明らかにされ3),脊髄後角におけるかゆみの神経回路が徐々に解明されつつある(図1).しかし,慢性的なかゆみのしくみはいまだ解明されていない.そこで,筆者らは,慢性的なかゆみの機構を解明するため,脊髄後角における変化,とくに,神経の活動を変化させるグリア細胞に着目した4).
慢性的なかゆみのモデルとして自然発症性のアトピー性皮膚炎のモデルマウスを用いた.このマウスは,無菌環境における飼育では皮膚炎およびかゆみを発症しないが,通常の環境における飼育により顔面から上背部を中心に皮膚炎およびひっかき行動を発症する5).そこで,アトピー性皮膚炎モデルマウスの上背部に対応する脊髄の領域である頸部脊髄後角におけるグリア細胞(アストロサイトおよびミクログリア)の形態学的な変化について調べたところ,ミクログリアには変化はなかったがアストロサイトが著明に活性化していた.この活性化は皮膚炎の発症の経時変化と相関しており,さらに皮膚炎の発症していない下背部に対応する脊髄の領域である腰部脊髄後角においては変化がなかった.脊髄後角における神経の活動についても,頸部脊髄においては亢進していたが腰部脊髄においては変化がなかった.また,接触性皮膚炎のモデルマウスにおいても6),皮膚炎をともなうかゆみの際に頸部脊髄後角のアストロサイトが活性化していた.したがって,脊髄後角におけるアストロサイトの活性化は慢性的なかゆみのモデルに共通して認められる現象であり,さらに,炎症をともなうかゆみをもつ皮膚に対応する脊髄後角に限局していることが明らかにされた.
アトピー性皮膚炎モデルマウスの後肢の爪を切りそろえることにより爪による皮膚への物理的な損傷を抑制した結果,皮膚炎が寛解し,これにともないひっかき行動および脊髄後角におけるアストロサイトの活性化も抑制された.接触性皮膚炎モデルマウスにおいても後肢の爪を切りそろえることにより同様の結果が得られた.一方で,爪を切りそろえた接触性皮膚炎モデルマウスに人為的にひっかき傷をくわえて皮膚炎を悪化させると,爪を切りそろえることにより減弱したひっかき行動およびアストロサイトの活性化が再発した.したがって,アストロサイトの活性化に皮膚炎の関与することが考えられた.
炎症を起こした皮膚から脊髄後角のアストロサイトへのシグナルの伝達について明らかにするため,皮膚と脊髄後角とをつなぐ1次求心性感覚神経の一種であるTRPV1陽性の1次求心性感覚神経線維に着目した.TRPV1の強力なアゴニストであるレシニフェラトキシンの投与によりTRPV1陽性の1次求心性感覚神経線維を除去したところ7),接触性皮膚炎モデルマウスにおいてひっかき行動およびアストロサイトの活性化が抑制された.以上の結果から,炎症を起こした皮膚からのシグナルがTRPV1陽性の1次求心性感覚神経線維を介し脊髄後角のアストロサイトに伝達され,その活性化を誘導している可能性が示唆された.
慢性的なかゆみにおけるアストロサイトの活性化の役割を明らかにするため,アストロサイトの活性化への関与の報告されていた転写因子STAT3に着目した8).アトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスの脊髄後角のアストロサイトにおいてはSTAT3が活性化していた.慢性的なかゆみの生じているアトピー性皮膚炎モデルマウスの脊髄くも膜下腔にSTAT3の活性化を抑制するJAK阻害剤AG490を複数回にわたり投与したところ,ひっかき行動およびアストロサイトの活性化,さらに,脊髄後角における神経の活動が有意に抑制された.また,アストロサイトにおいて特異的にSTAT3を不活性化した接触性皮膚炎モデルマウスにおいても同様の結果が観察された.これらのことから,STAT3に依存的な脊髄後角におけるアストロサイトの活性化が慢性的なかゆみに必要であることが明らかにされた.
さらに,脊髄後角におけるかゆみの誘発物質であるガストリン放出ペプチドを脊髄くも膜下腔に投与することにより誘発されたひっかき行動は,アストロサイトの活性化されたアトピー性皮膚炎モデルマウスにおいて増強された.この増強はJAK阻害剤によりSTAT3に依存的なアストロサイトの活性化を抑制することにより正常なレベルにまで改善されたことから,STAT3により活性化されたアストロサイトが脊髄後角においてガストリン放出ペプチドによるかゆみのシグナルを増強し,慢性的なかゆみを増悪させていることが示唆された.
活性化されたアストロサイトの産生する慢性的なかゆみに関与するタンパク質を同定するため,DNAマイクロアレイ法を用いてアトピー性皮膚炎モデルマウスの脊髄において発現の変動している遺伝子を網羅的に解析した.その結果,もっとも有意に発現の上昇するタンパク質としてLCN2が同定された.LCN2はアトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスの頸部脊髄において,mRNAレベルおよびタンパク質レベルで発現が上昇しており,免疫染色法によりLCN2を発現する細胞種はアストロサイトであることが確認された.アストロサイトにおいて特異的にSTAT3を不活性化した接触性皮膚炎モデルマウスにおいて,LCN2の発現の上昇は有意に抑制された.また,初代培養アストロサイトの培養上清においてもLCN2が検出され,これはJAK阻害剤により抑制された.これらの結果から,LCN2は慢性的なかゆみの際に活性化されたアストロサイトに由来するタンパク質であり,STAT3によりその発現が制御されていることが示唆された.
慢性的なかゆみにおけるLCN2の役割について検討するため,頸部脊髄後角のアストロサイトにおいて特異的にLCN2をノックダウンしたところ,アトピー性皮膚炎モデルマウスにおいてひっかき行動が有意に減少した.この表現型はLCN2ノックアウトマウスおよびsiRNAによりLCN2をノックダウンしたマウスにおいても確認された.さらに,脊髄くも膜下腔へのガストリン放出ペプチドの投与により誘発されたひっかき行動は,LCN2を同時に投与することによりいちじるしく増強され,その一方で,ガストリン放出ペプチド受容体ノックアウトマウスにおいてひっかき行動はほとんど増加しなかった.以上の結果から,STAT3に依存的にアストロサイトにおいて発現の上昇するLCN2が,脊髄後角においてガストリン放出ペプチド受容体を介するかゆみのシグナルを増強することにより,慢性的なかゆみにおいて重要な役割をはたしていることが明らかにされた.
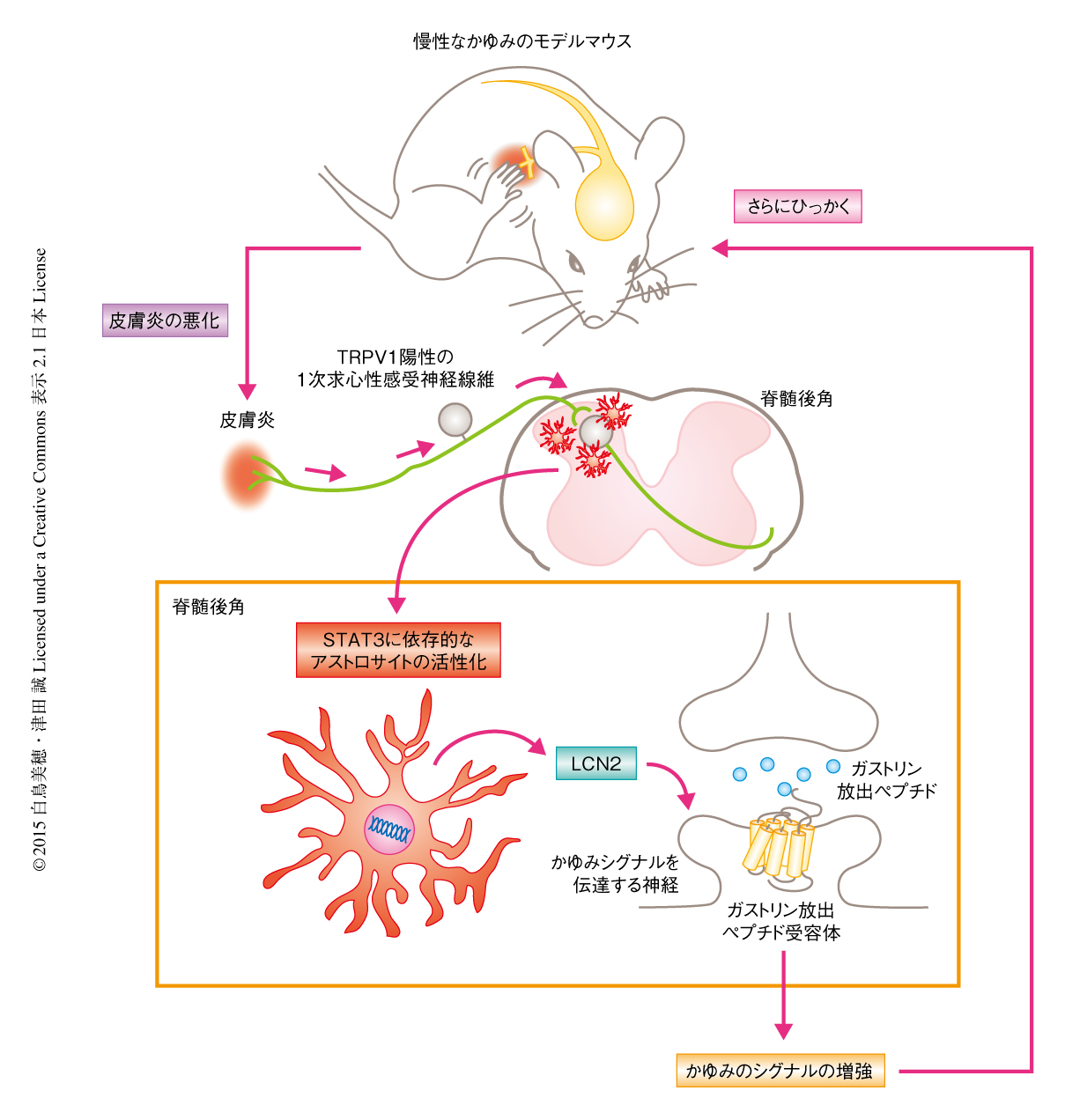
これまで,アトピー性皮膚炎や接触性皮膚炎にともなう慢性的なかゆみはおもに皮膚を中心に研究されてきた.今回の研究においては,研究の視点を中枢神経系にむけたことにより,転写因子STAT3に依存的に活性化する脊髄後角のアストロサイト,および,このアストロサイトから産生されるLCN2の慢性的なかゆみにおける重要性が示され,慢性的なかゆみの新しい機構が明らかにされた.アストロサイトの活性化する脊髄後角の領域は炎症をともなうかゆみを生じた皮膚と対応していたことから,皮膚炎からのシグナルが1次求心性神経を介してSTAT3に依存的にアストロサイトを活性化し,産生されたLCN2が脊髄におけるかゆみの誘発物質であるガストリン放出ペプチドの作用を亢進することによりかゆみを強め,それがさらなるひっかき行動につながる,というサイクルが想定された(図2).このサイクルは臨床において問題になっている“かゆみと掻破の悪循環”に類似していたことから,脊髄後角のアストロサイトがその中心となる機構のひとつである可能性がある.アトピー性皮膚炎における強く激しいかゆみはおもに炎症を起こした皮膚に認められる9).したがって,慢性的なかゆみの生じた患者の脊髄後角においてアストロサイトが活性化しているなら,このアストロサイトが慢性的なかゆみの新規の治療標的になる可能性が期待される.
略歴:2014年 九州大学大学院薬学研究院 修了,同年より同 学術研究員.
研究テーマ:アトピー性皮膚炎などの皮膚疾患にともなう慢性的なかゆみ.
関心事:慢性的なかゆみに対する新規の治療標的の創出.慢性的なかゆみの際の神経系の変化および皮膚炎症と神経系との関係性.
津田 誠(Makoto Tsuda)
九州大学大学院薬学研究院 教授.
研究室URL:http://life-innov.phar.kyushu-u.ac.jp/index.html
© 2015 白鳥美穂・津田 誠 Licensed under CC 表示 2.1 日本
(九州大学大学院薬学研究院 ライフイノベーション分野)
email:白鳥美穂,津田 誠
DOI: 10.7875/first.author.2015.098
STAT3-dependent reactive astrogliosis in the spinal dorsal horn underlies chronic itch.
Miho Shiratori-Hayashi, Keisuke Koga, Hidetoshi Tozaki-Saitoh, Yuta Kohro, Honami Toyonaga, Chiharu Yamaguchi, Ayumi Hasegawa, Takeshi Nakahara, Junichi Hachisuka, Shizuo Akira, Hideyuki Okano, Masutaka Furue, Kazuhide Inoue, Makoto Tsuda
Nature Medicine, 21, 927-931 (2015)
要 約
慢性的なかゆみはアトピー性皮膚炎や接触性皮膚炎など炎症性の皮膚疾患における代表的な症状である.これまで,かゆみは弱い痛みと位置づけられ基礎的な研究が非常に遅れていたが,最近,かゆみに特異的な物質および神経伝達経路の存在が明らかになり,そのしくみが徐々に明らかにされてきた.しかしながら,慢性的なかゆみの機構はいまだ不明である.筆者らは,アトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスを用いて,慢性的なひっかき行動により炎症を起こした皮膚に対応する脊髄後角の領域においてグリア細胞の一種であるアストロサイトが長期にわたり活性化されていること,アストロサイトにおいて転写因子STAT3を抑制することによりこの活性化および慢性的なかゆみが抑制されることを見い出した.さらに,アストロサイトにおいてSTAT3に依存的に発現の上昇するLCN2が,脊髄後角におけるかゆみの誘発物質であるガストリン放出ペプチドの作用を増強することにより慢性的なかゆみに関与することを発見した.今回の研究成果は,アトピー性皮膚炎など炎症性の皮膚疾患における慢性的なかゆみの機構において,これまで注目されてなかった中枢神経系の変化およびグリア細胞が重要な役割を担うことを明らかにしたもので,慢性的なかゆみに対する新規の治療薬の開発への応用が期待される.
はじめに
かゆみは皮膚や粘膜をひっかきたくなるような不快な感覚である.通常,かゆみは患部のひっかきにより軽減するが,アトピー性皮膚炎などに代表される病的なかゆみは慢性的で耐えがたく,過剰なひっかき行動をくり返してしまう.そのような長期的なひっかき行動は皮膚炎を悪化させさらにかゆみを増強する“かゆみと掻破の悪循環”を形成し,かゆみの慢性化および重症化をひき起こす1).慢性的なかゆみは睡眠障害,過度の肉体疲労,精神的ストレスをもたらしQOLをいちじるしく低下させる.現在,日本人の約1割がアトピー性皮膚炎を発症していると推定されており,かゆみの制御はきわめて重要な課題である.しかしながら,抗ヒスタミン薬など既存の治療薬が十分に奏功しないため,慢性的なかゆみの機構の解明および新規の治療薬の開発が強くもとめられている.
かゆみのシグナルは,皮膚に存在する1次求心性感覚神経線維の自由終末が刺激をうけ,神経線維を介して脊髄後角へと伝達され,その末端から放出される神経伝達物質によりニューロンにうけとられる.最近の研究により,脊髄後角におけるかゆみに特異的な物質としてガストリン放出ペプチドが特定され2),また,ガストリン放出ペプチドの受容体の発現するニューロンはかゆみに対し特異的であることが明らかにされ3),脊髄後角におけるかゆみの神経回路が徐々に解明されつつある(図1).しかし,慢性的なかゆみのしくみはいまだ解明されていない.そこで,筆者らは,慢性的なかゆみの機構を解明するため,脊髄後角における変化,とくに,神経の活動を変化させるグリア細胞に着目した4).
1.慢性的なかゆみのモデルマウスにおいては脊髄後角のアストロサイトが活性化される
慢性的なかゆみのモデルとして自然発症性のアトピー性皮膚炎のモデルマウスを用いた.このマウスは,無菌環境における飼育では皮膚炎およびかゆみを発症しないが,通常の環境における飼育により顔面から上背部を中心に皮膚炎およびひっかき行動を発症する5).そこで,アトピー性皮膚炎モデルマウスの上背部に対応する脊髄の領域である頸部脊髄後角におけるグリア細胞(アストロサイトおよびミクログリア)の形態学的な変化について調べたところ,ミクログリアには変化はなかったがアストロサイトが著明に活性化していた.この活性化は皮膚炎の発症の経時変化と相関しており,さらに皮膚炎の発症していない下背部に対応する脊髄の領域である腰部脊髄後角においては変化がなかった.脊髄後角における神経の活動についても,頸部脊髄においては亢進していたが腰部脊髄においては変化がなかった.また,接触性皮膚炎のモデルマウスにおいても6),皮膚炎をともなうかゆみの際に頸部脊髄後角のアストロサイトが活性化していた.したがって,脊髄後角におけるアストロサイトの活性化は慢性的なかゆみのモデルに共通して認められる現象であり,さらに,炎症をともなうかゆみをもつ皮膚に対応する脊髄後角に限局していることが明らかにされた.
2.TRPV1陽性の1次求心性感覚神経線維を介したシグナルは脊髄後角におけるアストロサイトの活性化に関与する
アトピー性皮膚炎モデルマウスの後肢の爪を切りそろえることにより爪による皮膚への物理的な損傷を抑制した結果,皮膚炎が寛解し,これにともないひっかき行動および脊髄後角におけるアストロサイトの活性化も抑制された.接触性皮膚炎モデルマウスにおいても後肢の爪を切りそろえることにより同様の結果が得られた.一方で,爪を切りそろえた接触性皮膚炎モデルマウスに人為的にひっかき傷をくわえて皮膚炎を悪化させると,爪を切りそろえることにより減弱したひっかき行動およびアストロサイトの活性化が再発した.したがって,アストロサイトの活性化に皮膚炎の関与することが考えられた.
炎症を起こした皮膚から脊髄後角のアストロサイトへのシグナルの伝達について明らかにするため,皮膚と脊髄後角とをつなぐ1次求心性感覚神経の一種であるTRPV1陽性の1次求心性感覚神経線維に着目した.TRPV1の強力なアゴニストであるレシニフェラトキシンの投与によりTRPV1陽性の1次求心性感覚神経線維を除去したところ7),接触性皮膚炎モデルマウスにおいてひっかき行動およびアストロサイトの活性化が抑制された.以上の結果から,炎症を起こした皮膚からのシグナルがTRPV1陽性の1次求心性感覚神経線維を介し脊髄後角のアストロサイトに伝達され,その活性化を誘導している可能性が示唆された.
3.脊髄後角におけるアストロサイトの活性化は慢性的なかゆみに必要である
慢性的なかゆみにおけるアストロサイトの活性化の役割を明らかにするため,アストロサイトの活性化への関与の報告されていた転写因子STAT3に着目した8).アトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスの脊髄後角のアストロサイトにおいてはSTAT3が活性化していた.慢性的なかゆみの生じているアトピー性皮膚炎モデルマウスの脊髄くも膜下腔にSTAT3の活性化を抑制するJAK阻害剤AG490を複数回にわたり投与したところ,ひっかき行動およびアストロサイトの活性化,さらに,脊髄後角における神経の活動が有意に抑制された.また,アストロサイトにおいて特異的にSTAT3を不活性化した接触性皮膚炎モデルマウスにおいても同様の結果が観察された.これらのことから,STAT3に依存的な脊髄後角におけるアストロサイトの活性化が慢性的なかゆみに必要であることが明らかにされた.
さらに,脊髄後角におけるかゆみの誘発物質であるガストリン放出ペプチドを脊髄くも膜下腔に投与することにより誘発されたひっかき行動は,アストロサイトの活性化されたアトピー性皮膚炎モデルマウスにおいて増強された.この増強はJAK阻害剤によりSTAT3に依存的なアストロサイトの活性化を抑制することにより正常なレベルにまで改善されたことから,STAT3により活性化されたアストロサイトが脊髄後角においてガストリン放出ペプチドによるかゆみのシグナルを増強し,慢性的なかゆみを増悪させていることが示唆された.
4.アストロサイトの産生するLCN2は脊髄においてかゆみのシグナルを増強することにより慢性的なかゆみに関与する
活性化されたアストロサイトの産生する慢性的なかゆみに関与するタンパク質を同定するため,DNAマイクロアレイ法を用いてアトピー性皮膚炎モデルマウスの脊髄において発現の変動している遺伝子を網羅的に解析した.その結果,もっとも有意に発現の上昇するタンパク質としてLCN2が同定された.LCN2はアトピー性皮膚炎モデルマウスおよび接触性皮膚炎モデルマウスの頸部脊髄において,mRNAレベルおよびタンパク質レベルで発現が上昇しており,免疫染色法によりLCN2を発現する細胞種はアストロサイトであることが確認された.アストロサイトにおいて特異的にSTAT3を不活性化した接触性皮膚炎モデルマウスにおいて,LCN2の発現の上昇は有意に抑制された.また,初代培養アストロサイトの培養上清においてもLCN2が検出され,これはJAK阻害剤により抑制された.これらの結果から,LCN2は慢性的なかゆみの際に活性化されたアストロサイトに由来するタンパク質であり,STAT3によりその発現が制御されていることが示唆された.
慢性的なかゆみにおけるLCN2の役割について検討するため,頸部脊髄後角のアストロサイトにおいて特異的にLCN2をノックダウンしたところ,アトピー性皮膚炎モデルマウスにおいてひっかき行動が有意に減少した.この表現型はLCN2ノックアウトマウスおよびsiRNAによりLCN2をノックダウンしたマウスにおいても確認された.さらに,脊髄くも膜下腔へのガストリン放出ペプチドの投与により誘発されたひっかき行動は,LCN2を同時に投与することによりいちじるしく増強され,その一方で,ガストリン放出ペプチド受容体ノックアウトマウスにおいてひっかき行動はほとんど増加しなかった.以上の結果から,STAT3に依存的にアストロサイトにおいて発現の上昇するLCN2が,脊髄後角においてガストリン放出ペプチド受容体を介するかゆみのシグナルを増強することにより,慢性的なかゆみにおいて重要な役割をはたしていることが明らかにされた.
おわりに
これまで,アトピー性皮膚炎や接触性皮膚炎にともなう慢性的なかゆみはおもに皮膚を中心に研究されてきた.今回の研究においては,研究の視点を中枢神経系にむけたことにより,転写因子STAT3に依存的に活性化する脊髄後角のアストロサイト,および,このアストロサイトから産生されるLCN2の慢性的なかゆみにおける重要性が示され,慢性的なかゆみの新しい機構が明らかにされた.アストロサイトの活性化する脊髄後角の領域は炎症をともなうかゆみを生じた皮膚と対応していたことから,皮膚炎からのシグナルが1次求心性神経を介してSTAT3に依存的にアストロサイトを活性化し,産生されたLCN2が脊髄におけるかゆみの誘発物質であるガストリン放出ペプチドの作用を亢進することによりかゆみを強め,それがさらなるひっかき行動につながる,というサイクルが想定された(図2).このサイクルは臨床において問題になっている“かゆみと掻破の悪循環”に類似していたことから,脊髄後角のアストロサイトがその中心となる機構のひとつである可能性がある.アトピー性皮膚炎における強く激しいかゆみはおもに炎症を起こした皮膚に認められる9).したがって,慢性的なかゆみの生じた患者の脊髄後角においてアストロサイトが活性化しているなら,このアストロサイトが慢性的なかゆみの新規の治療標的になる可能性が期待される.
文 献
- Ikoma, A., Steinhoff, M., Stander, S. et al.: The neurobiology of itch. Nat. Rev. Neurosci., 7, 535-547 (2006)[PubMed]
- Sun, Y. -G. & Chen, Z. -F.: A gastrin-releasing peptide receptor mediates the itch sensation in the spinal cord. Nature, 448, 700-703 (2007)[PubMed]
- Sun, Y. -G., Zhao, Z. -Q., Meng, X. -L. et al.: Cellular basis of itch sensation. Science, 325, 1531-1534 (2009)[PubMed]
- Eroglu, C. & Barres, B.: Regulation of synaptic connectivity by glia. Nature, 468, 223-231 (2010)[PubMed]
- Matsuda, H., Watanabe, N., Geba, G. et al.: Development of atopic dermatitis-like skin lesion with IgE hyperproduction in NC/Nga mice. Int. Immunol., 9, 461-466 (1997)[PubMed]
- Seike, M., Ikeda, M., Kodama, H. et al.: Inhibition of scratching behaviour caused by contact dermatitis in histidine decarboxylase gene knockout mice. Exp. Dermatol., 14, 169-175 (2005)[PubMed]
- Sandor, K., Helyes, Z., Elekes, K. et al.: Involvement of capsaicin-sensitive afferents and the Transient Receptor Potential Vanilloid 1 Receptor in xylene-induced nocifensive behaviour and inflammation in the mouse. Neurosci. Lett., 451, 204-207 (2009)[PubMed]
- Sofroniew, M.: Molecular dissection of reactive astrogliosis and glial scar formation. Trend. Neurosci., 32, 638-647 (2009)[PubMed]
- Ikoma, A., Rukwied, R., Stander, S. et al.: Neuronal sensitization for histamine-induced itch in lesional skin of patients with atopic dermatitis. Arch. Dermatol., 139, 1455-1458 (2003)[PubMed]
著者プロフィール
略歴:2014年 九州大学大学院薬学研究院 修了,同年より同 学術研究員.
研究テーマ:アトピー性皮膚炎などの皮膚疾患にともなう慢性的なかゆみ.
関心事:慢性的なかゆみに対する新規の治療標的の創出.慢性的なかゆみの際の神経系の変化および皮膚炎症と神経系との関係性.
津田 誠(Makoto Tsuda)
九州大学大学院薬学研究院 教授.
研究室URL:http://life-innov.phar.kyushu-u.ac.jp/index.html
© 2015 白鳥美穂・津田 誠 Licensed under CC 表示 2.1 日本