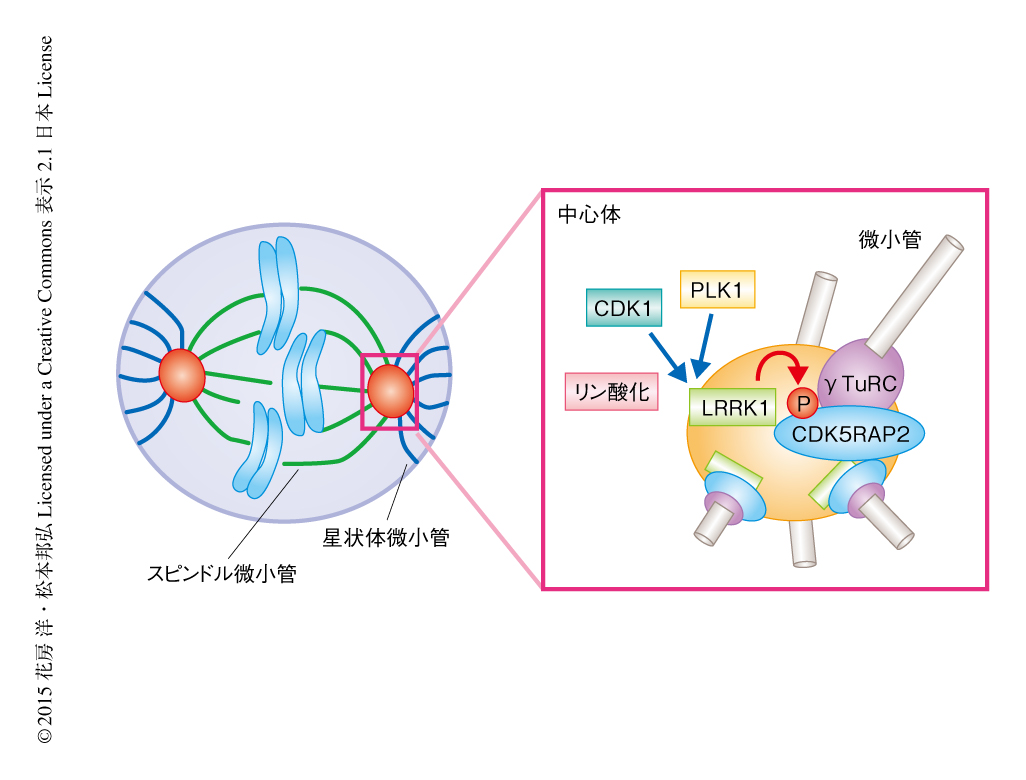
PLK1に依存的に活性化されたLRRK1はCDK5RAP2をリン酸化することにより紡錘体の配向を制御する
花房 洋・松本邦弘
(名古屋大学大学院理学研究科 生命理学専攻生体応答論講座)
email:花房 洋
DOI: 10.7875/first.author.2015.097
PLK1-dependent activation of LRRK1 regulates spindle orientation by phosphorylating CDK5RAP2.
Hiroshi Hanafusa, Shin Kedashiro, Motohiro Tezuka, Motoki Funatsu, Satoshi Usami, Fumiko Toyoshima, Kunihiro Matsumoto
Nature Cell Biology, 17, 1024-1035 (2015)
細胞分裂における分裂軸の適切な制御は初期の発生や器官の形成において重要である.分裂軸はM期の紡錘体の配向に依存して決定されており,紡錘体の配向にはM期の中心体が重要な役割を担う.これまで,M期キナーゼPLK1は中心体の成熟および紡錘体の配向において重要であると報告されていたが,その下流の経路については未解明であった.今回,筆者らは,ROCOファミリーキナーゼのひとつLRRK1がPLK1によりリン酸化され,このリン酸化に依存的にCDK1によりM期の中心体において活性化されることを明らかにした.中心体において活性化されたLRRK1は中心体構成タンパク質であるCDK5RAP2をリン酸化し,CDK5RAP2とγチューブリンとの結合を促進することにより微小管の核形成において不可欠なγTuRCを活性化していた.M期の中心体は細胞膜へと伸びる星状体微小管を形成し,星状体微小管は細胞膜と相互作用することにより紡錘体の配向を制御する.LRRK1は中心体における微小管の核形成の活性を促進することにより星状体微小管の形成を促進し,M期の紡錘体の配向を制御していた.
細胞分裂における紡錘体の配向を介した分裂軸の決定は,組織の形態形成,非対称分裂,幹細胞の自己増殖において重要であることが知られている1).また,紡錘体の配向は中心体から伸びた星状体微小管と細胞膜との相互作用により制御される.G2期からM期にかけてγチューブリンを含む複合体であるγTuRCが中心体へとリクルートされて活性化され,微小管の核形成の活性を上昇させる.この過程は中心体の成熟とよばれ,星状体微小管の形成において必須である2).M期キナーゼであるPLK1はさまざまな基質をリン酸化し,中心体の成熟,染色体分離,細胞質分裂において重要な役割をはたす3).以前に,筆者らは,紡錘体の配向を制御するキナーゼを網羅的にスクリーニングし,その候補としてPLK1およびLRRK1を同定した4).LRRK1はRas様GTPaseドメインとMAPKKK様キナーゼドメインをもつユニークなタンパク質であり,パーキンソン病の原因遺伝子にコードされるLRRK2と同じくROCOファミリーキナーゼに属する.最近,筆者らは,LRRK1が間期においてEGF受容体の細胞内輸送を制御することを明らかにしたが5-7),M期におけるLRRK1の機能は不明であった.そこで,PLK1との関係に焦点をあて,M期における紡錘体の配向の制御におけるLRRK1の機能について解析した.
LRRK1は紡錘体の配向を制御するキナーゼの候補として同定されたことから,M期におけるLRRK1の局在および活性化について検討した.LRRK1はキナーゼドメインに存在するThr1400(筆者らの用いているクローンは,データベースに登録されているものより27アミノ酸残基ほど短い)がリン酸化されると活性化する.そこで,この部位に対する抗リン酸化抗体を作製し,HeLa細胞を用いてLRRK1の活性化のタイミングおよび部位について検討した.その結果,LRRK1は細胞周期をとおして中心体に局在し,M期の中心体において強く活性化されることが明らかにされた.CDK1はサイクリンBによりG2期からM期の中心体において活性化し,M期の進行に必須のキナーゼとして知られている.LRRK1のThr1400はCDK1によるリン酸化のコンセンサス部位と一致したことから,CDK1がLRRK1の上流のキナーゼとして機能しているかどうか検討した.その結果,CDK1はLRRK1のThr1400を直接にリン酸化しLRRK1を活性化することが明らかにされた.
紡錘体の配向を制御するキナーゼの網羅的なスクリーニングにおいて,LRRK1とともにPLK1も候補として同定されていた4).そこで,LRRK1とPLK1が同じ経路において紡錘体の配向を制御するかどうか検討した.LRRK1とPLK1とは相互作用するかどうか調べたところ,PLK1はG2期からM期にかけてPoloボックスに依存的にLRRK1と結合し,LRRK1のSer1790をリン酸化することが明らかにされた.PLK1によるLRRK1のリン酸化にどのような意味があるのか検討したところ,LRRK1がM期の中心体において活性化されるのにPLK1によるSer1790のリン酸化が重要であることが明らかにされた.LRRK1のSer1790をAlaに置換した非リン酸化型LRRK1変異体はM期における活性化がみられず,逆に,Ser1790をAspに置換したリン酸化模倣型LRRK1変異体はPLK1の活性を阻害した細胞においても活性化が観察された.このことから,LRRK1はSer1790のリン酸化に依存的にM期において活性化されていることが明らかにされた.
M期における紡錘体の配向においてLRRK1が重要なのかどうか,siRNAを用いてLRRK1をノックダウンすることにより検討した.HeLa S3細胞においてLRRK1をノックダウンしたところ,紡錘体の配向は異常になった.この異常は野生型のLRRK1によりレスキューされたが,キナーゼ不活性型のLRRK1変異体によってはレスキューされなかった.このことから,LRRK1のキナーゼ活性が紡錘体の配向の制御に重要であることがわかった.さらに,LRRK1がPLK1の下流において紡錘体の配向を制御しているのかどうか検討した.PLK1の特異的な阻害剤であるBI 2536により細胞を処理するとM期における紡錘体の配向は異常になる.ここに,リン酸化模倣型LRRK1変異体を発現させると,この異常はレスキューされた.一方,非リン酸化型LRRK1変異体を発現させてもレスキューはみられなかった.このことから,LRRK1はPLK1の下流においてSer1790のリン酸化に依存的に紡錘体の配向を制御していることが示された.
さきにも述べたように,紡錘体の配向の制御には中心体から伸びる星状体微小管と細胞膜との相互作用が重要である8).LRRK1をノックダウンした細胞においては星状体微小管の形成が非常に貧弱になっていることが観察され,これが紡錘体の配向の異常をひき起こしている可能性が考えられた.そこで,LRRK1が中心体における微小管の核形成の活性において重要なのかどうか微小管再伸長アッセイにより検討した.微小管再伸長アッセイとは,細胞を60分ほど氷上におくことによりそれまで形成されていた微小管ネットワークをいったんバラバラに壊し,そののち37℃におくことにより微小管の再形成つまり微小管の核形成の活性を測定する方法である.その結果,LRRK1をノックダウンした細胞においては中心体からの微小管の核形成の活性が顕著に低下していることがわかった.このことから,LRRK1は中心体微小管の核形成の活性を促進することにより星状体微小管の形成を促進し,その結果,紡錘体の配向を制御することが明らかにされた.
LRRK1による紡錘体の配向の制御においてはLRRK1のキナーゼ活性が重要であった.そこで,中心体におけるLRRK1の基質を探索したところ,LRRK1は中心体構成タンパク質であるCDK5RAP2と結合しこれをリン酸化することがわかった.CDK5RAP2はN末端にCM1モチーフ,C末端にCM2モチーフという種をこえて保存された2つのモチーフをもち,CM1モチーフはγTuRCとの結合に,CM2モチーフは中心体への局在に重要である9).LRRK1はCDK5RAP2のCM1モチーフを含むN末端側の領域と結合し,CM1モチーフの近傍のSer140をリン酸化することが見い出された.そこで,LRRK1によるSer140のリン酸化がCDK5RAP2とγTuRCとの結合に影響するかどうか検討した.その結果,活性型のLRRK1変異体の存在のもとではCDK5RAP2のN末端側の断片とγTuRCの構成タンパク質のひとつであるγチューブリンとの結合が促進されたが,この促進はSer140をAlaに置換した非リン酸化型CDK5RAP2変異体のN末端側の断片においてはみられなかった.また,LRRK1をノックダウンした細胞においてはM期におけるCDK5RAP2のN末端側の断片とγチューブリンとの結合は顕著に低下していた.これらの結果から,LRRK1によるSer140のリン酸化がCDK5RAP2とγTuRCとの結合を促進する可能性が考えられた.
これまでに,精製タンパク質を用いたin vitroにおける実験から,CDK5RAP2はγTuRCと結合することによりその構造変化をひき起こし,γTuRCによる微小管の核形成を促進するというモデルが提唱されている10).このモデルと一致するように,U2OS細胞にCDK5RAP2のN末端側の断片を発現させると,この断片はCM2モチーフをもたないため中心体には局在せず,細胞質において異所的に微小管の核形成をひき起こす.つまり,CDK5RAP2のN末端側の断片は細胞質においてγTuRCを活性化する.そこで,この系を用いて,CDK5RAP2のCM1モチーフによるγTuRCの活性化においてLRRK1は重要であるのかどうか検討した.その結果,LRRK1をノックダウンした細胞において,CDK5RAP2のN末端側の断片による異所的な微小管の核形成の活性は顕著に低下していた.また,非リン酸化型CDK5RAP2変異体のN末端側の断片を発現させると,野生型のCDK5RAP2に比べ微小管の核形成の活性は低下した.これに対し,リン酸化模倣型CDK5RAP2変異体のN末端側の断片を発現させると,細胞質における異所的な微小管の核形成の活性は上昇した.以上の結果から,LRRK1はCDK5RAP2のSer140をリン酸化することによりCDK5RAP2とγTuRCとの結合を促進し,その結果,γTuRCの構造変化および活性化をひき起こすことが考えられた.
LRRK1はパーキンソン病の原因遺伝子にコードされるLRRK2とともにROCOファミリーキナーゼに属する.これまで,ROCOファミリーキナーゼを活性化する上流のタンパク質は不明であった.今回の研究により,M期においてPLK1およびCDK1がLRRK1を活性化していることが明らかにされた.LRRK1はPLK1によりSer1790をリン酸化され,このリン酸化に依存的にCDK1によりThr1400をリン酸化されて活性化される.このように,2つのM期キナーゼによる連続的なリン酸化がM期の中心体におけるLRRK1の活性化には必須であった(図1).
G2期からM期にかけてγTuRCなどが中心体にリクルートされ,中心体が成熟し微小管の核形成の活性が上昇する.細胞質に存在するγTuRCは不活性な状態に維持されており,中心体への移行とともにその活性化が誘導される.CDK5RAP2はγTuRCと結合しその構造変化をひき起こすことによりγTuRCを活性化すると考えられている.LRRK1をノックダウンした細胞においてγチューブリンの中心体への局在にはほとんど変化がなかったことから,LRRK1はγTuRCの中心体へのリクルートにおいては重要でないと考えられた.一方,LRRK1はCDK5RAP2をリン酸化することによりCDK5RAP2とγTuRCとの結合を促進し,γTuRCの活性化において機能していた.つまり,LRRK1はγTuRCの中心体へのリクルートではなく活性化のステップにおいて機能し,中心体の成熟を制御している可能性が考えられた.今回の研究により,LRRK1によるCDK5RAP2を介した中心体微小管の核形成の活性の促進は星状体微小管の形成を促進し,その結果,M期における紡錘体の配向を制御することが明らかにされた.
略歴:2001年 京都大学大学院生命科学研究科 修了,2002年 名古屋大学大学院理学研究科 助手,2013年 同 講師を経て,2015年より同 准教授.
研究テーマ:細胞内シグナル伝達.
関心事:研究,子供たちの将来.
松本 邦弘(Kunihiro Matsumoto)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi3.bio.nagoya-u.ac.jp/~bunshi6/matsumoto_japanese/index.html
© 2015 花房 洋・松本邦弘 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻生体応答論講座)
email:花房 洋
DOI: 10.7875/first.author.2015.097
PLK1-dependent activation of LRRK1 regulates spindle orientation by phosphorylating CDK5RAP2.
Hiroshi Hanafusa, Shin Kedashiro, Motohiro Tezuka, Motoki Funatsu, Satoshi Usami, Fumiko Toyoshima, Kunihiro Matsumoto
Nature Cell Biology, 17, 1024-1035 (2015)
要 約
細胞分裂における分裂軸の適切な制御は初期の発生や器官の形成において重要である.分裂軸はM期の紡錘体の配向に依存して決定されており,紡錘体の配向にはM期の中心体が重要な役割を担う.これまで,M期キナーゼPLK1は中心体の成熟および紡錘体の配向において重要であると報告されていたが,その下流の経路については未解明であった.今回,筆者らは,ROCOファミリーキナーゼのひとつLRRK1がPLK1によりリン酸化され,このリン酸化に依存的にCDK1によりM期の中心体において活性化されることを明らかにした.中心体において活性化されたLRRK1は中心体構成タンパク質であるCDK5RAP2をリン酸化し,CDK5RAP2とγチューブリンとの結合を促進することにより微小管の核形成において不可欠なγTuRCを活性化していた.M期の中心体は細胞膜へと伸びる星状体微小管を形成し,星状体微小管は細胞膜と相互作用することにより紡錘体の配向を制御する.LRRK1は中心体における微小管の核形成の活性を促進することにより星状体微小管の形成を促進し,M期の紡錘体の配向を制御していた.
はじめに
細胞分裂における紡錘体の配向を介した分裂軸の決定は,組織の形態形成,非対称分裂,幹細胞の自己増殖において重要であることが知られている1).また,紡錘体の配向は中心体から伸びた星状体微小管と細胞膜との相互作用により制御される.G2期からM期にかけてγチューブリンを含む複合体であるγTuRCが中心体へとリクルートされて活性化され,微小管の核形成の活性を上昇させる.この過程は中心体の成熟とよばれ,星状体微小管の形成において必須である2).M期キナーゼであるPLK1はさまざまな基質をリン酸化し,中心体の成熟,染色体分離,細胞質分裂において重要な役割をはたす3).以前に,筆者らは,紡錘体の配向を制御するキナーゼを網羅的にスクリーニングし,その候補としてPLK1およびLRRK1を同定した4).LRRK1はRas様GTPaseドメインとMAPKKK様キナーゼドメインをもつユニークなタンパク質であり,パーキンソン病の原因遺伝子にコードされるLRRK2と同じくROCOファミリーキナーゼに属する.最近,筆者らは,LRRK1が間期においてEGF受容体の細胞内輸送を制御することを明らかにしたが5-7),M期におけるLRRK1の機能は不明であった.そこで,PLK1との関係に焦点をあて,M期における紡錘体の配向の制御におけるLRRK1の機能について解析した.
1.LRRK1はM期の中心体においてCDK1により活性化される
LRRK1は紡錘体の配向を制御するキナーゼの候補として同定されたことから,M期におけるLRRK1の局在および活性化について検討した.LRRK1はキナーゼドメインに存在するThr1400(筆者らの用いているクローンは,データベースに登録されているものより27アミノ酸残基ほど短い)がリン酸化されると活性化する.そこで,この部位に対する抗リン酸化抗体を作製し,HeLa細胞を用いてLRRK1の活性化のタイミングおよび部位について検討した.その結果,LRRK1は細胞周期をとおして中心体に局在し,M期の中心体において強く活性化されることが明らかにされた.CDK1はサイクリンBによりG2期からM期の中心体において活性化し,M期の進行に必須のキナーゼとして知られている.LRRK1のThr1400はCDK1によるリン酸化のコンセンサス部位と一致したことから,CDK1がLRRK1の上流のキナーゼとして機能しているかどうか検討した.その結果,CDK1はLRRK1のThr1400を直接にリン酸化しLRRK1を活性化することが明らかにされた.
2.LRRK1はPLK1によるリン酸化に依存的に活性化される
紡錘体の配向を制御するキナーゼの網羅的なスクリーニングにおいて,LRRK1とともにPLK1も候補として同定されていた4).そこで,LRRK1とPLK1が同じ経路において紡錘体の配向を制御するかどうか検討した.LRRK1とPLK1とは相互作用するかどうか調べたところ,PLK1はG2期からM期にかけてPoloボックスに依存的にLRRK1と結合し,LRRK1のSer1790をリン酸化することが明らかにされた.PLK1によるLRRK1のリン酸化にどのような意味があるのか検討したところ,LRRK1がM期の中心体において活性化されるのにPLK1によるSer1790のリン酸化が重要であることが明らかにされた.LRRK1のSer1790をAlaに置換した非リン酸化型LRRK1変異体はM期における活性化がみられず,逆に,Ser1790をAspに置換したリン酸化模倣型LRRK1変異体はPLK1の活性を阻害した細胞においても活性化が観察された.このことから,LRRK1はSer1790のリン酸化に依存的にM期において活性化されていることが明らかにされた.
3.LRRK1はPLK1の下流において紡錘体の配向を制御する
M期における紡錘体の配向においてLRRK1が重要なのかどうか,siRNAを用いてLRRK1をノックダウンすることにより検討した.HeLa S3細胞においてLRRK1をノックダウンしたところ,紡錘体の配向は異常になった.この異常は野生型のLRRK1によりレスキューされたが,キナーゼ不活性型のLRRK1変異体によってはレスキューされなかった.このことから,LRRK1のキナーゼ活性が紡錘体の配向の制御に重要であることがわかった.さらに,LRRK1がPLK1の下流において紡錘体の配向を制御しているのかどうか検討した.PLK1の特異的な阻害剤であるBI 2536により細胞を処理するとM期における紡錘体の配向は異常になる.ここに,リン酸化模倣型LRRK1変異体を発現させると,この異常はレスキューされた.一方,非リン酸化型LRRK1変異体を発現させてもレスキューはみられなかった.このことから,LRRK1はPLK1の下流においてSer1790のリン酸化に依存的に紡錘体の配向を制御していることが示された.
4.LRRK1は中心体における微小管の核形成の活性に重要である
さきにも述べたように,紡錘体の配向の制御には中心体から伸びる星状体微小管と細胞膜との相互作用が重要である8).LRRK1をノックダウンした細胞においては星状体微小管の形成が非常に貧弱になっていることが観察され,これが紡錘体の配向の異常をひき起こしている可能性が考えられた.そこで,LRRK1が中心体における微小管の核形成の活性において重要なのかどうか微小管再伸長アッセイにより検討した.微小管再伸長アッセイとは,細胞を60分ほど氷上におくことによりそれまで形成されていた微小管ネットワークをいったんバラバラに壊し,そののち37℃におくことにより微小管の再形成つまり微小管の核形成の活性を測定する方法である.その結果,LRRK1をノックダウンした細胞においては中心体からの微小管の核形成の活性が顕著に低下していることがわかった.このことから,LRRK1は中心体微小管の核形成の活性を促進することにより星状体微小管の形成を促進し,その結果,紡錘体の配向を制御することが明らかにされた.
5.LRRK1は中心体構成タンパク質CDK5RAP2をリン酸化してγTuRCの活性化を促進する
LRRK1による紡錘体の配向の制御においてはLRRK1のキナーゼ活性が重要であった.そこで,中心体におけるLRRK1の基質を探索したところ,LRRK1は中心体構成タンパク質であるCDK5RAP2と結合しこれをリン酸化することがわかった.CDK5RAP2はN末端にCM1モチーフ,C末端にCM2モチーフという種をこえて保存された2つのモチーフをもち,CM1モチーフはγTuRCとの結合に,CM2モチーフは中心体への局在に重要である9).LRRK1はCDK5RAP2のCM1モチーフを含むN末端側の領域と結合し,CM1モチーフの近傍のSer140をリン酸化することが見い出された.そこで,LRRK1によるSer140のリン酸化がCDK5RAP2とγTuRCとの結合に影響するかどうか検討した.その結果,活性型のLRRK1変異体の存在のもとではCDK5RAP2のN末端側の断片とγTuRCの構成タンパク質のひとつであるγチューブリンとの結合が促進されたが,この促進はSer140をAlaに置換した非リン酸化型CDK5RAP2変異体のN末端側の断片においてはみられなかった.また,LRRK1をノックダウンした細胞においてはM期におけるCDK5RAP2のN末端側の断片とγチューブリンとの結合は顕著に低下していた.これらの結果から,LRRK1によるSer140のリン酸化がCDK5RAP2とγTuRCとの結合を促進する可能性が考えられた.
これまでに,精製タンパク質を用いたin vitroにおける実験から,CDK5RAP2はγTuRCと結合することによりその構造変化をひき起こし,γTuRCによる微小管の核形成を促進するというモデルが提唱されている10).このモデルと一致するように,U2OS細胞にCDK5RAP2のN末端側の断片を発現させると,この断片はCM2モチーフをもたないため中心体には局在せず,細胞質において異所的に微小管の核形成をひき起こす.つまり,CDK5RAP2のN末端側の断片は細胞質においてγTuRCを活性化する.そこで,この系を用いて,CDK5RAP2のCM1モチーフによるγTuRCの活性化においてLRRK1は重要であるのかどうか検討した.その結果,LRRK1をノックダウンした細胞において,CDK5RAP2のN末端側の断片による異所的な微小管の核形成の活性は顕著に低下していた.また,非リン酸化型CDK5RAP2変異体のN末端側の断片を発現させると,野生型のCDK5RAP2に比べ微小管の核形成の活性は低下した.これに対し,リン酸化模倣型CDK5RAP2変異体のN末端側の断片を発現させると,細胞質における異所的な微小管の核形成の活性は上昇した.以上の結果から,LRRK1はCDK5RAP2のSer140をリン酸化することによりCDK5RAP2とγTuRCとの結合を促進し,その結果,γTuRCの構造変化および活性化をひき起こすことが考えられた.
おわりに
LRRK1はパーキンソン病の原因遺伝子にコードされるLRRK2とともにROCOファミリーキナーゼに属する.これまで,ROCOファミリーキナーゼを活性化する上流のタンパク質は不明であった.今回の研究により,M期においてPLK1およびCDK1がLRRK1を活性化していることが明らかにされた.LRRK1はPLK1によりSer1790をリン酸化され,このリン酸化に依存的にCDK1によりThr1400をリン酸化されて活性化される.このように,2つのM期キナーゼによる連続的なリン酸化がM期の中心体におけるLRRK1の活性化には必須であった(図1).
G2期からM期にかけてγTuRCなどが中心体にリクルートされ,中心体が成熟し微小管の核形成の活性が上昇する.細胞質に存在するγTuRCは不活性な状態に維持されており,中心体への移行とともにその活性化が誘導される.CDK5RAP2はγTuRCと結合しその構造変化をひき起こすことによりγTuRCを活性化すると考えられている.LRRK1をノックダウンした細胞においてγチューブリンの中心体への局在にはほとんど変化がなかったことから,LRRK1はγTuRCの中心体へのリクルートにおいては重要でないと考えられた.一方,LRRK1はCDK5RAP2をリン酸化することによりCDK5RAP2とγTuRCとの結合を促進し,γTuRCの活性化において機能していた.つまり,LRRK1はγTuRCの中心体へのリクルートではなく活性化のステップにおいて機能し,中心体の成熟を制御している可能性が考えられた.今回の研究により,LRRK1によるCDK5RAP2を介した中心体微小管の核形成の活性の促進は星状体微小管の形成を促進し,その結果,M期における紡錘体の配向を制御することが明らかにされた.
文 献
- Knoblich, J. A.: Asymmetric cell division: recent developments and their implications for tumour biology. Nat. Rev. Mol. Cell Biol., 11, 849-860 (2010)[PubMed]
- Teixido-Travesa, N., Roig, J. & Luders, J.: The where, when and how of microtubule nucleation: one ring to rule them all. J. Cell Sci., 125, 4445-4456 (2012)[PubMed]
- Archambault, V. & Glover, D. M.: Polo-like kinases: conservation and divergence in their functions and regulation. Nat. Rev. Mol. Cell Biol., 10, 265-275 (2009)[PubMed]
- Matsumura, S., Hamasaki, M., Yamamoto, T. et al.: ABL1 regulates spindle orientation in adherent cells and mammalian skin. Nat. Commun., 3, 626 (2012)[PubMed]
- Hanafusa, H., Ishikawa, K., Kedashiro, S. et al.: Leucine-rich repeat kinase LRRK1 regulates endosomal trafficking of the EGF receptor. Nat. Commun., 2, 158 (2011)[PubMed]
- Ishikawa, K., Nara, A., Matsumoto, K. et al.: EGFR-dependent phosphorylation of leucine-rich repeat kinase LRRK1 is important for proper endosomal trafficking of EGFR. Mol. Biol. Cell, 23, 1294-1306 (2012)[PubMed]
- Kedashiro, S., Pastuhov, S., Nishioka, T. et al.: LRRK1-phosphorylated CLIP-170 regulates EGFR trafficking by recruiting p150Glued to microtubule plus ends. J. Cell Sci., 128, 385-396 (2015)[PubMed]
- Toyoshima, F. & Nishida, E.: Integrin-mediated adhesion orients the spindle parallel to the substratum in an EB1- and myosin X-dependent manner. EMBO J., 26, 1487-1498 (2007)[PubMed]
- Wang, Z., Wu, T., Shi, L. et al.: Conserved motif of CDK5RAP2 mediates its localization to centrosomes and the Golgi complex. J. Biol. Chem., 285, 22658-22665 (2010)[PubMed]
- Choi, Y. -K., Liu, P., Sze, S. K. et al.: CDK5RAP2 stimulates microtubule nucleation by the γ-tubulin ring complex. J. Cell Biol., 191, 1089-1095 (2010)[PubMed]
著者プロフィール
略歴:2001年 京都大学大学院生命科学研究科 修了,2002年 名古屋大学大学院理学研究科 助手,2013年 同 講師を経て,2015年より同 准教授.
研究テーマ:細胞内シグナル伝達.
関心事:研究,子供たちの将来.
松本 邦弘(Kunihiro Matsumoto)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi3.bio.nagoya-u.ac.jp/~bunshi6/matsumoto_japanese/index.html
© 2015 花房 洋・松本邦弘 Licensed under CC 表示 2.1 日本