シナプス接着分子Sdk2は網膜において物体の動きを検出する神経回路の形成に機能する
山形 方人
(米国Harvard大学Center for Brain Science)
email:山形方人
DOI: 10.7875/first.author.2015.100
Sidekick 2 directs formation of a retinal circuit that detects differential motion.
Arjun Krishnaswamy, Masahito Yamagata, Xin Duan, Y. Kate Hong, Joshua R. Sanes
Nature, 524, 466-470 (2015)
視覚情報をうけとり最初にそれを処理するのは網膜の神経回路である.網膜では,約30種類の網膜神経節細胞と双極細胞およびアマクリン細胞からなる約70種類の介在性ニューロンの神経突起が内網状層において神経ネットワークを形成している.網膜神経節細胞は脳にむけ視神経を伸長し網膜においてうけとった視覚情報を伝達する.この研究においては,W3B細胞と名づけられた網膜神経節細胞の形成する特徴的な神経回路に着目した.W3B細胞は目のまえの物体の動きが背景の動きと異なったときだけ応答する.W3B細胞はVG3細胞と名づけらけたアマクリン細胞から強力かつ選択的な入力をうける.VG3細胞は抑制性である通常のアマクリン細胞とは異なり,W3B細胞において興奮性シナプスを形成する.筆者らは,W3B細胞およびVG3細胞が免疫グロブリンスーパーファミリーに属するシナプス接着分子Sdk2を発現していることを見い出した.光遺伝学的な手法を含む電気生理学的な解析により,Sdk2はVG3細胞を介したW3B細胞の視覚応答に必須であることが判明した.通常,網膜神経節細胞は双極細胞からの入力を直接にうけとるのに対し,W3B細胞は双極細胞からの入力をVG3細胞を介し間接的にうけとる.このような神経回路においては,W3B細胞は受容野の中心部にある光受容体からタイミングの少し遅い入力が存在することにより,目のまえの物体の動きが背景の動きと異なったときだけ応答することが可能になると考えられた.Sdk2ノックアウトマウスにおいてはこの神経回路がなくなるため,その機能が劇的に弱まったと思われた.Sdk2はホモフィリックなシナプス接着分子であることから,W3B細胞とVG3細胞のあいだのシナプスの形成あるいは維持に必須であると解釈された.
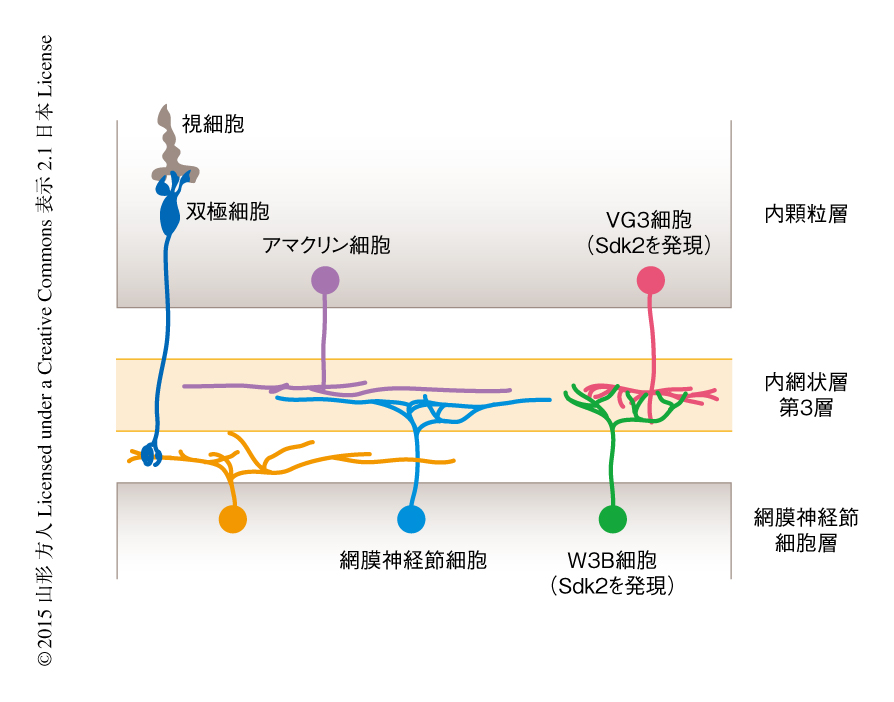
動物において目で見た視覚情報をうけとりその情報を最初に処理するのは,目のなかの神経組織である網膜である.多種多数のニューロンとそれらが化学シナプスおよび電気シナプスによりつながった神経回路をもつ網膜は,大脳と同じ中枢神経系であり,シンプルな構造ながら多様なニューロンが複雑かつ機能的な神経回路を形成している1).網膜は,光をうけとる視細胞にくわえ,網膜からの出力細胞である網膜神経節細胞,視細胞から網膜神経節細胞までのシグナル伝達およびシグナル処理のために必要な介在性ニューロンから構成される.とくに,約30種類の網膜神経節細胞と双極細胞およびアマクリン細胞からなる約70種類の介在性ニューロンが特異的なシナプスを形成する内網状層は,それらの神経突起が層状に入り組み視覚情報をたくみに処理する神経回路を形成している(図1).
網膜神経節細胞には特徴的な視覚情報に対し異なる応答を示す多数のタイプが報告されている2).異なるタイプの網膜神経節細胞は電気生理学的に区別されるだけでなく,形態,神経化学的な特徴,遺伝子発現プロファイルによっても区別される.特定の機能をもつ網膜神経節細胞のひとつであるW3B細胞は3),電気生理学的な測定によると,目のまえの物体の動きが背景の動きと異なったときに特徴的に応答する.この応答は網膜だけをとりだし直接に測定されることから,網膜にはこうした視覚情報をうけとり処理する神経回路が内在的に存在すると考えられる3,4).近年,特定のタイプの網膜神経節細胞の分子マーカーが報告され,その情報を利用して網膜神経節細胞のタイプを区別したり,発現する遺伝子を人為的に操作したりすることが可能になり,哺乳類の神経回路の構造,はたらき,発達を理解するため絶好のモデルになっている.
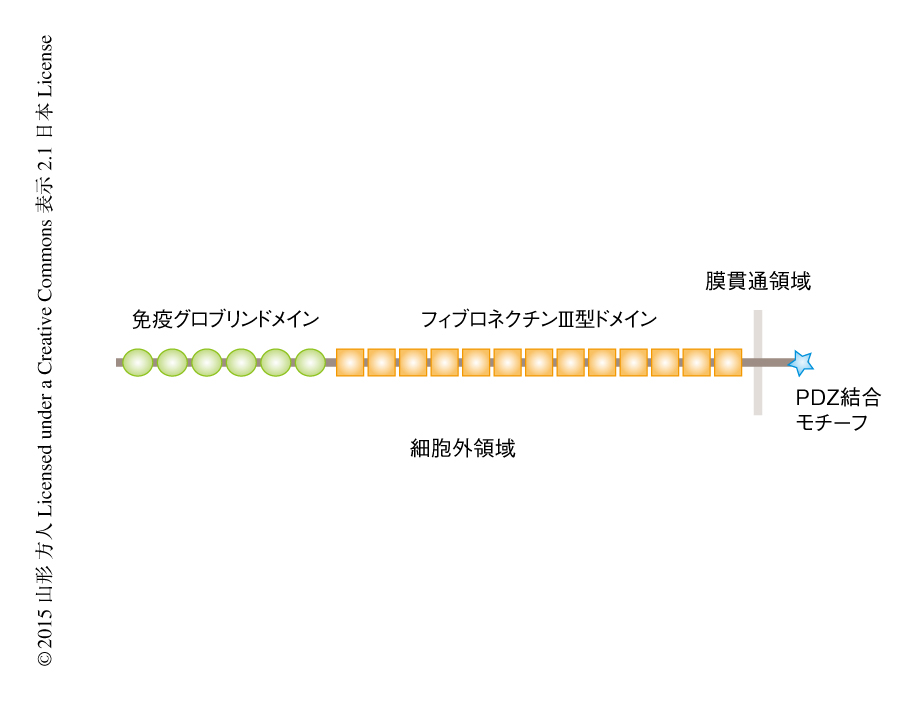
シナプスに局在しその形成にかかわる細胞表面タンパク質はシナプス接着分子とよばれ,神経回路の形成や機能に直接に関与する可能性が高い5).免疫グロブリンスーパーファミリーに属するSidekick1(Sdk1)およびSidekick2(Sdk2)は6,7)(図2).2002年,筆者らにより,ニワトリの網膜において異なる種類の網膜神経節細胞に特異的に発現するシナプス接着分子として発見された6).6個の免疫グロブリンドメイン,13個のフィブロネクチンIII型ドメイン,1つの膜貫通ドメイン,細胞質ドメインをもつ巨大なタンパク質である.細胞質ドメインにはシナプスに局在するタンパク質にしばしばみられるPDZドメインと結合するPDZ結合モチーフがあり,実際に,PDZドメインをもつある種の足場タンパク質と結合する8).さらに,Sdk1はSdk1と,Sdk2はSdk2と特異的に接着し,Sdk1とSdk2とは結合しないホモフィリック(同種親和的)な性質をもつ.したがって,2つのニューロンが同じSdkを発現していれば,神経突起どうしがホモフィリックな接着を起こし接続にいたると考えられる.
これまで,Sdkに関する研究はニワトリの網膜において行われてきた6,7).今回の研究においては,マウスの網膜においてSdk1およびSdk2の遺伝子の発現を解析し,W3B細胞およびその結合の相手であるVG3細胞において発現していることを見い出した.そして,Sdk1およびSdk2のノックアウトマウスを作製し,W3B細胞がかかわる神経回路の機能にあたえる影響について調べた.
in situハイブリダイゼーション法により,マウスの網膜においてSdk1およびSdk2が相補的に異なるタイプの網膜神経節細胞において発現していることが見い出された.これは,ニワトリの網膜における発現と酷似していたが,マウスの網膜ではSdk1およびSdk2を発現する網膜神経節細胞も存在する点が異なっていた.また,免疫染色により,Sdk1およびSdk2は網膜の内網状層において特異的な層に濃縮されていることがわかった.
Sdk1あるいはSdk2にCreERをノックインしたマウスを作製した.これらのマウスにおいてCreERを染色したところ,in situハイブリダイゼーション法と同様の結果がえられた.また,このSdk2ノックインマウスにおいてSdk2を発現しているニューロンの形態を観察したところ,Sdk2はW3B細胞という網膜神経節細胞のタイプにおいて発現していること,さらに,VG3細胞とよばれるVGlut3を発現するアマクリン細胞も発現していることがわかった.W3B細胞およびVG3細胞は5つの層からなる内網状層の第3層を中心に樹状突起を広げている(図1).
W3B細胞とVG3細胞は互いにシナプス結合を形成しているのだろうか.このことを明らかにするため,光遺伝学的な手法を用いた.そのために,VG3細胞においてRFPとチャネルロドプシン2との融合タンパク質を特異的に発現し,W3B細胞においてGFPを発現するマウスを作製した.このマウスから網膜をとりだし,光の照射によりチャネルロドプシン2を刺激してW3B細胞とVG3細胞のシナプス結合のようすを調べた結果,VG3細胞はW3B細胞に対しシナプス結合を直接に形成していることがわかった.これは,抑制性の神経伝達物質のみをもつ通常のアマクリン細胞とは異なり,VG3細胞は興奮性の神経伝達物質であるグルタミン酸を介する興奮性のシナプスをW3B細胞に形成していた.また,W3B細胞とVG3細胞はそれぞれの細胞体からの距離に反比例する強度をもってシナプス結合していた.
“Peters則”は,シナプス結合の強度は前シナプス部のアーバーと後シナプス部の樹状突起との近接度に比例する,つまり,シナプス結合するニューロンどうしの神経突起の距離という物理的な因子の重要性を主張する単純な経験則である9).網膜において,W3B細胞のほかにもVG3細胞の樹状突起と近接する樹状突起をもつ網膜神経節細胞が知られている.そのいくつかについて同じ方法によりVG3細胞とのシナプス結合の強度を調べたところ,それらのなかでVG3細胞とW3B細胞とのシナプス結合は群をぬいて強かった.つまり,神経突起どうしが近い距離にあるとシナプス結合しやすいという“Peters則”により,VG3細胞とW3B細胞のあいだのシナプス結合の強さおよび特異性は説明できなかった.つまり,近接だけではなく別の因子が存在すると結論され,VG3細胞およびW3B細胞に特異的に発現していたSdk2はその候補と考えられた.
Sdk2を完全に欠失した機能欠損型のSdk2ノックアウトマウスを作製したところ,外見は正常で網膜の形状も正常であった.しかし,光遺伝学的な手法による電気生理学的な解析を行ったところ,VG3細胞とW3B細胞とのあいだのシナプス結合の強度が約1/20に低下していることが明らかにされた.
Sdk2ノックアウトマウスの網膜においてVG3細胞およびW3B細胞の形態を観察したところ,アーバーの大きさおよび形状はおおかた正常であった.しかし,ニワトリにおいてRNAi法によりSdkをノックダウンしたときに観察されたのと同様に7),その樹状突起は内網状層からはみでて発芽していた.このことから,Sdk2ノックアウトマウスにおいてはW3B細胞とVG3細胞との接着になんらかの障害があると思われた.
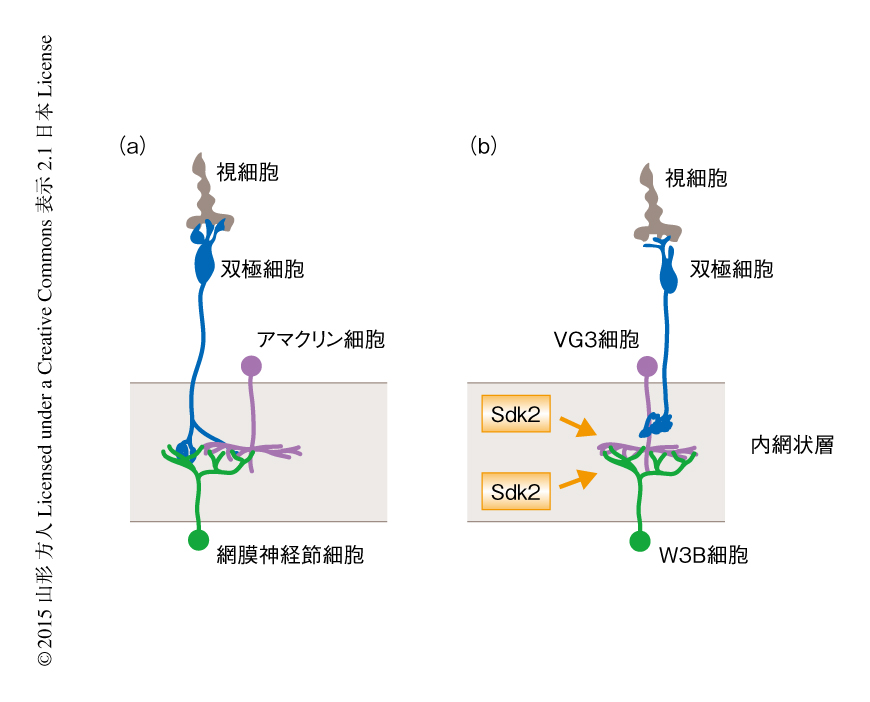
目のまえの物体の動きが背景の動きと異なったときに特徴的に発火するというW3B細胞の応答を,Sdk2ノックアウトマウスからとりだした網膜に対し視覚刺激をすることにより調べた.野生型のマウスの網膜からとりだしたW3B細胞の受容野の中心に光を照射したところ,光照射の開始時および光照射の停止時に大きな活動電位が観察された.Sdk2ノックアウトマウスにおいては,光照射の開始時の応答に変化はなかったが,光照射の停止時の活動電位は消失した.シナプス電流を測定したところ,Sdk2ノックアウトマウスでは,光照射の開始時のシナプス電流に異常はみられなかったが,光照射の停止時のシナプス電流は消失していた.W3B細胞にはほかのアマクリン細胞からも抑制性の入力があるが,これにはSdk2の有無の影響はなかった.通常の網膜神経節細胞は双極細胞からの入力を直接にうけとるのに対し,W3B細胞は双極細胞からの入力をVG3細胞を介し間接的に受容すると推定されている(図3).Sdk2の欠損により応答が消失するのは,この神経回路においてVG3細胞とW3B細胞のあいだの少し遅れたタイミングで入力する興奮性のシナプスに問題があるためと考えられた.そして,網膜では非標準型であるこの特殊な神経回路の存在が,目のまえの物体の動きが背景の動きと異なったときだけ応答することを可能にしていると思われた.実際に,Sdk2の欠損,さらに,Sdk2を発現するVG3細胞それ自体を除去すると,この応答も劇的に消失した.
ホモフィリックなシナプス接着分子Sdk2は,Sdk2を発現するVG3細胞とW3B細胞とのあいだの選択的かつ強い結合に必須であることが明らかにされた.適切なシナプス結合にはSdk2によるホモフィリックな相互作用が重要であり,Sdk2を欠損するとシナプス結合ができにくくなったり維持できなくなったりすることによりシナプス強度が劇的に低下すると考えられた.筆者らを含むこれまでの一連の研究から,網膜の内網状層において正しく機能する神経回路が形成されるには複数のステップがあると考えられている.最初のステップとして,プレキシンのようなガイダンスタンパク質により神経突起どうしが近接すると“Peters則”により弱い結合ができる.しかし,最終的に特異的なシナプス結合を機能的になるまで強めているのは,今回,実証されたSdk2,そしておそらくSdk1,さらに,ほかの免疫グロブリンスーパーファミリーを含めたタンパク質の存在が重要なのではないかと考えられる7,10).これは,これまで考えられてきた特異的なシナプス結合の形成機構に関する議論に対し11),新たな概念を提供した.
また,この研究において用いた戦略は,昨今の神経科学研究においてトピックスになっているニューロンのあいだの結合性マッピング(コネクトーム),神経回路における情報のコーディング,神経回路の形成といった問題へのアプローチとしても有効であろう.
略歴:1988年 名古屋大学大学院理学研究科 修了,京都大学大学院理学研究科,愛知医科大学,米国Washington大学,基礎生物学研究所などを経て,米国Harvard大学 研究員.
研究テーマ:シナプス結合の形成.コネクトミクス.
関心事:神経科学の研究および教育の推進のための施策の研究および活動.
© 2015 山形 方人 Licensed under CC 表示 2.1 日本
(米国Harvard大学Center for Brain Science)
email:山形方人
DOI: 10.7875/first.author.2015.100
Sidekick 2 directs formation of a retinal circuit that detects differential motion.
Arjun Krishnaswamy, Masahito Yamagata, Xin Duan, Y. Kate Hong, Joshua R. Sanes
Nature, 524, 466-470 (2015)
要 約
視覚情報をうけとり最初にそれを処理するのは網膜の神経回路である.網膜では,約30種類の網膜神経節細胞と双極細胞およびアマクリン細胞からなる約70種類の介在性ニューロンの神経突起が内網状層において神経ネットワークを形成している.網膜神経節細胞は脳にむけ視神経を伸長し網膜においてうけとった視覚情報を伝達する.この研究においては,W3B細胞と名づけられた網膜神経節細胞の形成する特徴的な神経回路に着目した.W3B細胞は目のまえの物体の動きが背景の動きと異なったときだけ応答する.W3B細胞はVG3細胞と名づけらけたアマクリン細胞から強力かつ選択的な入力をうける.VG3細胞は抑制性である通常のアマクリン細胞とは異なり,W3B細胞において興奮性シナプスを形成する.筆者らは,W3B細胞およびVG3細胞が免疫グロブリンスーパーファミリーに属するシナプス接着分子Sdk2を発現していることを見い出した.光遺伝学的な手法を含む電気生理学的な解析により,Sdk2はVG3細胞を介したW3B細胞の視覚応答に必須であることが判明した.通常,網膜神経節細胞は双極細胞からの入力を直接にうけとるのに対し,W3B細胞は双極細胞からの入力をVG3細胞を介し間接的にうけとる.このような神経回路においては,W3B細胞は受容野の中心部にある光受容体からタイミングの少し遅い入力が存在することにより,目のまえの物体の動きが背景の動きと異なったときだけ応答することが可能になると考えられた.Sdk2ノックアウトマウスにおいてはこの神経回路がなくなるため,その機能が劇的に弱まったと思われた.Sdk2はホモフィリックなシナプス接着分子であることから,W3B細胞とVG3細胞のあいだのシナプスの形成あるいは維持に必須であると解釈された.
はじめに
動物において目で見た視覚情報をうけとりその情報を最初に処理するのは,目のなかの神経組織である網膜である.多種多数のニューロンとそれらが化学シナプスおよび電気シナプスによりつながった神経回路をもつ網膜は,大脳と同じ中枢神経系であり,シンプルな構造ながら多様なニューロンが複雑かつ機能的な神経回路を形成している1).網膜は,光をうけとる視細胞にくわえ,網膜からの出力細胞である網膜神経節細胞,視細胞から網膜神経節細胞までのシグナル伝達およびシグナル処理のために必要な介在性ニューロンから構成される.とくに,約30種類の網膜神経節細胞と双極細胞およびアマクリン細胞からなる約70種類の介在性ニューロンが特異的なシナプスを形成する内網状層は,それらの神経突起が層状に入り組み視覚情報をたくみに処理する神経回路を形成している(図1).
網膜神経節細胞には特徴的な視覚情報に対し異なる応答を示す多数のタイプが報告されている2).異なるタイプの網膜神経節細胞は電気生理学的に区別されるだけでなく,形態,神経化学的な特徴,遺伝子発現プロファイルによっても区別される.特定の機能をもつ網膜神経節細胞のひとつであるW3B細胞は3),電気生理学的な測定によると,目のまえの物体の動きが背景の動きと異なったときに特徴的に応答する.この応答は網膜だけをとりだし直接に測定されることから,網膜にはこうした視覚情報をうけとり処理する神経回路が内在的に存在すると考えられる3,4).近年,特定のタイプの網膜神経節細胞の分子マーカーが報告され,その情報を利用して網膜神経節細胞のタイプを区別したり,発現する遺伝子を人為的に操作したりすることが可能になり,哺乳類の神経回路の構造,はたらき,発達を理解するため絶好のモデルになっている.
シナプスに局在しその形成にかかわる細胞表面タンパク質はシナプス接着分子とよばれ,神経回路の形成や機能に直接に関与する可能性が高い5).免疫グロブリンスーパーファミリーに属するSidekick1(Sdk1)およびSidekick2(Sdk2)は6,7)(図2).2002年,筆者らにより,ニワトリの網膜において異なる種類の網膜神経節細胞に特異的に発現するシナプス接着分子として発見された6).6個の免疫グロブリンドメイン,13個のフィブロネクチンIII型ドメイン,1つの膜貫通ドメイン,細胞質ドメインをもつ巨大なタンパク質である.細胞質ドメインにはシナプスに局在するタンパク質にしばしばみられるPDZドメインと結合するPDZ結合モチーフがあり,実際に,PDZドメインをもつある種の足場タンパク質と結合する8).さらに,Sdk1はSdk1と,Sdk2はSdk2と特異的に接着し,Sdk1とSdk2とは結合しないホモフィリック(同種親和的)な性質をもつ.したがって,2つのニューロンが同じSdkを発現していれば,神経突起どうしがホモフィリックな接着を起こし接続にいたると考えられる.
これまで,Sdkに関する研究はニワトリの網膜において行われてきた6,7).今回の研究においては,マウスの網膜においてSdk1およびSdk2の遺伝子の発現を解析し,W3B細胞およびその結合の相手であるVG3細胞において発現していることを見い出した.そして,Sdk1およびSdk2のノックアウトマウスを作製し,W3B細胞がかかわる神経回路の機能にあたえる影響について調べた.
1.Sdk2は網膜においてW3B細胞およびVG3細胞に発現している
in situハイブリダイゼーション法により,マウスの網膜においてSdk1およびSdk2が相補的に異なるタイプの網膜神経節細胞において発現していることが見い出された.これは,ニワトリの網膜における発現と酷似していたが,マウスの網膜ではSdk1およびSdk2を発現する網膜神経節細胞も存在する点が異なっていた.また,免疫染色により,Sdk1およびSdk2は網膜の内網状層において特異的な層に濃縮されていることがわかった.
Sdk1あるいはSdk2にCreERをノックインしたマウスを作製した.これらのマウスにおいてCreERを染色したところ,in situハイブリダイゼーション法と同様の結果がえられた.また,このSdk2ノックインマウスにおいてSdk2を発現しているニューロンの形態を観察したところ,Sdk2はW3B細胞という網膜神経節細胞のタイプにおいて発現していること,さらに,VG3細胞とよばれるVGlut3を発現するアマクリン細胞も発現していることがわかった.W3B細胞およびVG3細胞は5つの層からなる内網状層の第3層を中心に樹状突起を広げている(図1).
2.W3B細胞とVG3細胞の結合の強さは“Peters則”により説明できない
W3B細胞とVG3細胞は互いにシナプス結合を形成しているのだろうか.このことを明らかにするため,光遺伝学的な手法を用いた.そのために,VG3細胞においてRFPとチャネルロドプシン2との融合タンパク質を特異的に発現し,W3B細胞においてGFPを発現するマウスを作製した.このマウスから網膜をとりだし,光の照射によりチャネルロドプシン2を刺激してW3B細胞とVG3細胞のシナプス結合のようすを調べた結果,VG3細胞はW3B細胞に対しシナプス結合を直接に形成していることがわかった.これは,抑制性の神経伝達物質のみをもつ通常のアマクリン細胞とは異なり,VG3細胞は興奮性の神経伝達物質であるグルタミン酸を介する興奮性のシナプスをW3B細胞に形成していた.また,W3B細胞とVG3細胞はそれぞれの細胞体からの距離に反比例する強度をもってシナプス結合していた.
“Peters則”は,シナプス結合の強度は前シナプス部のアーバーと後シナプス部の樹状突起との近接度に比例する,つまり,シナプス結合するニューロンどうしの神経突起の距離という物理的な因子の重要性を主張する単純な経験則である9).網膜において,W3B細胞のほかにもVG3細胞の樹状突起と近接する樹状突起をもつ網膜神経節細胞が知られている.そのいくつかについて同じ方法によりVG3細胞とのシナプス結合の強度を調べたところ,それらのなかでVG3細胞とW3B細胞とのシナプス結合は群をぬいて強かった.つまり,神経突起どうしが近い距離にあるとシナプス結合しやすいという“Peters則”により,VG3細胞とW3B細胞のあいだのシナプス結合の強さおよび特異性は説明できなかった.つまり,近接だけではなく別の因子が存在すると結論され,VG3細胞およびW3B細胞に特異的に発現していたSdk2はその候補と考えられた.
3.目のまえの物体の動きが背景の動きと異なったときだけ応答する神経回路におけるSdk2の機能
Sdk2を完全に欠失した機能欠損型のSdk2ノックアウトマウスを作製したところ,外見は正常で網膜の形状も正常であった.しかし,光遺伝学的な手法による電気生理学的な解析を行ったところ,VG3細胞とW3B細胞とのあいだのシナプス結合の強度が約1/20に低下していることが明らかにされた.
Sdk2ノックアウトマウスの網膜においてVG3細胞およびW3B細胞の形態を観察したところ,アーバーの大きさおよび形状はおおかた正常であった.しかし,ニワトリにおいてRNAi法によりSdkをノックダウンしたときに観察されたのと同様に7),その樹状突起は内網状層からはみでて発芽していた.このことから,Sdk2ノックアウトマウスにおいてはW3B細胞とVG3細胞との接着になんらかの障害があると思われた.
目のまえの物体の動きが背景の動きと異なったときに特徴的に発火するというW3B細胞の応答を,Sdk2ノックアウトマウスからとりだした網膜に対し視覚刺激をすることにより調べた.野生型のマウスの網膜からとりだしたW3B細胞の受容野の中心に光を照射したところ,光照射の開始時および光照射の停止時に大きな活動電位が観察された.Sdk2ノックアウトマウスにおいては,光照射の開始時の応答に変化はなかったが,光照射の停止時の活動電位は消失した.シナプス電流を測定したところ,Sdk2ノックアウトマウスでは,光照射の開始時のシナプス電流に異常はみられなかったが,光照射の停止時のシナプス電流は消失していた.W3B細胞にはほかのアマクリン細胞からも抑制性の入力があるが,これにはSdk2の有無の影響はなかった.通常の網膜神経節細胞は双極細胞からの入力を直接にうけとるのに対し,W3B細胞は双極細胞からの入力をVG3細胞を介し間接的に受容すると推定されている(図3).Sdk2の欠損により応答が消失するのは,この神経回路においてVG3細胞とW3B細胞のあいだの少し遅れたタイミングで入力する興奮性のシナプスに問題があるためと考えられた.そして,網膜では非標準型であるこの特殊な神経回路の存在が,目のまえの物体の動きが背景の動きと異なったときだけ応答することを可能にしていると思われた.実際に,Sdk2の欠損,さらに,Sdk2を発現するVG3細胞それ自体を除去すると,この応答も劇的に消失した.
おわりに
ホモフィリックなシナプス接着分子Sdk2は,Sdk2を発現するVG3細胞とW3B細胞とのあいだの選択的かつ強い結合に必須であることが明らかにされた.適切なシナプス結合にはSdk2によるホモフィリックな相互作用が重要であり,Sdk2を欠損するとシナプス結合ができにくくなったり維持できなくなったりすることによりシナプス強度が劇的に低下すると考えられた.筆者らを含むこれまでの一連の研究から,網膜の内網状層において正しく機能する神経回路が形成されるには複数のステップがあると考えられている.最初のステップとして,プレキシンのようなガイダンスタンパク質により神経突起どうしが近接すると“Peters則”により弱い結合ができる.しかし,最終的に特異的なシナプス結合を機能的になるまで強めているのは,今回,実証されたSdk2,そしておそらくSdk1,さらに,ほかの免疫グロブリンスーパーファミリーを含めたタンパク質の存在が重要なのではないかと考えられる7,10).これは,これまで考えられてきた特異的なシナプス結合の形成機構に関する議論に対し11),新たな概念を提供した.
また,この研究において用いた戦略は,昨今の神経科学研究においてトピックスになっているニューロンのあいだの結合性マッピング(コネクトーム),神経回路における情報のコーディング,神経回路の形成といった問題へのアプローチとしても有効であろう.
文 献
- Dowling,J. E.: The Retina: An Approachable Part of the Brain, Revised Ed. Belknap Press, Cambridge (2012)
- Sanes, J. R. & Masland, R. H.: The types of retinal ganglion cells: current status and implications for neuronal classification. Annu. Rev. Neurosci., 38, 221-246 (2015)[PubMed]
- Zhang, Y., Kim, I. J., Sanes, J. R. et al.: The most numerous ganglion cell type of the mouse retina is a selective feature detector. Proc. Natl. Acad. Sci. USA, 109, 2391-2398 (2012)[PubMed]
- Kim, T., Soto, F. & Kerschensteiner, D.: An excitatory amacrine cell detects object motion and provides feature-selective input to ganglion cells in the mouse retina. eLife, 4, e08025 (2015)[PubMed]
- Yamagata, M.: Synaptic adhesion molecule. in Encyclopedia of Neuroscience (Binder, M. D., Hirokawa, N., Windhorst, U. eds.), pp.3945-3948, Springer, Berlin (2009)
- Yamagata, M., Weiner, J. A. & Sanes, J. R.: Sidekicks: synaptic adhesion molecules that promote lamina-specific connectivity in the retina. Cell, 110, 649-660 (2002)[PubMed]
- Yamagata, M. & Sanes, J. R.: Dscam and Sidekick proteins direct lamina-specific synaptic connections in vertebrate retina. Nature, 451, 465-469 (2008)[PubMed]
- Yamagata, M. & Sanes, J. R.: Synaptic localization and function of Sidekick recognition molecules require MAGI scaffolding proteins. J. Neurosci., 30, 3579-3588 (2010)[PubMed]
- Peters, A. & Feldman, M. L.: The projection of the lateral geniculate nucleus to area 17 of the rat cerebral cortex. I. General description. J. Neurocytol., 5, 63-84 (1976)[PubMed]
- Yamagata, M. & Sanes, J. R.: Expanding the Ig superfamily code for laminar specificity in retina: expression and role of contactins. J. Neurosci., 32, 14402-14414 (2012)[PubMed]
- Sanes, J. R. & Yamagata, M.: Many paths to synaptic specificity. Annu. Rev. Cell Dev. Biol., 25, 161-195 (2009)[PubMed]
著者プロフィール
略歴:1988年 名古屋大学大学院理学研究科 修了,京都大学大学院理学研究科,愛知医科大学,米国Washington大学,基礎生物学研究所などを経て,米国Harvard大学 研究員.
研究テーマ:シナプス結合の形成.コネクトミクス.
関心事:神経科学の研究および教育の推進のための施策の研究および活動.
© 2015 山形 方人 Licensed under CC 表示 2.1 日本