マイクロRNAとは何か,古くて新しい非対称性の謎を解く
鈴木 洋・宮園浩平
(東京大学大学院医学系研究科 分子病理学分野)
email:鈴木 洋
DOI: 10.7875/first.author.2015.091
Small-RNA asymmetry is directly driven by mammalian Argonautes.
Hiroshi I. Suzuki, Akihiro Katsura, Takahiko Yasuda, Toshihide Ueno, Hiroyuki Mano, Koichi Sugimoto, Kohei Miyazono
Nature Structural & Molecular Biology, 22, 512-521 (2015)
マイクロRNAの産生およびRNAiにおいて,その起点となる二本鎖RNAからどちらのRNA鎖が機能するガイド鎖として選択されるのかは,RNAiによる遺伝子の発現制御において中心的な命題である.この問題は,マイクロRNAとは何か,および,RNAiの特異性という根源的な問題とも直結している.これまで,ガイド鎖の選択における非対称性についてはいくつかの分子機構が提案されてきたが,近年の研究により,これまで想定されてきた非対称性に寄与する分子センサーはガイド鎖の選択において必須ではないことが示唆され,さらに,生体におけるマイクロRNAの非対称性は予想された以上に複雑であることも示され,マイクロRNAの非対称性を制御する標準的な分子機構はいまだ明らかにされていない.筆者らは,この研究において,哺乳類におけるマイクロRNAの非対称性の一般的な特性,および,これに対応する分子機構を解明し,さらに,対応する数理モデルを構築した.この理論的な枠組みにより,マイクロRNAの機能のより正確な理解,および,RNAiを応用した核酸医薬の最適化が可能になると期待される.
生物学においてしばしばみられる非対称性は,マイクロRNA(miRNA)の機能やRNAi(RNA interference,RNA干渉)の特異性を考えるうえでも重要である.細胞においてmiRNAは以下のような多段階のステップをへて産生される1,2).miRNA遺伝子から転写されたpri-miRNAは核においてDroshaにより切断されpre-miRNAへと変換される.pre-miRNAは細胞質においてDicerによる切断をうけ21~23塩基のmiRNA二本鎖になる.このmiRNA二本鎖はArgonaute(Ago)に取り込まれ,一方のRNA鎖が除去され,もう一方のRNA鎖だけがAgoと安定な複合体を形成する.この複合体がRISC(RNA-induced silencing complex)であり,Agoに取り込まれた一本鎖RNAがいわゆる成熟型miRNAである.RISCはmiRNAと相補的な配列をもつ標的となるmRNAと結合し,そのmRNAからのタンパク質への出力を抑制する.哺乳類にはAgo1~Ago4の4種類のAgoが存在し,Ago2がRNA切断活性をもつ.さまざまな研究分野においてツールとして汎用されているsiRNA(small interfering RNA)については,細胞に導入された二本鎖RNAが同様にAgoに取り込まれ機能している.この過程において,二本鎖RNAのうち最終的に機能するRNA鎖はガイド鎖,除去されるRNA鎖はパッセンジャー鎖とよばれ,miRNAの場合は機能するものがmiRNA,除去されるものがmiRNA*と表記される.しかしながら,近年の次世代シークエンサーを用いた解析技術の進展により,必ずしも片側のRNA鎖だけが機能するわけではなく両側のRNA鎖が機能するmiRNAも多く存在することが明らかにされ,現在では,二本鎖RNAのうち,pre-miRNAにおいて5’側にあったmiRNAを5p型,3’側にあったmiRNAを3p型と呼称するようになった3).
さらに,二本鎖RNAからガイド鎖を選択する分子機構についての理解は混迷をきわめている.二本鎖RNAからのガイド鎖の選択はランダムではなく非対称的な過程であるが,この非対称性を左右するパラメーターのひとつが二本鎖RNAの両方の末端の相対的な熱力学的な安定性である.この熱力学的安定性ルールでは,5’側の末端がより不安定なRNA鎖ほどガイド鎖として機能しやすい.熱力学的安定性ルールに寄与する分子センサーとしてショウジョウバエにおいてDcr-2とR2D2との複合体が提案されており,哺乳類ではそのカウンターパートとしてDicerとTRBP(あるいは,PACT)との複合体が提案されている.しかし,最近の研究において,ショウジョウバエのR2D2および哺乳類のDicer,TRBP,PACTはガイド鎖の選択において必須ではないことが示唆され4-7),さきに述べたmiRNAの非対称性の複雑性とあわせて,miRNAの非対称性の標準的な分子機構はいまだ明らかにされていない.この問題はmiRNAとは何かという根源的な問題と直結しており,また,現状ではRNAiを応用した核酸医薬の起点となる小分子RNAの作動機構を十分に制御できないことも意味している.
そもそも,miRNAの5p型と3p型のパターンはどういう特徴をもつのだろうか? 熱力学的安定性ルールはどのくらい5p型と3p型のパターンに寄与しているのか? 一方のRNA鎖が優先的に機能するmiRNAと両方のRNA鎖が機能するmiRNAの違いは何なのか? これらはいまだ不明である.さらに,miRNAの種類によっては組織や細胞種により5p型と3p型のmiRNAの比が変わることも報告されている3).
これらの疑問を検証するため,配列が非常に似ているにもかかわらず5p型と3p型との比が大きく異なるmiRNAファミリー,miR-30ファミリーおよびmiR-181ファミリーについて,5p型と3p型のパターンを詳細に比較した.その結果,これらのmiRNAについて,5p型はつねに強力な活性をもつが,3p型は相対的な熱力学的な安定性に応じ活性が変化しており,これは,これまで提案されたどの分子機構によっても十分には説明できないものであった.つまり,5p型については5p型を優先するようななんらかのバイアスがはたらき,3p型に対してはみかけのうえ熱力学的安定性ルールが適用されていることが示唆された.Ago2はpre-miRNAを取り込みその3p型のmiRNAとなる部分を切断することが報告されており,これが5p型に対するバイアスとして機能することも考えられたが,解析の結果,この可能性は否定された.一方で,これらのmiRNAの5p型はUあるいはAではじまることから,miRNAの5’末端の塩基が5p型へのバイアスに寄与している可能性が考えられた.これは,哺乳類の多くの成熟型miRNAがUあるいはAからはじまるという傾向と合致するものであった8).
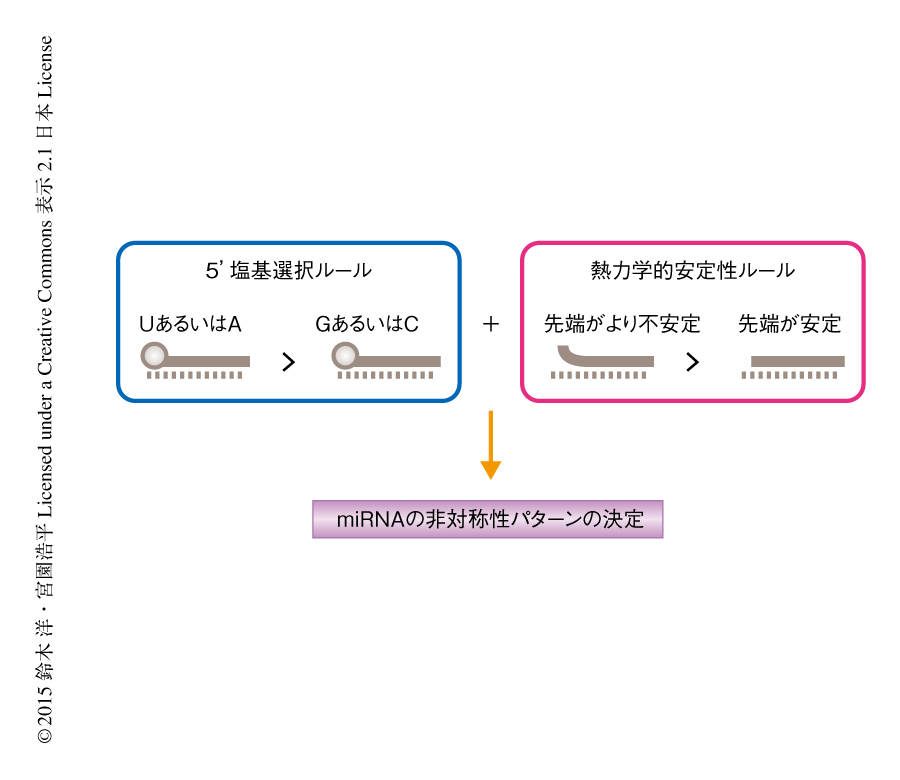
これらの結果から,miRNAの非対称性について以下のような仮説をたてた(図1).miRNAの非対称性を決定するルールは2つあり,ひとつは5’末端がUあるいはAであった場合には,GあるいはCであった場合よりガイド鎖として機能しやすいというものであり(5’塩基選択ルール),もうひとつはいわゆる熱力学的安定性ルールである.miRNAの最終的な非対称性のパターンはこの独立した2つのルールの重ね合わせにより決定されると仮説をたてた.例として,一方のRNA鎖は5’塩基選択ルールにより優先的に選択され,もう一方のRNA鎖は熱力学的安定性ルールにより優先に選択される場合を想定すると,両方のRNA鎖の機能するmiRNAの存在が説明されることになる.この仮説を検証するため,さまざまな相対的な熱力学的な安定性を示す内在性miRNAについて,5’末端をUあるいはA,または,GあるいはCとした変異体を作製し,内在性miRNAの熱力学的な安定性のダイナミックレンジおよびさまざまな5’末端の塩基のパターンを網羅した状況においてmiRNAの非対称性のパターンを解析した.結果は仮説ときわめてよく合致するものであり,これらの検討により,miRNAの非対称性の予想外の特徴,すなわち,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせが明らかにされた.これまで報告されていた5’末端の塩基の傾向や熱力学的安定性ルールは,miRNAの非対称性のもつ特徴のひとつの側面であったことになる.
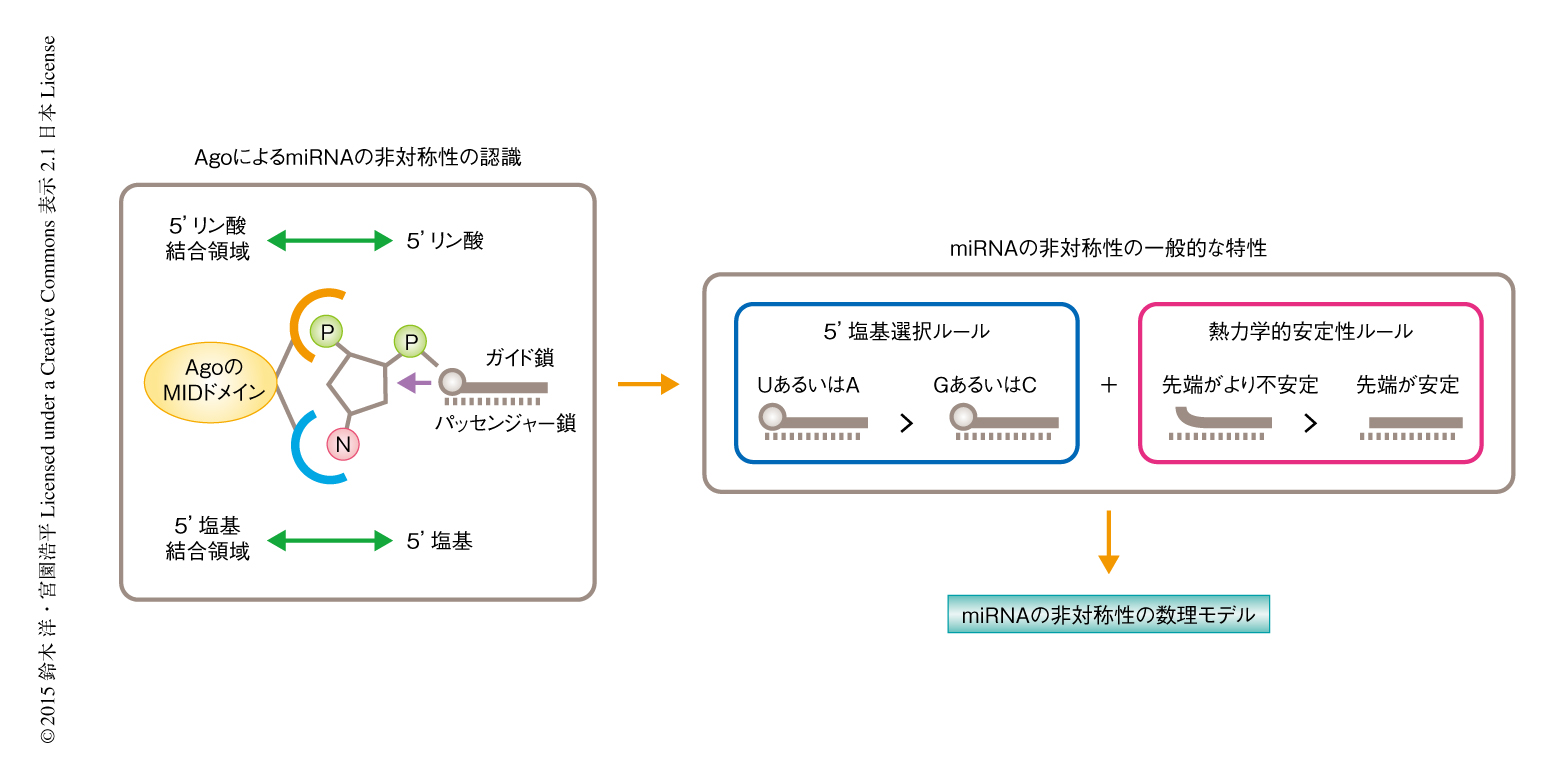
5’塩基選択ルールと熱力学的安定性ルールの重ね合わせという特徴は,ガイド鎖の選択におけるどのような分子機構に起因するのであろうか? Agoは二本鎖RNAの取り込みおよびガイド鎖の保持において,ガイド鎖の5’側をMIDドメインにより,3’側をPAZドメインにより保持するが,MIDドメインにおいてガイド鎖の5’末端の塩基と相互作用する5’塩基結合領域がUかAかの選択において重要であることが示唆されており8),この部分が5’塩基選択ルールを担う部分と考えられた.これまでに,DicerとTRBP(PACT)との複合体が熱力学的に安定な二本鎖RNAの末端をAgoのPAZドメインにひきわたすことが提案されており,さきに述べたように,Dicer,TRBP,PACTの非対称性における役割は必須ではないものの,PAZドメインが熱力学的安定性ルールに重要であるとし,さらに,MIDドメインとPAZドメインによる二本鎖RNAの確率論的な取り込みが起こっていると想定すると,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせが説明される.しかし,PAZドメインの欠損体あるいは変異体の解析からこの可能性は低く,また,in vitroにおけるPAZドメインと完全対称な二本鎖RNAとの結合能の解析からもこの可能性は否定された.
一方で,in vitroにおいてAgoのMIDドメインと完全対称な二本鎖RNAとの結合能を解析したところ,MIDドメインは二本鎖RNAの5’末端の塩基および熱力学的な安定性の両方を認識できることが明らかにされた.そこで,MIDドメインにおいて熱力学的な安定性を認識する領域を探索したが,近年,Agoとガイド鎖との複合体の構造解析が行われており9),二本鎖RNAの取り込みの際に重要なAgoとRNAとの結合が,Agoとガイド鎖との結合においても同様に維持されている可能性を考慮した.Agoとガイド鎖は5’末端の塩基およびガイド鎖の骨格のリン酸およびリボースと複数の相互作用を介し結合しているが,この関係性にもとづき,MIDドメインの5’リン酸結合領域がRNAの5’リン酸を引き込んで相互作用する際に,MIDドメインと5’リン酸との相互作用と二本鎖RNAの塩基のあいだの相互作用とが拮抗することにより熱力学的な安定性が認識されているのではないかという可能性が想起された.この可能性を検証するため,5’塩基結合領域および5’リン酸結合領域のAgo変異体を解析したところ,5’塩基結合領域の変異により5’塩基選択ルールが,5’リン酸結合領域の変異により熱力学的安定性ルールが,それぞれ減弱することが明らかにされた.5’塩基結合領域および5’リン酸結合領域の重要性は,Ago変異体と,両方のRNA鎖が機能するmiRNA,完全対称の二本鎖RNA,さまざまなsiRNAおよびmiRNAとの相互作用の解析,および,Agoを完全に欠損したES細胞に発現させたAgo変異体と結合するmiRNAの網羅的な解析などから支持された.
以上の結果から,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせは,AgoのMIDドメインが5’塩基結合領域および5’リン酸結合領域を介して二本鎖RNAの取り込みの方向性を決定していると考えることにより説明された(図2).また,従来のモデルとは異なり,RNAiにおける中心プレーヤーであるAgoそれ自体がmiRNAの最終的な非対称性を決定することにより,miRNAの産生およびRNAiの特異性を校正していると考えられた.
これらの解析により,AgoのMIDドメインが二本鎖RNAの一方の末端の熱力学的な安定性を検出することが明らかにされたが,それでは,熱力学的安定性ルールにおける両方の末端の相対的な安定性の検出はどのような理由から観測されるのだろうか? この問題は,Agoと二本鎖RNAの相互作用について,酵素反応速度理論を適用し,RNAの認識の初期の結合エネルギーの記述に5’塩基選択ルールおよび熱力学的安定性ルールを組み込み,さらに,5p型と3p型のmiRNAが競合的に取り込まれる場合に基質と可逆的な競合阻害物質の量の比が等しくなるという過程をおくことにより説明が可能となった.結果として,5p型と3p型のmiRNAの比を推定する数理モデル,および,5p型あるいは3p型のmiRNAを取り込んだRISCの量をそれぞれ推定する数理モデルが導出された.これらの数理モデルは,次世代シークエンサーにより計測されたマウスの全miRNAの5p型と3p型のパターン,および,さきに述べたmiRNAの網羅的な機能アッセイの結果を非常によく説明することが明らかにされた.このことは,AgoのMIDドメインと二本鎖RNAの一方の末端との相互作用が一対一の関係であっても,酵素反応速度理論により熱力学的安定性ルールの相対性が担保されることを意味した.
miRNAの非対称性とがんとの関係について解析した.がんにおいては,さまざまなmiRNAの発現異常がみられるが,最近の報告により,がんにおいてmiRNA遺伝子の変異がみられたり,miRNA遺伝子のSNPががんのリスクと関係したりすることが報告されている10,11).miRNA二本鎖にみられる配列の変化に注目したところ,白血病においてみられるmiR-142の変異,および,免疫反応と関係するmiR-146aのSNPが,miRNAの非対称性のモデルにより予測されたとおり,それらの非対称性を変化させることが明らかにされた.さらに,miR-146aのSNPの意義をThe Cancer Genome Atlasデータベースにおいて検討した結果,メラノーマなどにおいてmiR-146aのSNPが予後と関係すること,このSNPがmiR-146aの5p型と3p型の比,さらに,miR-146aの標的となる遺伝子の発現にも影響を及ぼすことが明らかにされた.これらの結果は,miRNA遺伝子の配列の変化はそのRNA鎖の機能を変えるだけなく非対称性のパターンも変えうること,さらに,miRNAの非対称性の変化は疾患の病態とも関係しうることを示唆した.
この研究はmiRNAの非対称性の問題について,哺乳類におけるmiRNAの非対称性の一般的な特性,これに対応する分子機構,対応する数理モデルを含む包括的な理論的な枠組みを提示した(図2).このモデルは,miRNAの非対称性やRNAiの特異性についてこれまで蓄積されたさまざまな知見を統合しつつ,その不十分な点を補完するとともに,miRNAの非対称性についてより正確な分子機構を提示した.ガイド鎖およびパッセンジャー鎖の制御が十分にできないことはRNAiにおいてオフターゲット効果を制御できないことを意味するが,最近,RNAiに関する知見をshRNAのデザインに統合することにより,RNAiの有用性をCRISPRを用いた遺伝子発現制御に劣らないものにまでひきあげることが可能であることが示唆されている12).Precision Medicine時代においては疾患遺伝子の正確な機能解析およびこれを対象とした核酸医薬の開発が重要であり,この研究によりRNAiを応用した核酸医薬の合理的な開発および最適化が加速することが期待される.
略歴:2010年 東京大学大学院医学研究科 早期修了,同年 同 特任助教を経て,2014年より米国Massachusetts Institute of Technology客員研究員.
研究テーマ:RNAバイオロジー.
抱負:Sciences for Precision Medicine.
宮園 浩平(Kohei Miyazono)
東京大学大学院医学研究科 教授.
研究室URL:http://beta-lab.umin.ac.jp/
© 2015 鈴木 洋・宮園浩平 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 分子病理学分野)
email:鈴木 洋
DOI: 10.7875/first.author.2015.091
Small-RNA asymmetry is directly driven by mammalian Argonautes.
Hiroshi I. Suzuki, Akihiro Katsura, Takahiko Yasuda, Toshihide Ueno, Hiroyuki Mano, Koichi Sugimoto, Kohei Miyazono
Nature Structural & Molecular Biology, 22, 512-521 (2015)
この論文に出現する遺伝子・タンパク質のUniprot ID
Argonautes, Drosha(Q9NRR4), Dicer(Q9UPY3), Argonaute, Ago, RISC, RNA-induced silencing complex, Ago1(Q9UL18), Ago4(Q9HCK5), Ago2(Q9UKV8), Dcr-2(A1ZAW0), R2D2(Q9VLW8), TRBP(Q15633), PACT(O75569)
要 約
マイクロRNAの産生およびRNAiにおいて,その起点となる二本鎖RNAからどちらのRNA鎖が機能するガイド鎖として選択されるのかは,RNAiによる遺伝子の発現制御において中心的な命題である.この問題は,マイクロRNAとは何か,および,RNAiの特異性という根源的な問題とも直結している.これまで,ガイド鎖の選択における非対称性についてはいくつかの分子機構が提案されてきたが,近年の研究により,これまで想定されてきた非対称性に寄与する分子センサーはガイド鎖の選択において必須ではないことが示唆され,さらに,生体におけるマイクロRNAの非対称性は予想された以上に複雑であることも示され,マイクロRNAの非対称性を制御する標準的な分子機構はいまだ明らかにされていない.筆者らは,この研究において,哺乳類におけるマイクロRNAの非対称性の一般的な特性,および,これに対応する分子機構を解明し,さらに,対応する数理モデルを構築した.この理論的な枠組みにより,マイクロRNAの機能のより正確な理解,および,RNAiを応用した核酸医薬の最適化が可能になると期待される.
はじめに
生物学においてしばしばみられる非対称性は,マイクロRNA(miRNA)の機能やRNAi(RNA interference,RNA干渉)の特異性を考えるうえでも重要である.細胞においてmiRNAは以下のような多段階のステップをへて産生される1,2).miRNA遺伝子から転写されたpri-miRNAは核においてDroshaにより切断されpre-miRNAへと変換される.pre-miRNAは細胞質においてDicerによる切断をうけ21~23塩基のmiRNA二本鎖になる.このmiRNA二本鎖はArgonaute(Ago)に取り込まれ,一方のRNA鎖が除去され,もう一方のRNA鎖だけがAgoと安定な複合体を形成する.この複合体がRISC(RNA-induced silencing complex)であり,Agoに取り込まれた一本鎖RNAがいわゆる成熟型miRNAである.RISCはmiRNAと相補的な配列をもつ標的となるmRNAと結合し,そのmRNAからのタンパク質への出力を抑制する.哺乳類にはAgo1~Ago4の4種類のAgoが存在し,Ago2がRNA切断活性をもつ.さまざまな研究分野においてツールとして汎用されているsiRNA(small interfering RNA)については,細胞に導入された二本鎖RNAが同様にAgoに取り込まれ機能している.この過程において,二本鎖RNAのうち最終的に機能するRNA鎖はガイド鎖,除去されるRNA鎖はパッセンジャー鎖とよばれ,miRNAの場合は機能するものがmiRNA,除去されるものがmiRNA*と表記される.しかしながら,近年の次世代シークエンサーを用いた解析技術の進展により,必ずしも片側のRNA鎖だけが機能するわけではなく両側のRNA鎖が機能するmiRNAも多く存在することが明らかにされ,現在では,二本鎖RNAのうち,pre-miRNAにおいて5’側にあったmiRNAを5p型,3’側にあったmiRNAを3p型と呼称するようになった3).
さらに,二本鎖RNAからガイド鎖を選択する分子機構についての理解は混迷をきわめている.二本鎖RNAからのガイド鎖の選択はランダムではなく非対称的な過程であるが,この非対称性を左右するパラメーターのひとつが二本鎖RNAの両方の末端の相対的な熱力学的な安定性である.この熱力学的安定性ルールでは,5’側の末端がより不安定なRNA鎖ほどガイド鎖として機能しやすい.熱力学的安定性ルールに寄与する分子センサーとしてショウジョウバエにおいてDcr-2とR2D2との複合体が提案されており,哺乳類ではそのカウンターパートとしてDicerとTRBP(あるいは,PACT)との複合体が提案されている.しかし,最近の研究において,ショウジョウバエのR2D2および哺乳類のDicer,TRBP,PACTはガイド鎖の選択において必須ではないことが示唆され4-7),さきに述べたmiRNAの非対称性の複雑性とあわせて,miRNAの非対称性の標準的な分子機構はいまだ明らかにされていない.この問題はmiRNAとは何かという根源的な問題と直結しており,また,現状ではRNAiを応用した核酸医薬の起点となる小分子RNAの作動機構を十分に制御できないことも意味している.
1.miRNAの非対称性の一般的な特性
そもそも,miRNAの5p型と3p型のパターンはどういう特徴をもつのだろうか? 熱力学的安定性ルールはどのくらい5p型と3p型のパターンに寄与しているのか? 一方のRNA鎖が優先的に機能するmiRNAと両方のRNA鎖が機能するmiRNAの違いは何なのか? これらはいまだ不明である.さらに,miRNAの種類によっては組織や細胞種により5p型と3p型のmiRNAの比が変わることも報告されている3).
これらの疑問を検証するため,配列が非常に似ているにもかかわらず5p型と3p型との比が大きく異なるmiRNAファミリー,miR-30ファミリーおよびmiR-181ファミリーについて,5p型と3p型のパターンを詳細に比較した.その結果,これらのmiRNAについて,5p型はつねに強力な活性をもつが,3p型は相対的な熱力学的な安定性に応じ活性が変化しており,これは,これまで提案されたどの分子機構によっても十分には説明できないものであった.つまり,5p型については5p型を優先するようななんらかのバイアスがはたらき,3p型に対してはみかけのうえ熱力学的安定性ルールが適用されていることが示唆された.Ago2はpre-miRNAを取り込みその3p型のmiRNAとなる部分を切断することが報告されており,これが5p型に対するバイアスとして機能することも考えられたが,解析の結果,この可能性は否定された.一方で,これらのmiRNAの5p型はUあるいはAではじまることから,miRNAの5’末端の塩基が5p型へのバイアスに寄与している可能性が考えられた.これは,哺乳類の多くの成熟型miRNAがUあるいはAからはじまるという傾向と合致するものであった8).
これらの結果から,miRNAの非対称性について以下のような仮説をたてた(図1).miRNAの非対称性を決定するルールは2つあり,ひとつは5’末端がUあるいはAであった場合には,GあるいはCであった場合よりガイド鎖として機能しやすいというものであり(5’塩基選択ルール),もうひとつはいわゆる熱力学的安定性ルールである.miRNAの最終的な非対称性のパターンはこの独立した2つのルールの重ね合わせにより決定されると仮説をたてた.例として,一方のRNA鎖は5’塩基選択ルールにより優先的に選択され,もう一方のRNA鎖は熱力学的安定性ルールにより優先に選択される場合を想定すると,両方のRNA鎖の機能するmiRNAの存在が説明されることになる.この仮説を検証するため,さまざまな相対的な熱力学的な安定性を示す内在性miRNAについて,5’末端をUあるいはA,または,GあるいはCとした変異体を作製し,内在性miRNAの熱力学的な安定性のダイナミックレンジおよびさまざまな5’末端の塩基のパターンを網羅した状況においてmiRNAの非対称性のパターンを解析した.結果は仮説ときわめてよく合致するものであり,これらの検討により,miRNAの非対称性の予想外の特徴,すなわち,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせが明らかにされた.これまで報告されていた5’末端の塩基の傾向や熱力学的安定性ルールは,miRNAの非対称性のもつ特徴のひとつの側面であったことになる.
2.miRNAの非対称性における分子機構を解きなおす
5’塩基選択ルールと熱力学的安定性ルールの重ね合わせという特徴は,ガイド鎖の選択におけるどのような分子機構に起因するのであろうか? Agoは二本鎖RNAの取り込みおよびガイド鎖の保持において,ガイド鎖の5’側をMIDドメインにより,3’側をPAZドメインにより保持するが,MIDドメインにおいてガイド鎖の5’末端の塩基と相互作用する5’塩基結合領域がUかAかの選択において重要であることが示唆されており8),この部分が5’塩基選択ルールを担う部分と考えられた.これまでに,DicerとTRBP(PACT)との複合体が熱力学的に安定な二本鎖RNAの末端をAgoのPAZドメインにひきわたすことが提案されており,さきに述べたように,Dicer,TRBP,PACTの非対称性における役割は必須ではないものの,PAZドメインが熱力学的安定性ルールに重要であるとし,さらに,MIDドメインとPAZドメインによる二本鎖RNAの確率論的な取り込みが起こっていると想定すると,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせが説明される.しかし,PAZドメインの欠損体あるいは変異体の解析からこの可能性は低く,また,in vitroにおけるPAZドメインと完全対称な二本鎖RNAとの結合能の解析からもこの可能性は否定された.
一方で,in vitroにおいてAgoのMIDドメインと完全対称な二本鎖RNAとの結合能を解析したところ,MIDドメインは二本鎖RNAの5’末端の塩基および熱力学的な安定性の両方を認識できることが明らかにされた.そこで,MIDドメインにおいて熱力学的な安定性を認識する領域を探索したが,近年,Agoとガイド鎖との複合体の構造解析が行われており9),二本鎖RNAの取り込みの際に重要なAgoとRNAとの結合が,Agoとガイド鎖との結合においても同様に維持されている可能性を考慮した.Agoとガイド鎖は5’末端の塩基およびガイド鎖の骨格のリン酸およびリボースと複数の相互作用を介し結合しているが,この関係性にもとづき,MIDドメインの5’リン酸結合領域がRNAの5’リン酸を引き込んで相互作用する際に,MIDドメインと5’リン酸との相互作用と二本鎖RNAの塩基のあいだの相互作用とが拮抗することにより熱力学的な安定性が認識されているのではないかという可能性が想起された.この可能性を検証するため,5’塩基結合領域および5’リン酸結合領域のAgo変異体を解析したところ,5’塩基結合領域の変異により5’塩基選択ルールが,5’リン酸結合領域の変異により熱力学的安定性ルールが,それぞれ減弱することが明らかにされた.5’塩基結合領域および5’リン酸結合領域の重要性は,Ago変異体と,両方のRNA鎖が機能するmiRNA,完全対称の二本鎖RNA,さまざまなsiRNAおよびmiRNAとの相互作用の解析,および,Agoを完全に欠損したES細胞に発現させたAgo変異体と結合するmiRNAの網羅的な解析などから支持された.
以上の結果から,5’塩基選択ルールと熱力学的安定性ルールの重ね合わせは,AgoのMIDドメインが5’塩基結合領域および5’リン酸結合領域を介して二本鎖RNAの取り込みの方向性を決定していると考えることにより説明された(図2).また,従来のモデルとは異なり,RNAiにおける中心プレーヤーであるAgoそれ自体がmiRNAの最終的な非対称性を決定することにより,miRNAの産生およびRNAiの特異性を校正していると考えられた.
3.熱力学的安定性ルールの相対性はどのように生じるのか?
これらの解析により,AgoのMIDドメインが二本鎖RNAの一方の末端の熱力学的な安定性を検出することが明らかにされたが,それでは,熱力学的安定性ルールにおける両方の末端の相対的な安定性の検出はどのような理由から観測されるのだろうか? この問題は,Agoと二本鎖RNAの相互作用について,酵素反応速度理論を適用し,RNAの認識の初期の結合エネルギーの記述に5’塩基選択ルールおよび熱力学的安定性ルールを組み込み,さらに,5p型と3p型のmiRNAが競合的に取り込まれる場合に基質と可逆的な競合阻害物質の量の比が等しくなるという過程をおくことにより説明が可能となった.結果として,5p型と3p型のmiRNAの比を推定する数理モデル,および,5p型あるいは3p型のmiRNAを取り込んだRISCの量をそれぞれ推定する数理モデルが導出された.これらの数理モデルは,次世代シークエンサーにより計測されたマウスの全miRNAの5p型と3p型のパターン,および,さきに述べたmiRNAの網羅的な機能アッセイの結果を非常によく説明することが明らかにされた.このことは,AgoのMIDドメインと二本鎖RNAの一方の末端との相互作用が一対一の関係であっても,酵素反応速度理論により熱力学的安定性ルールの相対性が担保されることを意味した.
4.miRNAの非対称性とがん
miRNAの非対称性とがんとの関係について解析した.がんにおいては,さまざまなmiRNAの発現異常がみられるが,最近の報告により,がんにおいてmiRNA遺伝子の変異がみられたり,miRNA遺伝子のSNPががんのリスクと関係したりすることが報告されている10,11).miRNA二本鎖にみられる配列の変化に注目したところ,白血病においてみられるmiR-142の変異,および,免疫反応と関係するmiR-146aのSNPが,miRNAの非対称性のモデルにより予測されたとおり,それらの非対称性を変化させることが明らかにされた.さらに,miR-146aのSNPの意義をThe Cancer Genome Atlasデータベースにおいて検討した結果,メラノーマなどにおいてmiR-146aのSNPが予後と関係すること,このSNPがmiR-146aの5p型と3p型の比,さらに,miR-146aの標的となる遺伝子の発現にも影響を及ぼすことが明らかにされた.これらの結果は,miRNA遺伝子の配列の変化はそのRNA鎖の機能を変えるだけなく非対称性のパターンも変えうること,さらに,miRNAの非対称性の変化は疾患の病態とも関係しうることを示唆した.
おわりに
この研究はmiRNAの非対称性の問題について,哺乳類におけるmiRNAの非対称性の一般的な特性,これに対応する分子機構,対応する数理モデルを含む包括的な理論的な枠組みを提示した(図2).このモデルは,miRNAの非対称性やRNAiの特異性についてこれまで蓄積されたさまざまな知見を統合しつつ,その不十分な点を補完するとともに,miRNAの非対称性についてより正確な分子機構を提示した.ガイド鎖およびパッセンジャー鎖の制御が十分にできないことはRNAiにおいてオフターゲット効果を制御できないことを意味するが,最近,RNAiに関する知見をshRNAのデザインに統合することにより,RNAiの有用性をCRISPRを用いた遺伝子発現制御に劣らないものにまでひきあげることが可能であることが示唆されている12).Precision Medicine時代においては疾患遺伝子の正確な機能解析およびこれを対象とした核酸医薬の開発が重要であり,この研究によりRNAiを応用した核酸医薬の合理的な開発および最適化が加速することが期待される.
文 献
- Suzuki, H. I. & Miyazono, K.: Emerging complexity of microRNA generation cascades. J. Biochem., 149, 15-25 (2011)[PubMed]
- Siomi, H. & Siomi, M. C.: Posttranscriptional regulation of microRNA biogenesis in animals. Mol. Cell, 38, 323-332 (2010)[PubMed]
- Chiang, H. R., Schoenfeld, L. W., Ruby, J. G. et al.: Mammalian microRNAs: experimental evaluation of novel and previously annotated genes. Genes Dev., 24, 992-1009 (2010)[PubMed]
- Nishida, K. M., Miyoshi, K., Ogino, A. et al.: Roles of R2D2, a cytoplasmic D2 body component, in the endogenous siRNA pathway in Drosophila. Mol. Cell, 49, 680-691 (2013)[PubMed]
- Betancur, J. G. & Tomari, Y.: Dicer is dispensable for asymmetric RISC loading in mammals. RNA, 18, 24-30 (2012)[PubMed]
- Kim, Y., Yeo, J., Lee, J. H. et al.: Deletion of human tarbp2 reveals cellular microRNA targets and cell-cycle function of TRBP. Cell Rep., 9, 1061-1074 (2014)[PubMed]
- Wilson, R. C., Tambe, A., Kidwell, M. A. et al.: Dicer-TRBP complex formation ensures accurate mammalian microRNA biogenesis. Mol. Cell, 57, 397-407 (2015)[PubMed]
- Frank, F., Sonenberg, N. & Nagar, B.: Structural basis for 5'-nucleotide base-specific recognition of guide RNA by human AGO2. Nature, 465, 818-822 (2010)[PubMed]
- Elkayam, E., Kuhn, C. D., Tocilj, A. et al.: The structure of human argonaute-2 in complex with miR-20a. Cell, 150, 100-110 (2012)[PubMed]
- Jazdzewski, K., Murray, E. L., Franssila, K. et al.: Common SNP in pre-miR-146a decreases mature miR expression and predisposes to papillary thyroid carcinoma. Proc. Natl. Acad. Sci. USA, 105, 7269-7274 (2008)[PubMed]
- The Cancer Genome Atlas Research Network: Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia. N. Engl. J. Med., 368, 2059-2074 (2013)[PubMed]
- Kampmann, M., Horlbeck, M. A., Chen, Y. et al.: Next-generation libraries for robust RNA interference-based genome-wide screens. Proc. Natl. Acad. Sci. USA, 112, E3384-E3391 (2015)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院医学研究科 早期修了,同年 同 特任助教を経て,2014年より米国Massachusetts Institute of Technology客員研究員.
研究テーマ:RNAバイオロジー.
抱負:Sciences for Precision Medicine.
宮園 浩平(Kohei Miyazono)
東京大学大学院医学研究科 教授.
研究室URL:http://beta-lab.umin.ac.jp/
© 2015 鈴木 洋・宮園浩平 Licensed under CC 表示 2.1 日本