低酸素の状態にある細胞の細胞系譜の追跡による成体の心臓において増殖する心筋細胞の同定
木村 航・Hesham A. Sadek
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:木村 航
DOI: 10.7875/first.author.2015.087
Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart.
Wataru Kimura, Feng Xiao, Diana C. Canseco, Shalini Muralidhar, SuWannee Thet, Helen M. Zhang, Yezan Abdulrahman, Rui Chen, Joseph A. Garcia, John M. Shelton, James A. Richardson, Abdelrahman M. Ashour, Aroumougame Asaithamby, Hanquan Liang, Chao Xing, Zhigang Lu, Cheng Cheng Zhang, Hesham A. Sadek
Nature, 523, 226-230 (2015)
近年,マウスやヒトなど成体の哺乳類の心臓において,すでに分化した心筋細胞の一部に増殖能を維持した心筋細胞が存在し,心筋のターンオーバーに寄与しているという報告がなされた.しかし,増殖能をもたない多数の心筋細胞から増殖能を維持した心筋細胞を区別し同定することは困難であった.筆者らは,この研究において,哺乳類の成体の心臓において心筋細胞のターンオーバーに寄与する心筋細胞は低酸素応答のマスター制御タンパク質として知られる転写因子Hif-1αを発現しているのではないかと考え,Hif-1αによる心筋細胞の細胞系譜の追跡により心筋細胞のターンオーバーに寄与する心筋細胞の集団を同定した.これらの心筋細胞は低酸素の状態にあり,増殖能をもつ胎仔あるいは新生仔の心筋細胞と共通した特徴をもっていた.この結果から,低酸素の状態にある心筋細胞が成体の心臓において心筋細胞のターンオーバーに寄与する新しい心筋細胞のおもな供給源となっていることが示唆され,また,低酸素の状態にある細胞の細胞系譜の追跡はさまざまな組織において細胞のターンオーバーに寄与する細胞を同定する有力なツールになる可能性が示された.
われわれ哺乳類の成体の心臓には再生能がなく,心筋梗塞などの障害によりいったん心筋が失われると,それにともない低下する心臓の機能を回復させることができない.そのおもな理由として,成体においては心臓の収縮機能を担う実体である心筋細胞はそのほとんどが細胞周期を永続的に停止しており増殖能をもたないことがあげられる.しかし近年,ヒトおよびマウスにおいて成体でもごくわずかに心筋細胞のターンオーバーの存在することが報告された1-3).マウスにおいては,成体でのわずかな心筋細胞のターンオーバーにおける新しい心筋細胞のおもな供給源は増殖能を保った少数の心筋細胞であることがわかっている2,4).しかし,増殖能をもつ心筋細胞の性質やその特異的なマーカーについては知られていないため,大多数の分裂しない心筋細胞からこれら少数の増殖能を保った心筋細胞を区別することはこれまで不可能であった.筆者らは,2014年,出生ののちの心筋細胞における急速な細胞周期の停止の原因は,胎仔期の嫌気的な解糖系からミトコンドリア好気呼吸への代謝の切り替わり,そして,それによる酸化ストレスの増加によることを報告した5)(新着論文レビュー でも掲載).また,いくつかの組織においては細胞のターンオーバーのもとになる幹細胞や前駆細胞は比較的低酸素な環境にあり,転写因子であり低酸素応答のマスター制御タンパク質として知られるHif-1αがその維持や機能において重要な役割をはたしていることが知られていた6-9).さらに,ゼブラフィッシュにおいてはHif-1αによる低酸素応答シグナルが活性化することが損傷ののちの心筋の再生に必要であること10),低酸素な環境および低酸素シグナルは胎仔および新生仔において心筋細胞の増殖を促進することが5,11),最近,つぎつぎと明らかにされた.筆者らは,これらの事実から,成体の心筋において増殖能を保った心筋細胞は,周囲の心筋細胞と比較して比較的低酸素な微小環境にあり,出生ののち上昇する酸化ストレスから守られているのではないかと考えた.この可能性を検討するため,Hif-1αを発現する心筋細胞をCre-loxP系を用いて不可逆的に標識することにより,低酸素の状態にある心筋細胞の細胞系譜の追跡を試みることにした.
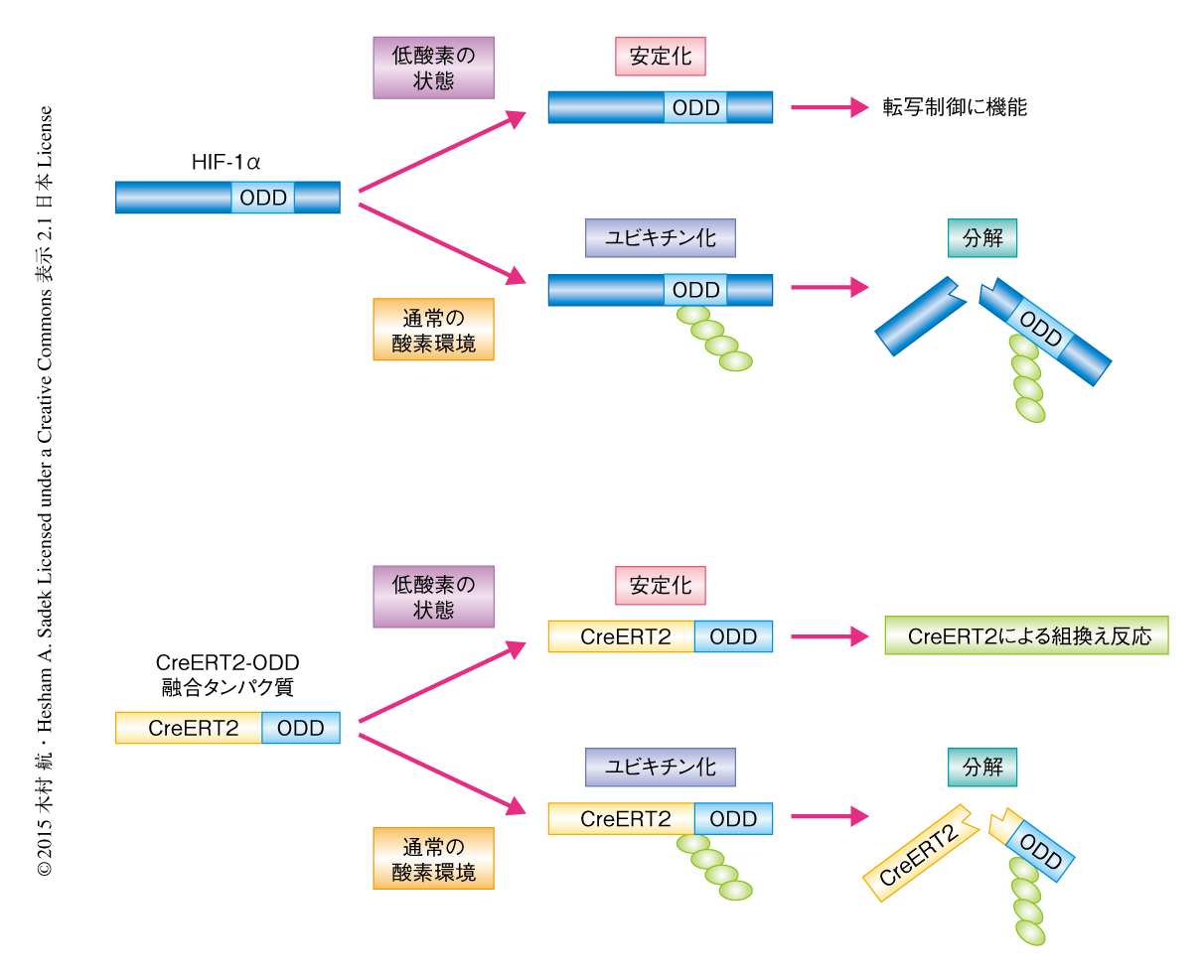
Hif-1αはおもに細胞の酸素濃度に応じてタンパク質分解をうけることにより制御されている.通常の酸素濃度ではHif-1αのODDドメインに存在するPro402およびPro564がプロリルヒドロキシラーゼにより細胞の酸素を基質としてヒドロキシル化され,つづいて,このヒドロキシProがユビキチンリガーゼであるVHLにより認識されてユビキチン化されて,ユビキチン-プロテアソーム系によりタンパク質分解をうける.一方,低酸素な環境においてはODDドメインのPro402およびPro564はヒドロキシル化されず,Hif-1αは安定化される(図1).そこで,Hif-1αのODDドメインとタモキシフェンに依存的に活性化するリコンビナーゼCreERT2との融合タンパク質を普遍的な遺伝子プロモーターであるCAGプロモーターの制御のもとで発現するトランスジェニックマウスを作製し,このトランスジェニックマウスをCreに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスと交配した.このマウスにおいて,tdTomatoの発現の活性化が低酸素に依存的に起こるかどうかを検討するため,タモキシフェンを投与してから2日のちに低酸素のマーカーであるピモニダゾールを投与したところ,tdTomato陽性を示す心筋細胞の約半数がピモニダゾール陽性であった.また,このマウスを断続的な低酸素の状態においたところ,tdTomato陽性細胞の数は増加した.さらに,免疫染色によりHif-1αとCreが同一の細胞に局在していることが確認された.
タモキシフェンを投与してから1週間のちに,このトランスジェニックマウスにおけるtdTomato陽性の心筋細胞の性質について検討した.tdTomato陽性の心筋細胞はtdTomato陰性の心筋細胞と比較して,その周囲をとりかこむ毛細血管の数が少ない傾向にあった.さらに,tdTomato陽性の心筋細胞はDNAの酸化損傷の程度が低く,細胞の大きさが有意に小さく,約半数は単核であることが判明した.このtdTomato陽性の心筋細胞が新たな心筋細胞の形成に寄与しているかどうかを検討した.タモキシフェンを投与してから1週間のちにはわずかな数の心筋細胞を含む細胞がtdTomatoにより標識され,それらの細胞と幹細胞のマーカーであるc-KitやSca-1に陽性を示す細胞との重なりは観察されなかった.また,血管内皮細胞,平滑筋細胞,線維芽細胞といった心筋細胞のほかの細胞においてもtdTomatoシグナルが認められた.さらに,タモキシフェンを投与してから4週間のちの心室および心房において,tdTomato陽性の心筋細胞の有意な増加がみられた.この増加率から計算されたtdTomato陽性の心筋細胞のターンオーバー率は年あたり約1%であり,これは以前の報告における心筋細胞のターンオーバー率とよく一致した.また,約40%のtdTomato陽性の心筋細胞は互いにとなりあうようクラスターを形成しており,このことから,tdTomato陽性の心筋細胞はクローナルに増殖している可能性が示唆された.さらに,このtdTomato陽性の心筋細胞の増加は心筋細胞の分裂によるものか,あるいは,低酸素の状態にある心筋細胞以外の細胞と心筋細胞との細胞融合によるものなのかを区別するため,ダブルカラーレポーターマウスとこのトランスジェニックマウスとを交配し細胞系譜を追跡した.その結果,tdTomato陽性かつEGFP陰性である細胞融合によらない心筋細胞の数がタモキシフェンを投与してから1カ月のちに有意に増加していたのに対し,tdTomato陽性かつEGFP陽性である細胞融合を示唆する心筋細胞の数は有意な増加を示しておらず,tdTomato陽性細胞の増加は心筋細胞の増殖によるものであることが示唆された.
このトランスジェニックマウスに用いたCAGプロモーターは普遍的な遺伝子プロモーターであることから,観察されたtdTomato陽性の心筋細胞は心筋細胞以外の細胞から分化したものである可能性は否定できなかった.そこで,新たに心筋細胞に特異的なプロモーターであるαMHCプロモーターの制御のもとでCreERT2-ODD融合タンパク質を発現するトランスジェニックマウスを作製し,さきと同じく,このトランスジェニックマウスをCreに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスと交配した.このマウスにおいても同様に,タモキシフェンを投与してから1週間のちにごく少数の心筋細胞がtdTomato陽性を示すことが確認された.心筋細胞以外にはtdTomato陽性を示す細胞はまったく検出されなかった.低酸素な環境におけるHif-1αの安定化の指標のひとつであるHif-1αのPro402のヒドロキシル化は,tdTomato陽性細胞において有意に低かった.さらに,tdTomato陽性の心筋細胞は,周囲をとりかこむ毛細血管の数が少ない,DNAの酸化損傷の程度が低い,細胞の大きさが小さい,単核である割合が高い,といった特徴をすべてもっていた.また,免疫染色により心筋細胞のみにCreの局在が観察され,それらがHif1α陽性であることが確認された.
このマウスを用いてタモキシフェンの投与ののち細胞系譜を追跡した.その結果,タモキシフェンを投与してから1カ月を経過した時点では,1週間を経過した時点と比較してtdTomato陽性の心筋細胞が増加しており,投与から2カ月を経過した時点ではさらなる増加が観察された.心筋細胞のターンオーバー率は年あたり約0.6%であった.また同様に,約40%のtdTomato陽性の心筋細胞はクラスターを形成しており,クローナルな増殖が示唆された.さらに,tdTomato陽性の心筋細胞はtdTomato陰性の心筋細胞と比較し約10倍の頻度でKi67陽性およびBrdUの取り込みを示した.さらに,心筋細胞のターンオーバーを加速させることが知られている冠動脈の結紮による急性心筋梗塞の誘導により,tdTomato陽性の心筋細胞のターンオーバーは加速した.
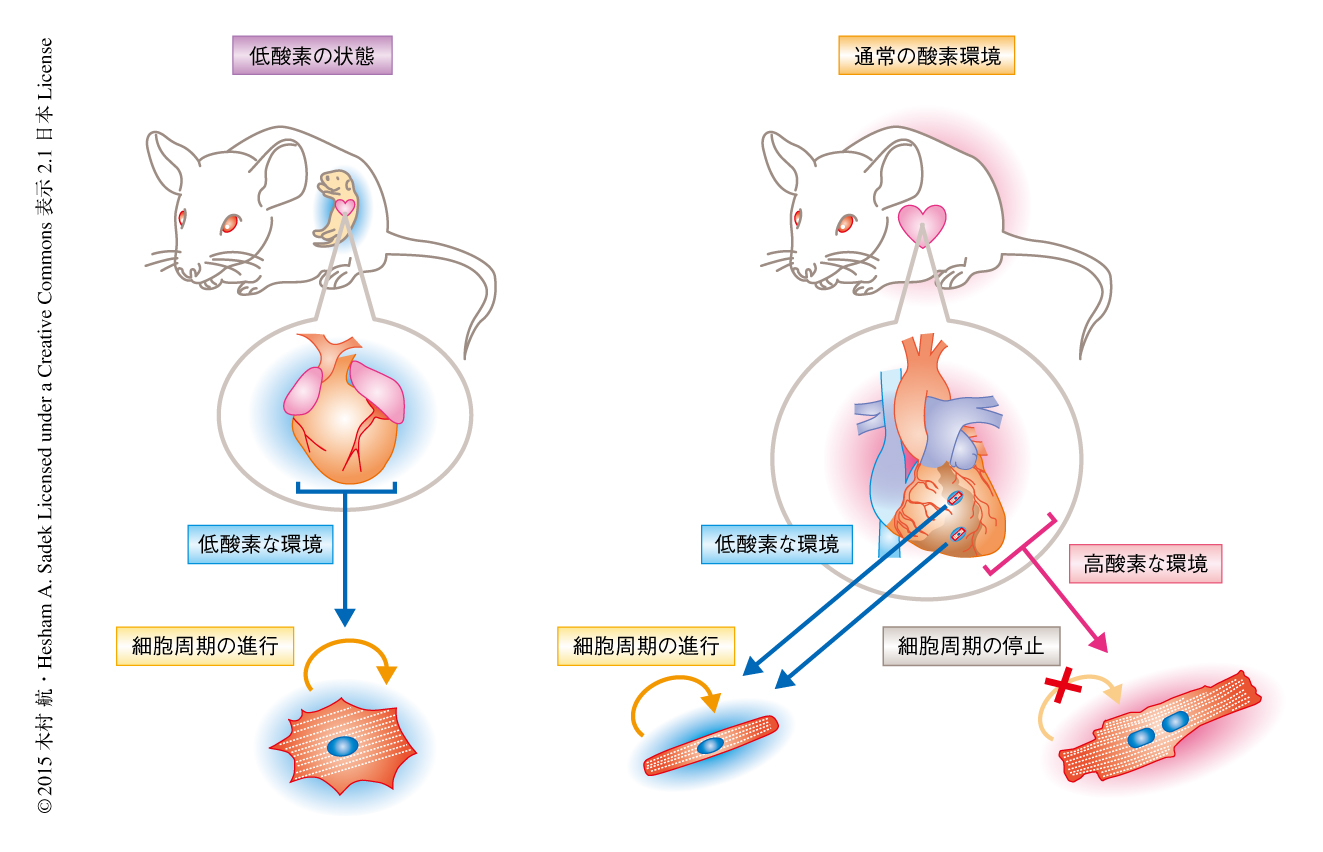
低酸素の状態にある心筋細胞の性質を分子レベルで追求するため,固定していない心臓の凍結切片からtdTomato陽性の心筋細胞をレーザーマイクロダイセクション法により単離し,その遺伝子発現をRNAシークエンシングによりtdTomato陰性の心筋細胞と比較した.その結果,tdTomato陽性の心筋細胞においてプロリルヒドロキシラーゼをコードする遺伝子を含むHif-1αの抑制にかかわる複数の遺伝子の発現の低下とともに,Hif-1αの下流の遺伝子の発現の上昇,さらには,Hif-1α遺伝子およびHif-1β遺伝子の発現の上昇が確認された.これらの結果は,低酸素の状態にある心筋細胞においてHif-1αが活性化されていることとともに,環境の酸素濃度とは独立して低酸素シグナルの活性化を保つなんらかの内在的な機構の存在を示唆した.さらに,心筋細胞の細胞周期の停止にかかわる転写因子Meis1およびそのホモログであるMeis2およびMeis3をコードする遺伝子の発現の低下とともに,サイクリン依存性キナーゼをコードする遺伝子など細胞周期の進行に必要な遺伝子の発現の上昇,また逆に,心筋の肥大にかかわる遺伝子の発現の低下など,低酸素の状態にある心筋細胞における低酸素応答シグナルの活性化,増殖能の維持といった性質の多くを支持する結果が得られた(図2).
心筋の再生は心疾患の治療における究極の目標のひとつである.これまで,多能性幹細胞,組織幹細胞,ダイレクトリプログラミング,細胞シートなどを用いた治療がくふうされ,それぞれ成果をあげているとはいえ,現状では心臓の完全な再生をなしとげる方法は発見されていない.今回,筆者らは,成体において増殖する心筋細胞を同定したが,この発見を心疾患の新しい治療法の開発に結びつけるためには,この心筋細胞の集団を増幅させる薬剤や分子の探索が必要になるだろう.また,マウスとは寿命が大幅に異なるヒトにおいても,成体において同じ心筋細胞の集団が存在するかどうか検討しなければならないだろう.これが今後の研究課題の主要な方向であることはまちがいないが,筆者は,心筋細胞のターンオーバーとは別のコンテクストにおいて,低酸素な環境や低酸素応答シグナルの役割についておもしろい研究をする余地がまだまだ残されていると感じている.低酸素の状態にある細胞の細胞系譜の追跡は,心臓にかぎらずさまざまな組織における細胞のターンオーバーの機構を追求するうえで有用なツールとなるだろう.
略歴:2007年 東京都立大学大学院理学研究科博士課程 修了,同年 浜松医科大学 特任研究員,2012年 米国Texas大学Southwestern Medical CenterにてVisiting Senior Fellow,2014年 同Assistant Instructorを経て,2015年より筑波大学生命領域学際研究センター 国際テニュアトラック助教.
研究テーマ:心臓の再生.
抱負:個別の器官にかぎらず,再生の一般の機構や原理を明らかにしていきたい.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2015 木村 航・Hesham A. Sadek Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:木村 航
DOI: 10.7875/first.author.2015.087
Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart.
Wataru Kimura, Feng Xiao, Diana C. Canseco, Shalini Muralidhar, SuWannee Thet, Helen M. Zhang, Yezan Abdulrahman, Rui Chen, Joseph A. Garcia, John M. Shelton, James A. Richardson, Abdelrahman M. Ashour, Aroumougame Asaithamby, Hanquan Liang, Chao Xing, Zhigang Lu, Cheng Cheng Zhang, Hesham A. Sadek
Nature, 523, 226-230 (2015)
要 約
近年,マウスやヒトなど成体の哺乳類の心臓において,すでに分化した心筋細胞の一部に増殖能を維持した心筋細胞が存在し,心筋のターンオーバーに寄与しているという報告がなされた.しかし,増殖能をもたない多数の心筋細胞から増殖能を維持した心筋細胞を区別し同定することは困難であった.筆者らは,この研究において,哺乳類の成体の心臓において心筋細胞のターンオーバーに寄与する心筋細胞は低酸素応答のマスター制御タンパク質として知られる転写因子Hif-1αを発現しているのではないかと考え,Hif-1αによる心筋細胞の細胞系譜の追跡により心筋細胞のターンオーバーに寄与する心筋細胞の集団を同定した.これらの心筋細胞は低酸素の状態にあり,増殖能をもつ胎仔あるいは新生仔の心筋細胞と共通した特徴をもっていた.この結果から,低酸素の状態にある心筋細胞が成体の心臓において心筋細胞のターンオーバーに寄与する新しい心筋細胞のおもな供給源となっていることが示唆され,また,低酸素の状態にある細胞の細胞系譜の追跡はさまざまな組織において細胞のターンオーバーに寄与する細胞を同定する有力なツールになる可能性が示された.
はじめに
われわれ哺乳類の成体の心臓には再生能がなく,心筋梗塞などの障害によりいったん心筋が失われると,それにともない低下する心臓の機能を回復させることができない.そのおもな理由として,成体においては心臓の収縮機能を担う実体である心筋細胞はそのほとんどが細胞周期を永続的に停止しており増殖能をもたないことがあげられる.しかし近年,ヒトおよびマウスにおいて成体でもごくわずかに心筋細胞のターンオーバーの存在することが報告された1-3).マウスにおいては,成体でのわずかな心筋細胞のターンオーバーにおける新しい心筋細胞のおもな供給源は増殖能を保った少数の心筋細胞であることがわかっている2,4).しかし,増殖能をもつ心筋細胞の性質やその特異的なマーカーについては知られていないため,大多数の分裂しない心筋細胞からこれら少数の増殖能を保った心筋細胞を区別することはこれまで不可能であった.筆者らは,2014年,出生ののちの心筋細胞における急速な細胞周期の停止の原因は,胎仔期の嫌気的な解糖系からミトコンドリア好気呼吸への代謝の切り替わり,そして,それによる酸化ストレスの増加によることを報告した5)(新着論文レビュー でも掲載).また,いくつかの組織においては細胞のターンオーバーのもとになる幹細胞や前駆細胞は比較的低酸素な環境にあり,転写因子であり低酸素応答のマスター制御タンパク質として知られるHif-1αがその維持や機能において重要な役割をはたしていることが知られていた6-9).さらに,ゼブラフィッシュにおいてはHif-1αによる低酸素応答シグナルが活性化することが損傷ののちの心筋の再生に必要であること10),低酸素な環境および低酸素シグナルは胎仔および新生仔において心筋細胞の増殖を促進することが5,11),最近,つぎつぎと明らかにされた.筆者らは,これらの事実から,成体の心筋において増殖能を保った心筋細胞は,周囲の心筋細胞と比較して比較的低酸素な微小環境にあり,出生ののち上昇する酸化ストレスから守られているのではないかと考えた.この可能性を検討するため,Hif-1αを発現する心筋細胞をCre-loxP系を用いて不可逆的に標識することにより,低酸素の状態にある心筋細胞の細胞系譜の追跡を試みることにした.
1.Hif-1αに依存的なタンパク質分解による低酸素の状態にある細胞の細胞系譜の追跡
Hif-1αはおもに細胞の酸素濃度に応じてタンパク質分解をうけることにより制御されている.通常の酸素濃度ではHif-1αのODDドメインに存在するPro402およびPro564がプロリルヒドロキシラーゼにより細胞の酸素を基質としてヒドロキシル化され,つづいて,このヒドロキシProがユビキチンリガーゼであるVHLにより認識されてユビキチン化されて,ユビキチン-プロテアソーム系によりタンパク質分解をうける.一方,低酸素な環境においてはODDドメインのPro402およびPro564はヒドロキシル化されず,Hif-1αは安定化される(図1).そこで,Hif-1αのODDドメインとタモキシフェンに依存的に活性化するリコンビナーゼCreERT2との融合タンパク質を普遍的な遺伝子プロモーターであるCAGプロモーターの制御のもとで発現するトランスジェニックマウスを作製し,このトランスジェニックマウスをCreに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスと交配した.このマウスにおいて,tdTomatoの発現の活性化が低酸素に依存的に起こるかどうかを検討するため,タモキシフェンを投与してから2日のちに低酸素のマーカーであるピモニダゾールを投与したところ,tdTomato陽性を示す心筋細胞の約半数がピモニダゾール陽性であった.また,このマウスを断続的な低酸素の状態においたところ,tdTomato陽性細胞の数は増加した.さらに,免疫染色によりHif-1αとCreが同一の細胞に局在していることが確認された.
2.低酸素の状態にある細胞は成体の心臓において心筋細胞のターンオーバーに寄与する
タモキシフェンを投与してから1週間のちに,このトランスジェニックマウスにおけるtdTomato陽性の心筋細胞の性質について検討した.tdTomato陽性の心筋細胞はtdTomato陰性の心筋細胞と比較して,その周囲をとりかこむ毛細血管の数が少ない傾向にあった.さらに,tdTomato陽性の心筋細胞はDNAの酸化損傷の程度が低く,細胞の大きさが有意に小さく,約半数は単核であることが判明した.このtdTomato陽性の心筋細胞が新たな心筋細胞の形成に寄与しているかどうかを検討した.タモキシフェンを投与してから1週間のちにはわずかな数の心筋細胞を含む細胞がtdTomatoにより標識され,それらの細胞と幹細胞のマーカーであるc-KitやSca-1に陽性を示す細胞との重なりは観察されなかった.また,血管内皮細胞,平滑筋細胞,線維芽細胞といった心筋細胞のほかの細胞においてもtdTomatoシグナルが認められた.さらに,タモキシフェンを投与してから4週間のちの心室および心房において,tdTomato陽性の心筋細胞の有意な増加がみられた.この増加率から計算されたtdTomato陽性の心筋細胞のターンオーバー率は年あたり約1%であり,これは以前の報告における心筋細胞のターンオーバー率とよく一致した.また,約40%のtdTomato陽性の心筋細胞は互いにとなりあうようクラスターを形成しており,このことから,tdTomato陽性の心筋細胞はクローナルに増殖している可能性が示唆された.さらに,このtdTomato陽性の心筋細胞の増加は心筋細胞の分裂によるものか,あるいは,低酸素の状態にある心筋細胞以外の細胞と心筋細胞との細胞融合によるものなのかを区別するため,ダブルカラーレポーターマウスとこのトランスジェニックマウスとを交配し細胞系譜を追跡した.その結果,tdTomato陽性かつEGFP陰性である細胞融合によらない心筋細胞の数がタモキシフェンを投与してから1カ月のちに有意に増加していたのに対し,tdTomato陽性かつEGFP陽性である細胞融合を示唆する心筋細胞の数は有意な増加を示しておらず,tdTomato陽性細胞の増加は心筋細胞の増殖によるものであることが示唆された.
3.低酸素の状態にある心筋細胞は成体の心臓において心筋細胞のターンオーバーに寄与する
このトランスジェニックマウスに用いたCAGプロモーターは普遍的な遺伝子プロモーターであることから,観察されたtdTomato陽性の心筋細胞は心筋細胞以外の細胞から分化したものである可能性は否定できなかった.そこで,新たに心筋細胞に特異的なプロモーターであるαMHCプロモーターの制御のもとでCreERT2-ODD融合タンパク質を発現するトランスジェニックマウスを作製し,さきと同じく,このトランスジェニックマウスをCreに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスと交配した.このマウスにおいても同様に,タモキシフェンを投与してから1週間のちにごく少数の心筋細胞がtdTomato陽性を示すことが確認された.心筋細胞以外にはtdTomato陽性を示す細胞はまったく検出されなかった.低酸素な環境におけるHif-1αの安定化の指標のひとつであるHif-1αのPro402のヒドロキシル化は,tdTomato陽性細胞において有意に低かった.さらに,tdTomato陽性の心筋細胞は,周囲をとりかこむ毛細血管の数が少ない,DNAの酸化損傷の程度が低い,細胞の大きさが小さい,単核である割合が高い,といった特徴をすべてもっていた.また,免疫染色により心筋細胞のみにCreの局在が観察され,それらがHif1α陽性であることが確認された.
このマウスを用いてタモキシフェンの投与ののち細胞系譜を追跡した.その結果,タモキシフェンを投与してから1カ月を経過した時点では,1週間を経過した時点と比較してtdTomato陽性の心筋細胞が増加しており,投与から2カ月を経過した時点ではさらなる増加が観察された.心筋細胞のターンオーバー率は年あたり約0.6%であった.また同様に,約40%のtdTomato陽性の心筋細胞はクラスターを形成しており,クローナルな増殖が示唆された.さらに,tdTomato陽性の心筋細胞はtdTomato陰性の心筋細胞と比較し約10倍の頻度でKi67陽性およびBrdUの取り込みを示した.さらに,心筋細胞のターンオーバーを加速させることが知られている冠動脈の結紮による急性心筋梗塞の誘導により,tdTomato陽性の心筋細胞のターンオーバーは加速した.
低酸素の状態にある心筋細胞の性質を分子レベルで追求するため,固定していない心臓の凍結切片からtdTomato陽性の心筋細胞をレーザーマイクロダイセクション法により単離し,その遺伝子発現をRNAシークエンシングによりtdTomato陰性の心筋細胞と比較した.その結果,tdTomato陽性の心筋細胞においてプロリルヒドロキシラーゼをコードする遺伝子を含むHif-1αの抑制にかかわる複数の遺伝子の発現の低下とともに,Hif-1αの下流の遺伝子の発現の上昇,さらには,Hif-1α遺伝子およびHif-1β遺伝子の発現の上昇が確認された.これらの結果は,低酸素の状態にある心筋細胞においてHif-1αが活性化されていることとともに,環境の酸素濃度とは独立して低酸素シグナルの活性化を保つなんらかの内在的な機構の存在を示唆した.さらに,心筋細胞の細胞周期の停止にかかわる転写因子Meis1およびそのホモログであるMeis2およびMeis3をコードする遺伝子の発現の低下とともに,サイクリン依存性キナーゼをコードする遺伝子など細胞周期の進行に必要な遺伝子の発現の上昇,また逆に,心筋の肥大にかかわる遺伝子の発現の低下など,低酸素の状態にある心筋細胞における低酸素応答シグナルの活性化,増殖能の維持といった性質の多くを支持する結果が得られた(図2).
おわりに
心筋の再生は心疾患の治療における究極の目標のひとつである.これまで,多能性幹細胞,組織幹細胞,ダイレクトリプログラミング,細胞シートなどを用いた治療がくふうされ,それぞれ成果をあげているとはいえ,現状では心臓の完全な再生をなしとげる方法は発見されていない.今回,筆者らは,成体において増殖する心筋細胞を同定したが,この発見を心疾患の新しい治療法の開発に結びつけるためには,この心筋細胞の集団を増幅させる薬剤や分子の探索が必要になるだろう.また,マウスとは寿命が大幅に異なるヒトにおいても,成体において同じ心筋細胞の集団が存在するかどうか検討しなければならないだろう.これが今後の研究課題の主要な方向であることはまちがいないが,筆者は,心筋細胞のターンオーバーとは別のコンテクストにおいて,低酸素な環境や低酸素応答シグナルの役割についておもしろい研究をする余地がまだまだ残されていると感じている.低酸素の状態にある細胞の細胞系譜の追跡は,心臓にかぎらずさまざまな組織における細胞のターンオーバーの機構を追求するうえで有用なツールとなるだろう.
文 献
- Bergmann, O., Bhardwaj, R. D., Bernard, S. et al.: Evidence for cardiomyocyte renewal in humans. Science, 324, 98-102 (2009)[PubMed]
- Senyo, S. E., Steinhauser, M. L., Pizzimenti, C. L. et al.: Mammalian heart renewal by pre-existing cardiomyocytes. Nature, 493, 433-436 (2013)[PubMed]
- Bergmann, O., Zdunek, S., Felker, A. et al.: Dynamics of cell generation and turnover in the human heart. Cell, 161, 1566-1575 (2015)[PubMed]
- Bersell, K., Arab, S., Haring, B. et al.: Neuregulin1/ErbB4 signaling induces cardiomyocyte proliferation and repair of heart injury. Cell, 138, 257-270 (2009)[PubMed]
- Puente, B. N. Kimura, W., Muralidhar, S. A. et al.: The oxygen-rich postnatal environment induces cardiomyocyte cell-cycle arrest through DNA damage response. Cell, 157, 565-579 (2014)[PubMed] [新着論文レビュー]
- Parmar, K., Mauch, P., Vergilio, J. A. et al.: Distribution of hematopoietic stem cells in the bone marrow according to regional hypoxia. Proc. Natl. Acad. Sci. USA, 104, 5431-5436 (2007)[PubMed]
- Mazumdar, J., O'Brien, W. T., Johnson, R. S. et al.: O2 regulates stem cells through Wnt/β-catenin signalling. Nature Cell Biol., 12, 1007-1013 (2010)[PubMed]
- Takubo, K. Goda, N., Yamada, W. et al.: Regulation of the HIF-1α level is essential for hematopoietic stem cells. Cell Stem Cell, 7, 391-402 (2010)[PubMed] [新着論文レビュー]
- Spencer, J. A., Ferraro, F., Roussakis, E. et al.: Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature, 508, 269-273 (2014)[PubMed]
- Jopling, C., Sleep, E., Raya, M. et al.: Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature, 464, 606-609 (2010)[PubMed]
- Guimaraes-Camboa, N., Stowe, J., Aneas, I. et al.: HIF1α represses cell stress pathways to allow proliferation of hypoxic fetal cardiomyocytes. Dev. Cell, 33, 507-521 (2015)[PubMed]
著者プロフィール
略歴:2007年 東京都立大学大学院理学研究科博士課程 修了,同年 浜松医科大学 特任研究員,2012年 米国Texas大学Southwestern Medical CenterにてVisiting Senior Fellow,2014年 同Assistant Instructorを経て,2015年より筑波大学生命領域学際研究センター 国際テニュアトラック助教.
研究テーマ:心臓の再生.
抱負:個別の器官にかぎらず,再生の一般の機構や原理を明らかにしていきたい.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2015 木村 航・Hesham A. Sadek Licensed under CC 表示 2.1 日本