グルコースの取り込みと転写因子RUNX2が骨芽細胞の分化と骨形成との協調においてはたす役割
島津絢子・Jianwen Wei・Gerard Karsenty
(米国Columbia大学College of Physicians and Surgeons,Department of Genetics and Development)
email:島津絢子
DOI: 10.7875/first.author.2015.085
Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation.
Jianwen Wei, Junko Shimazu, Munevver P. Makinistoglu, Antonio Maurizi, Daisuke Kajimura, Haihong Zong, Takeshi Takarada, Takashi Iezaki, Jeffrey E. Pessin, Eiichi Hinoi, Gerard Karsenty
Cell, 161, 1576-1591 (2015)
骨芽細胞はその分化に必須の転写因子であるRUNX2の発現よりまえに,骨形成に必要なおもなタンパク質を合成している.このため,骨芽細胞の分化と骨形成のあいだに明確なつながりはないようにみえ,骨芽細胞の分化と骨形成とがどのように協調して維持されているのかは明らかにされていなかった.筆者らは,骨と糖代謝との関係性に着目し,骨芽細胞はおもなエネルギー源をグルコース輸送体GLUT1により取り込まれるグルコースに依存しており,グルコースの取り込みがAMPキナーゼを介し骨芽細胞の分化および骨形成を促進していることをつきとめた.また,RUNX2がGLUT1の発現を促進することを発見し,このRUNX2とGlut1遺伝子とのフィードフォワード制御が骨芽細胞の分化および骨形成を生涯にわたり統合し協調させていることを明らかにした.この研究により,骨芽細胞におけるエネルギー代謝のバランスが骨芽細胞の分化と機能を統合していることが見い出されたとともに,骨と糖代謝とのクロストークの重要性が示された.
骨芽細胞は骨形成を行う細胞であり,RUNX2は骨芽細胞の分化に必須の転写因子である1).事実,RUNX2ノックアウトマウスは骨芽細胞が分化しないため骨形成がみられない2).他方,in vitroでの実験においてRUNX2はI型コラーゲンの遺伝子のプロモーターに結合しその発現を促進するとの報告がなされたものの3),in vivoでの実験においては,I型コラーゲンはRUNX2の発現よりもまえに産生されることがわかっていた.骨芽細胞は骨基質のおもな成分であるI型コラーゲンを産生する細胞であり,I型コラーゲンは骨芽細胞による骨形成を示すマーカーであることをふまえると,この結果は骨芽細胞の分化と骨形成とのあいだに明確なつながりはないことを示すようにみえる.これを前提とした場合,骨芽細胞の分化に必須の転写因子RUNX2は骨形成を直接に制御しているのか,そうでない場合には,どのように骨形成が制御され骨芽細胞の分化と協調しているのかという疑問が生じる.また,骨芽細胞は骨形成を行う細胞であると同時に,オステオカルシンというホルモンを分泌する内分泌細胞であり,オステオカルシンは糖代謝を制御することが知られている4).しかしながら,なぜ骨が糖代謝を制御しなければならないのかについては解明されていない.筆者らは,骨と糖代謝とのクロストークに着目し,骨芽細胞の高いエネルギー要求性について解明することにより,骨芽細胞の分化と骨形成とがどのように協調し生涯にわたり維持されているのかという疑問に答えられないかと考えた.
骨芽細胞のおもなエネルギー源を特定するため,骨芽細胞における酸素摂取速度の測定,マウスを使った高インスリン正常血糖クランプ法,細胞培養を用いた実験を行った.その結果,骨芽細胞はグルコース輸送体であるGLUT1を介しグルコースをおもなエネルギー源として取り込むことがわかった.
マウスの後肢を用いて発生段階におけるGlut1遺伝子の発現のタイミングおよび発現部位について調べた.これと並行して,骨芽細胞のマーカーとしてRunx2遺伝子を,また,間葉細胞のマーカーとしてI型コラーゲン遺伝子の発現について調べた.その結果,Runx2遺伝子の発現がみられるまえの胎生10.5日目において,Glut1遺伝子およびI型コラーゲン遺伝子とともに,Runx遺伝子ファミリーに属するRunx1遺伝子が発現していた.Runx2遺伝子の発現は胎生12.5日目よりのちにみられた.
GLUT1が骨芽細胞にあたえる影響について調べるため,発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスを作製し解析した.その結果,胎生18.5日目にRunx2遺伝子のハプロ不全によりひき起こされる鎖骨頭蓋骨異形成症5) の兆候がみられ,骨芽細胞の分化の遅れにより鎖骨が短くなり頭蓋骨の大泉門の閉鎖の不全がみられた.一方,Runx2遺伝子およびI型コラーゲン遺伝子の発現には異常はみられなかったが,それらのタンパク質は大きく減少していた.これらの結果から,発生段階におけるGLUT1を介したグルコースの取り込みが骨芽細胞の分化に必要であることがわかった.
胎生18.5日目よりのちの骨芽細胞に特異的なGLUT1ノックアウトマウスを用い出生ののちのGLUT1の役割について調べたところ,骨量および骨形成を示すパラメーターが低下していた.出生ののちにもRunx2遺伝子およびI型コラーゲン遺伝子の発現に異常はみられなかったが,それらのタンパク質はいちじるしく減少していた.さらに,RUNX2の減少によりその標的であるオステオカルシンの発現が抑制され,その結果,オステオカルシンの血中濃度が低下していた.オステオカルシンは全身の糖代謝を制御することが知られているが4,6),このマウスでは耐糖性およびインスリン感受性が一貫して抑制されていた.これらのことから,骨芽細胞におけるGLUT1によるグルコースの取り込みは出生ののちの骨形成および全身の糖代謝にも必要であることがわかった.
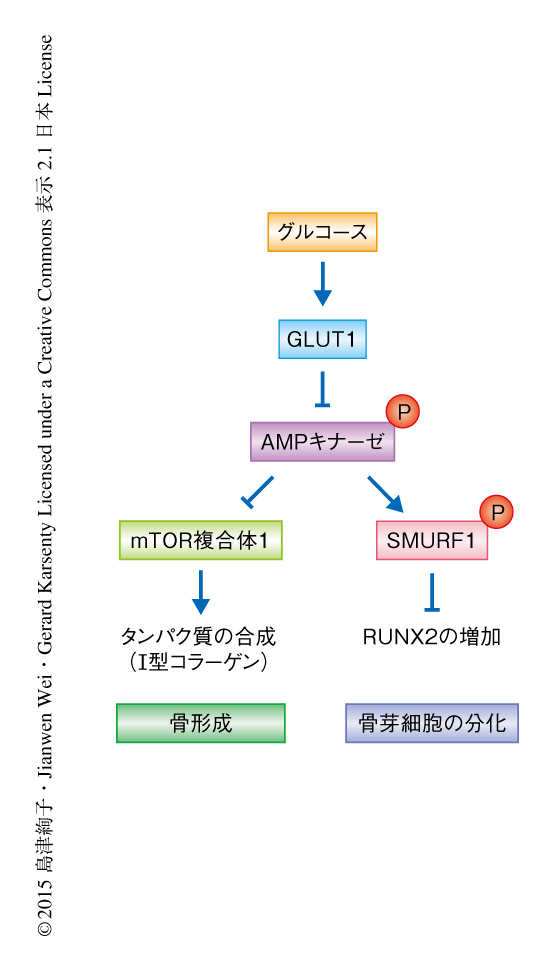
実験により,グルコースの取り込みの不足により,骨芽細胞に特異的なGLUT1ノックアウトマウスにおいて細胞におけるエネルギーセンサーとして知られるAMPキナーゼ7) が活性化されていること,また,mTOR複合体1の活性が抑制されていることがわかった.また,骨芽細胞に特異的なGLUT1ノックアウトマウスにおいてmTOR複合体1の負の制御タンパク質をノックアウトすることによりmTOR複合体1を活性化したところ,I型コラーゲンも正常に存在したがRUNX2は減少していた(図1a).そこで,mTOR複合体1の活性の低下および発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスにみられた表現型がAMPキナーゼの活性化によるものかどうか調べるため,GLUT1ノックアウトマウスにおいて骨芽細胞に特異的にAMPキナーゼα1をコードする遺伝子をヘテロで欠損させたマウスを作製した.このマウスの骨芽細胞においてAMPキナーゼおよびmTOR複合体1は活性化されRUNX2およびI型コラーゲンも正常に存在した.また,発生段階における骨芽細胞の分化の遅れが改善されるとともに,鎖骨頭蓋骨異形成症の症状はみられず,出生ののちの骨形成のパラメーターも改善された.これらの結果から,グルコースの取り込みがAMPキナーゼを介しRUNX2およびI型コラーゲンの量を制御することにより骨芽細胞の分化および骨形成を制御していることがわかった.
AMPキナーゼはユビキチンリガーゼであるSMURF1を直接にリン酸化すること,このSMURF1のリン酸化はRUNX2のユビキチン化に必須であることが見い出された(図1b).AMPキナーゼによるRUNX2の量の制御機構が明らかにされたため,グルコースの取り込みが十分でない状況においてもRUNX2により骨芽細胞の分化は促進されるかどうかを調べるため,GLUT1ノックアウトマウスにおいてSMURF1をコードする遺伝子をヘテロで欠損させたマウスを作製した.このマウスにおいてRUNX2は正常に存在したが,mTOR複合体1は活性化せずI型コラーゲンは減少していた.他方,RUNX2は正常に存在したにもかかわらず,発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスと同じように骨の形成に遅延がみられた.これらの実験から,GLUT1によるグルコースの取り込みが阻害されタンパク質の合成が抑制されている場合には,RUNX2のみでは骨芽細胞の分化を促進するのに十分ではないことが明らかにされた.
これらの実験により,GLUT1によるグルコースの取り込みはAMPキナーゼによるSMURF1の活性化を制御することにより,RUNX2の量,すなわち,骨芽細胞の分化を制御するとともに,これとは別の機構として,AMPキナーゼによるmTOR複合体1の制御によりI型コラーゲンの産生を制御することで骨形成を制御していることがわかった(図1).このことをin vivoにおいて証明するため,骨芽細胞の分化が十分でないRUNX2ヘテロノックアウトマウスにおいて慢性的な高血糖をひき起こすことにより骨形成が促進されるかどうか調べた.具体的には,妊娠中の母親マウスを薬理的に高血糖にすることにより,胎仔マウスに慢性的な高血糖をひき起こした.その結果,鎖骨頭蓋骨異形成症の症状を示すRUNX2ヘテロノックアウトマウスの胎仔は,慢性的な高血糖のもとでは鎖骨の短縮および大泉門の閉鎖不全の表現型が改善され,I型コラーゲンも正常に存在した.これらの実験から,骨芽細胞の分化が十分でない状況においても,グルコースの濃度を上昇させることによりI型コラーゲンの産生および骨形成は促進されることがわかった.
これらの実験の結果から,GLUT1による骨芽細胞の分化および骨形成のおのおのの制御機構が明らかにされたが,これらの結果は,骨芽細胞の分化と骨形成はどのように統合され協調しているのかという疑問には答えていなかった.そこで,RUNX2ノックアウトマウスの骨芽細胞においてはGLUT1の発現およびグルコースの取り込みの低いことに着目し,RUNX2ヘテロノックアウトマウスにおいても同様の現象がみられることが見い出された.また,Runx遺伝子ファミリーにコードされるRUNX2およびRUNX1がGlut1遺伝子のプロモーターの活動を促進することが明らかにされた.
Glut1遺伝子とRUNX2とのフィードフォワード制御が骨芽細胞の分化および骨形成を統合するのであれば,GLUT1とRUNX2のダブルヘテロノックアウトマウスはRUNX2ノックアウトマウスにみられるような骨芽細胞の分化および骨形成の異常を示すはずである.こうした予想を裏づけるように,GLUT1とRUNX2のダブルヘテロノックアウトマウスはRUNX2ノックアウトマウスと胎生16.5日目までほぼ見分けがつかなかった.このマウスは胎生18.5日目においても骨芽細胞の分化および骨形成に重篤な遅れがみられ,出生ののち間をおかずに死亡した.さらに,胎生12.5日目までのRunx1遺伝子の発現パターンおよびGlut1遺伝子のプロモーターの活性を促進する実験により,RUNX1が骨芽細胞に分化するまえの細胞においてI型コラーゲンの量を制御している可能性があげられた.これらの結果から,RUNX2とGlut1遺伝子との相互制御が増幅機構として機能することにより骨芽細胞の分化と骨制御とを統合し生涯にわたり維持していることが明らかにされた(図2).
筆者らは,この研究において,骨芽細胞によるグルコースの取り込みがAMPキナーゼを介してRUNX2の量および骨芽細胞の分化を促進するとともに,AMPキナーゼを介した別の機構によりI型コラーゲンの産生および骨形成が促進されることを発見した.また,RUNX2とGlut1遺伝子とのフィードフォワード制御により骨芽細胞の分化と骨形成とが統合され生涯にわたり協調されることも明らかにされた.これらの発見は臨床研究にも貢献するものであった.たとえば,鎖骨頭蓋骨異形成症の多くの患者においてRunx2遺伝子に変異はみられないが8,9),これらの患者においては骨芽細胞へのグルコースの取り込みあるいは利用の低下が疾患の原因になっている可能性がある.また,グルコースのもつ骨芽細胞への影響は,ケトン食事療法をうけている子供は縦成長に乏しいという事例10) を説明する理由にもなりうる.くわえて,骨芽細胞へのグルコースの取り込みは骨芽細胞の分化,骨形成,グルコースの恒常性にとり必須であることが明らかにされ,骨と糖代謝とクロストークの重要性が示された.
略歴:米国Columbia大学College of Physicians and Surgeons博士課程 在学中.
研究テーマ:骨芽細胞の生物学.骨芽細胞の分泌するホルモンがほかの臓器にどのような影響をあたえるか.
関心事:遺伝子レベルの小さな視点から身体全体の大きな現象の謎を解き明かす遺伝学のパワフルさと生理学のおもしろさ.
Jianwen Wei
米国Columbia大学College of Physicians and SurgeonsにてAssociate Research Scientist.
Gerard Karsenty
米国Columbia大学College of Physicians and SurgeonsにてProfessor.
© 2015 島津絢子・Jianwen Wei・Gerard Karsenty Licensed under CC 表示 2.1 日本
(米国Columbia大学College of Physicians and Surgeons,Department of Genetics and Development)
email:島津絢子
DOI: 10.7875/first.author.2015.085
Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation.
Jianwen Wei, Junko Shimazu, Munevver P. Makinistoglu, Antonio Maurizi, Daisuke Kajimura, Haihong Zong, Takeshi Takarada, Takashi Iezaki, Jeffrey E. Pessin, Eiichi Hinoi, Gerard Karsenty
Cell, 161, 1576-1591 (2015)
要 約
骨芽細胞はその分化に必須の転写因子であるRUNX2の発現よりまえに,骨形成に必要なおもなタンパク質を合成している.このため,骨芽細胞の分化と骨形成のあいだに明確なつながりはないようにみえ,骨芽細胞の分化と骨形成とがどのように協調して維持されているのかは明らかにされていなかった.筆者らは,骨と糖代謝との関係性に着目し,骨芽細胞はおもなエネルギー源をグルコース輸送体GLUT1により取り込まれるグルコースに依存しており,グルコースの取り込みがAMPキナーゼを介し骨芽細胞の分化および骨形成を促進していることをつきとめた.また,RUNX2がGLUT1の発現を促進することを発見し,このRUNX2とGlut1遺伝子とのフィードフォワード制御が骨芽細胞の分化および骨形成を生涯にわたり統合し協調させていることを明らかにした.この研究により,骨芽細胞におけるエネルギー代謝のバランスが骨芽細胞の分化と機能を統合していることが見い出されたとともに,骨と糖代謝とのクロストークの重要性が示された.
はじめに
骨芽細胞は骨形成を行う細胞であり,RUNX2は骨芽細胞の分化に必須の転写因子である1).事実,RUNX2ノックアウトマウスは骨芽細胞が分化しないため骨形成がみられない2).他方,in vitroでの実験においてRUNX2はI型コラーゲンの遺伝子のプロモーターに結合しその発現を促進するとの報告がなされたものの3),in vivoでの実験においては,I型コラーゲンはRUNX2の発現よりもまえに産生されることがわかっていた.骨芽細胞は骨基質のおもな成分であるI型コラーゲンを産生する細胞であり,I型コラーゲンは骨芽細胞による骨形成を示すマーカーであることをふまえると,この結果は骨芽細胞の分化と骨形成とのあいだに明確なつながりはないことを示すようにみえる.これを前提とした場合,骨芽細胞の分化に必須の転写因子RUNX2は骨形成を直接に制御しているのか,そうでない場合には,どのように骨形成が制御され骨芽細胞の分化と協調しているのかという疑問が生じる.また,骨芽細胞は骨形成を行う細胞であると同時に,オステオカルシンというホルモンを分泌する内分泌細胞であり,オステオカルシンは糖代謝を制御することが知られている4).しかしながら,なぜ骨が糖代謝を制御しなければならないのかについては解明されていない.筆者らは,骨と糖代謝とのクロストークに着目し,骨芽細胞の高いエネルギー要求性について解明することにより,骨芽細胞の分化と骨形成とがどのように協調し生涯にわたり維持されているのかという疑問に答えられないかと考えた.
1.骨芽細胞はGLUT1を介してグルコースを取り込む
骨芽細胞のおもなエネルギー源を特定するため,骨芽細胞における酸素摂取速度の測定,マウスを使った高インスリン正常血糖クランプ法,細胞培養を用いた実験を行った.その結果,骨芽細胞はグルコース輸送体であるGLUT1を介しグルコースをおもなエネルギー源として取り込むことがわかった.
2.グルコースの取り込みは骨芽細胞の分化に必要である
マウスの後肢を用いて発生段階におけるGlut1遺伝子の発現のタイミングおよび発現部位について調べた.これと並行して,骨芽細胞のマーカーとしてRunx2遺伝子を,また,間葉細胞のマーカーとしてI型コラーゲン遺伝子の発現について調べた.その結果,Runx2遺伝子の発現がみられるまえの胎生10.5日目において,Glut1遺伝子およびI型コラーゲン遺伝子とともに,Runx遺伝子ファミリーに属するRunx1遺伝子が発現していた.Runx2遺伝子の発現は胎生12.5日目よりのちにみられた.
GLUT1が骨芽細胞にあたえる影響について調べるため,発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスを作製し解析した.その結果,胎生18.5日目にRunx2遺伝子のハプロ不全によりひき起こされる鎖骨頭蓋骨異形成症5) の兆候がみられ,骨芽細胞の分化の遅れにより鎖骨が短くなり頭蓋骨の大泉門の閉鎖の不全がみられた.一方,Runx2遺伝子およびI型コラーゲン遺伝子の発現には異常はみられなかったが,それらのタンパク質は大きく減少していた.これらの結果から,発生段階におけるGLUT1を介したグルコースの取り込みが骨芽細胞の分化に必要であることがわかった.
3.グルコースの取り込みは出生ののちの骨形成および全身の糖代謝に必要である
胎生18.5日目よりのちの骨芽細胞に特異的なGLUT1ノックアウトマウスを用い出生ののちのGLUT1の役割について調べたところ,骨量および骨形成を示すパラメーターが低下していた.出生ののちにもRunx2遺伝子およびI型コラーゲン遺伝子の発現に異常はみられなかったが,それらのタンパク質はいちじるしく減少していた.さらに,RUNX2の減少によりその標的であるオステオカルシンの発現が抑制され,その結果,オステオカルシンの血中濃度が低下していた.オステオカルシンは全身の糖代謝を制御することが知られているが4,6),このマウスでは耐糖性およびインスリン感受性が一貫して抑制されていた.これらのことから,骨芽細胞におけるGLUT1によるグルコースの取り込みは出生ののちの骨形成および全身の糖代謝にも必要であることがわかった.
4.グルコースの取り込みはAMPキナーゼの制御を介し骨芽細胞の分化および骨形成を促進する
実験により,グルコースの取り込みの不足により,骨芽細胞に特異的なGLUT1ノックアウトマウスにおいて細胞におけるエネルギーセンサーとして知られるAMPキナーゼ7) が活性化されていること,また,mTOR複合体1の活性が抑制されていることがわかった.また,骨芽細胞に特異的なGLUT1ノックアウトマウスにおいてmTOR複合体1の負の制御タンパク質をノックアウトすることによりmTOR複合体1を活性化したところ,I型コラーゲンも正常に存在したがRUNX2は減少していた(図1a).そこで,mTOR複合体1の活性の低下および発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスにみられた表現型がAMPキナーゼの活性化によるものかどうか調べるため,GLUT1ノックアウトマウスにおいて骨芽細胞に特異的にAMPキナーゼα1をコードする遺伝子をヘテロで欠損させたマウスを作製した.このマウスの骨芽細胞においてAMPキナーゼおよびmTOR複合体1は活性化されRUNX2およびI型コラーゲンも正常に存在した.また,発生段階における骨芽細胞の分化の遅れが改善されるとともに,鎖骨頭蓋骨異形成症の症状はみられず,出生ののちの骨形成のパラメーターも改善された.これらの結果から,グルコースの取り込みがAMPキナーゼを介しRUNX2およびI型コラーゲンの量を制御することにより骨芽細胞の分化および骨形成を制御していることがわかった.
5.グルコースの取り込みが阻害されるとRUNX2のみでは骨芽細胞の分化は促進されない
AMPキナーゼはユビキチンリガーゼであるSMURF1を直接にリン酸化すること,このSMURF1のリン酸化はRUNX2のユビキチン化に必須であることが見い出された(図1b).AMPキナーゼによるRUNX2の量の制御機構が明らかにされたため,グルコースの取り込みが十分でない状況においてもRUNX2により骨芽細胞の分化は促進されるかどうかを調べるため,GLUT1ノックアウトマウスにおいてSMURF1をコードする遺伝子をヘテロで欠損させたマウスを作製した.このマウスにおいてRUNX2は正常に存在したが,mTOR複合体1は活性化せずI型コラーゲンは減少していた.他方,RUNX2は正常に存在したにもかかわらず,発生段階の骨芽細胞に特異的なGLUT1ノックアウトマウスと同じように骨の形成に遅延がみられた.これらの実験から,GLUT1によるグルコースの取り込みが阻害されタンパク質の合成が抑制されている場合には,RUNX2のみでは骨芽細胞の分化を促進するのに十分ではないことが明らかにされた.
6.骨芽細胞の分化が十分でない状況においてグルコースは骨形成を促進する
これらの実験により,GLUT1によるグルコースの取り込みはAMPキナーゼによるSMURF1の活性化を制御することにより,RUNX2の量,すなわち,骨芽細胞の分化を制御するとともに,これとは別の機構として,AMPキナーゼによるmTOR複合体1の制御によりI型コラーゲンの産生を制御することで骨形成を制御していることがわかった(図1).このことをin vivoにおいて証明するため,骨芽細胞の分化が十分でないRUNX2ヘテロノックアウトマウスにおいて慢性的な高血糖をひき起こすことにより骨形成が促進されるかどうか調べた.具体的には,妊娠中の母親マウスを薬理的に高血糖にすることにより,胎仔マウスに慢性的な高血糖をひき起こした.その結果,鎖骨頭蓋骨異形成症の症状を示すRUNX2ヘテロノックアウトマウスの胎仔は,慢性的な高血糖のもとでは鎖骨の短縮および大泉門の閉鎖不全の表現型が改善され,I型コラーゲンも正常に存在した.これらの実験から,骨芽細胞の分化が十分でない状況においても,グルコースの濃度を上昇させることによりI型コラーゲンの産生および骨形成は促進されることがわかった.
7.RUNX2とGlut1遺伝子とのクロストークは骨芽細胞の分化と骨形成とを協調させる
これらの実験の結果から,GLUT1による骨芽細胞の分化および骨形成のおのおのの制御機構が明らかにされたが,これらの結果は,骨芽細胞の分化と骨形成はどのように統合され協調しているのかという疑問には答えていなかった.そこで,RUNX2ノックアウトマウスの骨芽細胞においてはGLUT1の発現およびグルコースの取り込みの低いことに着目し,RUNX2ヘテロノックアウトマウスにおいても同様の現象がみられることが見い出された.また,Runx遺伝子ファミリーにコードされるRUNX2およびRUNX1がGlut1遺伝子のプロモーターの活動を促進することが明らかにされた.
Glut1遺伝子とRUNX2とのフィードフォワード制御が骨芽細胞の分化および骨形成を統合するのであれば,GLUT1とRUNX2のダブルヘテロノックアウトマウスはRUNX2ノックアウトマウスにみられるような骨芽細胞の分化および骨形成の異常を示すはずである.こうした予想を裏づけるように,GLUT1とRUNX2のダブルヘテロノックアウトマウスはRUNX2ノックアウトマウスと胎生16.5日目までほぼ見分けがつかなかった.このマウスは胎生18.5日目においても骨芽細胞の分化および骨形成に重篤な遅れがみられ,出生ののち間をおかずに死亡した.さらに,胎生12.5日目までのRunx1遺伝子の発現パターンおよびGlut1遺伝子のプロモーターの活性を促進する実験により,RUNX1が骨芽細胞に分化するまえの細胞においてI型コラーゲンの量を制御している可能性があげられた.これらの結果から,RUNX2とGlut1遺伝子との相互制御が増幅機構として機能することにより骨芽細胞の分化と骨制御とを統合し生涯にわたり維持していることが明らかにされた(図2).
おわりに
筆者らは,この研究において,骨芽細胞によるグルコースの取り込みがAMPキナーゼを介してRUNX2の量および骨芽細胞の分化を促進するとともに,AMPキナーゼを介した別の機構によりI型コラーゲンの産生および骨形成が促進されることを発見した.また,RUNX2とGlut1遺伝子とのフィードフォワード制御により骨芽細胞の分化と骨形成とが統合され生涯にわたり協調されることも明らかにされた.これらの発見は臨床研究にも貢献するものであった.たとえば,鎖骨頭蓋骨異形成症の多くの患者においてRunx2遺伝子に変異はみられないが8,9),これらの患者においては骨芽細胞へのグルコースの取り込みあるいは利用の低下が疾患の原因になっている可能性がある.また,グルコースのもつ骨芽細胞への影響は,ケトン食事療法をうけている子供は縦成長に乏しいという事例10) を説明する理由にもなりうる.くわえて,骨芽細胞へのグルコースの取り込みは骨芽細胞の分化,骨形成,グルコースの恒常性にとり必須であることが明らかにされ,骨と糖代謝とクロストークの重要性が示された.
文 献
- Karsenty, G., Kronenberg, H. M. & Settembre, C.: Genetic control of bone formation. Annu. Rev. Cell Dev. Biol., 25, 629-648 (2009)[PubMed]
- Komori, T., Yagi, H., Nomura, S. et al.: Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts. Cell, 789, 755-764 (1997)[PubMed]
- Kern, B., Shen, J., Starbuck, M. et al.: Cbfa1 contributes to the osteoblast-specific expression of type I collagen genes. J. Biol. Chem., 276, 7101-7107 (2001)[PubMed]
- Lee, N. K., Sowa, H., Hinoi, E. et al.: Endocrine regulation of energy metabolism by the skeleton. Cell, 130, 456-469 (2007)[PubMed]
- Otto, F., Thornell, A. P., Crompton, T. et al.: Cbfa1, a candidate gene for cleidocranial dysplasia syndrome, is essential for osteoblast differentiation and bone development. Cell, 89, 765-771 (1997)[PubMed]
- Ferron, M., Wei, J., Yoshizawa, T. et al.: Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism. Cell, 142, 296-308 (2010)[PubMed]
- Hardie, D. G., Ross, F. A., & Hawley, S. A.: AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell Biol., 13, 251-262 (2012)[PubMed]
- Puppin, C., Pellizzari, L., Fabbro, D. et al.: Functional analysis of a novel RUNX2 missense mutation found in a family with cleidocranial dysplasia. J. Hum. Genet., 50, 679-683 (2005)[PubMed]
- Tessa, A., Salvi, S., Casali, C. et al.: Six novel mutations of the RUNX2 gene in Italian patients with cleidocranial dysplasia. Hum. Mutat., 22, 104 (2003)[PubMed]
- Groesbeck, D. K., Bluml, R. M. & Kossoff, E. H.: Long-term use of the ketogenic diet in the treatment of epilepsy. Dev. Med. Child Neurol., 48, 978-981 (2006)[PubMed]
著者プロフィール
略歴:米国Columbia大学College of Physicians and Surgeons博士課程 在学中.
研究テーマ:骨芽細胞の生物学.骨芽細胞の分泌するホルモンがほかの臓器にどのような影響をあたえるか.
関心事:遺伝子レベルの小さな視点から身体全体の大きな現象の謎を解き明かす遺伝学のパワフルさと生理学のおもしろさ.
Jianwen Wei
米国Columbia大学College of Physicians and SurgeonsにてAssociate Research Scientist.
Gerard Karsenty
米国Columbia大学College of Physicians and SurgeonsにてProfessor.
© 2015 島津絢子・Jianwen Wei・Gerard Karsenty Licensed under CC 表示 2.1 日本