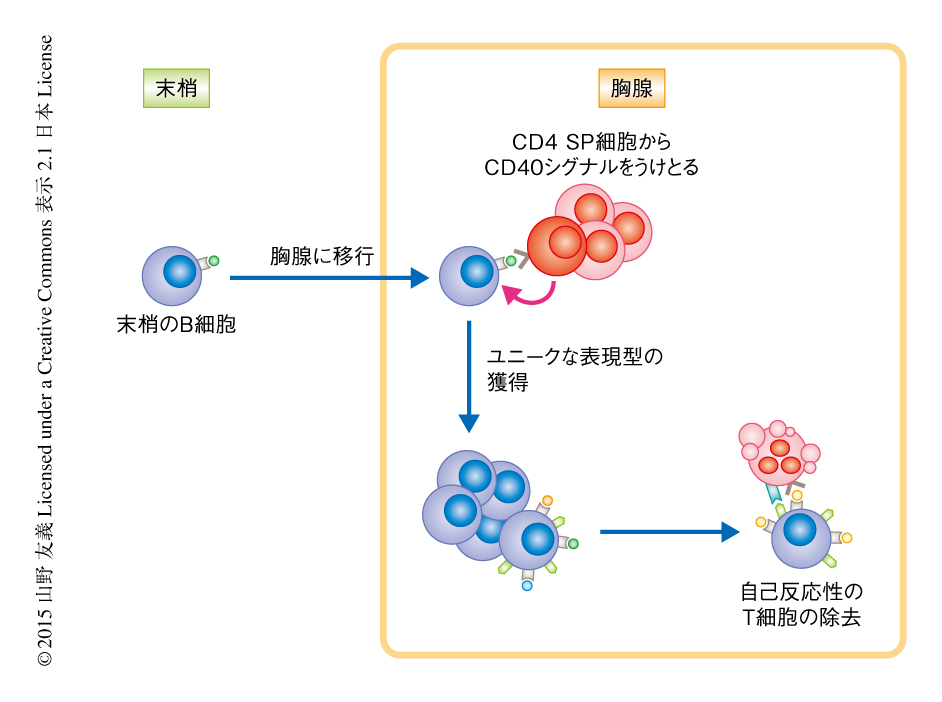
胸腺に移行した末梢のB細胞はユニークな表現型を獲得し未熟なT細胞の負の選択に寄与する
山野 友義
(ドイツLudwig Maximilians大学Institute for Immunology)
email:山野友義
DOI: 10.7875/first.author.2015.083
Thymic B cells are licensed to present self antigens for central T cell tolerance induction.
Tomoyoshi Yamano, Jelena Nedjic, Maria Hinterberger, Madlen Steinert, Sandra Koser, Sheena Pinto, Norbert Gerdes, Esther Lutgens, Naozumi Ishimaru, Meinrad Busslinger, Benedikt Brors, Bruno Kyewski, Ludger Klein
Immunity, 42, 1048-1061 (2015)
T細胞は胸腺において正の選択および負の選択をうけることにより成熟し,その結果,多様性をもち自己に対しては攻撃性をもたないT細胞の集団が産生される.T細胞の正の選択および負の選択においては胸腺に存在する抗原提示細胞が必須の役割を担う.胸腺のB細胞は胸腺における抗原提示細胞の40~50%をしめるにもかかわらず,その役割についてはあまり知られていない.この論文においては,末梢のB細胞は胸腺に移行すること,胸腺に移行した末梢のB細胞は自己反応性をもつT細胞との相互作用によりCD40シグナルをうけとり,Aireの発現,MHC II分子および補助シグナル分子の発現の増強,自発的な免疫グロブリンのクラススイッチといったユニークな表現型を獲得し,自己反応性T細胞の負の選択に寄与していることが明らかにされた.
骨髄において発生したT細胞の前駆細胞は胸腺に移行して分化する.T細胞受容体遺伝子の再編成によりT細胞受容体の膨大なレパートリーを獲得した未熟なT細胞のうち,胸腺の皮質上皮細胞の表面のMHC分子に提示された自己抗原を認識することのできるわずかな画分だけが正の選択として分化し,胸腺の髄質へと移行する.胸腺の髄質において自己抗原と強い反応を示した未熟なT細胞は負の選択により除去される1,2).これまで,負の選択においては胸腺の髄質上皮細胞および樹状細胞の役割がよく研究されてきた.胸腺の髄質上皮細胞は本来は末梢にしか存在しない組織に特異的な抗原,たとえば,膵臓において産生されるインスリンや肝臓において発現するC反応性タンパク質などを発現する.胸腺の髄質上皮細胞は組織に特異的な抗原を提示することによりこれらの抗原に対し攻撃性をもつ自己反応性のT細胞を除去する3,4).胸腺の髄質上皮細胞における組織に特異的な抗原の発現の一部はAireにより制御されており,Aire遺伝子の変異はAPECED(自己免疫性多腺内分泌障害,カンジダ症,外胚ジストロフィー)の原因になる5).胸腺の樹状細胞は胸腺の髄質上皮細胞の発現する抗原を取り込み提示することにより自己反応性のT細胞の除去に貢献する6).一方,胸腺のB細胞は胸腺における抗原提示細胞の40~50%をしめるにもかかわらず,その役割についてはあまり知られていない.今回,筆者らは,胸腺のB細胞はAireを発現していること,自発的な免疫グロブリンのクラススイッチをするといったユニークな表現型をもつこと,自己反応性T細胞の負の選択に寄与することを示した.
2つの異なるAireレポーターマウスを用いて,胸腺において髄質上皮細胞のほかの画分にAireを発現する細胞を発見し,細胞表面タンパク質の解析によりB細胞がAireを発現していることを同定した.4週齢のマウスではおよそ40~50%の胸腺のB細胞がAireレポーターを発現していた.一方,骨髄や脾臓など末梢に存在するB細胞はAireレポーターを発現していなかったことより,Aireの発現はB細胞のうち胸腺のB細胞のみがもつ特徴であることがわかった.Aireは遺伝子の異所性の発現を制御することが知られていたことから,野生型のマウスおよびAireノックアウトマウスから胸腺のB細胞を精製し,RNA-seq法により遺伝子発現を比較した.その結果,205個の遺伝子がAireにより制御されており,そのなかには胸腺の髄質上皮細胞がほとんど発現しない組織に特異的な抗原をコードする遺伝子が含まれていた.細胞表面タンパク質の解析により,胸腺のB細胞はMHC II分子および補助シグナル分子の発現が末梢のB細胞より高いこと,また,胸腺のB細胞のおよそ30~40%は免疫グロブリンGあるいは免疫グロブリンAを細胞の表面にもち免疫グロブリンのクラススイッチを起こしていた.
胸腺に存在するB細胞は,胸腺において胸腺前駆細胞から分化するのか,あるいは,末梢から移行してくるのか,その由来はわかっていない.近年の研究により,Notchシグナルをうけとった胸腺前駆細胞はT細胞へと分化し,Notchシグナルをうけとらなかった胸腺前駆細胞はB細胞あるいはミエロイド系細胞へと分化することが知られている.実際,Notch1を欠損したマウスにおいては胸腺のB細胞の増加がみられることから,胸腺のB細胞は胸腺前駆細胞から分化する可能性が示唆された7).しかし,胸腺前駆細胞がT細胞への分化を決定したのち分化の停止するT細胞受容体β鎖ノックアウトマウスでも胸腺においてB細胞の増加がみられることから,T細胞への分化が早期に停止したマウスにおいてみられる胸腺におけるB細胞の増加はB細胞の生存するスペースが増えるためとも考えられる8).4週齢のマウスにおいて胸腺のB細胞の前駆細胞を調べたところ,胸腺にはプロB細胞はほとんど存在していなかった.B細胞の前駆細胞の不在は,胸腺のB細胞は末梢から胸腺へと移行していることを示唆した.そこで,脾臓から取り出したB細胞をコンジェニックマウスに移入し胸腺へと移行するかどうか調べたところ,移入したB細胞は胸腺へと移行した.脾臓に移行したB細胞の表現型に変化はみられなかったが,胸腺に移行したB細胞はAireの発現,MHC II分子および補助シグナル分子の発現の増強,そして,10%のB細胞は免疫グロブリンGへのクラススイッチを起こしていた.これらの結果より,末梢から胸腺に移行したB細胞は胸腺においてユニークな表現型を獲得することがわかった.
末梢から胸腺に移行したB細胞は胸腺においてなんらかの刺激をうけることによりユニークな表現型を獲得する.in vitroにおいて脾臓のB細胞を抗CD40抗体により刺激したところAireの発現が誘導された.CD40またはそのリガンドであるCD154を欠損したマウスの胸腺のB細胞を調べてみたところ,Aireの発現および免疫グロブリンGを発現するB細胞はみられなかった.よって,CD40による刺激が胸腺のB細胞のユニークな表現型の獲得に必須であることがわかった.CD154は胸腺においてはおもにCD4 SP細胞が発現している.CD4 SP細胞の存在しないT細胞受容体α鎖ノックアウトマウスにおいては胸腺のB細胞におけるAireの発現および免疫グロブリンGを発現するB細胞がみられなかったことから,CD4 SP細胞が胸腺のB細胞のユニークな表現型の獲得に必要であることがわかった.T細胞受容体α鎖ノックアウトマウスを外来性の抗原である卵白アルブミンに対し特異性をもつT細胞受容体トランスジェニックマウスと掛け合わせることにより,すべてのCD4 SP細胞が卵白アルブミンに対し特異性をもつマウスを作製した.このマウスにおいてCD4 SP細胞はCD154を発現するにもかかわらず胸腺のB細胞はユニークな表現型を獲得していなかった.つぎに,MHC II分子のノックアウトマウスの脾臓から取り出したB細胞をコンジェニックマウスに移入したところ,移入したB細胞は胸腺に移行してもAireの発現および免疫グロブリンのクラススイッチはみられなかった.これらの結果より,胸腺のB細胞のユニークな表現型の獲得にはB細胞と多様なCD 4SP細胞に含まれるであろう自己反応性のT細胞との相互作用によりCD40シグナルをうけとることが必要であることがわかった.
胸腺のB細胞は胸腺においてCD4 SP細胞との相互作用によりCD40シグナルをうけとり,Aireの発現および免疫グロブリンのクラススイッチを起こす.これは,胚中心において起こる反応と酷似していた.そこで,胚中心のB細胞もAireを発現しているのではないかと考え,ヒツジの赤血球によりマウスを免疫し胚中心のB細胞の分化を誘導したが,胚中心のB細胞にはAireの発現はみられなかった.また,定常状態においてみられる腸管における胚中心のB細胞について調べたが,Aireの発現はみられなかった.そこで,胸腺のB細胞と胚中心のB細胞との違いはB細胞受容体を介した抗原の提示の有無ではないかと考え,in vitroの実験系において脾臓のB細胞を抗CD40抗体および抗免疫グロブリンM抗体とともに培養した.その結果,抗CD40抗体のみとの培養では脾臓のB細胞にAireの発現が誘導されたのに対し,抗CD40抗体および抗免疫グロブリンM抗体とで培養した脾臓B細胞においてはAireの発現が抑制されていた.よって,Aireを発現する胸腺のB細胞はB細胞受容体による刺激がくわわっていない,すなわち,胸腺のB細胞における抗原の提示はB細胞受容体を介した抗原の取り込みに非依存的であることが示唆された.これを確かめるため,ニワトリの卵白リゾチームに対し特異性をもつB細胞受容体のトランスジェニックマウスを解析した.このマウスの胸腺のB細胞はニワトリの卵白リゾチームがない状態にもかかわらずニワトリの卵白リゾチームに特異的な免疫グロブリンGまたは免疫グロブリンAへとクラススイッチを起こしており,また,Aireの発現も誘導されていた.これらの結果より,胸腺のB細胞は内在性の抗原をCD4 SP細胞に提示し自発的な免疫グロブリンのクラススイッチを起こしていると考えられた.これは,胚中心において起こるクラススイッチとは機構を異にするものであった.
胸腺のB細胞は自己反応性のT細胞の除去に寄与するかどうかを調べるため,B細胞の存在しないトランスジェニックマウスを解析したところ,野生型のマウスに比べ胸腺においてCD4 SP細胞が増加していることがわかった.このことは,B細胞の存在しないマウスではCD4 SP細胞の負の選択に欠陥のあることを示唆した.B細胞の存在しないトランスジェニックマウスから取り出した末梢のT細胞を野生型のマウスに移入すると増殖したことから,このマウスの末梢のT細胞には自己反応性のT細胞が含まれることがわかった.また,Aire遺伝子のプロモーターによりモデル抗原を発現するマウスおよびこのモデル抗原に特異的なT細胞受容体のトランスジェニックマウスを用いて,末梢のB細胞が胸腺に移行し抗原に特異的なT細胞に負の選択を誘導することが示された.
これまで,胸腺におけるB細胞の存在およびその役割についてはあまり注目されていなかったが,今回,筆者らは,そのユニークな表現型,および,未熟なT細胞の負の選択に寄与することを明らかにした(図1).胸腺における免疫グロブリンのクラススイッチは胚中心におけるクラススイッチとは機構を異にし,自発的に起こった.一方,免疫グロブリンGあるいは免疫グロブリンAを細胞の表面にもつ胸腺のB細胞の生理的な役割については未知である.これらは免疫グロブリンサブクラスに特異的なT細胞の除去に寄与しているのかもしれない.あるいは,胸腺から末梢へと移行し自然抗体としてはたらく可能性も考えられる.胸腺のB細胞は胸腺の形成に寄与するリンホトキシンを高く産生する.よって,胸腺のB細胞は抗原提示細胞としての役割にくわえ,胸腺の精巧な微小環境をつくりあげる重要な細胞のひとつとしてはたらいている可能性が考えられる.
(ドイツLudwig Maximilians大学Institute for Immunology)
email:山野友義
DOI: 10.7875/first.author.2015.083
Thymic B cells are licensed to present self antigens for central T cell tolerance induction.
Tomoyoshi Yamano, Jelena Nedjic, Maria Hinterberger, Madlen Steinert, Sandra Koser, Sheena Pinto, Norbert Gerdes, Esther Lutgens, Naozumi Ishimaru, Meinrad Busslinger, Benedikt Brors, Bruno Kyewski, Ludger Klein
Immunity, 42, 1048-1061 (2015)
要 約
T細胞は胸腺において正の選択および負の選択をうけることにより成熟し,その結果,多様性をもち自己に対しては攻撃性をもたないT細胞の集団が産生される.T細胞の正の選択および負の選択においては胸腺に存在する抗原提示細胞が必須の役割を担う.胸腺のB細胞は胸腺における抗原提示細胞の40~50%をしめるにもかかわらず,その役割についてはあまり知られていない.この論文においては,末梢のB細胞は胸腺に移行すること,胸腺に移行した末梢のB細胞は自己反応性をもつT細胞との相互作用によりCD40シグナルをうけとり,Aireの発現,MHC II分子および補助シグナル分子の発現の増強,自発的な免疫グロブリンのクラススイッチといったユニークな表現型を獲得し,自己反応性T細胞の負の選択に寄与していることが明らかにされた.
はじめに
骨髄において発生したT細胞の前駆細胞は胸腺に移行して分化する.T細胞受容体遺伝子の再編成によりT細胞受容体の膨大なレパートリーを獲得した未熟なT細胞のうち,胸腺の皮質上皮細胞の表面のMHC分子に提示された自己抗原を認識することのできるわずかな画分だけが正の選択として分化し,胸腺の髄質へと移行する.胸腺の髄質において自己抗原と強い反応を示した未熟なT細胞は負の選択により除去される1,2).これまで,負の選択においては胸腺の髄質上皮細胞および樹状細胞の役割がよく研究されてきた.胸腺の髄質上皮細胞は本来は末梢にしか存在しない組織に特異的な抗原,たとえば,膵臓において産生されるインスリンや肝臓において発現するC反応性タンパク質などを発現する.胸腺の髄質上皮細胞は組織に特異的な抗原を提示することによりこれらの抗原に対し攻撃性をもつ自己反応性のT細胞を除去する3,4).胸腺の髄質上皮細胞における組織に特異的な抗原の発現の一部はAireにより制御されており,Aire遺伝子の変異はAPECED(自己免疫性多腺内分泌障害,カンジダ症,外胚ジストロフィー)の原因になる5).胸腺の樹状細胞は胸腺の髄質上皮細胞の発現する抗原を取り込み提示することにより自己反応性のT細胞の除去に貢献する6).一方,胸腺のB細胞は胸腺における抗原提示細胞の40~50%をしめるにもかかわらず,その役割についてはあまり知られていない.今回,筆者らは,胸腺のB細胞はAireを発現していること,自発的な免疫グロブリンのクラススイッチをするといったユニークな表現型をもつこと,自己反応性T細胞の負の選択に寄与することを示した.
1.胸腺のB細胞はAireを発現している
2つの異なるAireレポーターマウスを用いて,胸腺において髄質上皮細胞のほかの画分にAireを発現する細胞を発見し,細胞表面タンパク質の解析によりB細胞がAireを発現していることを同定した.4週齢のマウスではおよそ40~50%の胸腺のB細胞がAireレポーターを発現していた.一方,骨髄や脾臓など末梢に存在するB細胞はAireレポーターを発現していなかったことより,Aireの発現はB細胞のうち胸腺のB細胞のみがもつ特徴であることがわかった.Aireは遺伝子の異所性の発現を制御することが知られていたことから,野生型のマウスおよびAireノックアウトマウスから胸腺のB細胞を精製し,RNA-seq法により遺伝子発現を比較した.その結果,205個の遺伝子がAireにより制御されており,そのなかには胸腺の髄質上皮細胞がほとんど発現しない組織に特異的な抗原をコードする遺伝子が含まれていた.細胞表面タンパク質の解析により,胸腺のB細胞はMHC II分子および補助シグナル分子の発現が末梢のB細胞より高いこと,また,胸腺のB細胞のおよそ30~40%は免疫グロブリンGあるいは免疫グロブリンAを細胞の表面にもち免疫グロブリンのクラススイッチを起こしていた.
2.末梢から胸腺に移行したB細胞は胸腺においてユニークな表現型を獲得する
胸腺に存在するB細胞は,胸腺において胸腺前駆細胞から分化するのか,あるいは,末梢から移行してくるのか,その由来はわかっていない.近年の研究により,Notchシグナルをうけとった胸腺前駆細胞はT細胞へと分化し,Notchシグナルをうけとらなかった胸腺前駆細胞はB細胞あるいはミエロイド系細胞へと分化することが知られている.実際,Notch1を欠損したマウスにおいては胸腺のB細胞の増加がみられることから,胸腺のB細胞は胸腺前駆細胞から分化する可能性が示唆された7).しかし,胸腺前駆細胞がT細胞への分化を決定したのち分化の停止するT細胞受容体β鎖ノックアウトマウスでも胸腺においてB細胞の増加がみられることから,T細胞への分化が早期に停止したマウスにおいてみられる胸腺におけるB細胞の増加はB細胞の生存するスペースが増えるためとも考えられる8).4週齢のマウスにおいて胸腺のB細胞の前駆細胞を調べたところ,胸腺にはプロB細胞はほとんど存在していなかった.B細胞の前駆細胞の不在は,胸腺のB細胞は末梢から胸腺へと移行していることを示唆した.そこで,脾臓から取り出したB細胞をコンジェニックマウスに移入し胸腺へと移行するかどうか調べたところ,移入したB細胞は胸腺へと移行した.脾臓に移行したB細胞の表現型に変化はみられなかったが,胸腺に移行したB細胞はAireの発現,MHC II分子および補助シグナル分子の発現の増強,そして,10%のB細胞は免疫グロブリンGへのクラススイッチを起こしていた.これらの結果より,末梢から胸腺に移行したB細胞は胸腺においてユニークな表現型を獲得することがわかった.
3.胸腺のB細胞のユニークな表現型の獲得には自己反応性のCD4 SP細胞とB細胞との相互作用が必要である
末梢から胸腺に移行したB細胞は胸腺においてなんらかの刺激をうけることによりユニークな表現型を獲得する.in vitroにおいて脾臓のB細胞を抗CD40抗体により刺激したところAireの発現が誘導された.CD40またはそのリガンドであるCD154を欠損したマウスの胸腺のB細胞を調べてみたところ,Aireの発現および免疫グロブリンGを発現するB細胞はみられなかった.よって,CD40による刺激が胸腺のB細胞のユニークな表現型の獲得に必須であることがわかった.CD154は胸腺においてはおもにCD4 SP細胞が発現している.CD4 SP細胞の存在しないT細胞受容体α鎖ノックアウトマウスにおいては胸腺のB細胞におけるAireの発現および免疫グロブリンGを発現するB細胞がみられなかったことから,CD4 SP細胞が胸腺のB細胞のユニークな表現型の獲得に必要であることがわかった.T細胞受容体α鎖ノックアウトマウスを外来性の抗原である卵白アルブミンに対し特異性をもつT細胞受容体トランスジェニックマウスと掛け合わせることにより,すべてのCD4 SP細胞が卵白アルブミンに対し特異性をもつマウスを作製した.このマウスにおいてCD4 SP細胞はCD154を発現するにもかかわらず胸腺のB細胞はユニークな表現型を獲得していなかった.つぎに,MHC II分子のノックアウトマウスの脾臓から取り出したB細胞をコンジェニックマウスに移入したところ,移入したB細胞は胸腺に移行してもAireの発現および免疫グロブリンのクラススイッチはみられなかった.これらの結果より,胸腺のB細胞のユニークな表現型の獲得にはB細胞と多様なCD 4SP細胞に含まれるであろう自己反応性のT細胞との相互作用によりCD40シグナルをうけとることが必要であることがわかった.
4.胸腺における免疫グロブリンのクラススイッチは胚中心において起こるクラススイッチとは機構を異にする
胸腺のB細胞は胸腺においてCD4 SP細胞との相互作用によりCD40シグナルをうけとり,Aireの発現および免疫グロブリンのクラススイッチを起こす.これは,胚中心において起こる反応と酷似していた.そこで,胚中心のB細胞もAireを発現しているのではないかと考え,ヒツジの赤血球によりマウスを免疫し胚中心のB細胞の分化を誘導したが,胚中心のB細胞にはAireの発現はみられなかった.また,定常状態においてみられる腸管における胚中心のB細胞について調べたが,Aireの発現はみられなかった.そこで,胸腺のB細胞と胚中心のB細胞との違いはB細胞受容体を介した抗原の提示の有無ではないかと考え,in vitroの実験系において脾臓のB細胞を抗CD40抗体および抗免疫グロブリンM抗体とともに培養した.その結果,抗CD40抗体のみとの培養では脾臓のB細胞にAireの発現が誘導されたのに対し,抗CD40抗体および抗免疫グロブリンM抗体とで培養した脾臓B細胞においてはAireの発現が抑制されていた.よって,Aireを発現する胸腺のB細胞はB細胞受容体による刺激がくわわっていない,すなわち,胸腺のB細胞における抗原の提示はB細胞受容体を介した抗原の取り込みに非依存的であることが示唆された.これを確かめるため,ニワトリの卵白リゾチームに対し特異性をもつB細胞受容体のトランスジェニックマウスを解析した.このマウスの胸腺のB細胞はニワトリの卵白リゾチームがない状態にもかかわらずニワトリの卵白リゾチームに特異的な免疫グロブリンGまたは免疫グロブリンAへとクラススイッチを起こしており,また,Aireの発現も誘導されていた.これらの結果より,胸腺のB細胞は内在性の抗原をCD4 SP細胞に提示し自発的な免疫グロブリンのクラススイッチを起こしていると考えられた.これは,胚中心において起こるクラススイッチとは機構を異にするものであった.
5.胸腺のB細胞は未熟なT細胞の負の選択に寄与する
胸腺のB細胞は自己反応性のT細胞の除去に寄与するかどうかを調べるため,B細胞の存在しないトランスジェニックマウスを解析したところ,野生型のマウスに比べ胸腺においてCD4 SP細胞が増加していることがわかった.このことは,B細胞の存在しないマウスではCD4 SP細胞の負の選択に欠陥のあることを示唆した.B細胞の存在しないトランスジェニックマウスから取り出した末梢のT細胞を野生型のマウスに移入すると増殖したことから,このマウスの末梢のT細胞には自己反応性のT細胞が含まれることがわかった.また,Aire遺伝子のプロモーターによりモデル抗原を発現するマウスおよびこのモデル抗原に特異的なT細胞受容体のトランスジェニックマウスを用いて,末梢のB細胞が胸腺に移行し抗原に特異的なT細胞に負の選択を誘導することが示された.
おわりに
これまで,胸腺におけるB細胞の存在およびその役割についてはあまり注目されていなかったが,今回,筆者らは,そのユニークな表現型,および,未熟なT細胞の負の選択に寄与することを明らかにした(図1).胸腺における免疫グロブリンのクラススイッチは胚中心におけるクラススイッチとは機構を異にし,自発的に起こった.一方,免疫グロブリンGあるいは免疫グロブリンAを細胞の表面にもつ胸腺のB細胞の生理的な役割については未知である.これらは免疫グロブリンサブクラスに特異的なT細胞の除去に寄与しているのかもしれない.あるいは,胸腺から末梢へと移行し自然抗体としてはたらく可能性も考えられる.胸腺のB細胞は胸腺の形成に寄与するリンホトキシンを高く産生する.よって,胸腺のB細胞は抗原提示細胞としての役割にくわえ,胸腺の精巧な微小環境をつくりあげる重要な細胞のひとつとしてはたらいている可能性が考えられる.
文 献
- Sprent, J. & Kishimoto, H.: The thymus and negative selection. Immunol. Rev., 185, 126-135 (2002)[PubMed]
- Klein, L., Kyewski, B., Allen, P. M. et al.: Positive and negative selection of the T cell repertoire: what thymocytes see (and don't see). Nat. Rev. Immunol., 14, 377-391 (2014)[PubMed]
- Hinterberger, M., Aichinger, M., Prazeres da Costa, O. et al.: Autonomous role of medullary thymic epithelial cells in central CD4+ T cell tolerance. Nat. Immunol., 11, 512-519 (2010)[PubMed]
- Derbinski, J., Schulte, A., Kyewski, B. et al.: Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nat. Immunol., 2, 1032-1039 (2001)[PubMed]
- Mathis, D. & Benoist, C.: Aire. Annu. Rev. Immunol., 27, 287-312 (2009)[PubMed]
- Ohnmacht, C., Pullner, A., King, S. B. et al.: Constitutive ablation of dendritic cells breaks self-tolerance of CD4 T cells and results in spontaneous fatal autoimmunity. J. Exp. Med., 206, 549-559 (2009)[PubMed]
- Wilson, A., MacDonald, H. R. & Radtke, F.: Notch 1-deficient common lymphoid precursors adopt a B cell fate in the thymus. J. Exp. Med., 194, 1003-1012 (2001)[PubMed]
- Akashi, K., Richie, L., Miyamoto, T. et al.: B lymphopoiesis in the thymus. J. Immunol., 164, 5221-5226 (2000)[PubMed]
著者プロフィール
略歴:2011年 東京理科大学大学院生命科学研究科 修了,同年 スイスZurich大学 客員研究員を経て,同年よりドイツLudwig Maximilians大学 博士研究員.
研究テーマ:胸腺におけるT細胞の分化
© 2015 山野 友義 Licensed under CC 表示 2.1 日本