選択的なオートファジーによる小胞体および核の分解
持田啓佑・中戸川 仁
(東京工業大学生命理工学研究科 生体システム専攻形態形成学分野)
email:持田啓佑
DOI: 10.7875/first.author.2015.080
Receptor-mediated selective autophagy degrades the endoplasmic reticulum and the nucleus.
Keisuke Mochida, Yu Oikawa, Yayoi Kimura, Hiromi Kirisako, Hisashi Hirano, Yoshinori Ohsumi, Hitoshi Nakatogawa
Nature, 522, 359-362 (2015)
オートファジーは細胞における主要な分解系のひとつであり,無作為の分解のほか,特定のタンパク質やオルガネラを選択的にも分解する.この選択的なオートファジーの標的の認識においては分解の目印になるオートファジー受容体が重要な役割を担う.この研究により,出芽酵母において新規のオートファジー受容体Atg39およびAtg40が同定され,小胞体および核がこれらを介した選択的なオートファジーにより分解されることが明らかにされた.Atg39は核の内部の成分を含む核膜に由来する二重膜の小胞を,Atg40は細胞質や細胞膜の直下の小胞体をオートファゴソームに積み込むことが示された.Atg39を介した核膜および核の内部の成分の分解は窒素飢餓にある細胞の生存に重要であった.Atg40は遺伝性の感覚神経障害の原因遺伝子の産物であるFAM134Bの機能的なホモログであることが示唆された.
細胞においては生命活動にともないさまざまな成分が合成されるが,合成された成分が不要あるいは異常になったとき,これらを分解することがきわめて重要になる.オートファジーは真核生物に保存された細胞における大規模な分解系である.細胞質においてカップ状の膜構造が形成されて伸張し,オートファゴソームとよばれる二重膜からなる小胞により細胞質の一部がとりかこまれる.このオートファゴソームは種々の加水分解酵素を含むオルガネラであるリソソームあるいは液胞と融合し,内容物は分解される1).オートファジーは細胞質の成分を無作為に分解するだけでなく,ほかの分解系では分解の困難なオルガネラやタンパク質凝集体などを選択的に認識し分解する.この選択的なオートファジーにおいて,分解すべき標的はオートファジー受容体により認識される.オートファジー受容体は標的に局在してオートファジーによる分解の目印になり,オートファゴソーム膜にあるAtg8との結合を介してオートファゴソームによる標的の選択的な取り込みを駆動する2).これまで,ミトコンドリアやペルオキシソームといったオルガネラが選択的なオートファジーの標的になること,そして,それぞれに特異的なオートファジー受容体が存在することが報告されている3).しかしながら,選択的なオートファジーがそのほかのオルガネラの分解にどのくらい関与するのかは不明であった.
既知のすべてのオートファジー受容体はAtg8と結合することから,Atg8結合タンパク質のなかに選択的なオートファジーを駆動する未知のオートファジー受容体が存在するのではないかと考えた.出芽酵母においてAtg8の免疫沈降および質量分析によりAtg8結合タンパク質の網羅的な同定を試みた.得られたタンパク質のなかには2つの機能未知なタンパク質が含まれAtg39およびAtg40と名づけた.Atg39およびAtg40は互いに配列類似性はなく,それぞれ,1つおよび2つの膜貫通領域と予測されるドメインをもっていた.さらに,Atg39およびAtg40には既知のオートファジー受容体に保存されたAtg8相互作用モチーフと予想される配列が見い出された.共免疫沈降法および酵母ツーハイブリッド法の結果,Atg39およびAtg40はAtg8相互作用モチーフを介しAtg8と相互作用することが明らかにされた.また,出芽酵母においてオートファジー受容体はオートファゴソーム膜の形成を駆動するタンパク質をリクルートするAtg11とも相互作用するが,Atg39およびAtg40もAtg11との相互作用が確認された.これらの結果から,Atg39およびAtg40は新たなオートファジー受容体であることが強く示唆された.
小胞体はタンパク質や脂質の合成など重要な細胞機能を担うオルガネラである.オートファジーが誘導される飢餓においては小胞体がオートファゴソームに高い頻度で取り込まれることが報告されている4).窒素飢餓を模倣するラパマイシンによる処理により,Atg39およびAtg40の発現量は劇的に上昇した.小胞体膜タンパク質Sec63の分解を指標に小胞体の選択的なオートファジーの活性を調べたところ,Atg39の欠損株あるいはAtg40の欠損株では部分的に,Atg39およびAtg40の二重欠損株ではほぼ完全に,小胞体の選択的なオートファジーが停止した.一方で,Atg39の欠損株あるいはAtg40の欠損株では,液胞内酵素集合体,ミトコンドリア,ペルオキシソームを標的とした選択的なオートファジーおよび細胞質のタンパク質の非選択的なオートファジーに欠損はみられなかったことから,Atg39およびAtg40が小胞体の選択的なオートファジーに特異的に機能することが明らかにされた.さらに,Atg8やAtg11との相互作用の失われるAtg39変異体あるいはAtg40変異体は小胞体の選択的なオートファジーに欠損を示すこと,Atg39の過剰発現あるいはAtg40の過剰発現により小胞体の選択的なオートファジーが亢進すること,GFPと融合したAtg39あるいはAtg40は小胞体に局在しその一部は強い輝点を形成してAtg8やAtg11の輝点と共局在すること,Atg39あるいはAtg40それ自体がオートファジーに依存して液胞に輸送されること,などが示され,Atg39およびAtg40は小胞体の選択的なオートファジーを駆動するオートファジー受容体であると結論づけられた.
出芽酵母の小胞体は,核の周囲の小胞体,細胞質の小胞体,細胞膜の直下の小胞体からなる5).Atg39およびAtg40の細胞内局在を調べるため,GFPと融合したAtg39あるいはAtg40を蛍光顕微鏡により観察した.Atg39およびAtg40は小胞体に局在したが,互いに異なる局在パターンを示した.Atg39は核の周囲の小胞体に特異的に局在し,Atg40は一部は核の周囲の小胞体にも存在したが,多くは細胞質や細胞膜の直下の小胞体に局在した.核の周囲の小胞体のタンパク質Hmg1,および,細胞質および細胞膜の直下の小胞体のタンパク質Rtn1をマーカーにして,それぞれの小胞体の分解について調べた.その結果,それぞれの局在と一致して,Atg39の欠損により核の周囲の小胞体の分解に顕著な欠損を生じたが,細胞質および細胞膜の直下の小胞体の分解には影響はなく,一方,Atg40の欠損により核の周囲の小胞体の分解に部分的な欠損がみられたが,細胞質や細胞膜の直下の小胞体の分解はとくに強い欠損を示した.これらの結果から,Atg39は核の周囲の小胞体,Atg40は細胞質および細胞膜の直下の小胞体と,それぞれ異なる小胞体の分解に特化したオートファジー受容体であることが明らかにされた.
電子顕微鏡を用いてオートファゴソームに取り込まれた小胞体の形態を観察した.液胞内プロテアーゼを欠損した細胞をラパマイシンにより処理すると液胞にオートファジックボディが蓄積する.このオートファジックボディはオートファゴソームの内膜からなる小胞で,内部にはオートファジーによる分解物が含まれる.オートファジックボディの内部に小胞体内腔タンパク質Kar2に対する抗体により標識される小胞体の断片が観察された.オートファジックボディの内部の小胞体の形態は一様ではなく,大きく2つに分類された.ひとつは二重膜の小胞の断面と思われる直径200 nmほどのリング状の構造であり,もうひとつはチューブやシートが複雑に折りたたまれたような構造であった.それぞれの割合を野生株とAtg39の欠損株あるいはAtg40の欠損株において定量したところ,リング状の小胞体を含むオートファジックボディはAtg39の欠損によりほぼ完全に消失したがAtg40の欠損により顕著な変化はみられなかった.一方,チューブやシート状の小胞体を含むオートファジックボディの割合はAtg40の欠損により顕著に低下したがAtg39の欠損ではこのような減少はみられなかった.すなわち,オートファゴソームの内部の二重膜の小胞は核の周囲の小胞体に,折りたたまれたチューブやシート状の小胞体は細胞質および細胞膜の直下の小胞体に由来することが示唆された.
電子顕微鏡による観察において,Atg39に依存的にオートファゴソームに取り込まれる二重膜の小胞の内部にはリボソームのような構造体はほとんどみられなかったことから,細胞質とは異なることが示唆された.二重膜の小胞の膜のあいだの領域に小胞体内腔タンパク質が検出されたこと,また,出芽酵母における核の周囲の小胞体は核膜に相当することなどから,二重膜の小胞の内部には核の内部の成分が存在するのではないかと考えた.実際に,核内膜のタンパク質Src1や核小体のタンパク質Nop1の分解を調べたところ,飢餓においてこれらタンパク質の分解がAtg39に依存して起こることが明らかにされた.さらに,オートファジックボディの内部に存在した二重膜の小胞の内部は,低い頻度ではあるが抗Nop1抗体により標識された.以上の結果から,Atg39をオートファジー受容体として,核の内部の成分を含む核膜に由来する二重膜の小胞がオートファゴソームに取り込まれ分解されること,すなわち,この現象が核の選択的なオートファジーともよぶべき現象であることが明らかにされた.
Atg39に依存的な核の選択的なオートファジーあるいはAtg40に依存的な小胞体の選択的なオートファジーの破綻が細胞にどのような影響をあたえるのか解析した.細胞を窒素飢餓にさらすとAtg39を欠損した細胞では核の形態に異常がみられ,野生株より早く生存率が低下した.これらの結果から,Atg39を介した核の周囲の小胞体および核の分解が窒素飢餓における細胞の生存に重要な役割をはたすことが示唆された.一方,Atg40を欠損した細胞を窒素飢餓にさらすと細胞の生存率には顕著な低下はみられなかったが,野生株と比較して高密度な細胞膜の直下の小胞体の編み目状の構造が観察された.Atg40に依存的な小胞体の選択的なオートファジーもほかの生理条件では細胞の生死を左右するような重要な役割をはたすかもしれない.
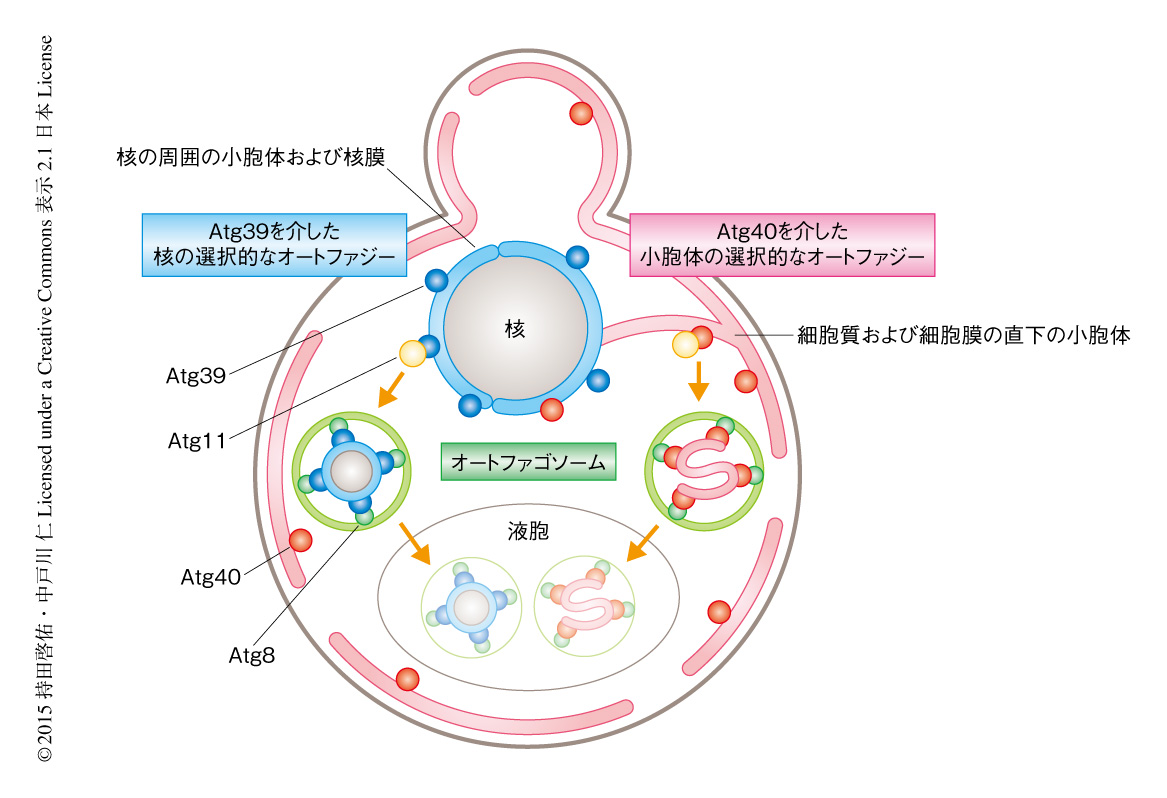
この研究により,細胞において重要なオルガネラである小胞体および核の一部がAtg39あるいはAtg40を介した選択的なオートファジーにより分解されることが示された.Atg39は核膜を核の内部の成分を含む二重膜の小胞として,Atg40は細胞質および細胞膜の直下の小胞体を複雑に折りたたまれた形状で,オートファゴソームに積み込むオートファジー受容体であることが明らかにされた(図1).
この論文と同時にNature誌に掲載された論文においては,FAM134Bがヒトにおける小胞体の選択的なオートファジーを駆動するオートファジー受容体として機能していること,その欠損は感覚神経の障害をひき起こすことが報告された6).アミノ酸配列レベルでの類似性はみられないがreticulonタンパク質ファミリーに類似したドメイン構造をもつなどの共通点から7),FAM134Bは哺乳動物におけるAtg40の機能的なホモログであることが示唆された.Atg39のホモログは近縁種の酵母にしか存在しないが,核の選択的なオートファジーについては哺乳類を含むほかの生物種においても報告のあることから8),同様の機能をはたすオートファジー受容体はこれらの生物にも存在するかもしれない.
タンパク質,脂質,糖,核酸など小胞体および核の成分のうち,飢餓の際に何をオートファジーにより分解することが重要なのかはいまだ不明である.飢餓の際に不足する成分を分解産物として供給することや,飢餓の際に蓄積するなんらかの有害物質を除去することが重要なのかもしれない.さらに,オートファゴソームへと取り込まれる断片化した小胞体や核膜に由来する二重膜の小胞はどのようにして形成されるのか,それらはオートファゴソームの形成と共役して起こるのか,その過程にAtg39あるいはAtg40は関与するのかなど,小胞体の選択的なオートファジーあるいは核の選択的なオートファジーの詳細な分子機構も,今後,解明すべき重要な課題である.
略歴:東京工業大学生命理工学研究科博士課程 在学中.
研究テーマ:オートファジーによる小胞体あるいは核の選択的な分解.
抱負:常識にとらわれない研究をしていきたい.
中戸川 仁(Hitoshi Nakatogawa)
東京工業大学生命理工学研究科 准教授.
研究室URL:http://www.nakatogawa-lab.bio.titech.ac.jp/
© 2015 持田啓佑・中戸川 仁 Licensed under CC 表示 2.1 日本
(東京工業大学生命理工学研究科 生体システム専攻形態形成学分野)
email:持田啓佑
DOI: 10.7875/first.author.2015.080
Receptor-mediated selective autophagy degrades the endoplasmic reticulum and the nucleus.
Keisuke Mochida, Yu Oikawa, Yayoi Kimura, Hiromi Kirisako, Hisashi Hirano, Yoshinori Ohsumi, Hitoshi Nakatogawa
Nature, 522, 359-362 (2015)
要 約
オートファジーは細胞における主要な分解系のひとつであり,無作為の分解のほか,特定のタンパク質やオルガネラを選択的にも分解する.この選択的なオートファジーの標的の認識においては分解の目印になるオートファジー受容体が重要な役割を担う.この研究により,出芽酵母において新規のオートファジー受容体Atg39およびAtg40が同定され,小胞体および核がこれらを介した選択的なオートファジーにより分解されることが明らかにされた.Atg39は核の内部の成分を含む核膜に由来する二重膜の小胞を,Atg40は細胞質や細胞膜の直下の小胞体をオートファゴソームに積み込むことが示された.Atg39を介した核膜および核の内部の成分の分解は窒素飢餓にある細胞の生存に重要であった.Atg40は遺伝性の感覚神経障害の原因遺伝子の産物であるFAM134Bの機能的なホモログであることが示唆された.
はじめに
細胞においては生命活動にともないさまざまな成分が合成されるが,合成された成分が不要あるいは異常になったとき,これらを分解することがきわめて重要になる.オートファジーは真核生物に保存された細胞における大規模な分解系である.細胞質においてカップ状の膜構造が形成されて伸張し,オートファゴソームとよばれる二重膜からなる小胞により細胞質の一部がとりかこまれる.このオートファゴソームは種々の加水分解酵素を含むオルガネラであるリソソームあるいは液胞と融合し,内容物は分解される1).オートファジーは細胞質の成分を無作為に分解するだけでなく,ほかの分解系では分解の困難なオルガネラやタンパク質凝集体などを選択的に認識し分解する.この選択的なオートファジーにおいて,分解すべき標的はオートファジー受容体により認識される.オートファジー受容体は標的に局在してオートファジーによる分解の目印になり,オートファゴソーム膜にあるAtg8との結合を介してオートファゴソームによる標的の選択的な取り込みを駆動する2).これまで,ミトコンドリアやペルオキシソームといったオルガネラが選択的なオートファジーの標的になること,そして,それぞれに特異的なオートファジー受容体が存在することが報告されている3).しかしながら,選択的なオートファジーがそのほかのオルガネラの分解にどのくらい関与するのかは不明であった.
1.Atg39およびAtg40は新規のオートファジー受容体である
既知のすべてのオートファジー受容体はAtg8と結合することから,Atg8結合タンパク質のなかに選択的なオートファジーを駆動する未知のオートファジー受容体が存在するのではないかと考えた.出芽酵母においてAtg8の免疫沈降および質量分析によりAtg8結合タンパク質の網羅的な同定を試みた.得られたタンパク質のなかには2つの機能未知なタンパク質が含まれAtg39およびAtg40と名づけた.Atg39およびAtg40は互いに配列類似性はなく,それぞれ,1つおよび2つの膜貫通領域と予測されるドメインをもっていた.さらに,Atg39およびAtg40には既知のオートファジー受容体に保存されたAtg8相互作用モチーフと予想される配列が見い出された.共免疫沈降法および酵母ツーハイブリッド法の結果,Atg39およびAtg40はAtg8相互作用モチーフを介しAtg8と相互作用することが明らかにされた.また,出芽酵母においてオートファジー受容体はオートファゴソーム膜の形成を駆動するタンパク質をリクルートするAtg11とも相互作用するが,Atg39およびAtg40もAtg11との相互作用が確認された.これらの結果から,Atg39およびAtg40は新たなオートファジー受容体であることが強く示唆された.
2.Atg39あるいはAtg40をオートファジー受容体とする選択的なオートファジーは小胞体を分解する
小胞体はタンパク質や脂質の合成など重要な細胞機能を担うオルガネラである.オートファジーが誘導される飢餓においては小胞体がオートファゴソームに高い頻度で取り込まれることが報告されている4).窒素飢餓を模倣するラパマイシンによる処理により,Atg39およびAtg40の発現量は劇的に上昇した.小胞体膜タンパク質Sec63の分解を指標に小胞体の選択的なオートファジーの活性を調べたところ,Atg39の欠損株あるいはAtg40の欠損株では部分的に,Atg39およびAtg40の二重欠損株ではほぼ完全に,小胞体の選択的なオートファジーが停止した.一方で,Atg39の欠損株あるいはAtg40の欠損株では,液胞内酵素集合体,ミトコンドリア,ペルオキシソームを標的とした選択的なオートファジーおよび細胞質のタンパク質の非選択的なオートファジーに欠損はみられなかったことから,Atg39およびAtg40が小胞体の選択的なオートファジーに特異的に機能することが明らかにされた.さらに,Atg8やAtg11との相互作用の失われるAtg39変異体あるいはAtg40変異体は小胞体の選択的なオートファジーに欠損を示すこと,Atg39の過剰発現あるいはAtg40の過剰発現により小胞体の選択的なオートファジーが亢進すること,GFPと融合したAtg39あるいはAtg40は小胞体に局在しその一部は強い輝点を形成してAtg8やAtg11の輝点と共局在すること,Atg39あるいはAtg40それ自体がオートファジーに依存して液胞に輸送されること,などが示され,Atg39およびAtg40は小胞体の選択的なオートファジーを駆動するオートファジー受容体であると結論づけられた.
3.Atg39は核の周囲の小胞体の分解をAtg40はおもに細胞質や細胞膜の直下の小胞体の分解を誘導する
出芽酵母の小胞体は,核の周囲の小胞体,細胞質の小胞体,細胞膜の直下の小胞体からなる5).Atg39およびAtg40の細胞内局在を調べるため,GFPと融合したAtg39あるいはAtg40を蛍光顕微鏡により観察した.Atg39およびAtg40は小胞体に局在したが,互いに異なる局在パターンを示した.Atg39は核の周囲の小胞体に特異的に局在し,Atg40は一部は核の周囲の小胞体にも存在したが,多くは細胞質や細胞膜の直下の小胞体に局在した.核の周囲の小胞体のタンパク質Hmg1,および,細胞質および細胞膜の直下の小胞体のタンパク質Rtn1をマーカーにして,それぞれの小胞体の分解について調べた.その結果,それぞれの局在と一致して,Atg39の欠損により核の周囲の小胞体の分解に顕著な欠損を生じたが,細胞質および細胞膜の直下の小胞体の分解には影響はなく,一方,Atg40の欠損により核の周囲の小胞体の分解に部分的な欠損がみられたが,細胞質や細胞膜の直下の小胞体の分解はとくに強い欠損を示した.これらの結果から,Atg39は核の周囲の小胞体,Atg40は細胞質および細胞膜の直下の小胞体と,それぞれ異なる小胞体の分解に特化したオートファジー受容体であることが明らかにされた.
電子顕微鏡を用いてオートファゴソームに取り込まれた小胞体の形態を観察した.液胞内プロテアーゼを欠損した細胞をラパマイシンにより処理すると液胞にオートファジックボディが蓄積する.このオートファジックボディはオートファゴソームの内膜からなる小胞で,内部にはオートファジーによる分解物が含まれる.オートファジックボディの内部に小胞体内腔タンパク質Kar2に対する抗体により標識される小胞体の断片が観察された.オートファジックボディの内部の小胞体の形態は一様ではなく,大きく2つに分類された.ひとつは二重膜の小胞の断面と思われる直径200 nmほどのリング状の構造であり,もうひとつはチューブやシートが複雑に折りたたまれたような構造であった.それぞれの割合を野生株とAtg39の欠損株あるいはAtg40の欠損株において定量したところ,リング状の小胞体を含むオートファジックボディはAtg39の欠損によりほぼ完全に消失したがAtg40の欠損により顕著な変化はみられなかった.一方,チューブやシート状の小胞体を含むオートファジックボディの割合はAtg40の欠損により顕著に低下したがAtg39の欠損ではこのような減少はみられなかった.すなわち,オートファゴソームの内部の二重膜の小胞は核の周囲の小胞体に,折りたたまれたチューブやシート状の小胞体は細胞質および細胞膜の直下の小胞体に由来することが示唆された.
4.Atg39を介した選択的なオートファジーによる核の内部の成分の分解
電子顕微鏡による観察において,Atg39に依存的にオートファゴソームに取り込まれる二重膜の小胞の内部にはリボソームのような構造体はほとんどみられなかったことから,細胞質とは異なることが示唆された.二重膜の小胞の膜のあいだの領域に小胞体内腔タンパク質が検出されたこと,また,出芽酵母における核の周囲の小胞体は核膜に相当することなどから,二重膜の小胞の内部には核の内部の成分が存在するのではないかと考えた.実際に,核内膜のタンパク質Src1や核小体のタンパク質Nop1の分解を調べたところ,飢餓においてこれらタンパク質の分解がAtg39に依存して起こることが明らかにされた.さらに,オートファジックボディの内部に存在した二重膜の小胞の内部は,低い頻度ではあるが抗Nop1抗体により標識された.以上の結果から,Atg39をオートファジー受容体として,核の内部の成分を含む核膜に由来する二重膜の小胞がオートファゴソームに取り込まれ分解されること,すなわち,この現象が核の選択的なオートファジーともよぶべき現象であることが明らかにされた.
5.小胞体の選択的なオートファジーあるいは核の選択的なオートファジーの生理的な重要性
Atg39に依存的な核の選択的なオートファジーあるいはAtg40に依存的な小胞体の選択的なオートファジーの破綻が細胞にどのような影響をあたえるのか解析した.細胞を窒素飢餓にさらすとAtg39を欠損した細胞では核の形態に異常がみられ,野生株より早く生存率が低下した.これらの結果から,Atg39を介した核の周囲の小胞体および核の分解が窒素飢餓における細胞の生存に重要な役割をはたすことが示唆された.一方,Atg40を欠損した細胞を窒素飢餓にさらすと細胞の生存率には顕著な低下はみられなかったが,野生株と比較して高密度な細胞膜の直下の小胞体の編み目状の構造が観察された.Atg40に依存的な小胞体の選択的なオートファジーもほかの生理条件では細胞の生死を左右するような重要な役割をはたすかもしれない.
おわりに
この研究により,細胞において重要なオルガネラである小胞体および核の一部がAtg39あるいはAtg40を介した選択的なオートファジーにより分解されることが示された.Atg39は核膜を核の内部の成分を含む二重膜の小胞として,Atg40は細胞質および細胞膜の直下の小胞体を複雑に折りたたまれた形状で,オートファゴソームに積み込むオートファジー受容体であることが明らかにされた(図1).
この論文と同時にNature誌に掲載された論文においては,FAM134Bがヒトにおける小胞体の選択的なオートファジーを駆動するオートファジー受容体として機能していること,その欠損は感覚神経の障害をひき起こすことが報告された6).アミノ酸配列レベルでの類似性はみられないがreticulonタンパク質ファミリーに類似したドメイン構造をもつなどの共通点から7),FAM134Bは哺乳動物におけるAtg40の機能的なホモログであることが示唆された.Atg39のホモログは近縁種の酵母にしか存在しないが,核の選択的なオートファジーについては哺乳類を含むほかの生物種においても報告のあることから8),同様の機能をはたすオートファジー受容体はこれらの生物にも存在するかもしれない.
タンパク質,脂質,糖,核酸など小胞体および核の成分のうち,飢餓の際に何をオートファジーにより分解することが重要なのかはいまだ不明である.飢餓の際に不足する成分を分解産物として供給することや,飢餓の際に蓄積するなんらかの有害物質を除去することが重要なのかもしれない.さらに,オートファゴソームへと取り込まれる断片化した小胞体や核膜に由来する二重膜の小胞はどのようにして形成されるのか,それらはオートファゴソームの形成と共役して起こるのか,その過程にAtg39あるいはAtg40は関与するのかなど,小胞体の選択的なオートファジーあるいは核の選択的なオートファジーの詳細な分子機構も,今後,解明すべき重要な課題である.
文 献
- Nakatogawa, H., Suzuki, K., Kamada, Y. et al.: Dynamics and diversity in autophagy mechanisms: lessons from yeast. Nat. Rev. Mol. Cell Biol., 10, 458-467 (2009)[PubMed]
- Stolz, A., Ernst, A. & Dikic, I.: Cargo recognition and trafficking in selective autophagy. Nat. Cell Biol., 16, 495-501 (2014)[PubMed]
- Okamoto, K.: Organellophagy: eliminating cellular building blocks via selective autophagy. J. Cell Biol., 205, 435-445 (2014)[PubMed]
- Hamasaki, M., Noda, T., Baba, M. et al.: Starvation triggers the delivery of the endoplasmic reticulum to the vacuole via autophagy in yeast. Traffic, 6, 56-65 (2005)[PubMed]
- Friedman, J. R. & Voeltz, G. K.: The ER in 3D: a multifunctional dynamic membrane network. Trends Cell Biol., 21, 709-717 (2011)[PubMed]
- Khaminets, A., Heinrich, T., Mari, M. et al.: Regulation of endoplasmic reticulum turnover by FAM134B-mediated selective autophagy. Nature, 522, 354-358 (2015)[PubMed]
- Voeltz, G. K., Prinz, W. A., Shibata, Y. et al.: A class of membrane proteins shaping the tubular endoplasmic reticulum. Cell, 124, 573-586 (2006)[PubMed]
- Mijaljica, D. & Devenish, R.: Nucleophagy at a glance. J. Cell Sci., 126, 4325-4330 (2013)[PubMed]
著者プロフィール
略歴:東京工業大学生命理工学研究科博士課程 在学中.
研究テーマ:オートファジーによる小胞体あるいは核の選択的な分解.
抱負:常識にとらわれない研究をしていきたい.
中戸川 仁(Hitoshi Nakatogawa)
東京工業大学生命理工学研究科 准教授.
研究室URL:http://www.nakatogawa-lab.bio.titech.ac.jp/
© 2015 持田啓佑・中戸川 仁 Licensed under CC 表示 2.1 日本