オートファジー始動複合体における高等生物に固有なタンパク質Atg101の構造と機能
鈴木浩典・野田展生
(微生物化学研究所 分子構造解析部)
email:鈴木浩典,野田展生
DOI: 10.7875/first.author.2015.078
Structure of the Atg101-Atg13 complex reveals essential roles of Atg101 in autophagy initiation.
Hironori Suzuki, Takeshi Kaizuka, Noboru Mizushima, Nobuo N. Noda
Nature Structural & Molecular Biology, 22, 572-580 (2015)
出芽酵母においてはAtg1,Atg13,Atg17,Atg29,Atg31の5者からなるAtg1複合体がオートファジーの始動を担うのに対し,ヒトなど高等生物においてはAtg1の相同タンパク質であるULK1/2,Atg13,Atg17の機能類縁体であるFIP200,Atg101の4者から構成されるULK複合体がオートファジーの始動を担う.すなわち,高等生物と出芽酵母とではオートファジーの始動にかかわるタンパク質に相違のあることから,それぞれのオートファジーの始動の機構は異なることが予想された.筆者らは,高等生物に固有のタンパク質であるAtg101について,Atg13との複合体としてX線結晶構造解析を行った.Atg101はAtg13結合面と名づけた領域においてAtg13と結合することにより,Atg13の安定化に寄与していることが明らかにされた.一方,Atg13結合面とは反対の側にはWFフィンガーと名づけた特徴的なループ構造が存在し,この構造が下流のAtgタンパク質の集積において必須の役割をはたすことが明らかにされた.
生物が生きるためには,細胞において必要な成分を合成するだけでなく,不要なものあるいは有害なものを分解することも非常に重要である.オートファジーはこのような細胞の機能を維持するため,酵母からヒトにいたる真核生物において広く保存された分解系である1).ヒトにおいては,オートファジーの異常により神経変性疾患,感染症,代謝性疾患など重篤な疾患がひき起こされる2)(蔭山 俊・小松雅明, 領域融合レビュー, 3, e006, 2014 も参照されたい).オートファジーが誘導されると,細胞質に隔離膜とよばれる膜構造が出現し,湾曲,伸長しながら被分解物をとりかこむ.隔離膜の末端がつながることにより形成された二重膜の構造体がオートファゴソームであり,このオートファゴソームは最終的にリソソーム(出芽酵母においては,液胞)と融合し,被分解物はリソソーム酵素により分解される.出芽酵母においてはオートファゴソームの形成の過程において18種類ものオートファジー関連タンパク質(Atgタンパク質)が必須であり3),その多くはヒトなど哺乳類においても保存されている(出芽酵母におけるオートファジーの研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012 も参照されたい).オートファゴソームの形成の分子機構を解明することを目的として,これまで,出芽酵母およびその近縁種に由来するAtgタンパク質を中心にその構造および機能が研究されてきた4)(Atgタンパク質の構造と分子機能については,野田展生・稲垣冬彦, 領域融合レビュー, 3, e012, 2014 も参照されたい).一方で,高等生物に固有のタンパク質も存在し,高等生物におけるオートファゴソームの形成の分子機構を理解するうえでは,それらのタンパク質の構造と機能を明らかにする必要もある.
出芽酵母とヒトなど高等生物とのあいだの相違点のひとつとして,オートファジー始動複合体におけるAtg29,Atg31,Atg101の存在があげられる.出芽酵母においてはAtg1,Atg13,Atg17,Atg29,Atg31の5者からなるAtg1複合体がオートファジーの始動を担うのに対し,ヒトなど高等生物においてはAtg1の相同タンパク質であるULK1/2,Atg13,Atg17の機能類縁体であるFIP200,Atg101の4者から構成されるULK複合体がオートファジーの始動を担う.出芽酵母のAtg1複合体に固有の構成タンパク質であるAtg29およびAtg31はAtg17と直接に相互作用するがAtg13とは結合しない.一方,高等生物のULK複合体に固有の構成タンパク質であるAtg101はAtg17の機能類縁体であるFIP200とは結合せず,Atg13と相互作用してその安定化に寄与する5-7).また,Atg29およびAtg31とAtg101とのあいだにはアミノ酸配列の相同性はない.そのため,Atg101はAtg29およびAtg31の機能類縁体とは考えにくい.その一方,これまで,Atg29およびAtg31とAtg101の両者をもつ生物種は報告されておらず7),その相互排他性の理由は明らかにされていなかった.
今回,筆者らは,Atg101とAtg13との複合体についてX線結晶構造解析を行った.得られた立体構造の情報をもとにin vitroおよびin vivoにおいてそれらの変異体を解析し,なぜ高等生物のオートファジーにはAtg101が必要なのかを明らかにした.
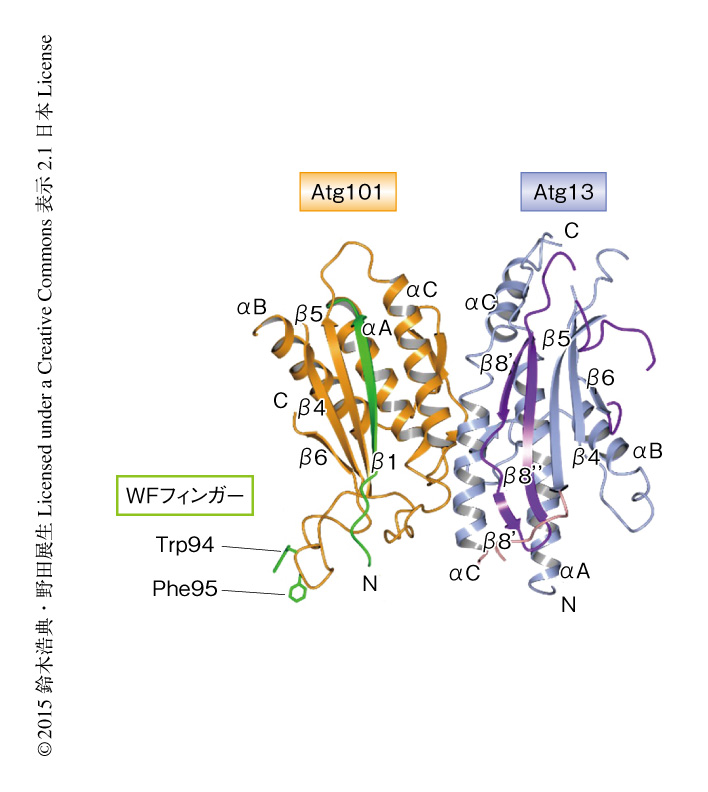
Atg101は出芽酵母やその近縁種には存在せず,分裂酵母からヒトなど高等生物にのみ存在し,それらのオートファジーにおいて必須のタンパク質である.当初,ヒトに由来するAtg101の構造解析を試みたが結晶化に難航した.そこで,進化のうえで哺乳類に近い分裂酵母に着目し,分裂酵母に由来するAtg101をGSTとの融合タンパク質として大腸菌を用いて発現させ精製した.性質は非常に良好であったため単独での結晶化を試みたが,結晶を得るにはいたらなかった.そこで,相互作用の相手であるAtg13との複合体の結晶化へと方針を切り替えた.Atg13はN末端側にHORMAドメインをもち,それ以外の領域は単独では構造をとらない天然変性状態として存在すると予想された.Atg101はAtg13のN末端側と相互作用することがわかっていたため5),分裂酵母に由来するAtg13のN末端側の断片を調製することにした.Atg13のN末端側の断片をGSTとの融合タンパク質として大腸菌を用いて発現させたものの,GSTによるアフィニティー精製ののちの試料は90%程度が凝集しており,GSTタグの除去ができなかった.タグの変更あるいは共発現を試みたものの発現させることはできず,結局,GST融合タンパク質として単独で発現させ,状態のよさそうな10%程度を精製することにした.得られたAtg13のN末端側の断片は単独では濃縮がむずかしいなど性質が悪かったが,Atg101と複合体を形成させたところ性質が劇的に改善し,再現性よく結晶を得ることに成功した.大型放射光施設SPring-8にてX線回折強度データを収集し,水銀を導入した結晶を用いた単波長異常分散法により,Atg101とAtg13のN末端側の断片との複合体の結晶構造を分解能3.0Åで決定した(図1,PDB ID:4YK8).
構造解析の結果,Atg101もまたHORMAドメイン構造をとり,Atg13と互いのHORMAドメインどうしでHORMA-HORMA複合体を形成していることがわかった.HORMAドメインの構造的な特徴はその代表的なタンパク質であるMad2に関して詳細に調べられていた.Mad2は3つのαへリックスと3つのβストランドを安定なコア構造としてもつが,N末端側の領域とC末端側の領域は大規模な構造変化をうけ,結晶構造としては開いた型と閉じた型の少なくとも2つの構造をとることが明らかにされていた8)(NMR法による解析から,2つの構造の中間体のような構造の存在も示唆されていた).Mad2は開いた型と閉じた型とが互いに結合して非対称な二量体を形成するが,Atg101とAtg13との複合体は,Atg101のHORMAドメインが開いた型の構造,Atg13のHORMAドメインが閉じた型の構造をとることにより,Mad2の非対称な二量体と類似した二量体の構造をとることが明らかにされた.開いた型のMad2は非対称な二量体を形成することにより閉じた型のMad2の構造を安定化することが知られていた.すなわち,Atg101のHORMAドメインもまた類似した様式でAtg13のHORMAドメインと結合することにより,その閉じた型の構造を安定化していると考えられた.
これまで,出芽酵母の近縁種であるLachancea thermotoleransに由来するAtg13の結晶構造が報告されており9),閉じた型のHORMAドメイン構造をとることが示されていた.このL. thermotoleransに由来するAtg13においてはHORMAドメインに挿入された領域が“帽子”のような構造をとってHORMAドメインにかぶさることにより,閉じた型のHORMAドメインを固定化していた.この“帽子”の領域は出芽酵母の近縁種に由来するAtg13において高度に保存されていることから,それらのHORMAドメインは単独で安定に存在することが示唆された.それに対し,分裂酵母に由来するAtg13は,配列のうえではこの“帽子”に相当する領域をもつもののアミノ酸残基の保存性の低さから“帽子”状の構造はとらず,HORMAドメインは閉じた型に固定化されていない不安定な状態にあることが明らかにされた.さきに述べたように,試料の調製の際にAtg13のN末端側の断片が凝集する傾向にあったのはこの点に起因していたのかもしれない.アミノ酸配列を比較したところ,そもそもヒトなど高等生物のAtg13には“帽子”に相当する領域は存在しなかった.つまり,高等生物のAtg13は単独では不安定であり,それを安定化するタンパク質としてAtg101を必要とすることが明らかにされた.
Atg101のオートファジーにおける役割を明らかにするため,マウスのAtg101欠損細胞を用いて機能解析を行った.結晶においてみられたAtg101におけるAtg13との相互作用部位をAtg13結合面と名づけた.細胞抽出液をゲルろ過クロマトグラフィーに供したところ,野生型のAtg101を発現させたAtg101欠損細胞においてULK複合体は安定な4者複合体を形成した.構造の情報をもとにAtg13結合面に変異を導入したAtg101をAtg101欠損細胞に発現させたところ,Atg101以外のULK複合体の構成タンパク質は3者複合体を形成したが,変異型のAtg101は単独で挙動した.実際に,顕微鏡による観察において,変異型のAtg101はULK複合体の構成タンパク質であるFIP200と細胞において共局在しなかった.また,哺乳類のオートファジーにおける選択的な基質であるp62が蓄積するなど,オートファジーの活性が顕著に低下していた.以上のことから,Atg101のAtg13結合面はAtg101それ自体がAtg13を介してULK複合体に組み込まれオートファジーにおいて機能するために必須であることが明らかにされた.
一方,Atg101はAtg13結合面とは反対側に特徴的なループ構造をもっていた.このループは通常のHORMAドメインをもつタンパク質には存在せず,この構造がAtg101の単独での結晶化をさまたげていたと考えられた.このループには2つの芳香族アミノ酸残基TrpおよびPheが存在し,結晶におけるパッキングにより隣接するAtg13のHORMAドメインのもつポケットにはまり込んでいた.この2つの残基はすべての生物種のAtg101において保存されており,側鎖を外につきだす構造をとっていたことから,なんらかの重要な機能を担うのではないかと推測された.そこで,このTrpおよびPheを含むループをWFフィンガーと名づけた.WFフィンガーのTrpおよびPheをAlaに置換したAtg101を作製し,in vitroにおけるプルダウン実験を行ったところ,変異型のAtg101は野生型のAtg101と同様にAtg13と結合すること,また,哺乳類細胞を用いた免疫沈降実験からも同様に,変異型のAtg101はAtg13と結合することが観察された.顕微鏡による観察においても,変異型のAtg101は細胞においてFIP200と共局在した.つまり,WFフィンガーに変異をもつAtg101は野生型のAtg101と同様にULK複合体を形成することが可能であった.しかしながら,WFフィンガーに変異をもつAtg101を発現させた細胞では,Atg101欠損細胞やAtg13結合面に変異を導入したAtg101を発現させた細胞と同様に,オートファジーの活性が顕著に低下していた.ULK複合体は下流のAtgタンパク質のオートファゴソームを形成する部位への集積にかかわる.そこで,いくつかの下流のAtgタンパク質の挙動を観察したところ,野生型のAtg101を発現させた細胞においてはその集積が観察されたのに対し,WFフィンガーに変異を導入したAtg101を発現させた細胞においてはその集積が顕著に阻害された.すなわち,Atg101はWFフィンガーを用いて下流のAtgタンパク質をオートファゴソームを形成する部位に集積する機能を担うことが明らかにされた.
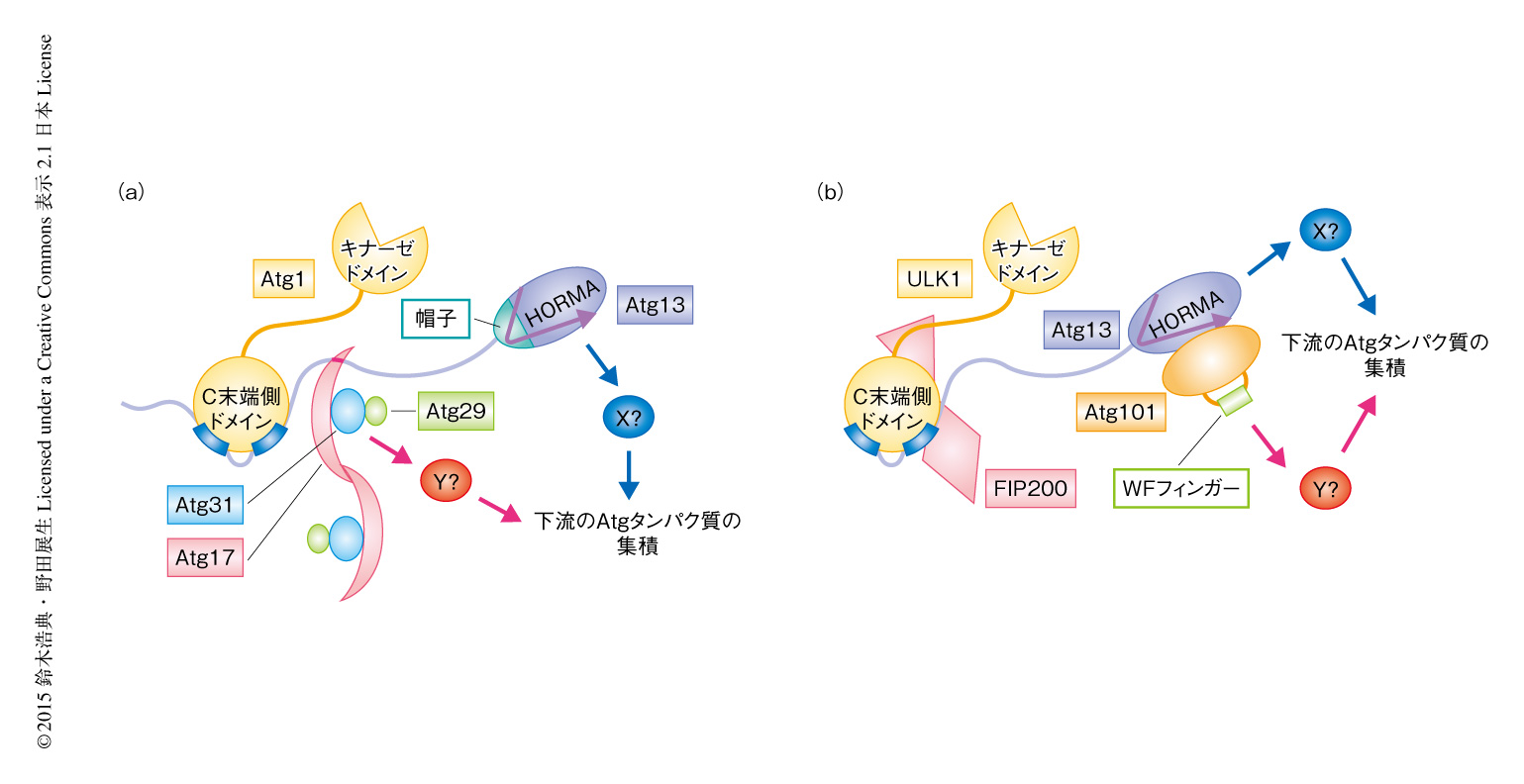
出芽酵母においては,Atg29およびAtg31が下流のAtgタンパク質の集積に関与することが報告されていた10).また最近,出芽酵母のAtg13はHORMAドメインを介し単独で下流のAtgタンパク質のひとつであるAtg9と相互作用することが明らかにされた11)(図2a).高等生物がAtg101をもちAtg29およびAtg31をもたないことの現時点での解釈として,高等生物では進化の過程においてなぜか不安定になったAtg13を安定化するためAtg101が必須になる一方,Atg101がAtg29およびAtg31の機能を兼ね備えることによりAtg29およびAtg31が不要になったと考えられる.下流のAtgタンパク質の集積に際し,Atg101により安定化したAtg13がAtg101と協働的にはたらく可能性も考えられる(図2b).
Atg101とAtg13との複合体の結晶構造の決定,さらに,生化学的および細胞生物学的なアプローチにより,高等生物のオートファジーにおいて固有のタンパク質であるAtg101の担う機能の一端が明らかにされた.これまで,Atg101はAtg13を安定化することが唯一の機能とされてきた.Atg101の不要なL. thermotoleransに由来するAtg13の構造と,Atg101の必要な分裂酵母に由来するAtg13の構造とを比較することにより,なぜ高等な生物ではAtg101のようなAtg13の安定化にはたらくタンパク質が必要になるのか説明された.また,構造解析を出発点として,WFフィンガーを介し下流のAtgタンパク質の集積を担うというAtg101のもつ新たな機能の存在が提唱された.ただし,現時点で,WFフィンガーと直接に相互作用するタンパク質は判明しておらず,Atg101がどのような分子機構によりその機能をはたすのかはわかっていない.WFフィンガーと結合するタンパク質の同定とさらなる構造機能解析を進めることにより,高等生物に特有のオートファジーの始動の機構を明らかにすることが今後の課題である.
略歴:2011年 東京大学大学院薬学系研究科博士課程 修了,同年 同 特任研究員を経て,2013年より微生物化学研究所 博士研究員.
研究テーマ:オートファジーの構造生物学.
抱負:少水常流如穿石.
野田 展生(Nobuo N. Noda)
微生物化学研究所 主席研究員.
© 2015 鈴木浩典・野田展生 Licensed under CC 表示 2.1 日本
(微生物化学研究所 分子構造解析部)
email:鈴木浩典,野田展生
DOI: 10.7875/first.author.2015.078
Structure of the Atg101-Atg13 complex reveals essential roles of Atg101 in autophagy initiation.
Hironori Suzuki, Takeshi Kaizuka, Noboru Mizushima, Nobuo N. Noda
Nature Structural & Molecular Biology, 22, 572-580 (2015)
要 約
出芽酵母においてはAtg1,Atg13,Atg17,Atg29,Atg31の5者からなるAtg1複合体がオートファジーの始動を担うのに対し,ヒトなど高等生物においてはAtg1の相同タンパク質であるULK1/2,Atg13,Atg17の機能類縁体であるFIP200,Atg101の4者から構成されるULK複合体がオートファジーの始動を担う.すなわち,高等生物と出芽酵母とではオートファジーの始動にかかわるタンパク質に相違のあることから,それぞれのオートファジーの始動の機構は異なることが予想された.筆者らは,高等生物に固有のタンパク質であるAtg101について,Atg13との複合体としてX線結晶構造解析を行った.Atg101はAtg13結合面と名づけた領域においてAtg13と結合することにより,Atg13の安定化に寄与していることが明らかにされた.一方,Atg13結合面とは反対の側にはWFフィンガーと名づけた特徴的なループ構造が存在し,この構造が下流のAtgタンパク質の集積において必須の役割をはたすことが明らかにされた.
はじめに
生物が生きるためには,細胞において必要な成分を合成するだけでなく,不要なものあるいは有害なものを分解することも非常に重要である.オートファジーはこのような細胞の機能を維持するため,酵母からヒトにいたる真核生物において広く保存された分解系である1).ヒトにおいては,オートファジーの異常により神経変性疾患,感染症,代謝性疾患など重篤な疾患がひき起こされる2)(蔭山 俊・小松雅明, 領域融合レビュー, 3, e006, 2014 も参照されたい).オートファジーが誘導されると,細胞質に隔離膜とよばれる膜構造が出現し,湾曲,伸長しながら被分解物をとりかこむ.隔離膜の末端がつながることにより形成された二重膜の構造体がオートファゴソームであり,このオートファゴソームは最終的にリソソーム(出芽酵母においては,液胞)と融合し,被分解物はリソソーム酵素により分解される.出芽酵母においてはオートファゴソームの形成の過程において18種類ものオートファジー関連タンパク質(Atgタンパク質)が必須であり3),その多くはヒトなど哺乳類においても保存されている(出芽酵母におけるオートファジーの研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012 も参照されたい).オートファゴソームの形成の分子機構を解明することを目的として,これまで,出芽酵母およびその近縁種に由来するAtgタンパク質を中心にその構造および機能が研究されてきた4)(Atgタンパク質の構造と分子機能については,野田展生・稲垣冬彦, 領域融合レビュー, 3, e012, 2014 も参照されたい).一方で,高等生物に固有のタンパク質も存在し,高等生物におけるオートファゴソームの形成の分子機構を理解するうえでは,それらのタンパク質の構造と機能を明らかにする必要もある.
出芽酵母とヒトなど高等生物とのあいだの相違点のひとつとして,オートファジー始動複合体におけるAtg29,Atg31,Atg101の存在があげられる.出芽酵母においてはAtg1,Atg13,Atg17,Atg29,Atg31の5者からなるAtg1複合体がオートファジーの始動を担うのに対し,ヒトなど高等生物においてはAtg1の相同タンパク質であるULK1/2,Atg13,Atg17の機能類縁体であるFIP200,Atg101の4者から構成されるULK複合体がオートファジーの始動を担う.出芽酵母のAtg1複合体に固有の構成タンパク質であるAtg29およびAtg31はAtg17と直接に相互作用するがAtg13とは結合しない.一方,高等生物のULK複合体に固有の構成タンパク質であるAtg101はAtg17の機能類縁体であるFIP200とは結合せず,Atg13と相互作用してその安定化に寄与する5-7).また,Atg29およびAtg31とAtg101とのあいだにはアミノ酸配列の相同性はない.そのため,Atg101はAtg29およびAtg31の機能類縁体とは考えにくい.その一方,これまで,Atg29およびAtg31とAtg101の両者をもつ生物種は報告されておらず7),その相互排他性の理由は明らかにされていなかった.
今回,筆者らは,Atg101とAtg13との複合体についてX線結晶構造解析を行った.得られた立体構造の情報をもとにin vitroおよびin vivoにおいてそれらの変異体を解析し,なぜ高等生物のオートファジーにはAtg101が必要なのかを明らかにした.
1.Atg101とAtg13との複合体のX線結晶構造解析
Atg101は出芽酵母やその近縁種には存在せず,分裂酵母からヒトなど高等生物にのみ存在し,それらのオートファジーにおいて必須のタンパク質である.当初,ヒトに由来するAtg101の構造解析を試みたが結晶化に難航した.そこで,進化のうえで哺乳類に近い分裂酵母に着目し,分裂酵母に由来するAtg101をGSTとの融合タンパク質として大腸菌を用いて発現させ精製した.性質は非常に良好であったため単独での結晶化を試みたが,結晶を得るにはいたらなかった.そこで,相互作用の相手であるAtg13との複合体の結晶化へと方針を切り替えた.Atg13はN末端側にHORMAドメインをもち,それ以外の領域は単独では構造をとらない天然変性状態として存在すると予想された.Atg101はAtg13のN末端側と相互作用することがわかっていたため5),分裂酵母に由来するAtg13のN末端側の断片を調製することにした.Atg13のN末端側の断片をGSTとの融合タンパク質として大腸菌を用いて発現させたものの,GSTによるアフィニティー精製ののちの試料は90%程度が凝集しており,GSTタグの除去ができなかった.タグの変更あるいは共発現を試みたものの発現させることはできず,結局,GST融合タンパク質として単独で発現させ,状態のよさそうな10%程度を精製することにした.得られたAtg13のN末端側の断片は単独では濃縮がむずかしいなど性質が悪かったが,Atg101と複合体を形成させたところ性質が劇的に改善し,再現性よく結晶を得ることに成功した.大型放射光施設SPring-8にてX線回折強度データを収集し,水銀を導入した結晶を用いた単波長異常分散法により,Atg101とAtg13のN末端側の断片との複合体の結晶構造を分解能3.0Åで決定した(図1,PDB ID:4YK8).
2.Atg101とAtg13との複合体はHORMA-HORMA複合体を形成する
構造解析の結果,Atg101もまたHORMAドメイン構造をとり,Atg13と互いのHORMAドメインどうしでHORMA-HORMA複合体を形成していることがわかった.HORMAドメインの構造的な特徴はその代表的なタンパク質であるMad2に関して詳細に調べられていた.Mad2は3つのαへリックスと3つのβストランドを安定なコア構造としてもつが,N末端側の領域とC末端側の領域は大規模な構造変化をうけ,結晶構造としては開いた型と閉じた型の少なくとも2つの構造をとることが明らかにされていた8)(NMR法による解析から,2つの構造の中間体のような構造の存在も示唆されていた).Mad2は開いた型と閉じた型とが互いに結合して非対称な二量体を形成するが,Atg101とAtg13との複合体は,Atg101のHORMAドメインが開いた型の構造,Atg13のHORMAドメインが閉じた型の構造をとることにより,Mad2の非対称な二量体と類似した二量体の構造をとることが明らかにされた.開いた型のMad2は非対称な二量体を形成することにより閉じた型のMad2の構造を安定化することが知られていた.すなわち,Atg101のHORMAドメインもまた類似した様式でAtg13のHORMAドメインと結合することにより,その閉じた型の構造を安定化していると考えられた.
これまで,出芽酵母の近縁種であるLachancea thermotoleransに由来するAtg13の結晶構造が報告されており9),閉じた型のHORMAドメイン構造をとることが示されていた.このL. thermotoleransに由来するAtg13においてはHORMAドメインに挿入された領域が“帽子”のような構造をとってHORMAドメインにかぶさることにより,閉じた型のHORMAドメインを固定化していた.この“帽子”の領域は出芽酵母の近縁種に由来するAtg13において高度に保存されていることから,それらのHORMAドメインは単独で安定に存在することが示唆された.それに対し,分裂酵母に由来するAtg13は,配列のうえではこの“帽子”に相当する領域をもつもののアミノ酸残基の保存性の低さから“帽子”状の構造はとらず,HORMAドメインは閉じた型に固定化されていない不安定な状態にあることが明らかにされた.さきに述べたように,試料の調製の際にAtg13のN末端側の断片が凝集する傾向にあったのはこの点に起因していたのかもしれない.アミノ酸配列を比較したところ,そもそもヒトなど高等生物のAtg13には“帽子”に相当する領域は存在しなかった.つまり,高等生物のAtg13は単独では不安定であり,それを安定化するタンパク質としてAtg101を必要とすることが明らかにされた.
3.Atg101のオートファジーにおける役割
Atg101のオートファジーにおける役割を明らかにするため,マウスのAtg101欠損細胞を用いて機能解析を行った.結晶においてみられたAtg101におけるAtg13との相互作用部位をAtg13結合面と名づけた.細胞抽出液をゲルろ過クロマトグラフィーに供したところ,野生型のAtg101を発現させたAtg101欠損細胞においてULK複合体は安定な4者複合体を形成した.構造の情報をもとにAtg13結合面に変異を導入したAtg101をAtg101欠損細胞に発現させたところ,Atg101以外のULK複合体の構成タンパク質は3者複合体を形成したが,変異型のAtg101は単独で挙動した.実際に,顕微鏡による観察において,変異型のAtg101はULK複合体の構成タンパク質であるFIP200と細胞において共局在しなかった.また,哺乳類のオートファジーにおける選択的な基質であるp62が蓄積するなど,オートファジーの活性が顕著に低下していた.以上のことから,Atg101のAtg13結合面はAtg101それ自体がAtg13を介してULK複合体に組み込まれオートファジーにおいて機能するために必須であることが明らかにされた.
一方,Atg101はAtg13結合面とは反対側に特徴的なループ構造をもっていた.このループは通常のHORMAドメインをもつタンパク質には存在せず,この構造がAtg101の単独での結晶化をさまたげていたと考えられた.このループには2つの芳香族アミノ酸残基TrpおよびPheが存在し,結晶におけるパッキングにより隣接するAtg13のHORMAドメインのもつポケットにはまり込んでいた.この2つの残基はすべての生物種のAtg101において保存されており,側鎖を外につきだす構造をとっていたことから,なんらかの重要な機能を担うのではないかと推測された.そこで,このTrpおよびPheを含むループをWFフィンガーと名づけた.WFフィンガーのTrpおよびPheをAlaに置換したAtg101を作製し,in vitroにおけるプルダウン実験を行ったところ,変異型のAtg101は野生型のAtg101と同様にAtg13と結合すること,また,哺乳類細胞を用いた免疫沈降実験からも同様に,変異型のAtg101はAtg13と結合することが観察された.顕微鏡による観察においても,変異型のAtg101は細胞においてFIP200と共局在した.つまり,WFフィンガーに変異をもつAtg101は野生型のAtg101と同様にULK複合体を形成することが可能であった.しかしながら,WFフィンガーに変異をもつAtg101を発現させた細胞では,Atg101欠損細胞やAtg13結合面に変異を導入したAtg101を発現させた細胞と同様に,オートファジーの活性が顕著に低下していた.ULK複合体は下流のAtgタンパク質のオートファゴソームを形成する部位への集積にかかわる.そこで,いくつかの下流のAtgタンパク質の挙動を観察したところ,野生型のAtg101を発現させた細胞においてはその集積が観察されたのに対し,WFフィンガーに変異を導入したAtg101を発現させた細胞においてはその集積が顕著に阻害された.すなわち,Atg101はWFフィンガーを用いて下流のAtgタンパク質をオートファゴソームを形成する部位に集積する機能を担うことが明らかにされた.
出芽酵母においては,Atg29およびAtg31が下流のAtgタンパク質の集積に関与することが報告されていた10).また最近,出芽酵母のAtg13はHORMAドメインを介し単独で下流のAtgタンパク質のひとつであるAtg9と相互作用することが明らかにされた11)(図2a).高等生物がAtg101をもちAtg29およびAtg31をもたないことの現時点での解釈として,高等生物では進化の過程においてなぜか不安定になったAtg13を安定化するためAtg101が必須になる一方,Atg101がAtg29およびAtg31の機能を兼ね備えることによりAtg29およびAtg31が不要になったと考えられる.下流のAtgタンパク質の集積に際し,Atg101により安定化したAtg13がAtg101と協働的にはたらく可能性も考えられる(図2b).
おわりに
Atg101とAtg13との複合体の結晶構造の決定,さらに,生化学的および細胞生物学的なアプローチにより,高等生物のオートファジーにおいて固有のタンパク質であるAtg101の担う機能の一端が明らかにされた.これまで,Atg101はAtg13を安定化することが唯一の機能とされてきた.Atg101の不要なL. thermotoleransに由来するAtg13の構造と,Atg101の必要な分裂酵母に由来するAtg13の構造とを比較することにより,なぜ高等な生物ではAtg101のようなAtg13の安定化にはたらくタンパク質が必要になるのか説明された.また,構造解析を出発点として,WFフィンガーを介し下流のAtgタンパク質の集積を担うというAtg101のもつ新たな機能の存在が提唱された.ただし,現時点で,WFフィンガーと直接に相互作用するタンパク質は判明しておらず,Atg101がどのような分子機構によりその機能をはたすのかはわかっていない.WFフィンガーと結合するタンパク質の同定とさらなる構造機能解析を進めることにより,高等生物に特有のオートファジーの始動の機構を明らかにすることが今後の課題である.
文 献
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Mizushima, N., Levine, B., Cuervo, A. M. et al.: Autophagy fights disease through cellular self-digestion. Nature, 451, 1069-1075 (2008)[PubMed]
- Mizushima, N., Yoshimori, T. & Ohsumi, Y.: The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107-132 (2011)[PubMed]
- Noda, N. N. & Inagaki, F.: Mechanisms of autophagy. Annu. Rev. Biophys., 44, 101-122 (2015)[PubMed]
- Mercer, C. A., Kaliappan, A. & Dennis, P. B.: A novel, human Atg13 binding protein, Atg101, interacts with ULK1 and is essential for macroautophagy. Autophagy, 5, 649-662 (2009)[PubMed]
- Hosokawa, N., Sasaki, T., Iemura, S. et al.: Atg101, a novel mammalian autophagy protein interacting with Atg13. Autophagy, 5, 973-979 (2009)[PubMed]
- Mizushima, N.: The role of the Atg1/ULK1 complex in autophagy regulation. Curr. Opin. Cell Biol., 22, 132-139 (2010)[PubMed]
- Mapelli, M., Massimiliano, L., Santaguida, S. et al.: The Mad2 conformational dimer: structure and implications for the spindle assembly checkpoint. Cell, 131, 730-743 (2007)[PubMed]
- Jao, C. C., Ragusa, M. J., Stanley, R. E. et al.: A HORMA domain in Atg13 mediates PI 3-kinase recruitment in autophagy. Proc. Natl. Acad. Sci. USA, 110, 5486-5491 (2013)[PubMed]
- Kawamata, T., Kamada, Y., Kabeya, Y. et al.: Organization of the pre-autophagosomal structure responsible for autophagosome formation. Mol. Biol. Cell, 19, 2039-2050 (2008)[PubMed]
- Suzuki, S. W., Yamamoto, H., Oikawa, Y. et al.: Atg13 HORMA domain recruits Atg9 vesicles during autophagosome formation. Proc. Natl. Acad. Sci. USA, 112, 3350-3355 (2015)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院薬学系研究科博士課程 修了,同年 同 特任研究員を経て,2013年より微生物化学研究所 博士研究員.
研究テーマ:オートファジーの構造生物学.
抱負:少水常流如穿石.
野田 展生(Nobuo N. Noda)
微生物化学研究所 主席研究員.
© 2015 鈴木浩典・野田展生 Licensed under CC 表示 2.1 日本