損傷した細胞の検知にかかわるDNGR-1とアクチン線維との複合体のクライオ電子顕微鏡法を用いた構造解析
藤井 高志
(大阪大学生命機能研究科 プロトニックナノマシン研究室)
email:藤井高志
DOI: 10.7875/first.author.2015.075
Structure of the complex of F-actin and DNGR-1, a C-type lectin receptor involved in dendritic cell cross-presentation of dead cell-associated antigens.
Pavel Hanč, Takashi Fujii, Salvador Iborra, Yurika Yamada, Jatta Huotari, Oliver Schulz, Susan Ahrens, Svend Kjær, Michael Way, David Sancho, Keiichi Namba, Caetano Reis e Sousa
Immunity, 42, 839-849 (2015)
免疫系は細胞の健康状態をつねに監視し,傷ついた細胞を検出し除去する分子機構を進化させてきた.そのような分子機構のひとつとして,樹状細胞にある受容体DNGR-1は,細胞骨格を構成するアクチン線維をリガンドとして認識することにより傷ついた細胞を検出し,そののちの一連の免疫応答をひき起こし傷ついた細胞を除去する.クライオ電子顕顕微鏡を用いた単粒子解析法による高分解能の構造解析と変異体の解析とを組み合わせることにより,DNGR-1によるアクチン線維の検出の機構が明らかにされた.
免疫系は外敵を認識し排除する分子機構だけでなく,細胞の健康状態をつねに監視し傷ついた細胞を検出し除去する分子機構を進化させてきた.たとえば,けがなど組織の物理的な損傷の際に,患部にある破壊された細胞は食細胞により早急に除去され組織の修復がはじまる.このように,細胞の損傷や死はその場で“何かよからぬこと”の起っているサインであり,損傷を封じ込め組織を修復するためすばやい免疫応答はきわめて重要である.昨今,損傷をうけた組織から生じる種々の分子のパターンである損傷関連分子パターン(damage-associated molecular pattern:DAMP)を認識し応答する分子機構はホットなトピックになっている.しかしながら,この傷ついた細胞の認識,および,そののちの一連の免疫応答についてはこれまでほとんど明らかにされていない.とくに,どんな分子を認識してその細胞を傷ついていると判定しているのかについては不明であった.そんななか,樹状細胞にある受容体DNGR-1が細胞骨格を構成するアクチン線維をリガンドとして認識し(単量体アクチンは認識しない),この一連の免疫応答をひき起こしていることが明らかにされた1,2).また,同じ時期に,DNGR-1の細胞外ドメインのX線結晶構造が明らかにされた3).
DNGR-1はジスルフィド結合を介したホモ二量体として存在する膜タンパク質であり,C型レクチンファミリーに属する.細胞外ドメインにC型レクチン様ドメインを1つのもち,これによりリガンドと結合すると考えられている.しかし,実際にアクチン線維とDNGR-1とがどのように結合し,そのシグナルが樹状細胞に伝達されているのかは明らかにされていなかった.筆者らは,クライオ電子顕微鏡を用いた単粒子解析法により,ヒトのβアクチン線維とマウスのDNGR-1との複合体の構造生物学的な基盤について明らかにした.
クライオ電子顕微鏡を用いた単粒子解析法においては,直径0.6μmほどの穴の無数に開いたカーボンの薄膜を載せた試料グリッドのうえに生体分子の水溶液をおき,その大半をろ紙で吸い取り,試料グリッドを液体エタンに突入させて急速に凍結し,これを試料として電子顕微鏡に挿入する.こうして生体分子を厚さ30~100 nmの非晶質の氷の薄膜に閉じ込め,電子線による投影像を撮影する.電子顕微鏡の分解能それ自体は個々の原子の並びを解像できるほど高いが,生体分子は水素結合などの弱い結合により立体構造を保持しているため電子線による損傷がきわめて大きく,損傷をさけるために電子線の照射量を低く抑えざるをえないため,ノイズのレベルが高くコントラストの低い像しか得られない.高分解能の像の情報が記録されているにもかかわらず,その情報は高いレベルのノイズにうもれてしまっている.ノイズを抑えて高分解能の像の情報をうかびあがらせるには,均一な構造の生体分子から数千数万もの数多くの像を収集し,その投影方向ごとに分類して整列し平均する必要がある.この分類,整列,平均により十分な数の方向で高分解能の投影像が得られれば,原理的には病院で行われているX線CTと同じ計算法により立体像を再構成することができる.(ただし,X線CTでは同一の個体から得た像を再構成するのに対し,クライオ電子顕微鏡を用いた単粒子解析法では多数の同じ生体分子から得た像から再構成する).線維状の複合体の場合には,電子線に対し線維の軸はほぼ垂直になるため,容易に全方位角の像を得ることができる.
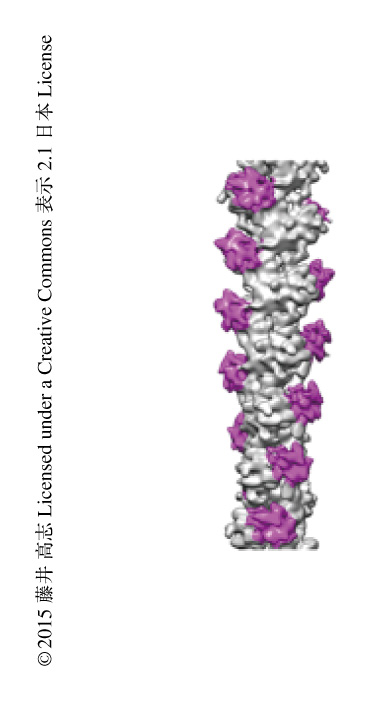
ヒトのβアクチンを重合して線維化し,精製したマウスのDNGR-1と混合することにより複合体を作製した.クライオ電子顕微鏡法により高分解能のデータを収集するため,これまでの経験をもとに氷の包埋の条件を幅広く検討することにより,複合体の形成率および薄い氷を作成できる条件を見い出すことができた4)(新着論文レビュー でも掲載).DNGR-1は溶液において二量体を形成しており,アクチン線維と結合したとき,二量体のもう片方のDNGR-1がほかのアクチン線維と結合してバンドル化することが懸念されたが,線維は単分散しておりバンドル状の凝集体は形成されていなかった.これは,DNGR-1二量体はひとつの線維に結合していることを示唆した.DNGR-1二量体の結合ドメインのあいだの距離は概算して5.4 nm以上はあり,ひとつの線維に対しDNGR-1二量体の結合ドメインが直列に結合することは十分に可能であった.この単分散した線維をクライオ電子顕微鏡法により観察することにより大量の画像データを取得した.らせん対称性を用いて,7.7Åの分解能でDNGR-1とアクチン線維の複合体の構造を再構成することができた(PDB ID:3J82).アクチン線維は2本の素線維がリボンのようにからみあった構造をしていたが,DNGR-1はその2本の素線維のあいだにはまり込むように結合していた(図1).つまり,DNGR-1はアクチン線維を構成する複数のアクチンサブユニットと相互作用することにより安定な複合体を形成していた.この事実から,DNGR-1はアクチンと安定な複合体を形成する際に,アクチン線維とのみ結合しアクチンサブユニットとは結合しないというこれまでの知見が構造生物学的に証明された.
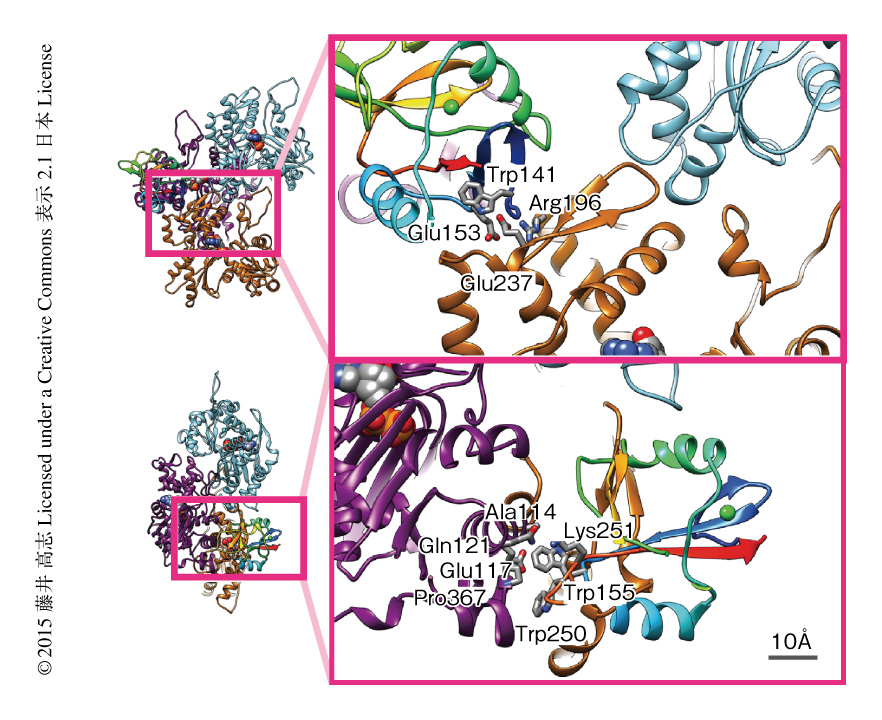
クライオ電子顕微鏡法により得られた構造からDNGR-1のアクチン線維に対する結合部位を予測し,実際に結合にかかわりそうなアミノ酸残基をAlaに置換することによりそれぞれのアミノ酸残基の役割を同定した.DNGR-1は3つのアクチンサブユニットと相互作用しており,19個のアミノ酸残基がアクチン線維に対する結合部位の候補になった.ドットブロット実験によりDNGR-1のアクチン線維に対する結合能を調べたところ,Trp141,Glu153,Trp155,Trp250をAlaに置換するとアクチン線維との結合能が失われた(図2).また,HeLa細胞に紫外線を照射することにより死細胞とし,蛍光セルソーターを用いて死細胞および蛍光色素で標識したDNGR-1を検出することにより,DNGR-1に結合した死細胞を検出した.この実験の結果もドットブロット実験の結果と一致し,Trp141,Glu153,Trp155,Trp250をAlaに置換するとDNGR-1の死細胞に対する結合能が失われた.
アクチン線維は細胞形態の維持および変形を担う細胞骨格としての役割だけでなく,多種多様なタンパク質と相互作用し細胞内相互作用ネットワークのハブともいえる役割も担う.たとえば,細胞における物質輸送に使われるミオシンはその代表的なものである.これまでに,ミオシン,コフィリン,ビンキュリン,フィンブリン,Arp2/3,SipA,コロニンについては,精度の差こそあれ,アクチンにおける結合部位が明らかにされている.その多くはアクチンのストランドに存在し,2つのストランドを架橋するようには存在していない.また,ストランドを架橋するように結合しているSipA,コロニン,Arp2/3は,比較的広い範囲にわたり4つ以上のアクチンサブユニットと結合していることが示唆されている.しかしながら,サブナノメートルの分解能で構造が明らかにされているのはミオシン,コフィリン,コロニンのみで,アクチンとの結合の様式が高い分解能で調べられているタンパク質は少ないため,はっきりしたことは依然として不明である.
一方で,DNGR-1は,ほぼ4つのアミノ酸残基がアクチンとの結合に決定的な役割を担っていた.そのため,アクチン線維のねじれの変化など,構造の変化に対してその結合力が大きく左右されることが予想された.アクチンにおけるDNGR-1との結合部位はユビキチン化,リン酸化,ニトロ化など翻訳後修飾の起こりやすい部位であることが指摘されている5).細胞の代謝や細胞死の途上においてアクチン結合タンパク質や翻訳後修飾によりアクチン線維の構造が変化し,DNGR-1との結合能が変化することは十分に起こりうる.その結果,死細胞に対する免疫応答が制御されている可能性がある.
自然免疫は急速に理解の深まっている分野であるが,その構造生物学な基盤はほとんど解明されていない.クライオ電子顕微鏡法はその急速な進展により構造生物学になくてはならない手法になりつつある.これまで構造解析が非常に困難であった生体分子の構造が高分解能で解析されつつあり,今後は,興味深い生命現象と連関する生体分子の高分解能での構造解析が進むものと思われる.今回の研究のように,構造生物学と免疫学といったいっけん大きく離れた異分野との共同研究により,相補的な進展のもたらされることを期待している.
略歴:2009年 大阪大学大学院生命機能研究科にて博士号取得,2012年 理化学研究所生命システム研究センター 基礎科学特別研究員を経て,2015年より科学技術振興機構 さきがけ専任研究者.
研究テーマ:クライオ電子顕微鏡法による生体超分子の高分解能での構造解析.
© 2015 藤井 高志 Licensed under CC 表示 2.1 日本
(大阪大学生命機能研究科 プロトニックナノマシン研究室)
email:藤井高志
DOI: 10.7875/first.author.2015.075
Structure of the complex of F-actin and DNGR-1, a C-type lectin receptor involved in dendritic cell cross-presentation of dead cell-associated antigens.
Pavel Hanč, Takashi Fujii, Salvador Iborra, Yurika Yamada, Jatta Huotari, Oliver Schulz, Susan Ahrens, Svend Kjær, Michael Way, David Sancho, Keiichi Namba, Caetano Reis e Sousa
Immunity, 42, 839-849 (2015)
要 約
免疫系は細胞の健康状態をつねに監視し,傷ついた細胞を検出し除去する分子機構を進化させてきた.そのような分子機構のひとつとして,樹状細胞にある受容体DNGR-1は,細胞骨格を構成するアクチン線維をリガンドとして認識することにより傷ついた細胞を検出し,そののちの一連の免疫応答をひき起こし傷ついた細胞を除去する.クライオ電子顕顕微鏡を用いた単粒子解析法による高分解能の構造解析と変異体の解析とを組み合わせることにより,DNGR-1によるアクチン線維の検出の機構が明らかにされた.
はじめに
免疫系は外敵を認識し排除する分子機構だけでなく,細胞の健康状態をつねに監視し傷ついた細胞を検出し除去する分子機構を進化させてきた.たとえば,けがなど組織の物理的な損傷の際に,患部にある破壊された細胞は食細胞により早急に除去され組織の修復がはじまる.このように,細胞の損傷や死はその場で“何かよからぬこと”の起っているサインであり,損傷を封じ込め組織を修復するためすばやい免疫応答はきわめて重要である.昨今,損傷をうけた組織から生じる種々の分子のパターンである損傷関連分子パターン(damage-associated molecular pattern:DAMP)を認識し応答する分子機構はホットなトピックになっている.しかしながら,この傷ついた細胞の認識,および,そののちの一連の免疫応答についてはこれまでほとんど明らかにされていない.とくに,どんな分子を認識してその細胞を傷ついていると判定しているのかについては不明であった.そんななか,樹状細胞にある受容体DNGR-1が細胞骨格を構成するアクチン線維をリガンドとして認識し(単量体アクチンは認識しない),この一連の免疫応答をひき起こしていることが明らかにされた1,2).また,同じ時期に,DNGR-1の細胞外ドメインのX線結晶構造が明らかにされた3).
DNGR-1はジスルフィド結合を介したホモ二量体として存在する膜タンパク質であり,C型レクチンファミリーに属する.細胞外ドメインにC型レクチン様ドメインを1つのもち,これによりリガンドと結合すると考えられている.しかし,実際にアクチン線維とDNGR-1とがどのように結合し,そのシグナルが樹状細胞に伝達されているのかは明らかにされていなかった.筆者らは,クライオ電子顕微鏡を用いた単粒子解析法により,ヒトのβアクチン線維とマウスのDNGR-1との複合体の構造生物学的な基盤について明らかにした.
1.クライオ電子顕微鏡法を用いた単粒子解析法
クライオ電子顕微鏡を用いた単粒子解析法においては,直径0.6μmほどの穴の無数に開いたカーボンの薄膜を載せた試料グリッドのうえに生体分子の水溶液をおき,その大半をろ紙で吸い取り,試料グリッドを液体エタンに突入させて急速に凍結し,これを試料として電子顕微鏡に挿入する.こうして生体分子を厚さ30~100 nmの非晶質の氷の薄膜に閉じ込め,電子線による投影像を撮影する.電子顕微鏡の分解能それ自体は個々の原子の並びを解像できるほど高いが,生体分子は水素結合などの弱い結合により立体構造を保持しているため電子線による損傷がきわめて大きく,損傷をさけるために電子線の照射量を低く抑えざるをえないため,ノイズのレベルが高くコントラストの低い像しか得られない.高分解能の像の情報が記録されているにもかかわらず,その情報は高いレベルのノイズにうもれてしまっている.ノイズを抑えて高分解能の像の情報をうかびあがらせるには,均一な構造の生体分子から数千数万もの数多くの像を収集し,その投影方向ごとに分類して整列し平均する必要がある.この分類,整列,平均により十分な数の方向で高分解能の投影像が得られれば,原理的には病院で行われているX線CTと同じ計算法により立体像を再構成することができる.(ただし,X線CTでは同一の個体から得た像を再構成するのに対し,クライオ電子顕微鏡を用いた単粒子解析法では多数の同じ生体分子から得た像から再構成する).線維状の複合体の場合には,電子線に対し線維の軸はほぼ垂直になるため,容易に全方位角の像を得ることができる.
2.構造解析
ヒトのβアクチンを重合して線維化し,精製したマウスのDNGR-1と混合することにより複合体を作製した.クライオ電子顕微鏡法により高分解能のデータを収集するため,これまでの経験をもとに氷の包埋の条件を幅広く検討することにより,複合体の形成率および薄い氷を作成できる条件を見い出すことができた4)(新着論文レビュー でも掲載).DNGR-1は溶液において二量体を形成しており,アクチン線維と結合したとき,二量体のもう片方のDNGR-1がほかのアクチン線維と結合してバンドル化することが懸念されたが,線維は単分散しておりバンドル状の凝集体は形成されていなかった.これは,DNGR-1二量体はひとつの線維に結合していることを示唆した.DNGR-1二量体の結合ドメインのあいだの距離は概算して5.4 nm以上はあり,ひとつの線維に対しDNGR-1二量体の結合ドメインが直列に結合することは十分に可能であった.この単分散した線維をクライオ電子顕微鏡法により観察することにより大量の画像データを取得した.らせん対称性を用いて,7.7Åの分解能でDNGR-1とアクチン線維の複合体の構造を再構成することができた(PDB ID:3J82).アクチン線維は2本の素線維がリボンのようにからみあった構造をしていたが,DNGR-1はその2本の素線維のあいだにはまり込むように結合していた(図1).つまり,DNGR-1はアクチン線維を構成する複数のアクチンサブユニットと相互作用することにより安定な複合体を形成していた.この事実から,DNGR-1はアクチンと安定な複合体を形成する際に,アクチン線維とのみ結合しアクチンサブユニットとは結合しないというこれまでの知見が構造生物学的に証明された.
3.変異体の解析
クライオ電子顕微鏡法により得られた構造からDNGR-1のアクチン線維に対する結合部位を予測し,実際に結合にかかわりそうなアミノ酸残基をAlaに置換することによりそれぞれのアミノ酸残基の役割を同定した.DNGR-1は3つのアクチンサブユニットと相互作用しており,19個のアミノ酸残基がアクチン線維に対する結合部位の候補になった.ドットブロット実験によりDNGR-1のアクチン線維に対する結合能を調べたところ,Trp141,Glu153,Trp155,Trp250をAlaに置換するとアクチン線維との結合能が失われた(図2).また,HeLa細胞に紫外線を照射することにより死細胞とし,蛍光セルソーターを用いて死細胞および蛍光色素で標識したDNGR-1を検出することにより,DNGR-1に結合した死細胞を検出した.この実験の結果もドットブロット実験の結果と一致し,Trp141,Glu153,Trp155,Trp250をAlaに置換するとDNGR-1の死細胞に対する結合能が失われた.
4.DNGR-1のアクチン線維に対する結合部位の特異性
アクチン線維は細胞形態の維持および変形を担う細胞骨格としての役割だけでなく,多種多様なタンパク質と相互作用し細胞内相互作用ネットワークのハブともいえる役割も担う.たとえば,細胞における物質輸送に使われるミオシンはその代表的なものである.これまでに,ミオシン,コフィリン,ビンキュリン,フィンブリン,Arp2/3,SipA,コロニンについては,精度の差こそあれ,アクチンにおける結合部位が明らかにされている.その多くはアクチンのストランドに存在し,2つのストランドを架橋するようには存在していない.また,ストランドを架橋するように結合しているSipA,コロニン,Arp2/3は,比較的広い範囲にわたり4つ以上のアクチンサブユニットと結合していることが示唆されている.しかしながら,サブナノメートルの分解能で構造が明らかにされているのはミオシン,コフィリン,コロニンのみで,アクチンとの結合の様式が高い分解能で調べられているタンパク質は少ないため,はっきりしたことは依然として不明である.
一方で,DNGR-1は,ほぼ4つのアミノ酸残基がアクチンとの結合に決定的な役割を担っていた.そのため,アクチン線維のねじれの変化など,構造の変化に対してその結合力が大きく左右されることが予想された.アクチンにおけるDNGR-1との結合部位はユビキチン化,リン酸化,ニトロ化など翻訳後修飾の起こりやすい部位であることが指摘されている5).細胞の代謝や細胞死の途上においてアクチン結合タンパク質や翻訳後修飾によりアクチン線維の構造が変化し,DNGR-1との結合能が変化することは十分に起こりうる.その結果,死細胞に対する免疫応答が制御されている可能性がある.
おわりに
自然免疫は急速に理解の深まっている分野であるが,その構造生物学な基盤はほとんど解明されていない.クライオ電子顕微鏡法はその急速な進展により構造生物学になくてはならない手法になりつつある.これまで構造解析が非常に困難であった生体分子の構造が高分解能で解析されつつあり,今後は,興味深い生命現象と連関する生体分子の高分解能での構造解析が進むものと思われる.今回の研究のように,構造生物学と免疫学といったいっけん大きく離れた異分野との共同研究により,相補的な進展のもたらされることを期待している.
文 献
- Sancho, D., Joffre, O. P., Keller, A. M. et al.: Identification of a dendritic cell receptor that couples sensing of necrosis to immunity. Nature, 458, 899-903 (2009)[PubMed]
- Ahrens, S., Zelenay, S., Sancho, D. et al.: F-actin is an evolutionarily conserved damage-associated molecular pattern recognized by DNGR-1, a receptor for dead cells. Immunity, 36, 635-645 (2012)[PubMed]
- Zhang, J. G., Czabotar, P. E., Policheni, A. N. et al.: The dendritic cell receptor Clec9A binds damaged cells via exposed actin filaments. Immunity, 36, 646-657 (2012)[PubMed]
- Fujii, T., Iwane, A. H., Yanagida, T. et al.: Direct visualization of secondary structures of F-actin by electron cryomicroscopy. Nature, 467, 724-728 (2010)[PubMed] [新着論文レビュー]
- Terman, J. R. & Kashina, A.: Post-translational modification and regulation of actin. Curr. Opin. Cell Biol., 25, 30-38 (2013)[PubMed]
著者プロフィール
略歴:2009年 大阪大学大学院生命機能研究科にて博士号取得,2012年 理化学研究所生命システム研究センター 基礎科学特別研究員を経て,2015年より科学技術振興機構 さきがけ専任研究者.
研究テーマ:クライオ電子顕微鏡法による生体超分子の高分解能での構造解析.
© 2015 藤井 高志 Licensed under CC 表示 2.1 日本