ダイニンによる膜の成分の供給が核の大きさの成長する速度を制御する
原 裕貴
(ドイツEuropean Molecular Biology Laboratory,Genome Biology Unit)
email:原 裕貴
DOI: 10.7875/first.author.2015.073
Dynein-based accumulation of membranes regulates nuclear expansion in Xenopus laevis egg extracts.
Yuki Hara, Christoph A. Merten
Developmental Cell, 33, 562-575 (2015)
核の大きさはつねに一定ではなく,発生の段階や細胞の種類により大きく異なる.古くから,この核の大きさは,細胞の全体の大きさとともに,核の周囲の空間の大きさと高い相関のあることが知られていた.今回,筆者らは,アフリカツメガエルの卵抽出液の無細胞系とマイクロ流体工学の技術とを組み合わせることにより,核の大きさの増大が周囲の空間の情報により制御される分子機構を明らかにした.核の周囲の空間を人為的に操作することにより,核の周囲の空間の大きさに依存して核の大きさの増大する速度が変化する定量的な特徴が見い出された.核の周囲の空間が制限されることにより周囲に形成される微小管の構造体は十分に拡大できず,核を構成する材料である膜の成分の供給に影響がおよぼされる.この制御機構により,細胞は核の位置のような空間情報を感知し核の成長する速度を制御することが示唆された.
真核生物の細胞の核は遺伝情報であるDNAを核膜でおおうことにより細胞質から隔離されている.この核の大きさは同じゲノムをもつ同一の生物であってもつねに一定ではなく,その発生の過程や細胞の種類により大きく変化する.また,100年も昔から,核の大きさにはひとつの定量的な特徴が知られており,核の大きさと細胞の全体の大きさのあいだには高い相関が存在する1,2).たとえば,酵母では細胞周期の変異体により得られる細胞の大きさの多様性にあわせ核の大きさも変化し,細胞の大きさと核の大きさとの比率が一定に保たれる3,4).このような核の大きさの変化は,同時に,転写や細胞分裂など細胞の機能にも影響をあたえることが示唆されている5).また,がん細胞では核の大きさが細胞の全体の大きさに対し異常に大きくなることをあわせて考えると6),細胞の機能を適切に発揮するため,細胞は核の大きさを制御していることが強く推察される.
では,核の大きさはどのように制御されているのだろうか? これまでに,細胞質に存在する核を構成する材料の絶対量により核の大きさを規定するモデルが提唱されている7).核を構成する材料のなかでも核膜の裏打ちタンパク質のひとつであるラミンBは核の大きさを直接に規定するタンパク質として同定されており,実際に,アフリカツメガエルの胚においてラミンBの量を操作することにより核の大きさが変化する実験的な証拠が示されている7).ここで,細胞の大きさの大小を考えると,巨大な細胞には多量のラミンBが存在するが,反対に,微小な細胞には少量のラミンBしか存在しないことになり,長年にわたり観察された細胞の大きさと核の大きさとの比率を説明することが可能である.しかし,このモデルだけでは説明の不可能な現象が報告されている.同一の細胞質のなかに多数の核が存在する場合,おのおのの核の大きさはもはや細胞の全体の大きさには依存しない.その代わり,核の大きさは周囲の空間と相関するようにみえる.たとえば,分裂酵母3) やアフリカツメガエルの卵細胞8) の場合,細胞質に多数の核が密集して存在する場合にはおのおのの核の大きさは小さく,核どうしが離れている場合には核の大きさは比較的に大きくなる現象が報告されている.これらの例から,細胞質の全体の大きさだけでなく,細胞質の核の周囲の“局所的な”空間に依存して核の大きさを制御する分子機構の存在が示唆される.しかし,これまでに,核の周囲の空間の大きさを“感知”し核の大きさを制御する現象について詳細な解析はなされておらず,その分子機構についても解明されていなかった.
核の周囲の空間が核の大きさの制御にどのような影響をあたえるかを解析するため,アフリカツメガエルの卵抽出液の無細胞系を用いin vitroにおいて核を再構築して,核の大きさの増大のようすを観察した.アフリカツメガエルの卵から間期の抽出液を調製し,そこに精子のDNAをくわえて約40分間の培養により,in vitroにおいて小さな球状の核を再構築することができる.さらに,卵抽出液にあらかじめシクロヘキシミドをくわえて自然発生的な細胞周期の進行を抑制することにより,再構築した核を断続的に大きくすることが可能である.この実験系を用いたところ,核が観察に用いたチャンバーの壁の近くに位置すること,あるいは,再構築した核どうしが近接することが意図せず起こり,核の周囲の空間について物理的な制約をうけた核を観察することができた.これらの制約をうけた核の増大する速度は,物理的な障害がなく核の周囲の空間に余裕のある核に比べ遅く,核の周囲の空間の制約により核の大きさの増大する速度の制御に影響の生じることが示唆された.
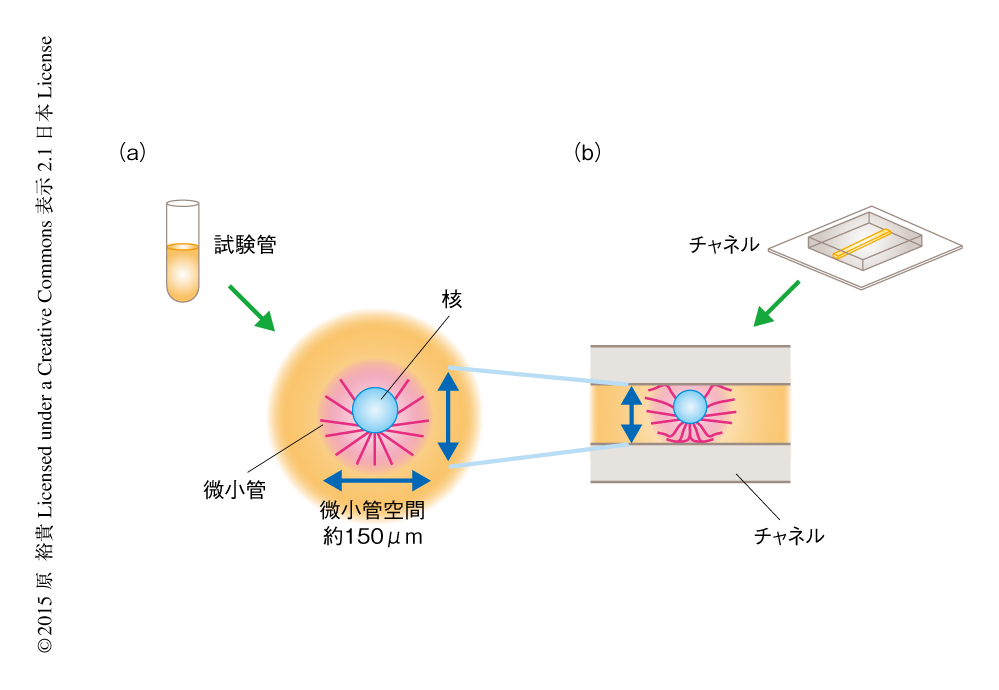
この影響をより体系的に解析するため,マイクロ流体工学の技術を応用して核の周囲の空間を人為的に操作した.マイクロメートルのスケールのチャネルを用意し,無細胞系を用いて再構築した小さな核をこのチャネルに注入し,さらにそのなかで培養して核の大きさの増大するようすを観察した.その際,断面積の異なるさまざまなチャネルを用いることにより核の周囲の空間の大きさを体系的に変化させ,核の大きさの増大する速度への影響を評価した.その結果,核の大きさの増大する速度はチャネルの断面積と正の相関関係をもつことが明らかにされた.また,ある断面積より狭いチャネルを用いた場合のみ増大する速度に変化が観察されたことをあわせて考えると,核の大きさの増大する速度に影響をあたえる空間“核ドメイン”の大きさにはおおよそ直径170μmの閾値が存在し,その閾値よりも狭い空間的な制約をあたえることにより核の大きさの増大する速度は低下することが示唆された(図1).
核の大きさの増大する速度を制御する核ドメインの分子機構を解明するため,微小管に着目した.微小管は核に付着した中心体を基点として伸長し,核の周囲に微小管が高密度で存在する構造体である“微小管空間”を形成する.用いたアフリカツメガエルの無細胞系においては,チャネルの内部にて培養をはじめるまえの状態である約40分間の培養ののち再構築された核の周囲に,推定した核ドメインと同等の大きさの微小管空間が形成された(図1).さらに核の培養をつづけることにより微小管空間の大きさは断続的に大きくなったが,空間的な制約をあたえたチャネルの内部において培養すると,空間的な制約のない場合に比べ,形成される微小管空間の大きさは小さくなった(図1).小胞体を含む細胞質の膜の成分を観察したところ微小管と共局在しており,とくに,核の周囲に形成される微小管空間の内側に豊富に存在していた.さらに,ダイニンが微小管のうえで膜の成分を輸送するという過去の知見をあわせて考えると9),微小管とダイニンが協調し,核を構成する材料である膜の成分を核に供給する分子機構の存在が示唆された.この可能性を検証するため,微小管あるいはダイニンそれぞれの機能阻害剤を用いて,核の大きさの増大への影響を解析した.それぞれの機能阻害剤をくわえることにより,核の大きさの増大する速度が低下するとともに,核の周囲の空間の大きさと核の大きさの増大する速度との相関が大きく低下した.以上のことから,微小管およびダイニンは核の大きさの増大する速度を制御し,さらに,核の周囲の空間の大きさに依存的な核の大きさの増大する速度の決定に寄与することが示唆された.空間的な制約のもとでは微小管空間を十分に拡大できないことにより,ダイニンと協調し供給される膜の成分の量が制限される可能性が考えられた.
核の周囲の空間の大きさに制約をあたえることにより観察された核の大きさの増大する速度の低下は,膜の成分の供給の不足だけが原因なのだろうか? 空間的な制約のもとで供給の不足している核を構成する材料について調べるため,空間的な制約を保ったまま過剰な量の卵抽出液を供給することの可能なマイクロ流体工学の装置を作製した.その結果,卵抽出液の過剰な供給をつづけることにより空間的な制約のもとでも核の大きさの増大する速度は上昇し,空間的な制約からうける影響を弱めることができた.また,この増大する速度の上昇は微小管あるいはダイニンの機能阻害剤をくわえるとみられなくなったことから,空間的な制約のもとでは微小管およびダイニンにより供給される核の増大に必要な材料の供給は制限されることが示唆された.
卵抽出液を膜の成分,モータータンパク質,微小管を構成するチューブリンの成分ごとに分画し,それぞれの画分を過剰にくわえた状態において核を培養することにより,細胞質に存在するどの材料の供給が不足するのか検証した.その結果,膜の成分あるいはモータータンパク質のどちらかを過剰にくわえることにより,卵抽出液を過剰にくわえた場合と同様に,空間的な制約からうける核の大きさの増大する速度への影響を弱めることができた.つまり,膜の成分それ自体の増加,あるいは,膜の成分の供給を促進するダイニンの量の増加により,核の周囲の微小管空間に供給される膜の成分の量が増加し,核の増大する速度が上昇したものと考えられた.しかし,微小管空間を構成する微小管の量それ自体は,空間的な制約のもとでは核の大きさの増大する速度に影響をあたえなかった.以上の結果から,核の周囲の空間の大きさが限定されることにより,形成される微小管空間の拡大が制限され,最終的に核に供給される膜の成分の量が不足することにより,核の大きさの増大する速度が低下することが示唆された.
今回,筆者らの解明した核の大きさの増大する速度を制御する微小管およびダイニンを介した分子機構のほかにも,多くの分子機構が並列あるいは相互作用して,実際の細胞において核の大きさを制御している5,7).今回の報告により,少なくともアフリカツメガエルの初期胚において,微小管およびダイニンによる膜の成分の供給が限定要因になり,核の周囲の空間の大きさに依存して核の大きさの増大する速度が制御されることが示された.この分子機構を考慮することにより,細胞が内部のさまざまな空間情報を感知し核の大きさを制御する可能性が示唆された.核が細胞において細胞膜に近接している場合は,細胞膜が物理的な障害となり微小管空間を十分に拡大することができず,細胞質のプールから核を構成する材料を効率的にあつめることができない.対照的に,核が細胞の中心に位置する場合は,物理的な障害なく微小管空間を拡大できるため,核を構成する材料を最大の速度であつめることが可能になる.一般に核は細胞の中心に位置することが知られているが10),細胞は核の大きさをより効率的かつ迅速に増大させるため核を細胞の中心に位置させているのかもしれない.
略歴:2010年 総合研究大学院大学生命科学研究科 修了,同年 国立遺伝学研究所 博士研究員,2011年 ドイツEuropean Molecular Biology Laboratory博士研究員を経て,2015年より山口大学大学院医学系研究科 助教.
研究テーマ:核の大きさを制御する分子機構,および,核の大きさのあたえる細胞の機能への影響.
関心事:オルガネラが,なぜそのかたちに,なぜその大きさに,なぜその位置に,存在するのかを考えること.
© 2015 原 裕貴 Licensed under CC 表示 2.1 日本
(ドイツEuropean Molecular Biology Laboratory,Genome Biology Unit)
email:原 裕貴
DOI: 10.7875/first.author.2015.073
Dynein-based accumulation of membranes regulates nuclear expansion in Xenopus laevis egg extracts.
Yuki Hara, Christoph A. Merten
Developmental Cell, 33, 562-575 (2015)
要 約
核の大きさはつねに一定ではなく,発生の段階や細胞の種類により大きく異なる.古くから,この核の大きさは,細胞の全体の大きさとともに,核の周囲の空間の大きさと高い相関のあることが知られていた.今回,筆者らは,アフリカツメガエルの卵抽出液の無細胞系とマイクロ流体工学の技術とを組み合わせることにより,核の大きさの増大が周囲の空間の情報により制御される分子機構を明らかにした.核の周囲の空間を人為的に操作することにより,核の周囲の空間の大きさに依存して核の大きさの増大する速度が変化する定量的な特徴が見い出された.核の周囲の空間が制限されることにより周囲に形成される微小管の構造体は十分に拡大できず,核を構成する材料である膜の成分の供給に影響がおよぼされる.この制御機構により,細胞は核の位置のような空間情報を感知し核の成長する速度を制御することが示唆された.
はじめに
真核生物の細胞の核は遺伝情報であるDNAを核膜でおおうことにより細胞質から隔離されている.この核の大きさは同じゲノムをもつ同一の生物であってもつねに一定ではなく,その発生の過程や細胞の種類により大きく変化する.また,100年も昔から,核の大きさにはひとつの定量的な特徴が知られており,核の大きさと細胞の全体の大きさのあいだには高い相関が存在する1,2).たとえば,酵母では細胞周期の変異体により得られる細胞の大きさの多様性にあわせ核の大きさも変化し,細胞の大きさと核の大きさとの比率が一定に保たれる3,4).このような核の大きさの変化は,同時に,転写や細胞分裂など細胞の機能にも影響をあたえることが示唆されている5).また,がん細胞では核の大きさが細胞の全体の大きさに対し異常に大きくなることをあわせて考えると6),細胞の機能を適切に発揮するため,細胞は核の大きさを制御していることが強く推察される.
では,核の大きさはどのように制御されているのだろうか? これまでに,細胞質に存在する核を構成する材料の絶対量により核の大きさを規定するモデルが提唱されている7).核を構成する材料のなかでも核膜の裏打ちタンパク質のひとつであるラミンBは核の大きさを直接に規定するタンパク質として同定されており,実際に,アフリカツメガエルの胚においてラミンBの量を操作することにより核の大きさが変化する実験的な証拠が示されている7).ここで,細胞の大きさの大小を考えると,巨大な細胞には多量のラミンBが存在するが,反対に,微小な細胞には少量のラミンBしか存在しないことになり,長年にわたり観察された細胞の大きさと核の大きさとの比率を説明することが可能である.しかし,このモデルだけでは説明の不可能な現象が報告されている.同一の細胞質のなかに多数の核が存在する場合,おのおのの核の大きさはもはや細胞の全体の大きさには依存しない.その代わり,核の大きさは周囲の空間と相関するようにみえる.たとえば,分裂酵母3) やアフリカツメガエルの卵細胞8) の場合,細胞質に多数の核が密集して存在する場合にはおのおのの核の大きさは小さく,核どうしが離れている場合には核の大きさは比較的に大きくなる現象が報告されている.これらの例から,細胞質の全体の大きさだけでなく,細胞質の核の周囲の“局所的な”空間に依存して核の大きさを制御する分子機構の存在が示唆される.しかし,これまでに,核の周囲の空間の大きさを“感知”し核の大きさを制御する現象について詳細な解析はなされておらず,その分子機構についても解明されていなかった.
1.核の周囲の空間は核の大きさの増大する速度に影響をあたえる
核の周囲の空間が核の大きさの制御にどのような影響をあたえるかを解析するため,アフリカツメガエルの卵抽出液の無細胞系を用いin vitroにおいて核を再構築して,核の大きさの増大のようすを観察した.アフリカツメガエルの卵から間期の抽出液を調製し,そこに精子のDNAをくわえて約40分間の培養により,in vitroにおいて小さな球状の核を再構築することができる.さらに,卵抽出液にあらかじめシクロヘキシミドをくわえて自然発生的な細胞周期の進行を抑制することにより,再構築した核を断続的に大きくすることが可能である.この実験系を用いたところ,核が観察に用いたチャンバーの壁の近くに位置すること,あるいは,再構築した核どうしが近接することが意図せず起こり,核の周囲の空間について物理的な制約をうけた核を観察することができた.これらの制約をうけた核の増大する速度は,物理的な障害がなく核の周囲の空間に余裕のある核に比べ遅く,核の周囲の空間の制約により核の大きさの増大する速度の制御に影響の生じることが示唆された.
この影響をより体系的に解析するため,マイクロ流体工学の技術を応用して核の周囲の空間を人為的に操作した.マイクロメートルのスケールのチャネルを用意し,無細胞系を用いて再構築した小さな核をこのチャネルに注入し,さらにそのなかで培養して核の大きさの増大するようすを観察した.その際,断面積の異なるさまざまなチャネルを用いることにより核の周囲の空間の大きさを体系的に変化させ,核の大きさの増大する速度への影響を評価した.その結果,核の大きさの増大する速度はチャネルの断面積と正の相関関係をもつことが明らかにされた.また,ある断面積より狭いチャネルを用いた場合のみ増大する速度に変化が観察されたことをあわせて考えると,核の大きさの増大する速度に影響をあたえる空間“核ドメイン”の大きさにはおおよそ直径170μmの閾値が存在し,その閾値よりも狭い空間的な制約をあたえることにより核の大きさの増大する速度は低下することが示唆された(図1).
2.微小管およびダイニンによる核の大きさの増大する速度の制御
核の大きさの増大する速度を制御する核ドメインの分子機構を解明するため,微小管に着目した.微小管は核に付着した中心体を基点として伸長し,核の周囲に微小管が高密度で存在する構造体である“微小管空間”を形成する.用いたアフリカツメガエルの無細胞系においては,チャネルの内部にて培養をはじめるまえの状態である約40分間の培養ののち再構築された核の周囲に,推定した核ドメインと同等の大きさの微小管空間が形成された(図1).さらに核の培養をつづけることにより微小管空間の大きさは断続的に大きくなったが,空間的な制約をあたえたチャネルの内部において培養すると,空間的な制約のない場合に比べ,形成される微小管空間の大きさは小さくなった(図1).小胞体を含む細胞質の膜の成分を観察したところ微小管と共局在しており,とくに,核の周囲に形成される微小管空間の内側に豊富に存在していた.さらに,ダイニンが微小管のうえで膜の成分を輸送するという過去の知見をあわせて考えると9),微小管とダイニンが協調し,核を構成する材料である膜の成分を核に供給する分子機構の存在が示唆された.この可能性を検証するため,微小管あるいはダイニンそれぞれの機能阻害剤を用いて,核の大きさの増大への影響を解析した.それぞれの機能阻害剤をくわえることにより,核の大きさの増大する速度が低下するとともに,核の周囲の空間の大きさと核の大きさの増大する速度との相関が大きく低下した.以上のことから,微小管およびダイニンは核の大きさの増大する速度を制御し,さらに,核の周囲の空間の大きさに依存的な核の大きさの増大する速度の決定に寄与することが示唆された.空間的な制約のもとでは微小管空間を十分に拡大できないことにより,ダイニンと協調し供給される膜の成分の量が制限される可能性が考えられた.
3.空間的な制約のもとでは膜の成分の供給が制限される
核の周囲の空間の大きさに制約をあたえることにより観察された核の大きさの増大する速度の低下は,膜の成分の供給の不足だけが原因なのだろうか? 空間的な制約のもとで供給の不足している核を構成する材料について調べるため,空間的な制約を保ったまま過剰な量の卵抽出液を供給することの可能なマイクロ流体工学の装置を作製した.その結果,卵抽出液の過剰な供給をつづけることにより空間的な制約のもとでも核の大きさの増大する速度は上昇し,空間的な制約からうける影響を弱めることができた.また,この増大する速度の上昇は微小管あるいはダイニンの機能阻害剤をくわえるとみられなくなったことから,空間的な制約のもとでは微小管およびダイニンにより供給される核の増大に必要な材料の供給は制限されることが示唆された.
卵抽出液を膜の成分,モータータンパク質,微小管を構成するチューブリンの成分ごとに分画し,それぞれの画分を過剰にくわえた状態において核を培養することにより,細胞質に存在するどの材料の供給が不足するのか検証した.その結果,膜の成分あるいはモータータンパク質のどちらかを過剰にくわえることにより,卵抽出液を過剰にくわえた場合と同様に,空間的な制約からうける核の大きさの増大する速度への影響を弱めることができた.つまり,膜の成分それ自体の増加,あるいは,膜の成分の供給を促進するダイニンの量の増加により,核の周囲の微小管空間に供給される膜の成分の量が増加し,核の増大する速度が上昇したものと考えられた.しかし,微小管空間を構成する微小管の量それ自体は,空間的な制約のもとでは核の大きさの増大する速度に影響をあたえなかった.以上の結果から,核の周囲の空間の大きさが限定されることにより,形成される微小管空間の拡大が制限され,最終的に核に供給される膜の成分の量が不足することにより,核の大きさの増大する速度が低下することが示唆された.
おわりに
今回,筆者らの解明した核の大きさの増大する速度を制御する微小管およびダイニンを介した分子機構のほかにも,多くの分子機構が並列あるいは相互作用して,実際の細胞において核の大きさを制御している5,7).今回の報告により,少なくともアフリカツメガエルの初期胚において,微小管およびダイニンによる膜の成分の供給が限定要因になり,核の周囲の空間の大きさに依存して核の大きさの増大する速度が制御されることが示された.この分子機構を考慮することにより,細胞が内部のさまざまな空間情報を感知し核の大きさを制御する可能性が示唆された.核が細胞において細胞膜に近接している場合は,細胞膜が物理的な障害となり微小管空間を十分に拡大することができず,細胞質のプールから核を構成する材料を効率的にあつめることができない.対照的に,核が細胞の中心に位置する場合は,物理的な障害なく微小管空間を拡大できるため,核を構成する材料を最大の速度であつめることが可能になる.一般に核は細胞の中心に位置することが知られているが10),細胞は核の大きさをより効率的かつ迅速に増大させるため核を細胞の中心に位置させているのかもしれない.
文 献
- Conklin, E. G.: Cell size and nuclear size. J. Exp. Zool., 62, 1-98 (1912)
- Willson, E. B.: The Cell in Development and Heredity. Macmillan, New York (1925)
- Neumann, F. R. & Nurse, P.: Nuclear size control in fission yeast. J. Cell Biol., 179, 593-600 (2007)[PubMed]
- Jorgensen, P., Edgington, N. P., Schneider, B. L. et al.: The size of the nucleus increases as yeast cells grow. Mol. Biol. Cell, 18, 3523-3532 (2007)[PubMed]
- Edens, L. J., White, K.H., Jevtic, P. et al.: Nuclear size regulation: from single cells to development and disease. Trends Cell Biol., 23, 151-159 (2013)[PubMed]
- Zink, D., Fischer, A. H. & Nickerson, J. A.: Nuclear structure in cancer cells. Nat. Rev. Cancer, 4, 677-687 (2004)[PubMed]
- Levy, D. L. & Heald, R.: Nuclear size is regulated by importin α and Ntf2 in Xenopus. Cell, 143, 288-298 (2010)[PubMed]
- Gurdon, J. B.: Injected nuclei in frog oocytes: fate, enlargement, and chromatin dispersal. J. Embryol. Exp. Morphol., 36, 523-540 (1976)[PubMed]
- Niclas, J., Allan, V. J. & Vale, R. D.: Cell cycle regulation of dynein association with membranes modulates microtubule-based organelle transport. J. Cell Biol., 133, 585-593 (1996)[PubMed]
- Gundersen, G. G. & Worman, H. J.: Nuclear positioning. Cell, 152, 1376-1389 (2013)[PubMed]
著者プロフィール
略歴:2010年 総合研究大学院大学生命科学研究科 修了,同年 国立遺伝学研究所 博士研究員,2011年 ドイツEuropean Molecular Biology Laboratory博士研究員を経て,2015年より山口大学大学院医学系研究科 助教.
研究テーマ:核の大きさを制御する分子機構,および,核の大きさのあたえる細胞の機能への影響.
関心事:オルガネラが,なぜそのかたちに,なぜその大きさに,なぜその位置に,存在するのかを考えること.
© 2015 原 裕貴 Licensed under CC 表示 2.1 日本