基底状態のヒトの腸管上皮幹細胞の培養法の確立
山本雄介・Frank McKeon・Wa Xian
(米国Jackson Laboratory for Genomic Medicine)
email:山本雄介
DOI: 10.7875/first.author.2015.072
Cloning and variation of ground state intestinal stem cells.
Xia Wang, Yusuke Yamamoto, Lane H. Wilson, Ting Zhang, Brooke E. Howitt, Melissa A. Farrow, Florian Kern, Gang Ning, Yue Hong, Chiea Chuen Khor, Benoit Chevalier, Denis Bertrand, Lingyan Wu, Niranjan Nagarajan, Francisco A. Sylvester, Jeffrey S. Hyams, Thomas Devers, Roderick Bronson, D. Borden Lacy, Khek Yu Ho, Christopher P. Crum, Frank McKeon, Wa Xian
Nature, 522, 173-178 (2015)
腸管,膵管,肝臓などの上皮組織の幹細胞を基底状態において単離し培養することは非常にむずかしい.この研究においては,ヒトの小腸および大腸の腸管上皮幹細胞を未分化な状態で培養する技術を確立した.単離し増殖した腸管上皮幹細胞は多くの継代をへてもゲノムに大きな変化は生じず,in vitroにおいて単離した腸管の部位にもとづき,小腸上皮幹細胞は小腸状の組織に,大腸上皮幹細胞は大腸状の構造に分化した.つまり,それぞれの腸管上皮幹細胞はおのおのの組織に分化するよう発生の段階において運命が決定されていることが示された.さらに,大腸上皮幹細胞を分化させて大腸状の組織を構成しClostridium difficileのトキシンAおよびトキシンBにて処理することにより,in vitroにおいて偽膜性大腸炎の症状を再現することに成功した.この手法は,ヒトの腸管上皮幹細胞を安定かつ効率に培養することを可能にし,病変モデルの確立や再生医療への応用が期待される.
全能性をもつES細胞やiPS細胞は再生医療の進展を考えるうえで非常に重要である.ただし,派生した細胞が奇形腫を形成する可能性や,おのおのの組織への分化の手法の確立など,いまだに解決の必要な課題もある.もうひとつの問題として,移植された組織や細胞を長期にわたり維持していくうえで,ES細胞やiPS細胞から組織の再構築能をもつ幹細胞を分化させる必要があると考えられる.1975年,移植の可能なヒトの皮膚上皮幹細胞の培養技術が確立された1).この手法を用いることにより,角膜,甲状腺,呼吸器官など多層上皮組織から皮膚と同様にp63陽性の幹細胞を単離し培養することに成功した2-4).ただし,この手法では腸管や膵臓などp63陰性の円柱上皮幹細胞を未成熟なまま培養することはできなかった.
腸管上皮細胞の培養の手法としてはマトリゲルを用いた3次元組織培養法が広く知られている.この手法では,LGR5陽性細胞である陰窩の底部から得た細胞塊あるいは陰窩の底部の円柱細胞を用いて,Wntシグナル活性化タンパク質などを添加することにより腸管上皮組織の培養が可能になった5).小分子化合物の添加によるLGR5陽性幹細胞の細胞増殖性の改善なども報告されているが6),組織培養により得られるヒトの腸管上皮幹細胞の割合は高くない.
この研究においては,基底状態のヒトの腸管上皮幹細胞の単離および増殖の技術を確立した.これにより,腸管上皮幹細胞を含む円柱上皮幹細胞の分子学的な解析が可能になっただけでなく,病変モデルの確立や再生医療への応用が期待される.
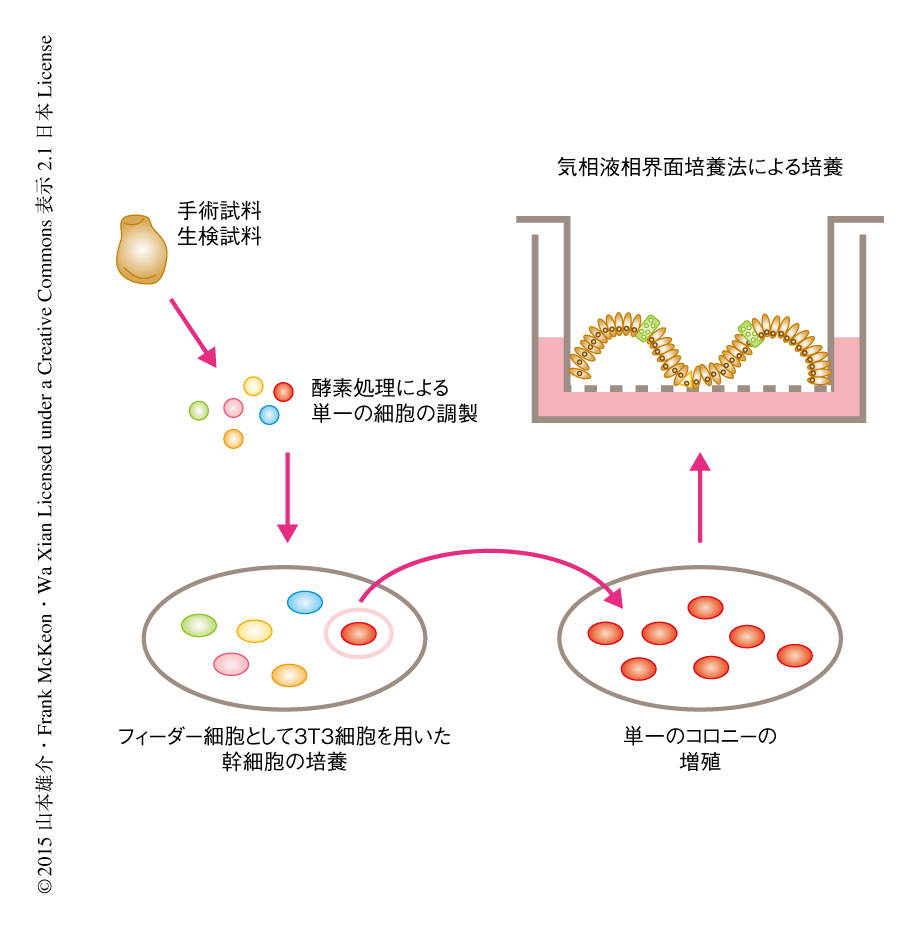
マウス線維芽細胞株である3T3細胞をフィーダー細胞にし,R-spondin,Noggin,Jagged-1,EGF,ニコチンアミド,TGFβ受容体の阻害剤,Rock阻害剤を添加した培地において,ヒト胎児の腸管から分離した細胞を培養した(図1).この条件において培養することにより細胞は高い増殖能を示し,マイクロアレイ解析により腸管上皮幹細胞のマーカー遺伝子として知られているOLFM4遺伝子,CD133遺伝子,Lgr5遺伝子,Lrig1遺伝子の発現が認められ,単一の細胞からでも50%以上の高い効率でコロニーが形成された.単一の細胞から得られたコロニーを増幅し,気相液相界面培養法により細胞の分化能を調べた.単一の細胞から増殖した細胞は腸管組織様の構造を形成し,腸管上皮細胞のマーカーであるVillin1を発現し,腸管内分泌細胞のマーカーであるchromogranin A,Paneth細胞のマーカーであるHD6,杯細胞のマーカーであるMucin2の発現が確認された.この手法を用いて得られた細胞コロニーは高い増殖能およびすべての腸管上皮細胞種への分化能をもっていたことから,基底状態の腸管上皮細胞であると示唆された.
ヒト胎児の小腸から十二指腸,空腸,回腸の腸管上皮幹細胞を単離および培養した.それぞれの腸管上皮幹細胞の形状は形態学的にはほぼ同一であったが,マイクロアレイ解析により24~178個の遺伝子がそれぞれ特異的に発現していることが確認された.これらの腸管上皮幹細胞は10日間の気相液相界面培養法により柔毛に類似した構造に分化した.とくに,回腸に由来する腸管上皮幹細胞から分化した組織は最大の柔毛構造を構成し多くの杯細胞が確認された.胃と小腸の中間に位置する十二指腸に由来する腸管上皮幹細胞は胃上皮細胞のマーカーであるTFF2やMucin5ACを発現する組織を形成した.回腸に由来する腸管上皮幹細胞から分化した組織はより大腸に近く,空腸に由来する腸管上皮幹細胞から分化した組織より多くのMucin2陽性の杯細胞が観察された.腸管上皮幹細胞から分化した組織においては,正常な腸管上皮組織と類似して,Ki67陽性の増殖細胞は構造の基底の部分に多く確認された.
同様の手法を用いて,ヒト胎児の大腸から上行結腸,横行結腸,下行結腸の腸管上皮幹細胞を単離および培養した.大腸に由来する腸管上皮幹細胞は小腸に由来する腸管上皮幹細胞と同様に長期にわたり培養が可能で,遺伝子発現の解析により上行結腸,横行結腸,下行結腸に由来する腸管上皮幹細胞のあいだでの遺伝子発現の差は非常に小さいことが示された.これらの腸管上皮幹細胞は気相液相界面培養法により実際の大腸の組織に類似した幅広い柔毛構造を形成し,多くの杯細胞が確認された.小腸腸管上皮幹細胞および大腸腸管上皮幹細胞の遺伝子発現データを用いて主成分分析を行ったところ,十二指腸,空腸,回腸に由来する腸管上皮幹細胞はそれぞれ異なったプロファイルを示したのに対し,上行結腸,横行結腸,下行結腸に由来する腸管上皮幹細胞の発現プロファイルはほぼ同一であった.その傾向は,気相液相界面培養法により分化した組織においてより顕著であった.
腸管上皮幹細胞の長期にわたる培養におけるゲノムの安定性について調べるため,腸管上皮幹細胞を5回,10回,15回,20回と継代培養した(7~10日間で1継代).それぞれの腸管上皮幹細胞のゲノムDNAについて,SNPアレイを用いてコピー数多型について,エキソン塩基配列決定法により1塩基多型について調べた.理論上,5回の継代(約50日間の培養)により1つの細胞から約3億~750億個の細胞が得られるが,この時点では,どのクローンにおいても染色体の異常は認められなかった.ただし,継代を15回,20回とくり返すと1つのクローンにおいて第12染色体に異常がみられ,その割合は継代ごとに増幅した.エキソン塩基配列決定法の結果,いくつかの遺伝子において1塩基多型が検出されたが,がん遺伝子やがん抑制遺伝子に変異は認められなかった.コピー数多型および1塩基多型の解析の結果,10回の継代(約100日の培養)まで腸管上皮幹細胞のゲノムはほぼ安定していることが示された.継代の回数の差が腸管上皮幹細胞の分化能に影響をあたえるかどうか調べるため,7回,17回,27回と継代した腸管上皮幹細胞を気相液相界面培養法により培養し腸管組織への分化を誘導した.組織学な解析によりどの試料においても同じように杯細胞の分化がみられ,大きな差はみられなかった.同様に,7回の継代の腸管上皮幹細胞と16回の継代の腸管上皮幹細胞のコロニー形成能を比較したが,どちらも50%以上で顕著な差はみられなかった.また,腫瘍形成能を試験するため25回にわたり継代培養した腸管上皮幹細胞を免疫不全マウスに皮下移植したが,腫瘍は形成されず長期にわたり培養した幹細胞はがん化していないことが示された.
単離された腸管上皮幹細胞は円柱上皮幹細胞であり,皮膚や肺気管などから単離された重層上皮幹細胞とは構造が異なる.それらを比較すると,重層上皮幹細胞ではp53遺伝子ファミリーのメンバーであるp63遺伝子が高く発現しており3),円柱上皮幹細胞である腸管上皮幹細胞においてはOLFM4遺伝子,Lgr5遺伝子,Lrig1遺伝子,EphB2遺伝子,Ascl2遺伝子などの腸管上皮幹細胞のマーカー遺伝子が特異的に高く発現していることが確認された.これらのマーカー遺伝子の発現は気相液相界面培養法による培養ののち低下した.しかし,腸管上皮幹細胞として報告されている+4細胞のマーカー遺伝子であるBmi1遺伝子の発現は分化ののちにもほぼ変わらなかった7).くわえて,いくつかの転写因子の発現は十二指腸,空腸,回腸,上行結腸,横行結腸,下行結腸から得られた腸管上皮幹細胞において一定のレベルで発現していたが,GATA4やGATA6は十二指腸,空腸,回腸から得られた腸管上皮幹細胞において高く発現し8),報告されているとおり,空腸や回腸の発生に重要な転写因子であることが幹細胞のレベルにおいて確認された.成人ヒトから得られた腸管上皮幹細胞においても,同様の転写因子の発現パターンが確認された.
Clostridium difficileはグラム陽性の芽胞を形成する細菌で,偽膜性大腸炎の原因となる.トキシンAとトキシンBという小分子化合物を産生し,それらは病原性と密接に関連している9,10).トキシンAとトキシンBはともに液体分泌,炎症,大腸の組織の損傷をひき起こすことが知られているが,それぞれの役割について不明なことはまだ多い.そこで,大腸上皮幹細胞を単離し気相液相界面培養法により培養して,それを大腸の組織のモデルとしてトキシンBに対する反応について調べた.組織学な解析や細胞接着のマーカーであるクローディン3およびカドヘリン17の蛍光免疫染色により,トキシンBの濃度に依存的な影響および時間に依存的な影響について検討した.高濃度かつ長時間のトキシンBの処理により,杯細胞の減少,細胞極性の消失,腸管様の構造の破壊がみられ,これらの症状はC. difficileによる偽膜性大腸炎と一致した.マイクロアレイを用いた遺伝子発現の解析により,トキシンBの濃度および処理時間に依存して,炎症,RhoBを介したアクチン構造,細胞接着に関連した遺伝子パスウェイが選択的に発現していることが確認された.また,炎症性腸疾患に関係していることが知られているDUOX2遺伝子およびDUOXA2遺伝子が高く発現していた.同様な結果はトキシンAの処理においても確認され,大腸上皮幹細胞を用いた気相液相界面培養法による培養はC. difficileの感染モデルとして使用できることが示された.
基底状態のヒトの腸管上皮幹細胞の培養法の確立により,以下が期待される.1)腸管上皮幹細胞における組織に特異的な分化能のプログラミングの機序の解明:それぞれの腸管の組織から分離した腸管上皮幹細胞は長期にわたる培養ののちにももとの組織への分化能を保持していた.おそらく,エピジェネティックなDNA修飾により幹細胞の運命は決定されていると予想される.2)患者に由来する腸管上皮幹細胞を用いた炎症性腸疾患のモデリング:内視鏡を用いた生検試料から腸管上皮幹細胞を分離し培養することができ,気相液相界面培養法を用いることにより病変を類似的につくりだすことが可能であると予想される.それにより,実際の患者の細胞を用いた潰瘍性大腸炎やクローン病など炎症性腸疾患のモデリングが可能になる.3)再生医療を視野にいれた幹細胞の自家移植:患者に由来する腸管上皮幹細胞を分離し増殖することが可能になったことから,ゲノム編集技術と組み合わせることにより,生検試料から単離した腸管上皮幹細胞に特異的な遺伝子治療を施し,それをまた患部にもどす自家細胞の移植が可能になるかもしれない.この培養法は腸管上皮幹細胞のほかの幹細胞の培養へも応用が可能であり,汎用性の高い手法であると期待される.
略歴:2008年 早稲田大学大学院生命理工学研究科博士課程 修了,同年 シンガポールGenome Institute of Singaporeポスドク,2010年 同 リサーチアソシエイトを経て,2013年より米国Jackson Laboratory for Genomic Medicineリサーチサイエンティスト.
研究テーマ:成体における幹細胞の維持の機構,悪性腫瘍の起源.
関心事:ジョギング,ラボの掃除.
Frank McKeon
米国MultiClonal Therapeutics社Founder.
Wa Xian
米国MultiClonal Therapeutics社Founder.
© 2015 山本雄介・Frank McKeon・Wa Xian Licensed under CC 表示 2.1 日本
(米国Jackson Laboratory for Genomic Medicine)
email:山本雄介
DOI: 10.7875/first.author.2015.072
Cloning and variation of ground state intestinal stem cells.
Xia Wang, Yusuke Yamamoto, Lane H. Wilson, Ting Zhang, Brooke E. Howitt, Melissa A. Farrow, Florian Kern, Gang Ning, Yue Hong, Chiea Chuen Khor, Benoit Chevalier, Denis Bertrand, Lingyan Wu, Niranjan Nagarajan, Francisco A. Sylvester, Jeffrey S. Hyams, Thomas Devers, Roderick Bronson, D. Borden Lacy, Khek Yu Ho, Christopher P. Crum, Frank McKeon, Wa Xian
Nature, 522, 173-178 (2015)
要 約
腸管,膵管,肝臓などの上皮組織の幹細胞を基底状態において単離し培養することは非常にむずかしい.この研究においては,ヒトの小腸および大腸の腸管上皮幹細胞を未分化な状態で培養する技術を確立した.単離し増殖した腸管上皮幹細胞は多くの継代をへてもゲノムに大きな変化は生じず,in vitroにおいて単離した腸管の部位にもとづき,小腸上皮幹細胞は小腸状の組織に,大腸上皮幹細胞は大腸状の構造に分化した.つまり,それぞれの腸管上皮幹細胞はおのおのの組織に分化するよう発生の段階において運命が決定されていることが示された.さらに,大腸上皮幹細胞を分化させて大腸状の組織を構成しClostridium difficileのトキシンAおよびトキシンBにて処理することにより,in vitroにおいて偽膜性大腸炎の症状を再現することに成功した.この手法は,ヒトの腸管上皮幹細胞を安定かつ効率に培養することを可能にし,病変モデルの確立や再生医療への応用が期待される.
はじめに
全能性をもつES細胞やiPS細胞は再生医療の進展を考えるうえで非常に重要である.ただし,派生した細胞が奇形腫を形成する可能性や,おのおのの組織への分化の手法の確立など,いまだに解決の必要な課題もある.もうひとつの問題として,移植された組織や細胞を長期にわたり維持していくうえで,ES細胞やiPS細胞から組織の再構築能をもつ幹細胞を分化させる必要があると考えられる.1975年,移植の可能なヒトの皮膚上皮幹細胞の培養技術が確立された1).この手法を用いることにより,角膜,甲状腺,呼吸器官など多層上皮組織から皮膚と同様にp63陽性の幹細胞を単離し培養することに成功した2-4).ただし,この手法では腸管や膵臓などp63陰性の円柱上皮幹細胞を未成熟なまま培養することはできなかった.
腸管上皮細胞の培養の手法としてはマトリゲルを用いた3次元組織培養法が広く知られている.この手法では,LGR5陽性細胞である陰窩の底部から得た細胞塊あるいは陰窩の底部の円柱細胞を用いて,Wntシグナル活性化タンパク質などを添加することにより腸管上皮組織の培養が可能になった5).小分子化合物の添加によるLGR5陽性幹細胞の細胞増殖性の改善なども報告されているが6),組織培養により得られるヒトの腸管上皮幹細胞の割合は高くない.
この研究においては,基底状態のヒトの腸管上皮幹細胞の単離および増殖の技術を確立した.これにより,腸管上皮幹細胞を含む円柱上皮幹細胞の分子学的な解析が可能になっただけでなく,病変モデルの確立や再生医療への応用が期待される.
1.ヒト胎児の腸管上皮幹細胞の単離
マウス線維芽細胞株である3T3細胞をフィーダー細胞にし,R-spondin,Noggin,Jagged-1,EGF,ニコチンアミド,TGFβ受容体の阻害剤,Rock阻害剤を添加した培地において,ヒト胎児の腸管から分離した細胞を培養した(図1).この条件において培養することにより細胞は高い増殖能を示し,マイクロアレイ解析により腸管上皮幹細胞のマーカー遺伝子として知られているOLFM4遺伝子,CD133遺伝子,Lgr5遺伝子,Lrig1遺伝子の発現が認められ,単一の細胞からでも50%以上の高い効率でコロニーが形成された.単一の細胞から得られたコロニーを増幅し,気相液相界面培養法により細胞の分化能を調べた.単一の細胞から増殖した細胞は腸管組織様の構造を形成し,腸管上皮細胞のマーカーであるVillin1を発現し,腸管内分泌細胞のマーカーであるchromogranin A,Paneth細胞のマーカーであるHD6,杯細胞のマーカーであるMucin2の発現が確認された.この手法を用いて得られた細胞コロニーは高い増殖能およびすべての腸管上皮細胞種への分化能をもっていたことから,基底状態の腸管上皮細胞であると示唆された.
2.小腸幹細胞の単離
ヒト胎児の小腸から十二指腸,空腸,回腸の腸管上皮幹細胞を単離および培養した.それぞれの腸管上皮幹細胞の形状は形態学的にはほぼ同一であったが,マイクロアレイ解析により24~178個の遺伝子がそれぞれ特異的に発現していることが確認された.これらの腸管上皮幹細胞は10日間の気相液相界面培養法により柔毛に類似した構造に分化した.とくに,回腸に由来する腸管上皮幹細胞から分化した組織は最大の柔毛構造を構成し多くの杯細胞が確認された.胃と小腸の中間に位置する十二指腸に由来する腸管上皮幹細胞は胃上皮細胞のマーカーであるTFF2やMucin5ACを発現する組織を形成した.回腸に由来する腸管上皮幹細胞から分化した組織はより大腸に近く,空腸に由来する腸管上皮幹細胞から分化した組織より多くのMucin2陽性の杯細胞が観察された.腸管上皮幹細胞から分化した組織においては,正常な腸管上皮組織と類似して,Ki67陽性の増殖細胞は構造の基底の部分に多く確認された.
3.大腸幹細胞の単離
同様の手法を用いて,ヒト胎児の大腸から上行結腸,横行結腸,下行結腸の腸管上皮幹細胞を単離および培養した.大腸に由来する腸管上皮幹細胞は小腸に由来する腸管上皮幹細胞と同様に長期にわたり培養が可能で,遺伝子発現の解析により上行結腸,横行結腸,下行結腸に由来する腸管上皮幹細胞のあいだでの遺伝子発現の差は非常に小さいことが示された.これらの腸管上皮幹細胞は気相液相界面培養法により実際の大腸の組織に類似した幅広い柔毛構造を形成し,多くの杯細胞が確認された.小腸腸管上皮幹細胞および大腸腸管上皮幹細胞の遺伝子発現データを用いて主成分分析を行ったところ,十二指腸,空腸,回腸に由来する腸管上皮幹細胞はそれぞれ異なったプロファイルを示したのに対し,上行結腸,横行結腸,下行結腸に由来する腸管上皮幹細胞の発現プロファイルはほぼ同一であった.その傾向は,気相液相界面培養法により分化した組織においてより顕著であった.
4.腸管上皮幹細胞の長期にわたる培養の影響
腸管上皮幹細胞の長期にわたる培養におけるゲノムの安定性について調べるため,腸管上皮幹細胞を5回,10回,15回,20回と継代培養した(7~10日間で1継代).それぞれの腸管上皮幹細胞のゲノムDNAについて,SNPアレイを用いてコピー数多型について,エキソン塩基配列決定法により1塩基多型について調べた.理論上,5回の継代(約50日間の培養)により1つの細胞から約3億~750億個の細胞が得られるが,この時点では,どのクローンにおいても染色体の異常は認められなかった.ただし,継代を15回,20回とくり返すと1つのクローンにおいて第12染色体に異常がみられ,その割合は継代ごとに増幅した.エキソン塩基配列決定法の結果,いくつかの遺伝子において1塩基多型が検出されたが,がん遺伝子やがん抑制遺伝子に変異は認められなかった.コピー数多型および1塩基多型の解析の結果,10回の継代(約100日の培養)まで腸管上皮幹細胞のゲノムはほぼ安定していることが示された.継代の回数の差が腸管上皮幹細胞の分化能に影響をあたえるかどうか調べるため,7回,17回,27回と継代した腸管上皮幹細胞を気相液相界面培養法により培養し腸管組織への分化を誘導した.組織学な解析によりどの試料においても同じように杯細胞の分化がみられ,大きな差はみられなかった.同様に,7回の継代の腸管上皮幹細胞と16回の継代の腸管上皮幹細胞のコロニー形成能を比較したが,どちらも50%以上で顕著な差はみられなかった.また,腫瘍形成能を試験するため25回にわたり継代培養した腸管上皮幹細胞を免疫不全マウスに皮下移植したが,腫瘍は形成されず長期にわたり培養した幹細胞はがん化していないことが示された.
5.円柱上皮幹細胞と重層上皮幹細胞との比較
単離された腸管上皮幹細胞は円柱上皮幹細胞であり,皮膚や肺気管などから単離された重層上皮幹細胞とは構造が異なる.それらを比較すると,重層上皮幹細胞ではp53遺伝子ファミリーのメンバーであるp63遺伝子が高く発現しており3),円柱上皮幹細胞である腸管上皮幹細胞においてはOLFM4遺伝子,Lgr5遺伝子,Lrig1遺伝子,EphB2遺伝子,Ascl2遺伝子などの腸管上皮幹細胞のマーカー遺伝子が特異的に高く発現していることが確認された.これらのマーカー遺伝子の発現は気相液相界面培養法による培養ののち低下した.しかし,腸管上皮幹細胞として報告されている+4細胞のマーカー遺伝子であるBmi1遺伝子の発現は分化ののちにもほぼ変わらなかった7).くわえて,いくつかの転写因子の発現は十二指腸,空腸,回腸,上行結腸,横行結腸,下行結腸から得られた腸管上皮幹細胞において一定のレベルで発現していたが,GATA4やGATA6は十二指腸,空腸,回腸から得られた腸管上皮幹細胞において高く発現し8),報告されているとおり,空腸や回腸の発生に重要な転写因子であることが幹細胞のレベルにおいて確認された.成人ヒトから得られた腸管上皮幹細胞においても,同様の転写因子の発現パターンが確認された.
6.大腸上皮幹細胞を用いた偽膜性大腸炎のモデル化
Clostridium difficileはグラム陽性の芽胞を形成する細菌で,偽膜性大腸炎の原因となる.トキシンAとトキシンBという小分子化合物を産生し,それらは病原性と密接に関連している9,10).トキシンAとトキシンBはともに液体分泌,炎症,大腸の組織の損傷をひき起こすことが知られているが,それぞれの役割について不明なことはまだ多い.そこで,大腸上皮幹細胞を単離し気相液相界面培養法により培養して,それを大腸の組織のモデルとしてトキシンBに対する反応について調べた.組織学な解析や細胞接着のマーカーであるクローディン3およびカドヘリン17の蛍光免疫染色により,トキシンBの濃度に依存的な影響および時間に依存的な影響について検討した.高濃度かつ長時間のトキシンBの処理により,杯細胞の減少,細胞極性の消失,腸管様の構造の破壊がみられ,これらの症状はC. difficileによる偽膜性大腸炎と一致した.マイクロアレイを用いた遺伝子発現の解析により,トキシンBの濃度および処理時間に依存して,炎症,RhoBを介したアクチン構造,細胞接着に関連した遺伝子パスウェイが選択的に発現していることが確認された.また,炎症性腸疾患に関係していることが知られているDUOX2遺伝子およびDUOXA2遺伝子が高く発現していた.同様な結果はトキシンAの処理においても確認され,大腸上皮幹細胞を用いた気相液相界面培養法による培養はC. difficileの感染モデルとして使用できることが示された.
おわりに
基底状態のヒトの腸管上皮幹細胞の培養法の確立により,以下が期待される.1)腸管上皮幹細胞における組織に特異的な分化能のプログラミングの機序の解明:それぞれの腸管の組織から分離した腸管上皮幹細胞は長期にわたる培養ののちにももとの組織への分化能を保持していた.おそらく,エピジェネティックなDNA修飾により幹細胞の運命は決定されていると予想される.2)患者に由来する腸管上皮幹細胞を用いた炎症性腸疾患のモデリング:内視鏡を用いた生検試料から腸管上皮幹細胞を分離し培養することができ,気相液相界面培養法を用いることにより病変を類似的につくりだすことが可能であると予想される.それにより,実際の患者の細胞を用いた潰瘍性大腸炎やクローン病など炎症性腸疾患のモデリングが可能になる.3)再生医療を視野にいれた幹細胞の自家移植:患者に由来する腸管上皮幹細胞を分離し増殖することが可能になったことから,ゲノム編集技術と組み合わせることにより,生検試料から単離した腸管上皮幹細胞に特異的な遺伝子治療を施し,それをまた患部にもどす自家細胞の移植が可能になるかもしれない.この培養法は腸管上皮幹細胞のほかの幹細胞の培養へも応用が可能であり,汎用性の高い手法であると期待される.
文 献
- Rheinwald, J. G. & Green, H.: Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell, 6, 331-343 (1975)[PubMed]
- Rama, P., Matuska, S., Paganoni, G. et al.: Limbal stem-cell therapy and long-term corneal regeneration. N. Engl. J. Med., 363, 147-155 (2010)[PubMed]
- Senoo, M., Pinto, F., Crum, C.P. et al.: p63 is essential for the proliferative potential of stem cells of stratified epithelia. Cell, 129, 523-536 (2007)[PubMed]
- Kumar, P. A., Hu, Y., Yamamoto, Y. et al.: Distal airway stem cells yield alveoli in vitro and during lung regeneration following H1N1 influenza infection. Cell, 147, 525-538 (2011)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Yin, X., Farin, H. F., van Es, J. H. et al.: Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nat. Methods, 11, 106-112 (2014)[PubMed]
- Sangiorgi, E. & Capecchi, M. R.: Bmi1 is expressed in vivo in intestinal stem cells. Nat. Genet., 40, 915-920 (2008)[PubMed]
- Walker, E. M., Thompson, C. A. & Battle, M. A.: GATA4 and GATA6 regulate intestinal epithelial cytodifferentiation during development. Dev. Biol., 392, 283-294 (2014)[PubMed]
- Voth, D. E. & Ballard, J. D.: Clostridium difficile toxins: mechanism of action and role in disease. Clin. Microbiol. Rev., 18, 247-263 (2005)[PubMed]
- Lyras, D., O'Connor, J. R., Howarth, P. M. et al.: Toxin B is essential for virulence of Clostridium difficile. Nature, 458, 1176-1179 (2009)[PubMed]
著者プロフィール
略歴:2008年 早稲田大学大学院生命理工学研究科博士課程 修了,同年 シンガポールGenome Institute of Singaporeポスドク,2010年 同 リサーチアソシエイトを経て,2013年より米国Jackson Laboratory for Genomic Medicineリサーチサイエンティスト.
研究テーマ:成体における幹細胞の維持の機構,悪性腫瘍の起源.
関心事:ジョギング,ラボの掃除.
Frank McKeon
米国MultiClonal Therapeutics社Founder.
Wa Xian
米国MultiClonal Therapeutics社Founder.
© 2015 山本雄介・Frank McKeon・Wa Xian Licensed under CC 表示 2.1 日本