アセチルコリンにより活性化された局所の神経回路は大脳皮質の活動の時間的な動態を規定する
杉原弘記・Mriganka Sur
(米国Massachusetts Institute of Technology,Department of Brain and Cognitive Sciences,Picower Institute for Learning and Memory)
email:杉原弘記
DOI: 10.7875/first.author.2015.070
An acetylcholine-activated microcircuit drives temporal dynamics of cortical activity.
Naiyan Chen, Hiroki Sugihara, Mriganka Sur
Nature Neuroscience, 18, 892-902 (2015)
アセチルコリンは大脳皮質における情報伝達や活動の状態を変化させる.たとえば,ニューロンの集団が同期して活動していてもアセチルコリンにより脱同期の生じることが知られている.筆者らは,マウスの1次視覚野へのアセチルコリンの入力が大脳皮質において特定の局所の神経回路にはたらくことを発見した.すなわち,アセチルコリンはソマトスタチン陽性抑制性ニューロンの活動を活性化することにより,パルブアルブミン陽性抑制性ニューロンおよび興奮性ニューロンを抑制した.また,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを選択的に抑制したところ,アセチルコリンの刺激による脱同期が阻害されたことから,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期に必要であることが示された.さらに,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを直接的に活性化させたところ,アセチルコリンの刺激と同様の脱同期が起こった.すなわち,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期にとり十分であることが示された.以上の結果は,抑制性ニューロンおよび興奮性ニューロンの形成する特定の局所の神経回路が,ニューロンの活動において時間的な動態の形成に重要な役割を担うことを示した.
前脳の基底部にあるマイネルト基底核から大脳皮質に供給されるアセチルコリンは,主要な神経修飾因子のひとつである1).覚醒や睡眠などの脳の活動の状態や注意効果に関係しているとされ,時間的な動態を変化させ情報処理を促進すると考えられている2-4).たとえば,睡眠状態あるいは麻酔下において大脳皮質の局所における電位を測定すると,大きな振幅をもつ低周波数の活動が記録される3,4).これは,近傍のニューロンの集団が同期して活動しているためと考えられる.このとき,マイネルト基底核を電気刺激すると大脳皮質の局所における電位は高周波数の成分からなる活動に変化する.脱同期とよばれる現象である(図1).近傍のニューロンの集団はそれぞれ異なる時点で発火していることから,そのニューロンの集団が伝達できる情報量は増加することになる.先行研究によると,ニューロンの活動の同期には第5層にある錘体ニューロンの周期的な多重発火が関与しているとされる2).しかし,より最近の計算理論的な研究および実験的な研究により,抑制性ニューロンが脱同期や分散の符号化に関与している可能性が指摘されている5-7).近年の2光子顕微鏡法および光遺伝学的な手法の発展により,ニューロンの種類を可視化し,また,制御することが可能になってきた.アセチルコリンによる脱同期は抑制性ニューロンによりなされているのだろうか? もしそうなら,どの種類の抑制性ニューロンがかかわっているのか? そして,それらの細胞種はどのようにかかわりあっているのか?
アセチルコリンに対する抑制性ニューロンの反応を測定した.これまでの研究により,非高頻度発火型の抑制性ニューロンはアセチルコリンに反応して興奮性の活動を示すことが知られている8,9).このうち,ソマトスタチン陽性抑制性ニューロン,血管作動性腸管ペプチド陽性抑制性ニューロン,第1層抑制性ニューロンについて,マウスの1次視覚野の浅層のスライス標本において電気生理学的な記録を行った.いずれの抑制性ニューロンもアセチルコリンに対し興奮性の反応を示したが,ソマトスタチン陽性抑制性ニューロンは低濃度のアセチルコリンの刺激にも反応し広範囲の濃度選択性を示した.
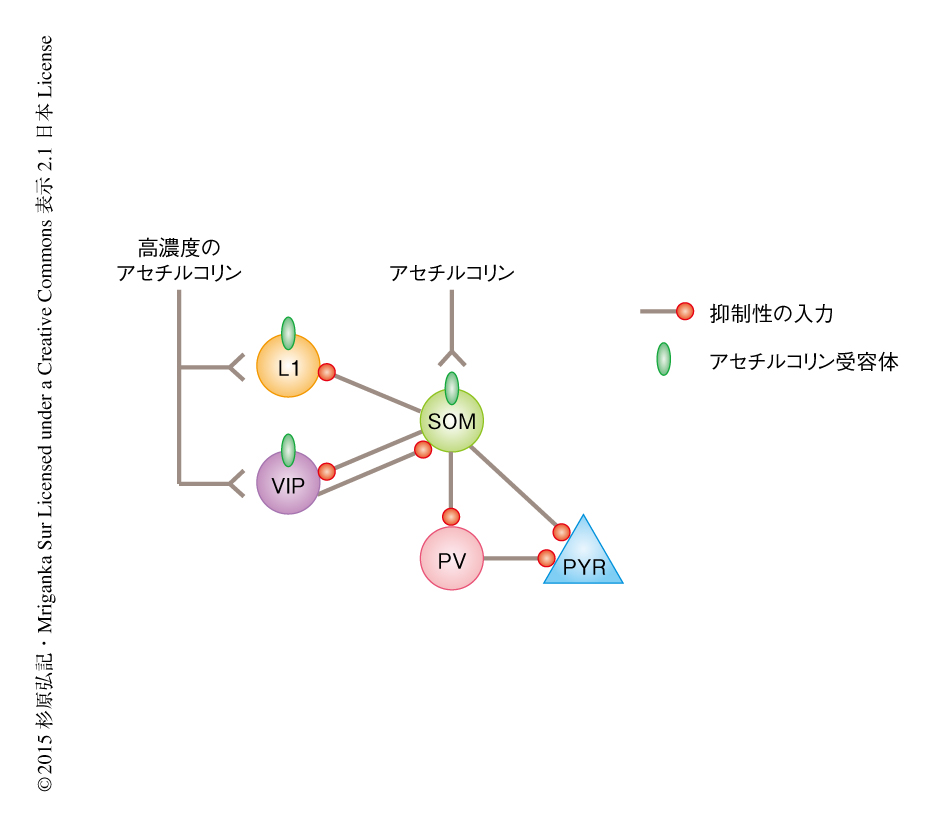
アセチルコリンの刺激に対する抑制性の入力を測定した.調べたすべての細胞種,ソマトスタチン陽性抑制性ニューロン,血管作動性腸管ペプチド陽性抑制性ニューロン,第1層抑制性ニューロン,パルブアルブミン陽性抑制性ニューロン,興奮性ニューロンにおいて,抑制性の入力が確認された.光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを脱分極させたところ,これらの抑制性の入力は有意に減少した.すなわち,ソマトスタチン陽性抑制性ニューロンがアセチルコリンに反応し,ほかのニューロンを抑制していることがわかった(図2).
麻酔下のマウスの1次視覚野の表層において,スライス標本において同定された神経回路につき検討した.光の刺激によりアセチルコリン作動性ニューロンを興奮させるよう遺伝子操作したマウスにおいて,ソマトスタチン陽性抑制性ニューロン,パルブアルブミン陽性抑制性ニューロン,興奮性ニューロンの電気生理学的な記録を行った.光の刺激,すなわち,アセチルコリンの刺激により,ソマトスタチン陽性抑制性ニューロンでは発火の頻度が上昇し,パルブアルブミン陽性抑制性ニューロンでは発火の頻度が低下した.これらは,スライス標本における結果と一致した.しかし,興奮性ニューロンにおいてはアセチルコリンの刺激に対し活動の頻度は変化しなかった.興奮性ニューロンはパルブアルブミン陽性抑制性ニューロンからも抑制性の入力をうけており,ソマトスタチン陽性抑制性ニューロンによるパルブアルブミン陽性抑制性ニューロンの抑制により脱抑制が生じることになる.ソマトスタチン陽性抑制性ニューロンによる興奮性ニューロンの直接的な抑制がこの脱抑制と相殺されていると考えられた(図2).
これまでの結果は,アセチルコリンによる大脳皮質の活動の時間的な動態の変化にとりソマトスタチン陽性抑制性ニューロンが重要な役割を担う可能性を示唆した.そこで,スライス標本における実験と同じ光遺伝学的な手法により,ソマトスタチン陽性抑制性ニューロンの活動を抑制したうえでアセチルコリンの刺激による局所における電位の変化を測定したところ,脱同期は起こらなかった.すなわち,アセチルコリンによる大脳皮質の活動の脱同期にはソマトスタチン陽性抑制性ニューロンの活性化が必要であることが示された.
血管作動性腸管ペプチド陽性抑制性ニューロンの脱同期への関与について調べた.同様の光遺伝学的な手法により血管作動性腸管ペプチド陽性抑制性ニューロンを抑制したうえでアセチルコリンの刺激をあたえたが,アセチルコリンの刺激により脱同期が起こった.すなわち,アセチルコリンによる大脳皮質の活動の脱同期には血管作動性腸管ペプチド陽性抑制性ニューロンの活性化は必要ではないことが示唆された.しかし,アセチルコリンの刺激をあたえずに血管作動性腸管ペプチド陽性抑制性ニューロンの抑制のみを行ったところ,アセチルコリンの刺激と同様の脱同期が観察された.血管作動性腸管ペプチド陽性抑制性ニューロンはソマトスタチン陽性抑制性ニューロンを抑制することが報告されている(図2).血管作動性腸管ペプチド陽性抑制性ニューロンの抑制による脱抑制により,ソマトスタチン陽性抑制性ニューロンが相対的に活性化されたのかもしれない.すなわち,脱抑制による活性化がアセチルコリンの刺激により活性化される局所の神経回路と同じ神経回路を活性化したためと考えられた.
ここまで,アセチルコリンによるソマトスタチン陽性抑制性ニューロンの活性化,および,それにともなう局所の神経回路の抑制あるいは脱抑制が脱同期に関与していることが示された.また,血管作動性腸管ペプチド陽性抑制性ニューロンの光遺伝学的な抑制の実験は,同様の局所の神経回路が活性化さえすればアセチルコリンの刺激がなくても脱同期の生じる可能性を示唆した.そこで,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを直接的に活性化させたところ,アセチルコリンの刺激と同様の脱同期が観察された.このことから,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期にとり十分条件であることが示された.
この研究においては,アセチルコリンによる脱同期の神経機構のひとつとして,ソマトスタチン陽性抑制性ニューロンの活性化を起点としたパルブアルブミン陽性抑制性ニューロンおよび興奮性ニューロンからなる局所の神経回路を提示した.それでは,これらの神経回路はどのように脱同期を実現しているのだろうか.ソマトスタチン陽性抑制性ニューロンは視覚刺激の空間的な加算を制御していることが報告されている10).すなわち,視覚刺激を大きくしていくと1次視覚野においてニューロンの反応も増大するが,一定の大きさをこえると反応が抑制される.周辺抑制とよばれる現象である.ソマトスタチン陽性抑制性ニューロンはこの周辺抑制に関与していると考えられている.また,周辺抑制を起こすような大きな視覚刺激はニューロンの集団の活動を脱同期することが報告されている11).これらのことから,おそらく,ソマトスタチン陽性抑制性ニューロンは空間的な加算の制御と同様の機構により時間的な制御も行っているのであろう.
2光子顕微鏡法および光遺伝学的な手法の発展により,抑制性ニューロンの種類およびその機能の違いに関する研究が進んでいる.この研究は,神経修飾における細胞種の役割を示した研究と位置づけることができる.また,アセチルコリンによる神経修飾のほかの例として,可塑性の促進があげられる.すなわち,アセチルコリンと感覚入力との同時刺激のくり返しにより感覚入力の反応が増強することが知られている.以前に,筆者らは,これらのアセチルコリンによる可塑性に脳の支持細胞の一種であるアストロサイトが関与していることを示した12).今回の研究とあわせて考えると,神経修飾因子がさまざまな機能を示すのは,それぞれ異なる種類の細胞とその局所の神経回路が関係しているからなのかもしれない.
略歴:2001年 総合研究大学院大学生命科学研究科 修了,米国California大学San Francisco校 博士研究員,2005年 米国Massachusetts Institute of Technology博士研究員を経て,2010年より同Research Scientist.
研究テーマ:大脳皮質における局所の神経回路とその機能.
関心事:おいしいコーヒーのいれ方.
Mriganka Sur
米国Massachusetts Institute of TechnologyにてProfessor.
研究室URL:http://web.mit.edu/msur/
© 2015 杉原弘記・Mriganka Sur Licensed under CC 表示 2.1 日本
(米国Massachusetts Institute of Technology,Department of Brain and Cognitive Sciences,Picower Institute for Learning and Memory)
email:杉原弘記
DOI: 10.7875/first.author.2015.070
An acetylcholine-activated microcircuit drives temporal dynamics of cortical activity.
Naiyan Chen, Hiroki Sugihara, Mriganka Sur
Nature Neuroscience, 18, 892-902 (2015)
要 約
アセチルコリンは大脳皮質における情報伝達や活動の状態を変化させる.たとえば,ニューロンの集団が同期して活動していてもアセチルコリンにより脱同期の生じることが知られている.筆者らは,マウスの1次視覚野へのアセチルコリンの入力が大脳皮質において特定の局所の神経回路にはたらくことを発見した.すなわち,アセチルコリンはソマトスタチン陽性抑制性ニューロンの活動を活性化することにより,パルブアルブミン陽性抑制性ニューロンおよび興奮性ニューロンを抑制した.また,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを選択的に抑制したところ,アセチルコリンの刺激による脱同期が阻害されたことから,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期に必要であることが示された.さらに,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを直接的に活性化させたところ,アセチルコリンの刺激と同様の脱同期が起こった.すなわち,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期にとり十分であることが示された.以上の結果は,抑制性ニューロンおよび興奮性ニューロンの形成する特定の局所の神経回路が,ニューロンの活動において時間的な動態の形成に重要な役割を担うことを示した.
はじめに
前脳の基底部にあるマイネルト基底核から大脳皮質に供給されるアセチルコリンは,主要な神経修飾因子のひとつである1).覚醒や睡眠などの脳の活動の状態や注意効果に関係しているとされ,時間的な動態を変化させ情報処理を促進すると考えられている2-4).たとえば,睡眠状態あるいは麻酔下において大脳皮質の局所における電位を測定すると,大きな振幅をもつ低周波数の活動が記録される3,4).これは,近傍のニューロンの集団が同期して活動しているためと考えられる.このとき,マイネルト基底核を電気刺激すると大脳皮質の局所における電位は高周波数の成分からなる活動に変化する.脱同期とよばれる現象である(図1).近傍のニューロンの集団はそれぞれ異なる時点で発火していることから,そのニューロンの集団が伝達できる情報量は増加することになる.先行研究によると,ニューロンの活動の同期には第5層にある錘体ニューロンの周期的な多重発火が関与しているとされる2).しかし,より最近の計算理論的な研究および実験的な研究により,抑制性ニューロンが脱同期や分散の符号化に関与している可能性が指摘されている5-7).近年の2光子顕微鏡法および光遺伝学的な手法の発展により,ニューロンの種類を可視化し,また,制御することが可能になってきた.アセチルコリンによる脱同期は抑制性ニューロンによりなされているのだろうか? もしそうなら,どの種類の抑制性ニューロンがかかわっているのか? そして,それらの細胞種はどのようにかかわりあっているのか?
1.ソマトスタチン陽性抑制性ニューロンはアセチルコリンの刺激に反応しほかのニューロンを抑制する
アセチルコリンに対する抑制性ニューロンの反応を測定した.これまでの研究により,非高頻度発火型の抑制性ニューロンはアセチルコリンに反応して興奮性の活動を示すことが知られている8,9).このうち,ソマトスタチン陽性抑制性ニューロン,血管作動性腸管ペプチド陽性抑制性ニューロン,第1層抑制性ニューロンについて,マウスの1次視覚野の浅層のスライス標本において電気生理学的な記録を行った.いずれの抑制性ニューロンもアセチルコリンに対し興奮性の反応を示したが,ソマトスタチン陽性抑制性ニューロンは低濃度のアセチルコリンの刺激にも反応し広範囲の濃度選択性を示した.
アセチルコリンの刺激に対する抑制性の入力を測定した.調べたすべての細胞種,ソマトスタチン陽性抑制性ニューロン,血管作動性腸管ペプチド陽性抑制性ニューロン,第1層抑制性ニューロン,パルブアルブミン陽性抑制性ニューロン,興奮性ニューロンにおいて,抑制性の入力が確認された.光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを脱分極させたところ,これらの抑制性の入力は有意に減少した.すなわち,ソマトスタチン陽性抑制性ニューロンがアセチルコリンに反応し,ほかのニューロンを抑制していることがわかった(図2).
2.麻酔下のマウスにおいてアセチルコリンの刺激による興奮性ニューロンの反応は抑制と脱抑制のバランスのうえにある
麻酔下のマウスの1次視覚野の表層において,スライス標本において同定された神経回路につき検討した.光の刺激によりアセチルコリン作動性ニューロンを興奮させるよう遺伝子操作したマウスにおいて,ソマトスタチン陽性抑制性ニューロン,パルブアルブミン陽性抑制性ニューロン,興奮性ニューロンの電気生理学的な記録を行った.光の刺激,すなわち,アセチルコリンの刺激により,ソマトスタチン陽性抑制性ニューロンでは発火の頻度が上昇し,パルブアルブミン陽性抑制性ニューロンでは発火の頻度が低下した.これらは,スライス標本における結果と一致した.しかし,興奮性ニューロンにおいてはアセチルコリンの刺激に対し活動の頻度は変化しなかった.興奮性ニューロンはパルブアルブミン陽性抑制性ニューロンからも抑制性の入力をうけており,ソマトスタチン陽性抑制性ニューロンによるパルブアルブミン陽性抑制性ニューロンの抑制により脱抑制が生じることになる.ソマトスタチン陽性抑制性ニューロンによる興奮性ニューロンの直接的な抑制がこの脱抑制と相殺されていると考えられた(図2).
3.ソマトスタチン陽性抑制性ニューロンの活性化はアセチルコリンによる脱同期の必要条件である
これまでの結果は,アセチルコリンによる大脳皮質の活動の時間的な動態の変化にとりソマトスタチン陽性抑制性ニューロンが重要な役割を担う可能性を示唆した.そこで,スライス標本における実験と同じ光遺伝学的な手法により,ソマトスタチン陽性抑制性ニューロンの活動を抑制したうえでアセチルコリンの刺激による局所における電位の変化を測定したところ,脱同期は起こらなかった.すなわち,アセチルコリンによる大脳皮質の活動の脱同期にはソマトスタチン陽性抑制性ニューロンの活性化が必要であることが示された.
4.血管作動性腸管ペプチド陽性抑制性ニューロンの活性化はアセチルコリンによる脱同期の必要条件ではない
血管作動性腸管ペプチド陽性抑制性ニューロンの脱同期への関与について調べた.同様の光遺伝学的な手法により血管作動性腸管ペプチド陽性抑制性ニューロンを抑制したうえでアセチルコリンの刺激をあたえたが,アセチルコリンの刺激により脱同期が起こった.すなわち,アセチルコリンによる大脳皮質の活動の脱同期には血管作動性腸管ペプチド陽性抑制性ニューロンの活性化は必要ではないことが示唆された.しかし,アセチルコリンの刺激をあたえずに血管作動性腸管ペプチド陽性抑制性ニューロンの抑制のみを行ったところ,アセチルコリンの刺激と同様の脱同期が観察された.血管作動性腸管ペプチド陽性抑制性ニューロンはソマトスタチン陽性抑制性ニューロンを抑制することが報告されている(図2).血管作動性腸管ペプチド陽性抑制性ニューロンの抑制による脱抑制により,ソマトスタチン陽性抑制性ニューロンが相対的に活性化されたのかもしれない.すなわち,脱抑制による活性化がアセチルコリンの刺激により活性化される局所の神経回路と同じ神経回路を活性化したためと考えられた.
5.ソマトスタチン陽性抑制性ニューロンの活性化はアセチルコリンによる脱同期の十分条件である
ここまで,アセチルコリンによるソマトスタチン陽性抑制性ニューロンの活性化,および,それにともなう局所の神経回路の抑制あるいは脱抑制が脱同期に関与していることが示された.また,血管作動性腸管ペプチド陽性抑制性ニューロンの光遺伝学的な抑制の実験は,同様の局所の神経回路が活性化さえすればアセチルコリンの刺激がなくても脱同期の生じる可能性を示唆した.そこで,光遺伝学的な手法によりソマトスタチン陽性抑制性ニューロンを直接的に活性化させたところ,アセチルコリンの刺激と同様の脱同期が観察された.このことから,ソマトスタチン陽性抑制性ニューロンの活性化が脱同期にとり十分条件であることが示された.
おわりに
この研究においては,アセチルコリンによる脱同期の神経機構のひとつとして,ソマトスタチン陽性抑制性ニューロンの活性化を起点としたパルブアルブミン陽性抑制性ニューロンおよび興奮性ニューロンからなる局所の神経回路を提示した.それでは,これらの神経回路はどのように脱同期を実現しているのだろうか.ソマトスタチン陽性抑制性ニューロンは視覚刺激の空間的な加算を制御していることが報告されている10).すなわち,視覚刺激を大きくしていくと1次視覚野においてニューロンの反応も増大するが,一定の大きさをこえると反応が抑制される.周辺抑制とよばれる現象である.ソマトスタチン陽性抑制性ニューロンはこの周辺抑制に関与していると考えられている.また,周辺抑制を起こすような大きな視覚刺激はニューロンの集団の活動を脱同期することが報告されている11).これらのことから,おそらく,ソマトスタチン陽性抑制性ニューロンは空間的な加算の制御と同様の機構により時間的な制御も行っているのであろう.
2光子顕微鏡法および光遺伝学的な手法の発展により,抑制性ニューロンの種類およびその機能の違いに関する研究が進んでいる.この研究は,神経修飾における細胞種の役割を示した研究と位置づけることができる.また,アセチルコリンによる神経修飾のほかの例として,可塑性の促進があげられる.すなわち,アセチルコリンと感覚入力との同時刺激のくり返しにより感覚入力の反応が増強することが知られている.以前に,筆者らは,これらのアセチルコリンによる可塑性に脳の支持細胞の一種であるアストロサイトが関与していることを示した12).今回の研究とあわせて考えると,神経修飾因子がさまざまな機能を示すのは,それぞれ異なる種類の細胞とその局所の神経回路が関係しているからなのかもしれない.
文 献
- Kitt, C. A., Hohmann, C., Coyle, J. T. et al.: Cholinergic innervation of mouse forebrain structures. J. Comp. Neurol., 341, 117-129 (1994)[PubMed]
- Metherate, R., Cox, C. & Ashe, J.: Cellular bases of neocortical activation: modulation of neural oscillations by the nucleus basalis and endogenous acetylcholine. J. Neurosci., 12, 4701-4711 (1992)[PubMed]
- Goard, M. & Dan, Y.: Basal forebrain activation enhances cortical coding of natural scenes. Nat. Neurosci., 12, 1444-1449 (2009)[PubMed]
- Harris, K. D. & Thiele, A.: Cortical state and attention. Nat. Rev. Neurosci., 12, 509-523 (2011)[PubMed]
- Renart, A., de la Rocha, J., Bartho, P. et al.: The asynchronous state in cortical circuits. Science, 327, 587-590 (2010)[PubMed]
- King, P. D., Zylberberg, J. & DeWeese, M. R.: Inhibitory interneurons decorrelate excitatory cells to drive sparse code formation in a spiking model of V1. J. Neurosci., 33, 5475-5485 (2013)[PubMed]
- Sippy, T. & Yuste, R.: Decorrelating action of inhibition in neocortical networks. J. Neurosci., 33, 9813-9830 (2013)[PubMed]
- Arroyo, S., Bennett, C., Aziz, D. et al.: Prolonged disynaptic inhibition in the cortex mediated by slow, non-α7 nicotinic excitation of a specific subset of cortical interneurons. J. Neurosci., 32, 3859-3864 (2012)[PubMed]
- Xiang, Z., Huguenard, J. R. & Prince, D. A.: Cholinergic switching within neocortical inhibitory networks. Science, 281, 985-988 (1998)[PubMed]
- Adesnik, H., Bruns, W., Taniguchi, H. et al.: A neural circuit for spatial summation in visual cortex. Nature, 490, 226-231 (2012)[PubMed]
- Vinje, W. E. & Gallant, J. L.: Sparse coding and decorrelation in primary visual cortex during natural vision. Science, 287, 1273-1276 (2000)[PubMed]
- Chen, N., Sugihara, H., Sharma, J. et al.: Nucleus basalis-enabled stimulus-specific plasticity in the visual cortex is mediated by astrocytes. Proc. Natl. Acad. Sci. USA, 109, 2832-2841 (2012)[PubMed]
著者プロフィール
略歴:2001年 総合研究大学院大学生命科学研究科 修了,米国California大学San Francisco校 博士研究員,2005年 米国Massachusetts Institute of Technology博士研究員を経て,2010年より同Research Scientist.
研究テーマ:大脳皮質における局所の神経回路とその機能.
関心事:おいしいコーヒーのいれ方.
Mriganka Sur
米国Massachusetts Institute of TechnologyにてProfessor.
研究室URL:http://web.mit.edu/msur/
© 2015 杉原弘記・Mriganka Sur Licensed under CC 表示 2.1 日本