細胞運動の際の極性の形成における細胞膜の張力と膜変形タンパク質によるフィードバック制御機構
辻田和也・伊藤俊樹
(神戸大学バイオシグナル研究センター 生体膜機能研究分野)
email:辻田和也,伊藤俊樹
DOI: 10.7875/first.author.2015.068
Feedback regulation between plasma membrane tension and membrane-bending proteins organizes cell polarity during leading edge formation.
Kazuya Tsujita, Tadaomi Takenawa, Toshiki Itoh
Nature Cell Biology, 17, 749-758 (2015)
近年,細胞運動の際の先導端の形成において,細胞膜の張力が阻害的なシグナルとしてはたらき,その極性の形成に必須であることが報告された.しかしながら,細胞膜の張力を認識するタンパク質が不明なため,この物理的なシグナルがどのようにアクチンの重合活性を制御するのかは明らかではなかった.筆者らは,細胞膜を曲げる活性をもつF-BARドメインをもつFBP17が細胞膜の張力センサーとしてはたらき,先導端の形成を制御していることを明らかにした.生細胞イメージングにより,FBP17は重合と脱重合とをくり返しながら自己組織的に先導端に極性を形成することがわかった.細胞膜の張力を人工的に上昇させると,この極性の形成は亢進した.逆に,細胞膜の張力を低下させるとFBP17は細胞の全体にわたり重合し,このターンオーバーおよび極性の形成は瞬時に阻害された.これらの結果から,細胞膜の張力はFBP17の重合を阻害することにより極性の形成を制御していると考えられた.さらに,この極性の形成において,FBP17それ自体によるN-WASPを介したアクチンの重合活性が必須であることが明らかにされた.FBP17-N-WASP-Arp2/3複合体を介したアクチンの重合は細胞膜を押すことにより張力を発生させる.つまり,FBP17の重合と細胞膜の張力によるフィードバック制御が先導端における極性の形成に重要であると考えられた.
細胞における極性の形成は細胞運動,細胞分裂,組織の形成など基本的な生命現象に不可欠である.よって,細胞がシグナルタンパク質の極性を形成する機構を理解することは,細胞生物学におけるもっとも重要な課題のひとつである.細胞運動を例に考えてみよう.細胞骨格タンパク質であるアクチンの重合は細胞が運動するための推進力になる1).細胞が方向性をもって動くためには,アクチン重合装置を先導端に極性化させる必要がある.これまでの細胞生物学的な研究および数理モデルを用いた研究により,先導端への極性化は自律的に起こること,また,アクチンの重合を活性化させる正のフィードバック活性化因子と,それに付随する細胞の全体にわたる負のフィードバックループがこの極性の形成に重要であること,が明らかにされている2,3)(図1).実際に,アクチン重合装置であるWASPファミリータンパク質複合体は非常に動的なターンオーバーをくり返しながら自己組織的に先導端に極性を形成することが知られている.これらの自律的かつ振動的なふるまいは,活性化因子と阻害因子によるフィードバック機構により説明できると考えられている2,3).近年,細胞が運動する際に発生する細胞膜の張力が負のフィードバック制御因子としてはたらき,先導端への極性化において必須であることが報告された4,5)(図1).しかしながら,細胞膜の張力という物理的なシグナルがアクチン重合装置を制御する機構に関しては不明であった.
以前に,筆者らは,細胞膜を曲げる活性をもつF-BARドメインを発見した6).F-BARドメインをもつ多くのタンパク質はN-WASPなどWASPファミリータンパク質に結合することが知られている.なかでも,TOCAファミリータンパク質であるFBP17,Toca-1,CIP4はN-WASP-Arp2/3複合体を介したアクチンの重合の活性化に必須である.これらのタンパク質は細胞膜を曲げながらそれ自体が重合し,N-WASPのクラスター化を促進することによりアクチンの重合を活性化する.重要なことに,この重合の過程は正のフィードバック機構をともなうと考えられている.つまり,F-BARドメインは細胞膜の曲率を“認識”するので,曲がった細胞膜にはさらなるF-BARドメインのリクルートが誘導されると考えられる.筆者らは,FBP17が細胞膜において重合と脱重合とをくり返しながら先導端に極性を形成することを観察していた.細胞膜を曲げる能力は細胞膜の張力に依存すると考えられるので,FBP17は細胞膜の張力センサーとしてはたらき,先導端の形成を制御しているのではないかと考えた.
アフリカミドリザルの腎細胞であるCOS-1細胞は数カ所の先導端を自発的に形成する.共焦点レーザー顕微鏡による観察により,内在性のFBP17はこれらの先導端にドット状に局在することがわかった.培地に低張液をくわえ浸透圧を上げることにより細胞膜の張力を上昇させると,1カ所の先導端が生き残ると同時にほかの箇所におけるアクチンの重合が消滅し細胞の極性化は亢進した.FBP17のドットもきれいに先導端に極性を形成していた.逆に,高張液をくわえることにより細胞膜の張力を低下させると,FBP17のドットは細胞の全体にわたりランダムに局在しその極性は完全に崩壊した.おもしろいことに,アクチンの重合も細胞の全体において無秩序に起こり,その多くはFBP17のドットと一致していた.さらに詳細にこれらの過程を調べるため,生細胞イメージングにより観察した.細胞膜の張力を上昇させると,細胞膜の縁に全体的に局在していたFBP17が1カ所の先導端に極性を形成するようすが観察された.それにともないアクチンの重合も活性化されていた.逆に,細胞膜の張力を低下させると,FBP17の極性は瞬時に失われ細胞の全体にわたりランダムに重合するようすがみられた.これらの結果から,細胞膜の張力がFBP17の極性の形成に必須であることがわかった.
FBP17の局在は細胞膜の張力を変化させたときのアクチンの重合の様式と一致したことから,FBP17が先導端の形成を制御しているのではないかと考えた.RNAi法を用いた実験により,FBP17はCOS-1細胞において,先導端の形成および細胞運動に重要であることが明らかにされた.さらに,FBP17は細胞膜の張力に依存的な先導端への極性化の亢進にも重要な役割をはたすことがわかった.レスキュー実験により,FBP17の極性の形成および先導端の形成には,N-WASP-Arp2/3複合体に依存的なアクチンの重合活性が必須であることが示唆された.
BP17の膜変形活性が張力への応答による極性の形成に必要ではないかと考えた.膜変形活性を欠失させたBP17変異体を解析した結果,細胞膜を曲げる活性が先導端への極性化に必須であることがわかった.
FBP17の膜変形活性が細胞膜の張力に依存するかどうか,in vitroにおいて再構成実験を行った.人工リポソームに高張液をくわえリポソーム膜の張力を低下させると,FBP17の膜変形活性は顕著に増大した.in vivoにおいても解析した.COS-1細胞にFBP17を高く発現させると長い細胞膜の陥入をひき起こすことがわかっている.ここで,細胞膜の張力を上昇させると,FBP17による細胞膜の陥入は阻害された.逆に,細胞膜の張力を低下させると,細胞膜の陥入は促進された.以上の結果から,FBP17の膜変形活性は細胞膜の張力に依存することが明らかにされた.
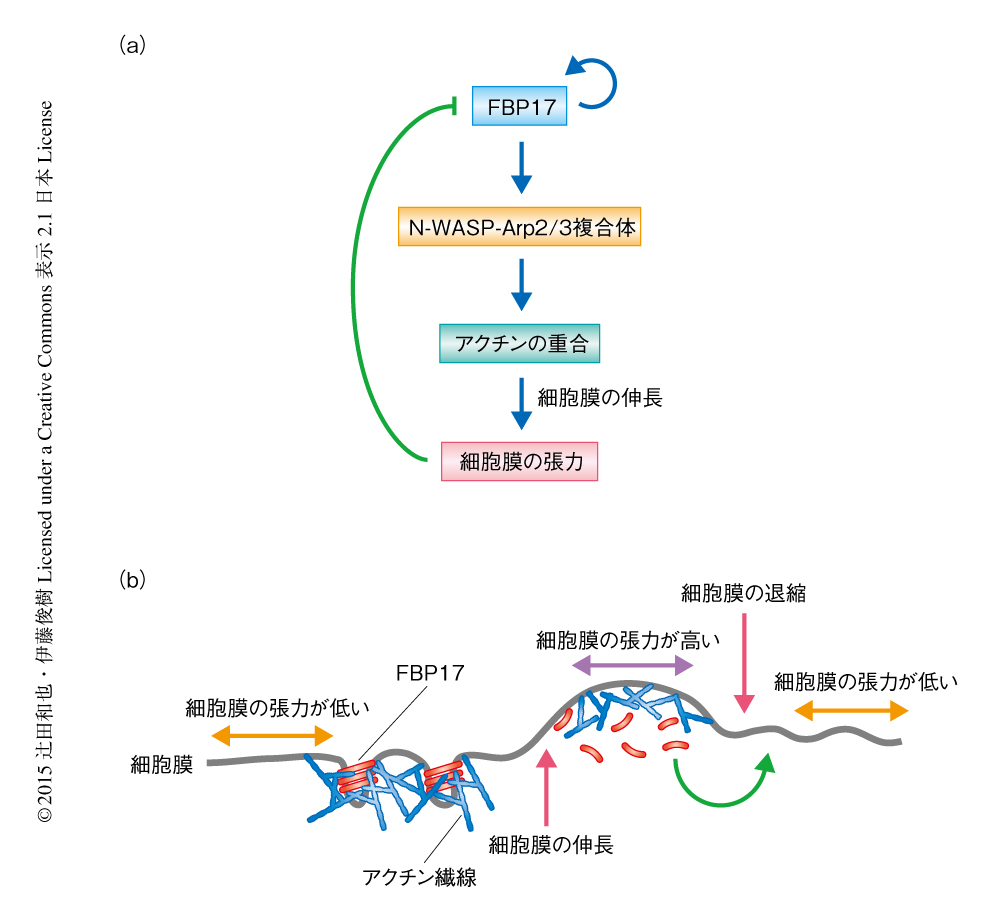
FBP17の極性の形成が細胞膜の張力により制御される分子機構について解析した.タイムラプスイメージングにより,先導端において連続的かつ個々に独立した単位の細胞膜の伸長および退縮が起こっていることがわかった.この結果は,2次元の環境の場合,細胞は先導端において細胞膜の伸長と退縮とをくり返しながら動いていることを意味した.興味深いことに,FBP17は重合と脱重合とをくり返しながらダイナミックに先導端に極性を形成することがわかった.さらに,このターンオーバーは先導端における伸長および退縮と同調していた.つまり,FBP17は細胞膜が退縮する際に重合し,伸長にともない脱重合していた.以前の研究により,WASPファミリータンパク質とArp2/3との複合体を介したアクチンの重合は細胞膜を押すことにより張力を発生させることがわかっていた.FBP17の重合はその活性化に重要であるので,FBP17のアクチンの重合活性とそれにともなう細胞膜の張力のフィードバックループがFBP17の極性の形成に必要ではないかと考えた(図2a).それを確かめるため,N-WASPの阻害剤を用いて調べた結果,FBP17はN-WASPの活性を阻害させると瞬時に先導端における極性を失い,細胞の全体にわたりランダムに重合することがわかった.Arp2/3複合体を阻害した場合においても,同様の結果が得られた.また,FBP17のターンオーバーも失われた.これらの結果は,細胞膜の張力を人工的に低下させた場合の挙動と一致した.さらに,N-WASPと結合できないFBP17変異体に関しては先導端への極性化およびターンオーバーはみられなかった.よって,FBP17によるアクチンの重合を介した細胞膜の張力の上昇が,FBP17それ自体を細胞膜から外すことに必要であると考えられた(図2).
細胞膜の退縮による一時的な細胞膜の張力の低下がFBP17のリクルートに寄与しているのではないかと考えた.この退縮にはミオシンの収縮力が必須であることがわかっており,実際にミオシンの活性を阻害すると,細胞膜の張力が上昇することが知られている.そこで,ミオシンを阻害した際のFBP17の極性の形成について調べた.ミオシンの活性を阻害すると,FBP17は先導端から瞬時に脱重合することがわかった.さらに,このとき細胞膜の張力を人工的に低下させると,FBP17は細胞の全体にわたりランダムに重合した.これらの結果から,FBP17は先導端における細胞膜の張力の変動を感知しながらダイナミックに極性を形成することが考えられた(図2b).
これまで,イノシトールリン脂質結合ドメインを代表とする酸性リン脂質結合タンパク質は,特定の場所で産生される酸性リン脂質と結合して特定の場所に局在するというモデルが一般的であった.しかしながら,F-BARドメインは細胞膜に一様に存在するホスファチジルセリンと結合することから,FBP17の極性の形成はリン脂質に対する結合の特異性では説明がつかなかった.今回の研究により,FBP17をモデルとしてタンパク質が細胞膜の張力を認識して特定の場所に極性を形成する分子機構がはじめて提唱された.さらに,BARドメインファミリーが普遍的な細胞膜の張力センサーとしてはたらく可能性のあることが示唆された.細胞膜の張力は,細胞運動のみならず,細胞膜の形状の変化をともなう細胞分裂,神経突起の形成,上皮細胞の極性化,組織の形成など,基本的な生命現象を理解するうえで不可欠であり,その重要性に注目があつまりつつある4,5).しかしながら,細胞膜の張力を認識するタンパク質は不明であったため,この物理的なシグナルがこれらの機能をどのように制御するのかまったくわかっていない.もし,BARドメインファミリーが普遍的な細胞膜の張力センサーとしてはたらくのであれば,細胞膜の張力を介した生命現象を理解するうえで大きな進展が期待される.実際に,BARドメインファミリーをもつタンパク質は細胞膜の張力の関与する生命現象に関与していることがわかっている.筆者らの研究成果が,細胞膜の張力を介したシグナル伝達の研究の発展に貢献できれば幸いである.
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員,2009年 神戸大学医学研究科 特命助教を経て,2013年より神戸大学バイオシグナル研究センター 助教.
研究テーマ:細胞膜の張力を介したシグナル伝達機構.
関心事:細胞膜ストレスと疾患との関連.
伊藤 俊樹(Toshiki Itoh)
神戸大学バイオシグナル研究センター 教授.
研究室URL:http://www.research.kobe-u.ac.jp/brce-itoh/
© 2015 辻田和也・伊藤俊樹 Licensed under CC 表示 2.1 日本
(神戸大学バイオシグナル研究センター 生体膜機能研究分野)
email:辻田和也,伊藤俊樹
DOI: 10.7875/first.author.2015.068
Feedback regulation between plasma membrane tension and membrane-bending proteins organizes cell polarity during leading edge formation.
Kazuya Tsujita, Tadaomi Takenawa, Toshiki Itoh
Nature Cell Biology, 17, 749-758 (2015)
要 約
近年,細胞運動の際の先導端の形成において,細胞膜の張力が阻害的なシグナルとしてはたらき,その極性の形成に必須であることが報告された.しかしながら,細胞膜の張力を認識するタンパク質が不明なため,この物理的なシグナルがどのようにアクチンの重合活性を制御するのかは明らかではなかった.筆者らは,細胞膜を曲げる活性をもつF-BARドメインをもつFBP17が細胞膜の張力センサーとしてはたらき,先導端の形成を制御していることを明らかにした.生細胞イメージングにより,FBP17は重合と脱重合とをくり返しながら自己組織的に先導端に極性を形成することがわかった.細胞膜の張力を人工的に上昇させると,この極性の形成は亢進した.逆に,細胞膜の張力を低下させるとFBP17は細胞の全体にわたり重合し,このターンオーバーおよび極性の形成は瞬時に阻害された.これらの結果から,細胞膜の張力はFBP17の重合を阻害することにより極性の形成を制御していると考えられた.さらに,この極性の形成において,FBP17それ自体によるN-WASPを介したアクチンの重合活性が必須であることが明らかにされた.FBP17-N-WASP-Arp2/3複合体を介したアクチンの重合は細胞膜を押すことにより張力を発生させる.つまり,FBP17の重合と細胞膜の張力によるフィードバック制御が先導端における極性の形成に重要であると考えられた.
はじめに
細胞における極性の形成は細胞運動,細胞分裂,組織の形成など基本的な生命現象に不可欠である.よって,細胞がシグナルタンパク質の極性を形成する機構を理解することは,細胞生物学におけるもっとも重要な課題のひとつである.細胞運動を例に考えてみよう.細胞骨格タンパク質であるアクチンの重合は細胞が運動するための推進力になる1).細胞が方向性をもって動くためには,アクチン重合装置を先導端に極性化させる必要がある.これまでの細胞生物学的な研究および数理モデルを用いた研究により,先導端への極性化は自律的に起こること,また,アクチンの重合を活性化させる正のフィードバック活性化因子と,それに付随する細胞の全体にわたる負のフィードバックループがこの極性の形成に重要であること,が明らかにされている2,3)(図1).実際に,アクチン重合装置であるWASPファミリータンパク質複合体は非常に動的なターンオーバーをくり返しながら自己組織的に先導端に極性を形成することが知られている.これらの自律的かつ振動的なふるまいは,活性化因子と阻害因子によるフィードバック機構により説明できると考えられている2,3).近年,細胞が運動する際に発生する細胞膜の張力が負のフィードバック制御因子としてはたらき,先導端への極性化において必須であることが報告された4,5)(図1).しかしながら,細胞膜の張力という物理的なシグナルがアクチン重合装置を制御する機構に関しては不明であった.
以前に,筆者らは,細胞膜を曲げる活性をもつF-BARドメインを発見した6).F-BARドメインをもつ多くのタンパク質はN-WASPなどWASPファミリータンパク質に結合することが知られている.なかでも,TOCAファミリータンパク質であるFBP17,Toca-1,CIP4はN-WASP-Arp2/3複合体を介したアクチンの重合の活性化に必須である.これらのタンパク質は細胞膜を曲げながらそれ自体が重合し,N-WASPのクラスター化を促進することによりアクチンの重合を活性化する.重要なことに,この重合の過程は正のフィードバック機構をともなうと考えられている.つまり,F-BARドメインは細胞膜の曲率を“認識”するので,曲がった細胞膜にはさらなるF-BARドメインのリクルートが誘導されると考えられる.筆者らは,FBP17が細胞膜において重合と脱重合とをくり返しながら先導端に極性を形成することを観察していた.細胞膜を曲げる能力は細胞膜の張力に依存すると考えられるので,FBP17は細胞膜の張力センサーとしてはたらき,先導端の形成を制御しているのではないかと考えた.
1.細胞膜の張力はFBP17の先導端への極性化に必須である
アフリカミドリザルの腎細胞であるCOS-1細胞は数カ所の先導端を自発的に形成する.共焦点レーザー顕微鏡による観察により,内在性のFBP17はこれらの先導端にドット状に局在することがわかった.培地に低張液をくわえ浸透圧を上げることにより細胞膜の張力を上昇させると,1カ所の先導端が生き残ると同時にほかの箇所におけるアクチンの重合が消滅し細胞の極性化は亢進した.FBP17のドットもきれいに先導端に極性を形成していた.逆に,高張液をくわえることにより細胞膜の張力を低下させると,FBP17のドットは細胞の全体にわたりランダムに局在しその極性は完全に崩壊した.おもしろいことに,アクチンの重合も細胞の全体において無秩序に起こり,その多くはFBP17のドットと一致していた.さらに詳細にこれらの過程を調べるため,生細胞イメージングにより観察した.細胞膜の張力を上昇させると,細胞膜の縁に全体的に局在していたFBP17が1カ所の先導端に極性を形成するようすが観察された.それにともないアクチンの重合も活性化されていた.逆に,細胞膜の張力を低下させると,FBP17の極性は瞬時に失われ細胞の全体にわたりランダムに重合するようすがみられた.これらの結果から,細胞膜の張力がFBP17の極性の形成に必須であることがわかった.
2.FBP17は先導端の形成に重要であり細胞運動を制御する
FBP17の局在は細胞膜の張力を変化させたときのアクチンの重合の様式と一致したことから,FBP17が先導端の形成を制御しているのではないかと考えた.RNAi法を用いた実験により,FBP17はCOS-1細胞において,先導端の形成および細胞運動に重要であることが明らかにされた.さらに,FBP17は細胞膜の張力に依存的な先導端への極性化の亢進にも重要な役割をはたすことがわかった.レスキュー実験により,FBP17の極性の形成および先導端の形成には,N-WASP-Arp2/3複合体に依存的なアクチンの重合活性が必須であることが示唆された.
3.F-BARドメインを介した細胞膜を曲げる活性が先導端への極性化に必須である
BP17の膜変形活性が張力への応答による極性の形成に必要ではないかと考えた.膜変形活性を欠失させたBP17変異体を解析した結果,細胞膜を曲げる活性が先導端への極性化に必須であることがわかった.
4.FBP17のF-BARドメインを介した膜変形活性は細胞膜の張力に依存する
FBP17の膜変形活性が細胞膜の張力に依存するかどうか,in vitroにおいて再構成実験を行った.人工リポソームに高張液をくわえリポソーム膜の張力を低下させると,FBP17の膜変形活性は顕著に増大した.in vivoにおいても解析した.COS-1細胞にFBP17を高く発現させると長い細胞膜の陥入をひき起こすことがわかっている.ここで,細胞膜の張力を上昇させると,FBP17による細胞膜の陥入は阻害された.逆に,細胞膜の張力を低下させると,細胞膜の陥入は促進された.以上の結果から,FBP17の膜変形活性は細胞膜の張力に依存することが明らかにされた.
5.膜変形活性とアクチンの重合による細胞膜の張力の発生との相互的な作用がFBP17の極性の形成に必要である
FBP17の極性の形成が細胞膜の張力により制御される分子機構について解析した.タイムラプスイメージングにより,先導端において連続的かつ個々に独立した単位の細胞膜の伸長および退縮が起こっていることがわかった.この結果は,2次元の環境の場合,細胞は先導端において細胞膜の伸長と退縮とをくり返しながら動いていることを意味した.興味深いことに,FBP17は重合と脱重合とをくり返しながらダイナミックに先導端に極性を形成することがわかった.さらに,このターンオーバーは先導端における伸長および退縮と同調していた.つまり,FBP17は細胞膜が退縮する際に重合し,伸長にともない脱重合していた.以前の研究により,WASPファミリータンパク質とArp2/3との複合体を介したアクチンの重合は細胞膜を押すことにより張力を発生させることがわかっていた.FBP17の重合はその活性化に重要であるので,FBP17のアクチンの重合活性とそれにともなう細胞膜の張力のフィードバックループがFBP17の極性の形成に必要ではないかと考えた(図2a).それを確かめるため,N-WASPの阻害剤を用いて調べた結果,FBP17はN-WASPの活性を阻害させると瞬時に先導端における極性を失い,細胞の全体にわたりランダムに重合することがわかった.Arp2/3複合体を阻害した場合においても,同様の結果が得られた.また,FBP17のターンオーバーも失われた.これらの結果は,細胞膜の張力を人工的に低下させた場合の挙動と一致した.さらに,N-WASPと結合できないFBP17変異体に関しては先導端への極性化およびターンオーバーはみられなかった.よって,FBP17によるアクチンの重合を介した細胞膜の張力の上昇が,FBP17それ自体を細胞膜から外すことに必要であると考えられた(図2).
細胞膜の退縮による一時的な細胞膜の張力の低下がFBP17のリクルートに寄与しているのではないかと考えた.この退縮にはミオシンの収縮力が必須であることがわかっており,実際にミオシンの活性を阻害すると,細胞膜の張力が上昇することが知られている.そこで,ミオシンを阻害した際のFBP17の極性の形成について調べた.ミオシンの活性を阻害すると,FBP17は先導端から瞬時に脱重合することがわかった.さらに,このとき細胞膜の張力を人工的に低下させると,FBP17は細胞の全体にわたりランダムに重合した.これらの結果から,FBP17は先導端における細胞膜の張力の変動を感知しながらダイナミックに極性を形成することが考えられた(図2b).
おわりに
これまで,イノシトールリン脂質結合ドメインを代表とする酸性リン脂質結合タンパク質は,特定の場所で産生される酸性リン脂質と結合して特定の場所に局在するというモデルが一般的であった.しかしながら,F-BARドメインは細胞膜に一様に存在するホスファチジルセリンと結合することから,FBP17の極性の形成はリン脂質に対する結合の特異性では説明がつかなかった.今回の研究により,FBP17をモデルとしてタンパク質が細胞膜の張力を認識して特定の場所に極性を形成する分子機構がはじめて提唱された.さらに,BARドメインファミリーが普遍的な細胞膜の張力センサーとしてはたらく可能性のあることが示唆された.細胞膜の張力は,細胞運動のみならず,細胞膜の形状の変化をともなう細胞分裂,神経突起の形成,上皮細胞の極性化,組織の形成など,基本的な生命現象を理解するうえで不可欠であり,その重要性に注目があつまりつつある4,5).しかしながら,細胞膜の張力を認識するタンパク質は不明であったため,この物理的なシグナルがこれらの機能をどのように制御するのかまったくわかっていない.もし,BARドメインファミリーが普遍的な細胞膜の張力センサーとしてはたらくのであれば,細胞膜の張力を介した生命現象を理解するうえで大きな進展が期待される.実際に,BARドメインファミリーをもつタンパク質は細胞膜の張力の関与する生命現象に関与していることがわかっている.筆者らの研究成果が,細胞膜の張力を介したシグナル伝達の研究の発展に貢献できれば幸いである.
文 献
- Pollard, T. D. & Borisy, G. G.: Cellular motility driven by assembly and disassembly of actin filaments. Cell, 112, 453-465 (2003)[PubMed]
- Jilkine, A. & Edelstein-Keshet, L. A.: Comparison of mathematical models for polarization of single eukaryotic cells in response to guided cues. PLoS Comput. Biol., 7, e1001121 (2011)[PubMed]
- Graziano, B. R. & Weiner, O. D.: Self-organization of protrusions and polarity during eukaryotic chemotaxis. Curr. Opin. Cell Biol. 30, 60-67 (2014)[PubMed]
- Gauthier. N. C., Masters, T. A. & Sheetz, M. P.: Mechanical feedback between membrane tension and dynamics. Trends Cell Biol., 22, 527-535 (2012)[PubMed]
- Diz-Munoz, A., Fletcher, D. A. & Weiner, O. D.: Use the force: membrane tension as an organizer of cell shape and motility. Trends Cell Biol., 23, 47-53 (2013)[PubMed]
- Itoh, T. & DeCamilli P.: BAR, F-BAR (EFC) and ENTH/ANTH domains in the regulation of membrane-cytosol interface and membrane curvature. Biochim. Biophys. Acta, 1761, 897-912 (2006)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員,2009年 神戸大学医学研究科 特命助教を経て,2013年より神戸大学バイオシグナル研究センター 助教.
研究テーマ:細胞膜の張力を介したシグナル伝達機構.
関心事:細胞膜ストレスと疾患との関連.
伊藤 俊樹(Toshiki Itoh)
神戸大学バイオシグナル研究センター 教授.
研究室URL:http://www.research.kobe-u.ac.jp/brce-itoh/
© 2015 辻田和也・伊藤俊樹 Licensed under CC 表示 2.1 日本