ユビキチンリガーゼ複合体SCFUcc1はグリオキシル酸回路の代謝スイッチとして機能する
中務邦雄・嘉村 巧
(名古屋大学大学院理学研究科 生命理学専攻分子修飾制御学グループ)
email:中務邦雄
DOI: 10.7875/first.author.2015.062
The ubiquitin ligase SCFUcc1 acts as a metabolic switch for the glyoxylate cycle.
Kunio Nakatsukasa, Takashi Nishimura, Stuart D. Byrne, Michiyo Okamoto, Azusa Takahashi-Nakaguchi, Hiroji Chibana, Fumihiko Okumura, Takumi Kamura
Molecular Cell, 59, 22-34 (2015)
微生物や植物に特有の代謝経路であるグリオキシル酸回路は,微生物によるバイオ燃料の生産のプラットフォームとして注目されているだけでなく,病原性の酵母の感染や植物の種子の発芽に必須の役割をはたすことが知られている.これらの生物はグルコースが不足すると酢酸や脂肪酸を材料にグリオキシル酸回路→クエン酸回路→糖新生という一連の代謝反応によりグルコースを合成する.これまで,グリオキシル酸回路の活性は,グルコースが豊富にあると低いレベルに抑制されること,グルコースが不足して酢酸や脂肪酸が炭素源として細胞に取り込まれると高いレベルに活性化されることが知られていたが,そのスイッチのくわしい分子機構は明らかにされていなかった.筆者らは,グリオキシル酸回路において最初の反応を触媒するクエン酸合成酵素Cit2に着目した.グルコースが豊富にあるとFボックスタンパク質としてUcc1を含むユビキチンリガーゼ複合体であるSCFUcc1がCit2をユビキチン化しその分解を促進してグリオキシル酸回路の活性を抑制した.また,グルコースが不足して酢酸や脂肪酸からグルコースを合成する必要が生じるとSCFUcc1はCit2をユビキチン化できなくなり安定化したCit2がグリオキシル酸回路を活性化した.この研究は,代謝経路の活性が代謝酵素の分解により制御されるというユニークなスイッチの分子機構について明らかにした.今後,バイオ燃料などの有用物質の生産をめざす代謝工学および感染症の克服をめざす医学などの分野において,Ucc1は重要なツールおよび標的になると期待される.
細胞に取り込まれたグルコースは化学反応に必要なエネルギーのもとになるだけでなく,糖鎖や核酸など生体高分子の材料にもなる.多くの生物はグルコースが不足するとグリコーゲンの分解や糖新生によりグルコースを合成することが知られている.植物と微生物の一部には糖新生の材料を供給するための特有のしくみとしてグリオキシル酸回路が備わっている.グリオキシル酸回路は酢酸や脂肪酸から合成されたアセチルCoAからグルコースを合成する一連の代謝反応の初期の段階を担う.具体的には,酢酸や脂肪酸から合成されたアセチルCoAがグリオキシル酸回路に取り込まれコハク酸が合成される.コハク酸はミトコンドリアに輸送されクエン酸回路に取り込まれてオキサロ酢酸が合成される.そして,オキサロ酢酸は細胞質に輸送され糖新生によりグルコースが合成される.グリオキシル酸回路は,植物の発芽1),病原性の酵母の感染2),菌類の性分化3) など,グルコースの不足しやすい状況において必須の役割を担うことが知られている.また,グリオキシル酸回路の活性は細胞におけるアセチルCoAの量に直接的に影響することが知られている.アセチルCoAはさまざまなバイオ燃料の重要な材料になるため4),代謝工学の観点からもグリオキシル酸回路の活性の制御機構は重要な課題である.
一般に,代謝経路においては代謝酵素の遺伝子の転写や翻訳など酵素の合成の段階における制御がよく知られている.また,代謝酵素の活性はリン酸化などの翻訳後修飾によっても制御される.さらに,上流あるいは下流の代謝産物によるフィードバック制御あるいはフィードフォワード制御についても古くから研究されてきた.近年,これらにくわえ,代謝経路は酵素の分解によっても制御されうることが明らかにされつつある.
ユビキチン-プロテアソーム系はタンパク質の代表的な分解系であり,さまざまな細胞機能の制御にかかわっている.ユビキチンは,ユビキチン活性化酵素,ユビキチン結合酵素,ユビキチンリガーゼとよばれる3種類の酵素の連続的な反応により,基質となるタンパク質に付加される.とくに,Lys48を介して形成されるポリユビキチン鎖はプロテアソームにより分解されるシグナルになることが知られている.これら3種類の酵素のなかで,基質を認識する役割を担うのがユビキチンリガーゼである.ユビキチンリガーゼはほかの2種類の酵素に比べ種類が豊富で,出芽酵母では約100種類,哺乳類では約700種類が知られている.さらに,ユビキチンリガーゼには単量体で機能するものと複合体を形成して機能するものがある.複合体型のユビキチンリガーゼとしてよく知られているのがSCF複合体である.SCF複合体は,Skp1,Cullin(出芽酵母では,Cdc53),Rbx1,Fボックスタンパク質から構成される.このなかで,Fボックスタンパク質には複数が存在し,出芽酵母では約20種類,哺乳類では約70種類,高等植物では約700種類あるといわれている.それぞれのFボックスタンパク質が特異的な基質を認識することにより,SCF複合体は多様な基質の制御にかかわると考えられている.SCF複合体の生理機能を解明するにはFボックスタンパク質により認識される特異的な基質の同定が不可欠だが,基質の判明しているFボックスタンパク質はごくわずかである5,6).また,SCF複合体だけでなく,ほかのユビキチンリガーゼについても特異的な基質の同定はきわめて重要な課題になっている.
機能が未知であった出芽酵母のFボックスタンパク質Ylr224w(のちに,Ucc1と命名)の解析を目的にしてUcc1と結合するタンパク質を網羅的に検索した結果,クエン酸合成酵素Cit2が同定された.クエン酸合成酵素はアセチルCoAとオキサロ酢酸からクエン酸を合成する酵素で,出芽酵母にはCit1,Cit2,Cit3の3種類が存在する.Cit1とCit3はクエン酸回路において,Cit2はグリオキシル酸回路において機能することが知られている.ほかのクエン酸回路の酵素と同様にCit1およびCit3はミトコンドリアに局在する.一方,グリオキシル酸回路の酵素はペルオキシソームと細胞質の両方あるいはどちらかに局在することが知られている.出芽酵母のCit2はペルオキシソームに局在することが報告されていたが,膜画分の分画実験から得られた結果であったため,細胞質にも局在するかどうかは不明であった.そこで,全細胞抽出液を用いた分画実験および蛍光顕微鏡による観察を行ったところ,Cit2はペルオキシソームと細胞質の両方に局在することが明らかにされた.また,Ucc1は細胞質に局在することも明らかにされたことから,Cit2とUcc1は細胞質において相互作用すると考えられた.この結果は,ユビキチン-プロテアソーム系がおもに細胞質において機能することと一致した.
Cit2がUcc1により制御され分解される基質である可能性について検討した.シクロヘキシミドチェイス実験の結果,Cit2はユビキチンリガーゼ複合体SCFUcc1およびプロテアソームに依存して分解された.また,UCC1遺伝子を欠損した出芽酵母ではCit2の分解が抑制されたことによりクエン酸が蓄積した.すなわち,Cit2の量はUcc1を介した分解によって制御されていることが明らかにされた.さらに,以下に示すとおり,Cit2がUcc1の基質であることを支持する遺伝学的な証拠も得られた.
第1に,プロピオン酸培地における増殖試験を行った.出芽酵母はプロピオン酸を唯一の炭素源として含む培地においても増殖できる7).出芽酵母に取り込まれたプロピオン酸は,ミトコンドリアにおいてプロピオニルCoAに変換され,さらに,2-メチルクエン酸,アセチルCoAなどをへてクエン酸に変換されたのち,クエン酸回路に取り込まれる.プロピオン酸は同時にペルオキシソームへと輸送され,ペルオキシソームのCit2によりプロピオニルCoAから2-メチルクエン酸へと変換される.理由は明らかではないが,ペルオキシソームに蓄積した2-メチルクエン酸は細胞の増殖に悪影響をおよぼすと考えられている.実際に,過去の報告のとおり,cit2欠損株はプロピオン酸培地において野生株よりもよく増殖することが確認された.一方,ucc1欠損株はプロピオン酸培地において野生株よりさらに増殖が悪くなった.これは,Ucc1の欠損によりCit2が蓄積した結果,ペルオキシソームにおいて2-メチルクエン酸の濃度が増大したからと考えられた.
第2に,ブタノールを含む培地で増殖試験を行った.代謝工学および合成生物学の分野では,出芽酵母にブタノールを大量に合成させる試みが進んでいる.出芽酵母にブタノールを高い効率で合成させるには,培地に放出されたブタノールに対して耐性であることがひとつの要件ではないかと考えられている.過去の研究において,過剰発現により出芽酵母がブタノールに対し耐性になる遺伝子のスクリーニングが行われ,そのうちのひとつとしてUCC1遺伝子(Ylr224w遺伝子)が同定されていた8).実際に,Ucc1を過剰に発現させると出芽酵母は1%ブタノールに対し耐性を示した.さらに,Cit2を欠損させた出芽酵母も1%ブタノールに耐性になった.Ucc1を過剰発現させた細胞とCit2を欠損した細胞との表現型の一致は,Cit2がUcc1により制御され分解される基質であることを支持した.現在のところ,Ucc1の過剰発現,あるいは,Cit2の欠損により出芽酵母がブタノールに耐性になるしくみは明らかではないが,グリオキシル酸回路の改変がブタノールの生産効率の上昇につながる可能性を示唆する結果といえた.
CIT2遺伝子およびUCC1遺伝子の転写を解析した結果,酢酸を炭素源とするとCIT2遺伝子の転写が上昇しUCC1遺伝子の転写が低下してCit2タンパク質の量が増加したその一方で,グルコースを炭素源とするとCIT2遺伝子の転写が低下しUCC1遺伝子の転写が上昇してCit2タンパク質の量が減少した.つまり,Ucc1とCit2は炭素源に応じて転写のレベルで量的に制御されると考えられた.
Ucc1によるCit2の認識の機構をさらに詳細に解析するため,Cit2の試験管内ユビキチン化アッセイ系を構築した.具体的には,精製したユビキチン活性化酵素Uba1,ユビキチン活性化酵素Cdc34,ユビキチンリガーゼ複合体SCFUcc1,ユビキチン,さらに,Mg2+,ATPを添加し試験管内において反応させた.その結果,Cit2のポリユビキチン化が観察された.
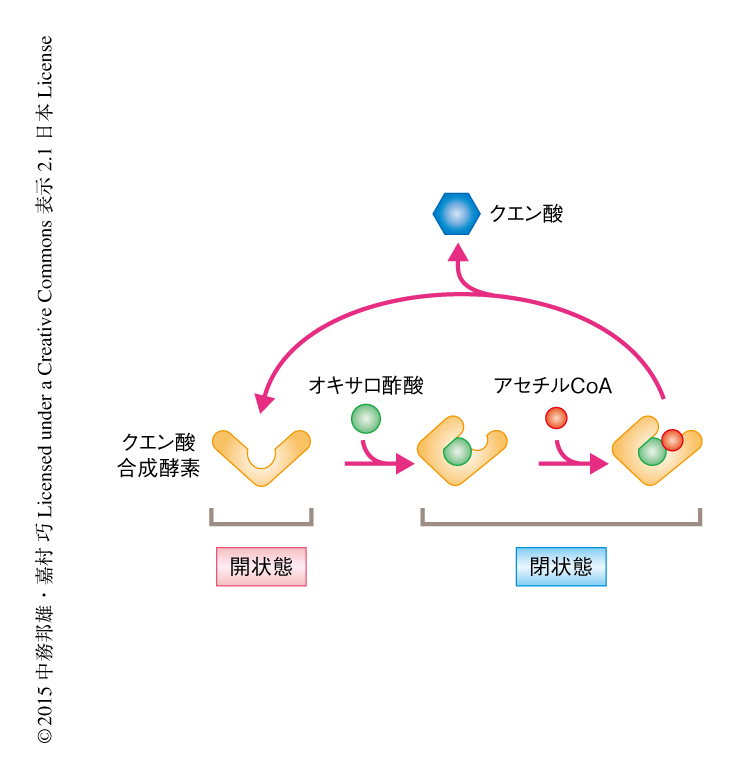
クエン酸合成酵素はオキサロ酢酸とアセチルCoAからクエン酸を合成する酵素であり,その反応機構は古くから詳細に調べられている.クエン酸合成酵素はオキサロ酢酸と結合すると開状態から閉状態へと構造変化する.さらに,オキサロ酢酸が結合すると新たにアセチルCoAが結合するためのポケットが形成され,そこに結合したアセチルCoAとオキサロ酢酸から縮合反応によりクエン酸が合成される(図1).オキサロ酢酸がクエン酸合成酵素の構造変化をひき起こすことに着目し,試験管内ユビキチン化アッセイ系によりオキサロ酢酸がCit2のユビキチン化にあたえる影響について調べた.その結果,驚いたことに,開状態のCit2はUcc1により強く認識されユビキチン化されやすいことがわかった.逆に,オキサロ酢酸と結合した閉状態のCit2はUcc1により認識されにくくなりユビキチン化されなくなった.すなわち,オキサロ酢酸がCit2の構造変化をひき起こしユビキチン化を阻害することが明らかにされた.
ただし,オキサロ酢酸はin vitroにおいて容易に脱炭酸してピルビン酸に変換されてしまうため,ほかの代謝中間体に比べ絶対定量は技術的にむずかしいことが知られている9,10)。しかし,過去の研究から,出芽酵母を酢酸や脂肪酸を炭素源として培養するとグリオキシル酸回路やクエン酸回路が活性化して代謝中間体の量が増加することが知られていた11).試験管内ユビキチン化アッセイ系で得られた結果とあわせると,量の増加したオキサロ酢酸がCit2の分解を阻害しグリオキシル回路はさらに安定的に回りつづけるという正のフィードバックループ(すなわち,質的な制御)の存在が考えられた.実際に,酢酸を炭素源として培養した出芽酵母においては,ユビキチン-プロテアソーム系そのものは機能しているにもかかわらずCit2は安定でまったく分解されていなかった.
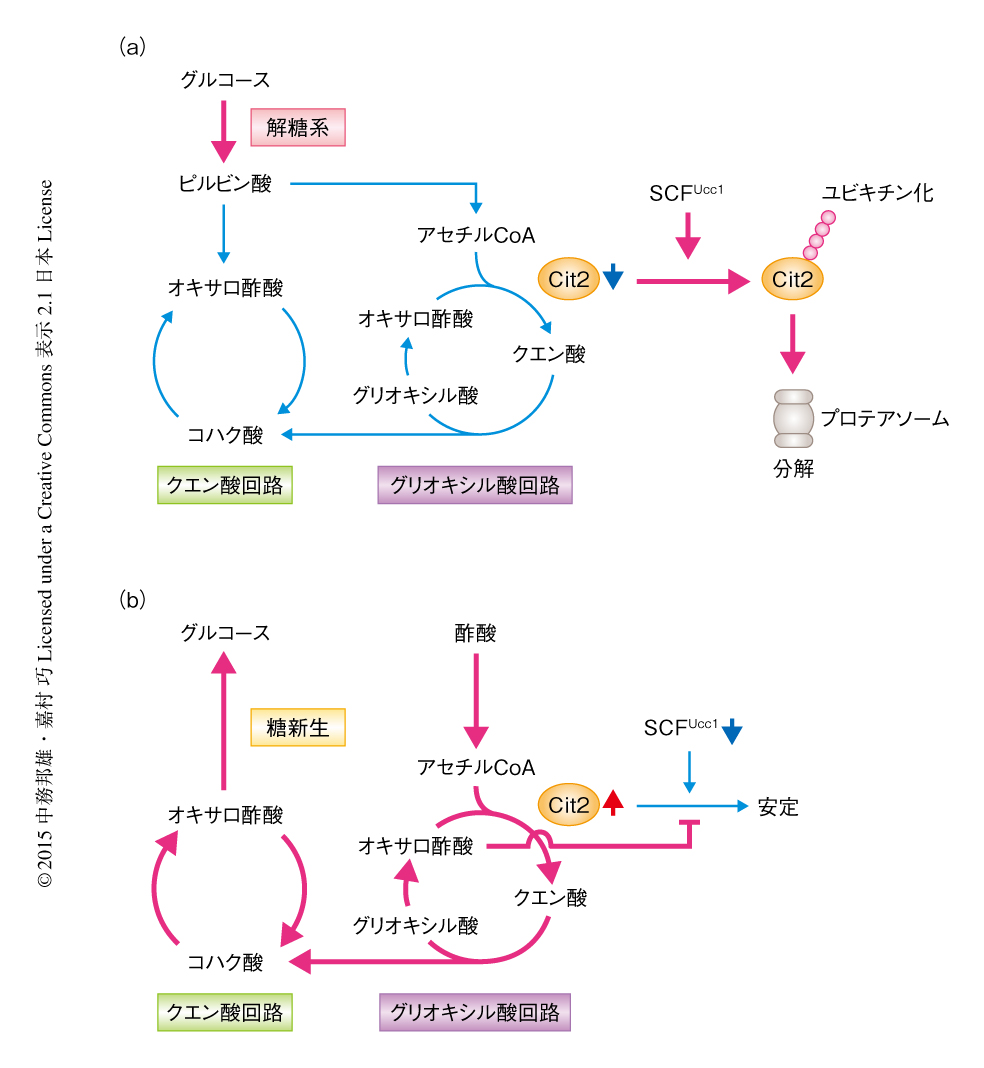
以上の結果をもとに,ユビキチンリガーゼSCFUcc1の役割についてまとめた(図2).グルコースを炭素源とした場合,Cit2はSCFUcc1によりユビキチン化されプロテアソームにおいて分解されるので,結果としてグリオキシル酸回路の活性は低いレベルに抑制される.酢酸を炭素源とした場合,Cit2の発現が上昇しUcc1の発現は低下し,また,オキサロ酢酸を含む代謝中間体の量が増加する.オキサロ酢酸と結合したCit2はUcc1により認識されにくくなるため,ユビキチン化されなくなり安定化する(正のフィードバック制御).その結果,グリオキシル酸回路はますます活性化され,最終的にグルコースが合成される.このような分解によるグリオキシル酸回路のスイッチ機構は,ほかの微生物あるいは植物にどのくらい保存されているのか検討する必要があるだろう.
この研究は,代謝経路の基本的な制御機構を明らかにしただけでなく,代謝工学あるいは感染症の予防の分野にも波及する効果のあるものと考えられる.さらに,高等植物には約700種類のFボックスタンパク質がコードされており,グリオキシル酸回路だけでなく,植物に特有のさまざまな代謝経路がSCF複合体による酵素の分解により制御されている可能性が十分に考えられる.逆に,代謝経路を酵素の分解により自由自在に制御することができれば,微生物や植物による有用物質の生産,ストレスに強い植物の育種など,さまざまな工学的な応用につながると期待される.
略歴:2004年 名古屋大学大学院理学研究科博士後期課程 修了,同年 米国Pittsburgh大学 博士研究員を経て,2009年より名古屋大学大学院理学研究科 助教.
嘉村 巧(Takumi Kamura)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi4.bio.nagoya-u.ac.jp/~2kamura/index.html
© 2015 中務邦雄・嘉村 巧 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻分子修飾制御学グループ)
email:中務邦雄
DOI: 10.7875/first.author.2015.062
The ubiquitin ligase SCFUcc1 acts as a metabolic switch for the glyoxylate cycle.
Kunio Nakatsukasa, Takashi Nishimura, Stuart D. Byrne, Michiyo Okamoto, Azusa Takahashi-Nakaguchi, Hiroji Chibana, Fumihiko Okumura, Takumi Kamura
Molecular Cell, 59, 22-34 (2015)
要 約
微生物や植物に特有の代謝経路であるグリオキシル酸回路は,微生物によるバイオ燃料の生産のプラットフォームとして注目されているだけでなく,病原性の酵母の感染や植物の種子の発芽に必須の役割をはたすことが知られている.これらの生物はグルコースが不足すると酢酸や脂肪酸を材料にグリオキシル酸回路→クエン酸回路→糖新生という一連の代謝反応によりグルコースを合成する.これまで,グリオキシル酸回路の活性は,グルコースが豊富にあると低いレベルに抑制されること,グルコースが不足して酢酸や脂肪酸が炭素源として細胞に取り込まれると高いレベルに活性化されることが知られていたが,そのスイッチのくわしい分子機構は明らかにされていなかった.筆者らは,グリオキシル酸回路において最初の反応を触媒するクエン酸合成酵素Cit2に着目した.グルコースが豊富にあるとFボックスタンパク質としてUcc1を含むユビキチンリガーゼ複合体であるSCFUcc1がCit2をユビキチン化しその分解を促進してグリオキシル酸回路の活性を抑制した.また,グルコースが不足して酢酸や脂肪酸からグルコースを合成する必要が生じるとSCFUcc1はCit2をユビキチン化できなくなり安定化したCit2がグリオキシル酸回路を活性化した.この研究は,代謝経路の活性が代謝酵素の分解により制御されるというユニークなスイッチの分子機構について明らかにした.今後,バイオ燃料などの有用物質の生産をめざす代謝工学および感染症の克服をめざす医学などの分野において,Ucc1は重要なツールおよび標的になると期待される.
はじめに
細胞に取り込まれたグルコースは化学反応に必要なエネルギーのもとになるだけでなく,糖鎖や核酸など生体高分子の材料にもなる.多くの生物はグルコースが不足するとグリコーゲンの分解や糖新生によりグルコースを合成することが知られている.植物と微生物の一部には糖新生の材料を供給するための特有のしくみとしてグリオキシル酸回路が備わっている.グリオキシル酸回路は酢酸や脂肪酸から合成されたアセチルCoAからグルコースを合成する一連の代謝反応の初期の段階を担う.具体的には,酢酸や脂肪酸から合成されたアセチルCoAがグリオキシル酸回路に取り込まれコハク酸が合成される.コハク酸はミトコンドリアに輸送されクエン酸回路に取り込まれてオキサロ酢酸が合成される.そして,オキサロ酢酸は細胞質に輸送され糖新生によりグルコースが合成される.グリオキシル酸回路は,植物の発芽1),病原性の酵母の感染2),菌類の性分化3) など,グルコースの不足しやすい状況において必須の役割を担うことが知られている.また,グリオキシル酸回路の活性は細胞におけるアセチルCoAの量に直接的に影響することが知られている.アセチルCoAはさまざまなバイオ燃料の重要な材料になるため4),代謝工学の観点からもグリオキシル酸回路の活性の制御機構は重要な課題である.
一般に,代謝経路においては代謝酵素の遺伝子の転写や翻訳など酵素の合成の段階における制御がよく知られている.また,代謝酵素の活性はリン酸化などの翻訳後修飾によっても制御される.さらに,上流あるいは下流の代謝産物によるフィードバック制御あるいはフィードフォワード制御についても古くから研究されてきた.近年,これらにくわえ,代謝経路は酵素の分解によっても制御されうることが明らかにされつつある.
ユビキチン-プロテアソーム系はタンパク質の代表的な分解系であり,さまざまな細胞機能の制御にかかわっている.ユビキチンは,ユビキチン活性化酵素,ユビキチン結合酵素,ユビキチンリガーゼとよばれる3種類の酵素の連続的な反応により,基質となるタンパク質に付加される.とくに,Lys48を介して形成されるポリユビキチン鎖はプロテアソームにより分解されるシグナルになることが知られている.これら3種類の酵素のなかで,基質を認識する役割を担うのがユビキチンリガーゼである.ユビキチンリガーゼはほかの2種類の酵素に比べ種類が豊富で,出芽酵母では約100種類,哺乳類では約700種類が知られている.さらに,ユビキチンリガーゼには単量体で機能するものと複合体を形成して機能するものがある.複合体型のユビキチンリガーゼとしてよく知られているのがSCF複合体である.SCF複合体は,Skp1,Cullin(出芽酵母では,Cdc53),Rbx1,Fボックスタンパク質から構成される.このなかで,Fボックスタンパク質には複数が存在し,出芽酵母では約20種類,哺乳類では約70種類,高等植物では約700種類あるといわれている.それぞれのFボックスタンパク質が特異的な基質を認識することにより,SCF複合体は多様な基質の制御にかかわると考えられている.SCF複合体の生理機能を解明するにはFボックスタンパク質により認識される特異的な基質の同定が不可欠だが,基質の判明しているFボックスタンパク質はごくわずかである5,6).また,SCF複合体だけでなく,ほかのユビキチンリガーゼについても特異的な基質の同定はきわめて重要な課題になっている.
1.Fボックスタンパク質Ucc1はグリオキシル酸回路のクエン酸合成酵素Cit2と結合する
機能が未知であった出芽酵母のFボックスタンパク質Ylr224w(のちに,Ucc1と命名)の解析を目的にしてUcc1と結合するタンパク質を網羅的に検索した結果,クエン酸合成酵素Cit2が同定された.クエン酸合成酵素はアセチルCoAとオキサロ酢酸からクエン酸を合成する酵素で,出芽酵母にはCit1,Cit2,Cit3の3種類が存在する.Cit1とCit3はクエン酸回路において,Cit2はグリオキシル酸回路において機能することが知られている.ほかのクエン酸回路の酵素と同様にCit1およびCit3はミトコンドリアに局在する.一方,グリオキシル酸回路の酵素はペルオキシソームと細胞質の両方あるいはどちらかに局在することが知られている.出芽酵母のCit2はペルオキシソームに局在することが報告されていたが,膜画分の分画実験から得られた結果であったため,細胞質にも局在するかどうかは不明であった.そこで,全細胞抽出液を用いた分画実験および蛍光顕微鏡による観察を行ったところ,Cit2はペルオキシソームと細胞質の両方に局在することが明らかにされた.また,Ucc1は細胞質に局在することも明らかにされたことから,Cit2とUcc1は細胞質において相互作用すると考えられた.この結果は,ユビキチン-プロテアソーム系がおもに細胞質において機能することと一致した.
2.Cit2はユビキチンリガーゼ複合体SCFUcc1およびプロテアソームに依存して分解される
Cit2がUcc1により制御され分解される基質である可能性について検討した.シクロヘキシミドチェイス実験の結果,Cit2はユビキチンリガーゼ複合体SCFUcc1およびプロテアソームに依存して分解された.また,UCC1遺伝子を欠損した出芽酵母ではCit2の分解が抑制されたことによりクエン酸が蓄積した.すなわち,Cit2の量はUcc1を介した分解によって制御されていることが明らかにされた.さらに,以下に示すとおり,Cit2がUcc1の基質であることを支持する遺伝学的な証拠も得られた.
第1に,プロピオン酸培地における増殖試験を行った.出芽酵母はプロピオン酸を唯一の炭素源として含む培地においても増殖できる7).出芽酵母に取り込まれたプロピオン酸は,ミトコンドリアにおいてプロピオニルCoAに変換され,さらに,2-メチルクエン酸,アセチルCoAなどをへてクエン酸に変換されたのち,クエン酸回路に取り込まれる.プロピオン酸は同時にペルオキシソームへと輸送され,ペルオキシソームのCit2によりプロピオニルCoAから2-メチルクエン酸へと変換される.理由は明らかではないが,ペルオキシソームに蓄積した2-メチルクエン酸は細胞の増殖に悪影響をおよぼすと考えられている.実際に,過去の報告のとおり,cit2欠損株はプロピオン酸培地において野生株よりもよく増殖することが確認された.一方,ucc1欠損株はプロピオン酸培地において野生株よりさらに増殖が悪くなった.これは,Ucc1の欠損によりCit2が蓄積した結果,ペルオキシソームにおいて2-メチルクエン酸の濃度が増大したからと考えられた.
第2に,ブタノールを含む培地で増殖試験を行った.代謝工学および合成生物学の分野では,出芽酵母にブタノールを大量に合成させる試みが進んでいる.出芽酵母にブタノールを高い効率で合成させるには,培地に放出されたブタノールに対して耐性であることがひとつの要件ではないかと考えられている.過去の研究において,過剰発現により出芽酵母がブタノールに対し耐性になる遺伝子のスクリーニングが行われ,そのうちのひとつとしてUCC1遺伝子(Ylr224w遺伝子)が同定されていた8).実際に,Ucc1を過剰に発現させると出芽酵母は1%ブタノールに対し耐性を示した.さらに,Cit2を欠損させた出芽酵母も1%ブタノールに耐性になった.Ucc1を過剰発現させた細胞とCit2を欠損した細胞との表現型の一致は,Cit2がUcc1により制御され分解される基質であることを支持した.現在のところ,Ucc1の過剰発現,あるいは,Cit2の欠損により出芽酵母がブタノールに耐性になるしくみは明らかではないが,グリオキシル酸回路の改変がブタノールの生産効率の上昇につながる可能性を示唆する結果といえた.
3.Ucc1およびCit2の発現の制御
CIT2遺伝子およびUCC1遺伝子の転写を解析した結果,酢酸を炭素源とするとCIT2遺伝子の転写が上昇しUCC1遺伝子の転写が低下してCit2タンパク質の量が増加したその一方で,グルコースを炭素源とするとCIT2遺伝子の転写が低下しUCC1遺伝子の転写が上昇してCit2タンパク質の量が減少した.つまり,Ucc1とCit2は炭素源に応じて転写のレベルで量的に制御されると考えられた.
4.Ucc1によるCit2の認識の制御機構
Ucc1によるCit2の認識の機構をさらに詳細に解析するため,Cit2の試験管内ユビキチン化アッセイ系を構築した.具体的には,精製したユビキチン活性化酵素Uba1,ユビキチン活性化酵素Cdc34,ユビキチンリガーゼ複合体SCFUcc1,ユビキチン,さらに,Mg2+,ATPを添加し試験管内において反応させた.その結果,Cit2のポリユビキチン化が観察された.
クエン酸合成酵素はオキサロ酢酸とアセチルCoAからクエン酸を合成する酵素であり,その反応機構は古くから詳細に調べられている.クエン酸合成酵素はオキサロ酢酸と結合すると開状態から閉状態へと構造変化する.さらに,オキサロ酢酸が結合すると新たにアセチルCoAが結合するためのポケットが形成され,そこに結合したアセチルCoAとオキサロ酢酸から縮合反応によりクエン酸が合成される(図1).オキサロ酢酸がクエン酸合成酵素の構造変化をひき起こすことに着目し,試験管内ユビキチン化アッセイ系によりオキサロ酢酸がCit2のユビキチン化にあたえる影響について調べた.その結果,驚いたことに,開状態のCit2はUcc1により強く認識されユビキチン化されやすいことがわかった.逆に,オキサロ酢酸と結合した閉状態のCit2はUcc1により認識されにくくなりユビキチン化されなくなった.すなわち,オキサロ酢酸がCit2の構造変化をひき起こしユビキチン化を阻害することが明らかにされた.
ただし,オキサロ酢酸はin vitroにおいて容易に脱炭酸してピルビン酸に変換されてしまうため,ほかの代謝中間体に比べ絶対定量は技術的にむずかしいことが知られている9,10)。しかし,過去の研究から,出芽酵母を酢酸や脂肪酸を炭素源として培養するとグリオキシル酸回路やクエン酸回路が活性化して代謝中間体の量が増加することが知られていた11).試験管内ユビキチン化アッセイ系で得られた結果とあわせると,量の増加したオキサロ酢酸がCit2の分解を阻害しグリオキシル回路はさらに安定的に回りつづけるという正のフィードバックループ(すなわち,質的な制御)の存在が考えられた.実際に,酢酸を炭素源として培養した出芽酵母においては,ユビキチン-プロテアソーム系そのものは機能しているにもかかわらずCit2は安定でまったく分解されていなかった.
5.ユビキチンリガーゼ複合体SCFUcc1はグリオキシル酸回路の代謝スイッチとして機能する
以上の結果をもとに,ユビキチンリガーゼSCFUcc1の役割についてまとめた(図2).グルコースを炭素源とした場合,Cit2はSCFUcc1によりユビキチン化されプロテアソームにおいて分解されるので,結果としてグリオキシル酸回路の活性は低いレベルに抑制される.酢酸を炭素源とした場合,Cit2の発現が上昇しUcc1の発現は低下し,また,オキサロ酢酸を含む代謝中間体の量が増加する.オキサロ酢酸と結合したCit2はUcc1により認識されにくくなるため,ユビキチン化されなくなり安定化する(正のフィードバック制御).その結果,グリオキシル酸回路はますます活性化され,最終的にグルコースが合成される.このような分解によるグリオキシル酸回路のスイッチ機構は,ほかの微生物あるいは植物にどのくらい保存されているのか検討する必要があるだろう.
おわりに
この研究は,代謝経路の基本的な制御機構を明らかにしただけでなく,代謝工学あるいは感染症の予防の分野にも波及する効果のあるものと考えられる.さらに,高等植物には約700種類のFボックスタンパク質がコードされており,グリオキシル酸回路だけでなく,植物に特有のさまざまな代謝経路がSCF複合体による酵素の分解により制御されている可能性が十分に考えられる.逆に,代謝経路を酵素の分解により自由自在に制御することができれば,微生物や植物による有用物質の生産,ストレスに強い植物の育種など,さまざまな工学的な応用につながると期待される.
文 献
- Lorenz, M. C. & Fink, G. R.: The glyoxylate cycle is required for fungal virulence. Nature, 412, 83-86 (2001)[PubMed]
- Graham, I. A.: Seed storage oil mobilization. Annu. Plant Biol., 59, 115-142 (2008)[PubMed]
- Peraza-Reyes, L. & Berteaux-Lecellier, V.: Peroxisomes and sexual development in fungi. Front. Physiol., 4, 244 (2013)[PubMed]
- Nielsen, J., Larson, C., van Maris, A. et al.: Metabolic engineering of yeast for production of fuels and chemicals. Curr. Opin. Biotechnol., 24, 398-404 (2013)[PubMed]
- Deshaies, R. J. & Joazeiro, C. A.: RING domain E3 ubiquitin ligases. Annu Rev. Biochem., 78, 399-434 (2009)[PubMed]
- Skaar, J. R., Pagan, J. K. & Pagano, M.: Mechanisms and function of substrate recruitment by F-box proteins. Nat. Rev. Mol. Cell Biol., 14, 369-381 (2013)[PubMed]
- Graybill, E. R., Rouhier, M. F., Kirby, C. E. et al.: Functional comparison of citrate synthase isoforms from S. cerevisiae. Arch. Biochem. Biophys., 465, 26-37 (2007)[PubMed]
- Gonzalez-Ramos, D., van den Broek, M., van Maris, A. J. et al.: Genome-scale analyses of butanol tolerance in Saccharomyces cerevisiae reveal an essential role of protein degradation. Biotechnol. Biofuels, 6, 48 (2013)[PubMed]
- 冨田 勝, 西岡孝明 (編): メタボローム研究の最前線. シュプリンガー・フェアラーク東京 (2003)
- Krebs, H. A.: The effect of inorganic salts on the ketone decomposition of oxaloacetic acid. Biochem. J., 36, 303-305 (1942)[PubMed]
- Daran-Lapujade, P., Jansen, M. L., Daran, J. M. et al.: Role of transcriptional regulation in controlling fluxes in central carbon metabolism of Saccharomyces cerevisiae. A chemostat culture study. J. Biol. Chem., 279, 9125-9138 (2004)[PubMed]
著者プロフィール
略歴:2004年 名古屋大学大学院理学研究科博士後期課程 修了,同年 米国Pittsburgh大学 博士研究員を経て,2009年より名古屋大学大学院理学研究科 助教.
嘉村 巧(Takumi Kamura)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi4.bio.nagoya-u.ac.jp/~2kamura/index.html
© 2015 中務邦雄・嘉村 巧 Licensed under CC 表示 2.1 日本