サイクリックジグアニル酸は細菌において細胞周期を制御しゲノムの複製を駆動する
尾崎 省吾
(スイスBasel大学Biozentrum,Focal area of Infection Biology)
email:尾崎省吾
DOI: 10.7875/first.author.2015.060
Cyclic di-GMP acts as a cell cycle oscillator to drive chromosome replication.
C. Lori, S. Ozaki, S. Steiner, R. Böhm, S. Abel, B. N. Dubey, T. Schirmer, S. Hiller, U. Jenal
Nature, 523, 236-239 (2015)
サイクリックヌクレオチドは普遍的なシグナル伝達分子である.ほとんどの細菌は環境においてどのようにふるまうかを決定するためサイクリックジグアニル酸を利用する.しかし,その細胞増殖における役割は不明であった.今回,筆者らは,サイクリックジグアニル酸が細胞の増殖に必須な役割をもつCckAと直接的に結合することを明らかにした.CckAはキナーゼ活性およびホスファターゼ活性をもつ2機能性の酵素である.サイクリックジグアニル酸との結合はCckAのキナーゼ活性を阻害しホスファターゼ活性を亢進した.G1期後期からS期初期にかけてサイクリックジグアニル酸の濃度の上昇にともない誘導されるCckAのホスファターゼ活性は,ゲノムの複製の引き金となり細胞周期の進行を駆動した.これらの結果から,サイクリックジグアニル酸は真核生物のサイクリンと同様のはたらきを担う,細菌における細胞周期の制御分子であることがはじめて明らかにされた.
細胞周期を適時的に進行させることは生物の真理である.真核生物の細胞周期はサイクリン依存性キナーゼにより支配されている1).サイクリン依存性キナーゼの活性はその制御サブユニットとサイクリンとの結合に依存する.サイクリンは細胞周期の進行に応じてその濃度がダイナミックに変化することにより,適時的にサイクリン依存性キナーゼを活性化し細胞周期を駆動する.しかし,これらに相当する分子機構は細菌においては未解明であった.
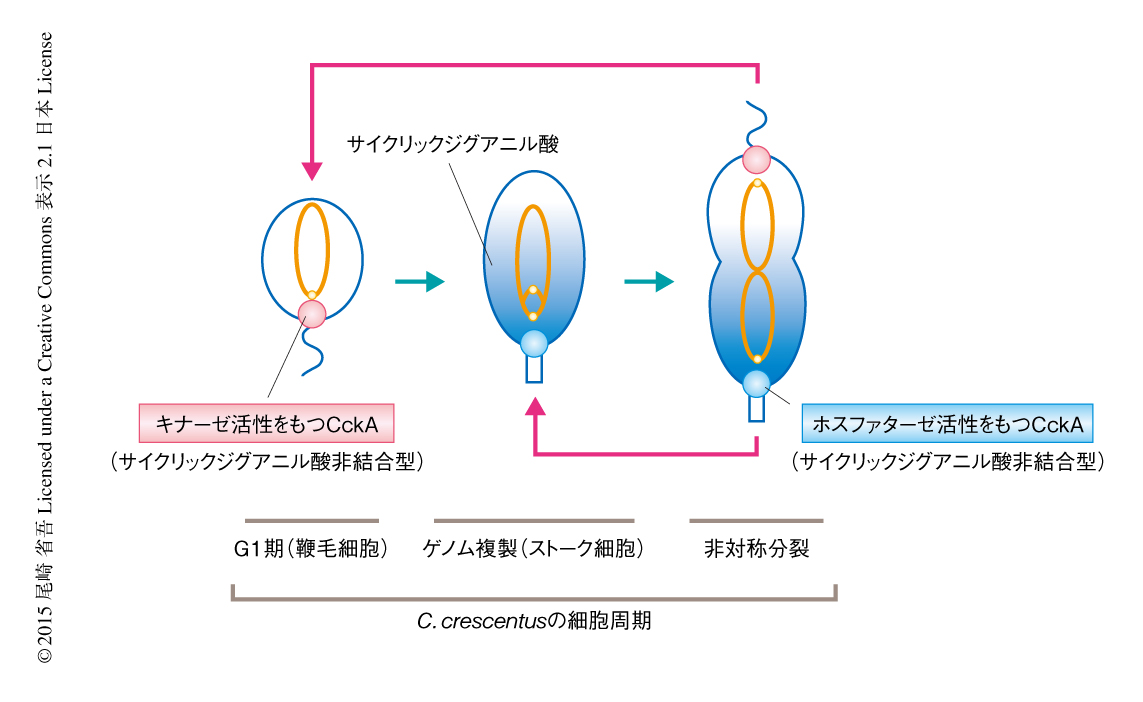
Caulobacter crescentusは細胞周期の研究に用いられるモデル細菌である.非対称的に細胞分裂し鞭毛細胞とストーク細胞という異なる2種類の娘細胞を生じる(図1).ストーク細胞はすみやかにゲノムの複製を開始し細胞分裂する.他方,鞭毛細胞はゲノムの複製を抑制し栄養の獲得のために鞭毛により運動する.鞭毛細胞がふたたび増殖のサイクルをはじめるためには,鞭毛装置を解体しストーク細胞へと分化する必要がある.この過程において,細胞におけるサイクリックジグアニル酸の濃度が一過的に上昇する2).サイクリックジグアニル酸は2分子のGTPから合成されるシグナル分子で,ほとんどの細菌において利用されている3,4).細胞の分化において決定的な役割を担っており,C. crescentusにおいてサイクリックジグアニル酸を産生できない変異株はオルガネラの形成能を完全に欠損する5).くわえて,この変異株はゲノムの複製に異常を生じるため,サイクリックジグアニル酸はゲノム複製の制御にも関与することが示唆されているがその分子機構は不明であった.また,一般にサイクリックジグアニル酸は受容体との結合を介して機能するが,C. crescentusにおいてその受容体は十分には理解されていない.この研究では,遺伝学的な手法によるサイクリックジグアニル酸制御系の解析および生化学的な手法による新規の受容体の性状解析をつうじ,サイクリックジグアニル酸がサイクリン様の分子として細胞周期の進行を駆動することを明らかにした.
C. crescentusのサイクリックジグアニル酸産生不能変異株はゲノムの複製に異常を起こすものの野生株と同じ程度の生育能を保持しているという観察にもとづき,サイクリックジグアニル酸はゲノムの複製をほかの独立制御系と協調し重複して制御すると考えた.この重複性を明らかにするため合成致死スクリーニングを行った.トランスポゾンを用いてランダムに遺伝子を破壊し,生じた変異のなかからサイクリックジグアニル酸産生不能変異株において特異的に生育阻害を示す変異を同定した.その結果,divK遺伝子のプロモーター領域にトランスポゾンの挿入された変異を見い出した.この変異を野生株に形質導入しても細胞生育能やゲノム複製能に顕著な変化は起こらなかったが,この変異をサイクリックジグアニル酸産生不能変異株に形質導入したところ,ゲノム複製の不全により細胞の増殖が阻害された.この変異によりDivKのタンパク質発現量は1/10に低下することがウェスタンブロット法よりわかった.これらの結果より,サイクリックジグアニル酸はDivKとともにゲノムの複製を重複して制御することが示唆された.
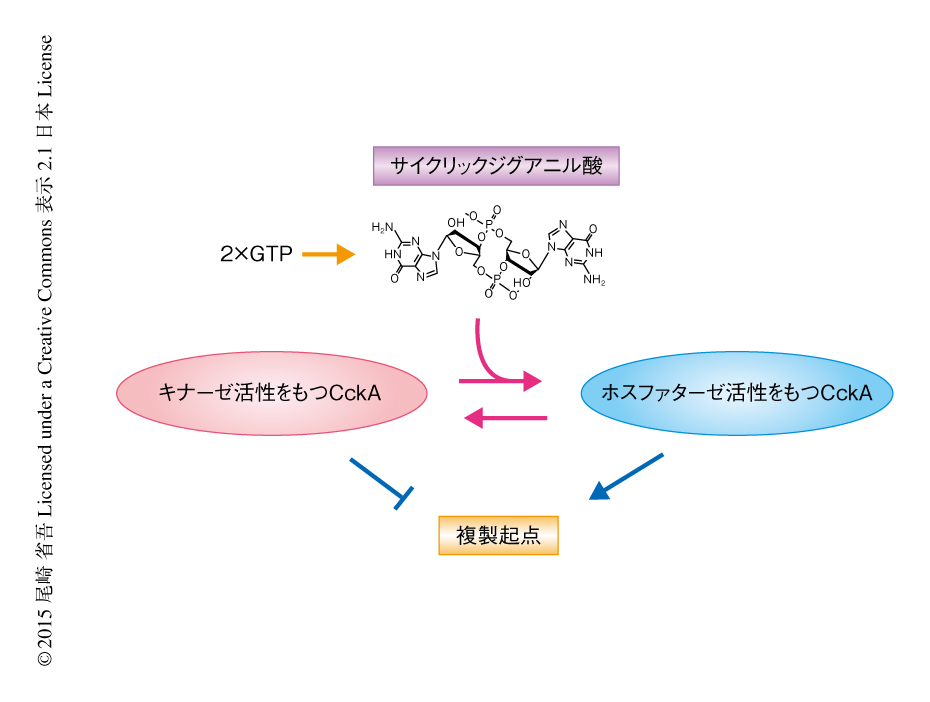
DivKはCckAのキナーゼ活性を間接的に阻害する6).CckAは細胞の生育に必須のタンパク質で,キナーゼ活性およびホスファターゼ活性をもつ2機能性の酵素である7)(図2).CckAはG1期にキナーゼ活性をもち自己リン酸化し,このリン酸基をCtrAに転移する.リン酸化したCtrAは活性化し複製起点に結合してゲノム複製の開始を阻害する.G1期後期になるとCckAはホスファターゼ活性をもつようになりCtrAを脱リン酸化し不活性化を促進する.これにより複製起点はライセンス化され細胞はゲノム複製を開始できるようになる.このように,CckAの活性モードの変換はゲノム複製の開始のオン/オフを担う鍵であるにもかかわらず,その分子機構は不明であった.
サイクリックジグアニル酸がCckAの活性モードの変換に関与することが強く支持されたことから,精製タンパク質を用いてCckAの酵素活性に対するサイクリックジグアニル酸の役割について解析した.まず,CckAによる自己リン酸化反応およびCtrAへのリン酸基転移反応を試験管内において再構成した.この再構成系にサイクリックジグアニル酸を添加したところ,CckAおよびCtrAのすみやかな脱リン酸化が促進された.同様のサイクリックジグアニル酸に依存的な脱リン酸化反応はCckAのみに観察されたため,サイクリックジグアニル酸がCckAのホスファターゼ活性を促進することがわかった(図2).変異タンパク質を用いた詳細な解析の結果,サイクリックジグアニル酸はCckAのキナーゼ活性も減弱させることが示された.
サイクリックジグアニル酸とCckAとの相互作用を解析した結果,CckAのATP加水分解ドメインにサイクリックジグアニル酸が特異的に結合することがわかった.さらに,変異体の解析により,ATP加水分解ドメインに存在するTyr514のAspへの置換によりサイクリックジグアニル酸との結合能は特異的に欠損することが見い出された.この変異タンパク質は野生型と同じレベルのキナーゼ活性を保持するにもかかわらず,サイクリックジグアニル酸により亢進されるホスファターゼ活性は欠損していた.サイクリックジグアニル酸に依存しない内在性のホスファターゼ活性は正常に保持していたので,サイクリックジグアニル酸との結合におけるTyr514の特異的な寄与が示唆された.
CckAとサイクリックジグアニル酸との結合様式をさらに詳細に理解するため,ATP加水分解ドメインをNMR法により解析したところ,サイクリックジグアニル酸の濃度の上昇に依存して有意にシグナルの変化する複数のアミノ酸残基が見い出された.ホモロジーモデルにおけるマッピングの結果,これらのアミノ酸残基はTyr514の近傍に位置していた.アラニンスキャニング法により,同様にサイクリックジグアニル酸との結合能を欠損する複数の変異タンパク質が単離され,その変異の位置はNMR法による解析の結果とよく一致した.これらの結果より,Tyr514ならびにその近傍のアミノ酸残基がサイクリックジグアニル酸との結合において重要なはたらきをもつと結論づけられた.これらのアミノ酸残基はほかの種の細菌のCckAホモログのあいだで高度に保存されていた.このことは,サイクリックジグアニル酸によるCckAの活性モードの変換が細菌のあいだで保存された共通の分子機構であることを示唆した.
細胞におけるサイクリックジグアニル酸とCckAとの相互作用の役割を明らかにするため,CckAのTyr514のAspへの置換とdivK遺伝子のプロモーター領域へのトランスポゾンの挿入との二重変異株を構築した.すると,この二重変異株はサイクリックジグアニル酸産生不能変異とdivK遺伝子のプロモーター領域へのトランスポゾンの挿入との二重変異株と同様の合成致死性を示した.また,この合成致死性はサイクリックジグアニル酸には依存しなかった.さらに,合成致死条件のもとCtrAの活性の亢進およびゲノム複製の開始の阻害が観察された.これらの結果は,サイクリックジグアニル酸の主たる機能がCckAとの相互作用を介することを強く支持した.さらに,細胞においてリン酸化されたCckAを定量的に解析し,野生株とCckAのTyr514の変異株とで比較した.その結果,変異株においてリン酸化されたCckAのしめる割合が顕著に上昇していた.この結果は,CckAのTyr514変異によりサイクリックジグアニル酸により亢進されるホスファターゼ活性は欠損するという試験管内における観察とよく一致した.これらの結果を総合し,細胞においてサイクリックジグアニル酸との結合がCckAのホスファターゼ活性を亢進し,ゲノムの複製を駆動すると結論づけた.細胞におけるサイクリックジグアニル酸の濃度はG1期後期に一過的に上昇することから5),このサイクリックジグアニル酸の周期的な変動がCckAの適時的な活性モードの変換を可能にすると考えられた.CckAの活性モードの変換は,サイクリックジグアニル酸だけでなくDivKによる重複した制御をうけていたが,この重複性は細胞の増殖においてこの制御がきわめて重要であることを反映するものと考えられた.
CckAは細胞分裂のまえに両方の細胞極に局在しうる.この2カ所に局在したCckAがそれぞれ異なる活性モードをとり,細胞分裂ののちの娘細胞の運命を決定し非対称複製が起こるというモデルが提唱されている8).このモデルでは,細胞分裂ののち,ホスファターゼ活性をもつCckAの局在する娘細胞(ストーク細胞)はすみやかにゲノムが複製するのに対し,キナーゼ活性をもつCckAの局在する娘細胞(鞭毛細胞)はゲノムの複製を抑制しG1期にとどまる(図1).しかしながら,この非対称複製の基礎になる分子機構は不明であった.
C. crescentusにおいて主要なサイクリックジグアニル酸合成酵素はストーク細胞となる細胞極に局在するのに対し,主要なサイクリックジグアニル酸分解酵素は鞭毛細胞となる細胞極に局在する.これらの酵素が細胞においてサイクリックジグアニル酸の濃度勾配を生じるならば,ストーク細胞となる細胞極にはホスファターゼ活性をもつサイクリックジグアニル酸と結合したCckAが存在し,鞭毛細胞となる細胞極にはキナーゼ活性をもつサイクリックジグアニル酸と結合していないCckAが存在すると考えた(図1).このアイディアは非対称複製の分子機構を矛盾なく説明しうる.そこで,非対称複製におけるサイクリックジグアニル酸の役割を検証した.生細胞において複製起点を蛍光により標識し9),タイムラプスイメージング解析によりゲノム複製のはじまる細胞極をモニターした.その結果,野生株においては観察した細胞の大部分がストーク細胞においてゲノム複製が開始しており,非対称複製が維持されていた.一方,CckAのTyr514変異株ではストーク細胞におけるゲノム複製と鞭毛細胞におけるゲノム複製とがほぼ等しい確率で起こっており,非対称複製は損なわれていた.さらに,非対称複製の維持には内在性のサイクリックジグアニル酸合成酵素が重要であることがわかった.これらの結果は,サイクリックジグアニル酸により非対称複製が制御される分子機構を強く裏づけた.
今回,筆者らは,サイクリックジグアニル酸がサイクリン様の分子としてCckAを制御することを明らかにした.サイクリックジグアニル酸は鞭毛の運動やバイオフィルムの形成など細菌のふるまいを決定するだけでなく,抗生物質耐性や持続感染性など感染症における今日の主要な問題とも密接に関連する10).他方,CckAはすべての細菌に保存されるヒスチジンキナーゼファミリーに属する.ヒスチジンキナーゼファミリーは2成分シグナル伝達系とよばれる分子機構においてセンサーを構成し環境の変化に適応して細菌が生存するために重要なはたらきを担っている11).今回の発見は,これら2つの主要なシグナル伝達系を直接に連結するはじめての報告である.今後は,CckAと同様の分子機構により制御されるヒスチジンキナーゼファミリータンパク質が多く発見されることが強く期待される.
略歴:2008年 九州大学大学院薬学研究院 修了,同年 同 助教を経て,2011年よりスイスBasel大学 博士研究員.
研究テーマ:サイクリックジグアニル酸が駆動する細胞プログラム.
関心事:単純な(と思われがちな)細菌の単純ならざるしくみ.
© 2015 尾崎 省吾 Licensed under CC 表示 2.1 日本
(スイスBasel大学Biozentrum,Focal area of Infection Biology)
email:尾崎省吾
DOI: 10.7875/first.author.2015.060
Cyclic di-GMP acts as a cell cycle oscillator to drive chromosome replication.
C. Lori, S. Ozaki, S. Steiner, R. Böhm, S. Abel, B. N. Dubey, T. Schirmer, S. Hiller, U. Jenal
Nature, 523, 236-239 (2015)
要 約
サイクリックヌクレオチドは普遍的なシグナル伝達分子である.ほとんどの細菌は環境においてどのようにふるまうかを決定するためサイクリックジグアニル酸を利用する.しかし,その細胞増殖における役割は不明であった.今回,筆者らは,サイクリックジグアニル酸が細胞の増殖に必須な役割をもつCckAと直接的に結合することを明らかにした.CckAはキナーゼ活性およびホスファターゼ活性をもつ2機能性の酵素である.サイクリックジグアニル酸との結合はCckAのキナーゼ活性を阻害しホスファターゼ活性を亢進した.G1期後期からS期初期にかけてサイクリックジグアニル酸の濃度の上昇にともない誘導されるCckAのホスファターゼ活性は,ゲノムの複製の引き金となり細胞周期の進行を駆動した.これらの結果から,サイクリックジグアニル酸は真核生物のサイクリンと同様のはたらきを担う,細菌における細胞周期の制御分子であることがはじめて明らかにされた.
はじめに
細胞周期を適時的に進行させることは生物の真理である.真核生物の細胞周期はサイクリン依存性キナーゼにより支配されている1).サイクリン依存性キナーゼの活性はその制御サブユニットとサイクリンとの結合に依存する.サイクリンは細胞周期の進行に応じてその濃度がダイナミックに変化することにより,適時的にサイクリン依存性キナーゼを活性化し細胞周期を駆動する.しかし,これらに相当する分子機構は細菌においては未解明であった.
Caulobacter crescentusは細胞周期の研究に用いられるモデル細菌である.非対称的に細胞分裂し鞭毛細胞とストーク細胞という異なる2種類の娘細胞を生じる(図1).ストーク細胞はすみやかにゲノムの複製を開始し細胞分裂する.他方,鞭毛細胞はゲノムの複製を抑制し栄養の獲得のために鞭毛により運動する.鞭毛細胞がふたたび増殖のサイクルをはじめるためには,鞭毛装置を解体しストーク細胞へと分化する必要がある.この過程において,細胞におけるサイクリックジグアニル酸の濃度が一過的に上昇する2).サイクリックジグアニル酸は2分子のGTPから合成されるシグナル分子で,ほとんどの細菌において利用されている3,4).細胞の分化において決定的な役割を担っており,C. crescentusにおいてサイクリックジグアニル酸を産生できない変異株はオルガネラの形成能を完全に欠損する5).くわえて,この変異株はゲノムの複製に異常を生じるため,サイクリックジグアニル酸はゲノム複製の制御にも関与することが示唆されているがその分子機構は不明であった.また,一般にサイクリックジグアニル酸は受容体との結合を介して機能するが,C. crescentusにおいてその受容体は十分には理解されていない.この研究では,遺伝学的な手法によるサイクリックジグアニル酸制御系の解析および生化学的な手法による新規の受容体の性状解析をつうじ,サイクリックジグアニル酸がサイクリン様の分子として細胞周期の進行を駆動することを明らかにした.
1.サイクリックジグアニル酸の産生不能変異と合成的に致死となる遺伝子の探索
C. crescentusのサイクリックジグアニル酸産生不能変異株はゲノムの複製に異常を起こすものの野生株と同じ程度の生育能を保持しているという観察にもとづき,サイクリックジグアニル酸はゲノムの複製をほかの独立制御系と協調し重複して制御すると考えた.この重複性を明らかにするため合成致死スクリーニングを行った.トランスポゾンを用いてランダムに遺伝子を破壊し,生じた変異のなかからサイクリックジグアニル酸産生不能変異株において特異的に生育阻害を示す変異を同定した.その結果,divK遺伝子のプロモーター領域にトランスポゾンの挿入された変異を見い出した.この変異を野生株に形質導入しても細胞生育能やゲノム複製能に顕著な変化は起こらなかったが,この変異をサイクリックジグアニル酸産生不能変異株に形質導入したところ,ゲノム複製の不全により細胞の増殖が阻害された.この変異によりDivKのタンパク質発現量は1/10に低下することがウェスタンブロット法よりわかった.これらの結果より,サイクリックジグアニル酸はDivKとともにゲノムの複製を重複して制御することが示唆された.
2.サイクリックジグアニル酸はCckAのキナーゼ活性を制御する
DivKはCckAのキナーゼ活性を間接的に阻害する6).CckAは細胞の生育に必須のタンパク質で,キナーゼ活性およびホスファターゼ活性をもつ2機能性の酵素である7)(図2).CckAはG1期にキナーゼ活性をもち自己リン酸化し,このリン酸基をCtrAに転移する.リン酸化したCtrAは活性化し複製起点に結合してゲノム複製の開始を阻害する.G1期後期になるとCckAはホスファターゼ活性をもつようになりCtrAを脱リン酸化し不活性化を促進する.これにより複製起点はライセンス化され細胞はゲノム複製を開始できるようになる.このように,CckAの活性モードの変換はゲノム複製の開始のオン/オフを担う鍵であるにもかかわらず,その分子機構は不明であった.
サイクリックジグアニル酸がCckAの活性モードの変換に関与することが強く支持されたことから,精製タンパク質を用いてCckAの酵素活性に対するサイクリックジグアニル酸の役割について解析した.まず,CckAによる自己リン酸化反応およびCtrAへのリン酸基転移反応を試験管内において再構成した.この再構成系にサイクリックジグアニル酸を添加したところ,CckAおよびCtrAのすみやかな脱リン酸化が促進された.同様のサイクリックジグアニル酸に依存的な脱リン酸化反応はCckAのみに観察されたため,サイクリックジグアニル酸がCckAのホスファターゼ活性を促進することがわかった(図2).変異タンパク質を用いた詳細な解析の結果,サイクリックジグアニル酸はCckAのキナーゼ活性も減弱させることが示された.
サイクリックジグアニル酸とCckAとの相互作用を解析した結果,CckAのATP加水分解ドメインにサイクリックジグアニル酸が特異的に結合することがわかった.さらに,変異体の解析により,ATP加水分解ドメインに存在するTyr514のAspへの置換によりサイクリックジグアニル酸との結合能は特異的に欠損することが見い出された.この変異タンパク質は野生型と同じレベルのキナーゼ活性を保持するにもかかわらず,サイクリックジグアニル酸により亢進されるホスファターゼ活性は欠損していた.サイクリックジグアニル酸に依存しない内在性のホスファターゼ活性は正常に保持していたので,サイクリックジグアニル酸との結合におけるTyr514の特異的な寄与が示唆された.
CckAとサイクリックジグアニル酸との結合様式をさらに詳細に理解するため,ATP加水分解ドメインをNMR法により解析したところ,サイクリックジグアニル酸の濃度の上昇に依存して有意にシグナルの変化する複数のアミノ酸残基が見い出された.ホモロジーモデルにおけるマッピングの結果,これらのアミノ酸残基はTyr514の近傍に位置していた.アラニンスキャニング法により,同様にサイクリックジグアニル酸との結合能を欠損する複数の変異タンパク質が単離され,その変異の位置はNMR法による解析の結果とよく一致した.これらの結果より,Tyr514ならびにその近傍のアミノ酸残基がサイクリックジグアニル酸との結合において重要なはたらきをもつと結論づけられた.これらのアミノ酸残基はほかの種の細菌のCckAホモログのあいだで高度に保存されていた.このことは,サイクリックジグアニル酸によるCckAの活性モードの変換が細菌のあいだで保存された共通の分子機構であることを示唆した.
3.サイクリックジグアニル酸と結合したCckAはゲノム複製の開始を制御する
細胞におけるサイクリックジグアニル酸とCckAとの相互作用の役割を明らかにするため,CckAのTyr514のAspへの置換とdivK遺伝子のプロモーター領域へのトランスポゾンの挿入との二重変異株を構築した.すると,この二重変異株はサイクリックジグアニル酸産生不能変異とdivK遺伝子のプロモーター領域へのトランスポゾンの挿入との二重変異株と同様の合成致死性を示した.また,この合成致死性はサイクリックジグアニル酸には依存しなかった.さらに,合成致死条件のもとCtrAの活性の亢進およびゲノム複製の開始の阻害が観察された.これらの結果は,サイクリックジグアニル酸の主たる機能がCckAとの相互作用を介することを強く支持した.さらに,細胞においてリン酸化されたCckAを定量的に解析し,野生株とCckAのTyr514の変異株とで比較した.その結果,変異株においてリン酸化されたCckAのしめる割合が顕著に上昇していた.この結果は,CckAのTyr514変異によりサイクリックジグアニル酸により亢進されるホスファターゼ活性は欠損するという試験管内における観察とよく一致した.これらの結果を総合し,細胞においてサイクリックジグアニル酸との結合がCckAのホスファターゼ活性を亢進し,ゲノムの複製を駆動すると結論づけた.細胞におけるサイクリックジグアニル酸の濃度はG1期後期に一過的に上昇することから5),このサイクリックジグアニル酸の周期的な変動がCckAの適時的な活性モードの変換を可能にすると考えられた.CckAの活性モードの変換は,サイクリックジグアニル酸だけでなくDivKによる重複した制御をうけていたが,この重複性は細胞の増殖においてこの制御がきわめて重要であることを反映するものと考えられた.
4.サイクリックジグアニル酸を介したCckAの活性モードの空間的な制御は娘細胞の運命を決定する
CckAは細胞分裂のまえに両方の細胞極に局在しうる.この2カ所に局在したCckAがそれぞれ異なる活性モードをとり,細胞分裂ののちの娘細胞の運命を決定し非対称複製が起こるというモデルが提唱されている8).このモデルでは,細胞分裂ののち,ホスファターゼ活性をもつCckAの局在する娘細胞(ストーク細胞)はすみやかにゲノムが複製するのに対し,キナーゼ活性をもつCckAの局在する娘細胞(鞭毛細胞)はゲノムの複製を抑制しG1期にとどまる(図1).しかしながら,この非対称複製の基礎になる分子機構は不明であった.
C. crescentusにおいて主要なサイクリックジグアニル酸合成酵素はストーク細胞となる細胞極に局在するのに対し,主要なサイクリックジグアニル酸分解酵素は鞭毛細胞となる細胞極に局在する.これらの酵素が細胞においてサイクリックジグアニル酸の濃度勾配を生じるならば,ストーク細胞となる細胞極にはホスファターゼ活性をもつサイクリックジグアニル酸と結合したCckAが存在し,鞭毛細胞となる細胞極にはキナーゼ活性をもつサイクリックジグアニル酸と結合していないCckAが存在すると考えた(図1).このアイディアは非対称複製の分子機構を矛盾なく説明しうる.そこで,非対称複製におけるサイクリックジグアニル酸の役割を検証した.生細胞において複製起点を蛍光により標識し9),タイムラプスイメージング解析によりゲノム複製のはじまる細胞極をモニターした.その結果,野生株においては観察した細胞の大部分がストーク細胞においてゲノム複製が開始しており,非対称複製が維持されていた.一方,CckAのTyr514変異株ではストーク細胞におけるゲノム複製と鞭毛細胞におけるゲノム複製とがほぼ等しい確率で起こっており,非対称複製は損なわれていた.さらに,非対称複製の維持には内在性のサイクリックジグアニル酸合成酵素が重要であることがわかった.これらの結果は,サイクリックジグアニル酸により非対称複製が制御される分子機構を強く裏づけた.
おわりに
今回,筆者らは,サイクリックジグアニル酸がサイクリン様の分子としてCckAを制御することを明らかにした.サイクリックジグアニル酸は鞭毛の運動やバイオフィルムの形成など細菌のふるまいを決定するだけでなく,抗生物質耐性や持続感染性など感染症における今日の主要な問題とも密接に関連する10).他方,CckAはすべての細菌に保存されるヒスチジンキナーゼファミリーに属する.ヒスチジンキナーゼファミリーは2成分シグナル伝達系とよばれる分子機構においてセンサーを構成し環境の変化に適応して細菌が生存するために重要なはたらきを担っている11).今回の発見は,これら2つの主要なシグナル伝達系を直接に連結するはじめての報告である.今後は,CckAと同様の分子機構により制御されるヒスチジンキナーゼファミリータンパク質が多く発見されることが強く期待される.
文 献
- Hochegger, H., Takeda, S. & Hunt, T.: Cyclin-dependent kinases and cell-cycle transitions: does one fit all? Nat. Rev. Mol. Cell Biol., 9, 910-916 (2008)[PubMed]
- Paul, R., Weiser, S., Amiot, N. C. et al.: Cell cycle-dependent dynamic localization of a bacterial response regulator with a novel di-guanylate cyclase output domain. Genes Dev., 18, 715-727 (2004)[PubMed]
- Schirmer, T. & Jenal, U.: Structural and mechanistic determinants of c-di-GMP signalling. Nat. Rev. Microbiol., 7, 724-735 (2009)[PubMed]
- Romling, U., Galperin, M. Y. & Gomelsky, M.: Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiol. Mol. Biol. Rev., 77, 1-52 (2013)[PubMed]
- Abel, S., Bucher, T., Nicollier, M. et al.: Bi-modal distribution of the second messenger c-di-GMP controls cell fate and asymmetry during the Caulobacter cell cycle. PLoS Genet., 9, e1003744 (2013)[PubMed]
- Tsokos, C. G., Perchuk, B. S. & Laub, M. T.: A dynamic complex of signaling proteins uses polar localization to regulate cell-fate asymmetry in Caulobacter crescentus. Dev. Cell, 20, 329-341 (2011)[PubMed]
- Biondi, E. G., Reisinger, S. J., Skerker, J. M. et al.: Regulation of the bacterial cell cycle by an integrated genetic circuit. Nature, 444, 899-904 (2006)[PubMed]
- Chen, Y. E., Tropini, C., Jonas, K. et al.: Spatial gradient of protein phosphorylation underlies replicative asymmetry in a bacterium. Proc. Natl. Acad. Sci. USA, 108, 1052-1057 (2011)[PubMed]
- Viollier, P. H., Thanbichler, M., McGrath, P. T. et al.: Rapid and sequential movement of individual chromosomal loci to specific subcellular locations during bacterial DNA replication. Proc. Natl. Acad. Sci. USA, 101, 9257-9262 (2004)[PubMed]
- Danilchanka, O. & Mekalanos, J. J.: Cyclic dinucleotides and the innate immune response. Cell, 154, 962-970 (2013)[PubMed]
- Capra, E. J. & Laub, M. T.: Evolution of two-component signal transduction systems. Annu. Rev. Microbiol., 66, 325-347 (2012)[PubMed]
著者プロフィール
略歴:2008年 九州大学大学院薬学研究院 修了,同年 同 助教を経て,2011年よりスイスBasel大学 博士研究員.
研究テーマ:サイクリックジグアニル酸が駆動する細胞プログラム.
関心事:単純な(と思われがちな)細菌の単純ならざるしくみ.
© 2015 尾崎 省吾 Licensed under CC 表示 2.1 日本