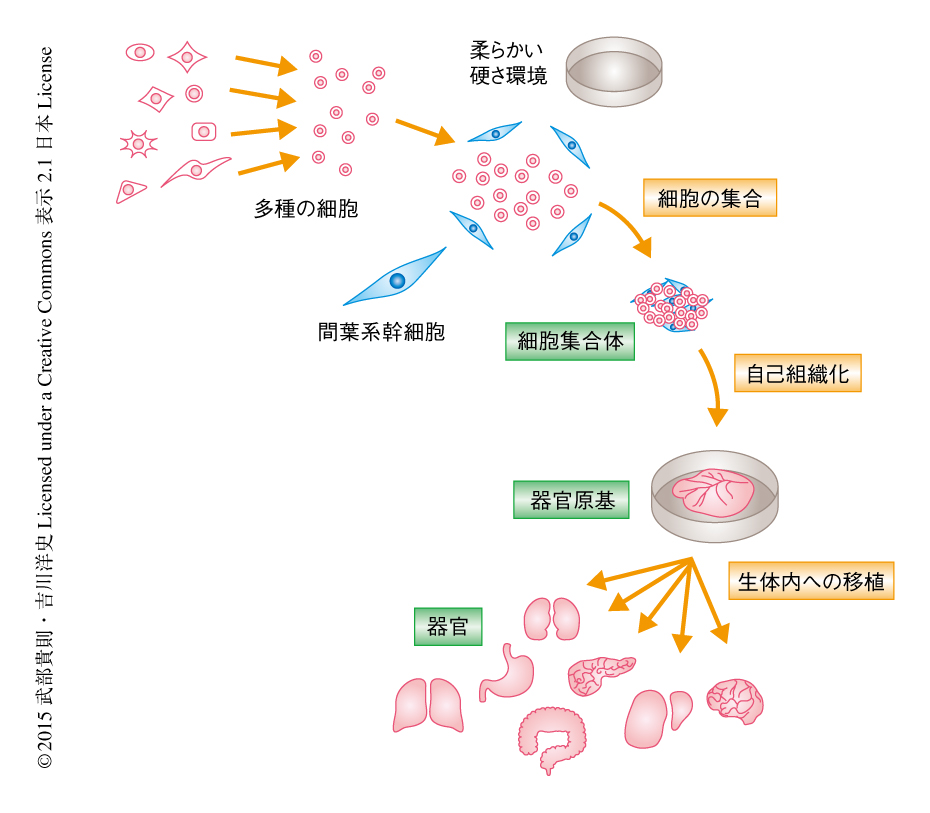
間葉系細胞の凝集を利用したさまざまな器官原基の人為的な構成
武部貴則1・吉川洋史2
(1横浜市立大学大学院医学研究科 臓器再生医学,2埼玉大学大学院理工学研究科物質科学部門)
email:武部貴則
DOI: 10.7875/first.author.2015.059
Vascularized and complex organ buds from diverse tissues via mesenchymal cell-driven condensation.
Takanori Takebe, Masahiro Enomura, Emi Yoshizawa, Masaki Kimura, Hiroyuki Koike, Yasuharu Ueno, Takahisa Matsuzaki, Takashi Yamazaki, Takafumi Toyohara, Kenji Osafune, Hiromitsu Nakauchi, Hiroshi Y. Yoshikawa, Hideki Taniguchi
Cell Stem Cell, 16, 556-565 (2015)
近年,筆者らは,器官形成期に生じる細胞間相互作用を再現する特殊な培養法により,ヒトのiPS細胞に由来する肝臓の内胚葉細胞から巨大な肝臓原基が自律的に形成されることを発見した.この現象においては,まず,多数の細胞が巨大な集合体を形成し,そののち,器官原基が自己組織化する.この分子機構を詳細に解析したところ,立体的な肝臓原基の作製には,間葉系幹細胞を起点とした細胞集合体の力学的な収縮,および,硬さ環境など最適な物理因子をもつ外部環境の設計が必要なことが明らかにされた.さらに,この方法をほかの器官原基の作製に応用した結果,肝臓のみならず,膵臓,腎臓,腸,肺,心臓,脳,がん細胞などを含む複数の種類の細胞から,立体的な複合組織を創出することに成功した.創出された器官原基は,移植ののちすみやかに血流をもつ血管網を再構成するのみならず,機能的な組織を自律的に形成した.なかでも,腎臓原基や膵臓原基の移植では,最終的に尿を産生する腎臓の組織や糖尿病の治療効果をもつ膵臓の組織を生みだすことが示された.この方法は,複雑な構造をもつ組織の形成を実現する画期的な技術基盤であり,さまざまな器官の再生医療への応用のみならず,新たな医薬品の開発のためのツールとして応用が強く期待される.
人工多能性幹細胞(induced pluripotent stem cell,iPS細胞)などの幹細胞を用いた再生医療の実現をめざすうえでは,目的とする細胞のみならず,血管,血液,間質,神経などの支持細胞を含む立体的な構造の時間変化および空間変化を再現することが必要であるという仮説が有力になりつつある.これらを実現するために,多能性幹細胞に由来する器官の創出に多種多様な細胞間相互作用を応用する革新的な3次元(4次元)培養系が待望されていた.
近年,筆者らは,胎内において器官原基が形成される過程を模倣する新規の細胞培養技術である器官原基法を開発し,試験管内においてヒトのiPS細胞から立体的な肝臓原基の自律的な自己組織化(self-organization)が起こることを示した1,2).すなわち,前腸内胚葉からの肝臓原基の形成に必要な,間葉系前駆細胞および血管内皮前駆細胞と肝内胚葉細胞との細胞間相互作用を模倣する培養系を確立した.この方法により,特別な条件において未分化な内胚葉細胞,血管内皮細胞,間葉系細胞を共培養すると,約48時間の培養により細胞が集合し(self-condensation),数日間の培養により立体的な肝臓原基が形成された3).一方,肝臓原基が形成される分子機構に関しては未解明な点が多く,ほかの器官原基への応用が可能であるかどうかは不明であった.
そこで,この研究では,器官原基の形成機構の解明をめざし,内胚葉細胞,血管内皮細胞,間葉系細胞を用いたiPS細胞に由来する肝臓原基の形成を,分子細胞生物学的な手法や細胞動態の数理モデルなどにより解析し,器官原基法のために必須となる細胞の外部環境および内部環境の解明を試みた.さらに,この動作原理がほかの器官の再構成のための手法として利用可能であるかどうか検討した.
タイムラプスイメージング解析により細胞の動態を追跡するため,各種の細胞を蛍光で標識し器官原基法により共培養した.その結果,迅速な集合により細胞集合体が形成されたのち,内皮細胞によるネットワークの形成といった自己組織化をつうじた空間の再構成が起こり,器官原基が形成されることを見い出した.このような初期の過程に生じる細胞集合のダイナミクスをより詳細に解析するため,細胞集合体の平均半径および円形度の経時変化を計測した.その結果,細胞集合体は,播種ののち約10時間までは50μm/h以下の速度で中心にむかってゆるやかに収縮し,そののちの数時間で最大で1 mm/hに達するほどに急速に収縮したのち,収縮の速度は指数関数的に低下することがわかった.一方,円形度は細胞の播種ののちほぼ単調に低下し,細胞集合体の急激な収縮がはじまる10~13時間のちに約0.5という最小値を示した.そののち上昇に転じ,20時間のちには約0.85とほぼ一定値に収束した.
以上の結果から,器官原基の形成の初期過程では多細胞系の急速な力学的な収縮が起こっていることを示唆された.実際,走化性などを介した細胞遊走からは1 mm/hに達するような速い細胞の移動を説明することはできない.また,播種ののち10~13時間でみられた急激な細胞集合体の収縮のダイナミクスは,指数関数により示される粘弾性体の収縮モデル(Kelvin-Voigt model)により近似できることもわかった.つまり,細胞集合体の形成および収縮は個々の細胞の自律的な遊走ではなく,多数の細胞系における力学的な収縮によるものであることが示唆された.この現象においては,このような収縮力が等方的に作用した結果,表面エネルギーが最小となる球状(円形度は1)の集合体が形成したと考えられた.一方,収縮の初期にみられた円形度の低下から,収縮の初期においては細胞集合体の収縮力は細胞と基板との接着力と均衡していることが示唆された.
では,何がこの収縮力を発生させているのだろうか? 力学的な組織形成の過程は原腸陥入においても報告されており,細胞骨格系タンパク質の収縮力が関与していることが示されている.そこで,細胞骨格系タンパク質の活性化を阻害する薬剤ブレビスタチンを添加したところ細胞集合体の形成が阻害されたことから,アクトミオシン系による収縮力が重要な役割をはたしていることがわかった.また実際に,アクトミオシンの発現の経時変化をみたところ,播種ののち数時間で発現量は最大になった.これは,さきに示した,大きな収縮がはじまる時間スケールとほぼ一致した.さらに,細胞集合体の形成に必要な細胞種を検討したところ,間葉系前駆細胞が欠けた場合にのみ細胞集合体の形成が阻害されることがわかった.以上の結果から,間葉系前駆細胞の骨格系タンパク質の収縮力が,力学的な細胞集合体の形成の駆動源である可能性が示された.
以上のように,力学的な細胞集合体の形成には細胞のあいだの相互作用,とくに,収縮力と接着力が重要であることがわかった.一方,この現象はマトリゲルのうえで効率的に生じることがわかっているが,細胞とマトリゲルとのあいだの相互作用がどのくらい影響をあたえるかはわかっていなかった.近年の研究により,基板の硬さ(ヤング率)が細胞の接着力や収縮力など力学的な相互作用に強く影響をあたえることが単一種の細胞を観察した系において報告されている.そこで,多細胞系から器官原基が形成される過程において基板の硬さがどのような影響をあたえるかを検証した.具体的には,硬さを自在に制御することの可能なヒドロゲルの基板を構築し,さまざまな硬さ条件の基板のうえに細胞を播種した.その結果,細胞集合体はヤング約10 kPaという硬さ条件において効率的に形成されることがわかった.また,細胞集合体を形成する間葉系前駆細胞の運動を追跡しその速度および運動配向性を解析したところ,ともに同じ硬さ条件において極大を示すことが明らかにされた.これは,細胞集合体の形成に最適な細胞外環境の硬さが存在することを明確に示した.また一般に,100μm以下の小型のスフェロイドなどの形成においては,細胞と細胞のあいだの接着力が細胞と細胞外との接着力をうわまわることが必要であることが知られている4).今回の結果は,ミリメートルにわたる大きなサイズスケールの場合でも,細胞と細胞のあいだの収縮力および接着力と,細胞と細胞外との接着力とのあいだに力の競争が存在し,ゲル基板の硬さがその制御因子であることを示したものと考えられた.実際,収縮力の源である間葉系前駆細胞は,周辺の環境の硬さに敏感に応答してその機能を発現することが知られており5),今回の実験においても,ゲル基板の硬さの影響を強くうけていることが考えられた.以上の結果から,最適な力学的な条件をもつゲル基板の設計が器官原基法における鍵になることが明らかにされた.
最適な硬さ環境における間葉系前駆細胞を起点とした収縮が自律的な細胞集合体の形成に重要であるならば,器官原基法は胚葉の由来に関係なくほかの器官原基に拡張できるものと考えられた.そこで,さらなる汎用性を評価するため,マウスの胚および成体の複数の器官から細胞を単離し,器官原基法により共培養した.驚くべきことに,細胞集合体の形成による複合組織の形成は,肝臓のみならず,膵臓,腸,肺,心臓,腎臓,脳,さらには,がん細胞を含むすべての細胞種において保たれていた.すなわち,移植手術にたえうる力学的な強度をもつ細胞集合体が形成されることが判明した.実際,血管内皮細胞を含む組織を再構成して移植することにより,従来の組織工学的なアプローチと比べ,移植ののちはるかに短い時間で血液の再灌流が生じた.したがって,器官原基法は任意の種類および量の多細胞系から複合組織を形成するうえで汎用的な基盤技術になると考えられた.
単離されたマウスの膵β細胞株,血管内皮細胞,間葉系前駆細胞の共培養により細胞集合体を形成し生体へ移植したところ,迅速に血液に再灌流が生じ,生着したβ細胞は最終的に豊富な微小血管ネットワークをもつ膵島様の組織を形成した.さらに,疾患モデルに対する治療の有効性を評価するため,1型劇症糖尿病モデルマウスの腎臓の被膜下に細胞集合体を移植した.対照となるマウスでは糖尿病を誘導したのち6日目に死亡したのに対し,細胞集合体を移植したマウスは早期に血糖値が正常化し生存した.今後,ヒトiPS細胞などに由来する膵臓原基を再構成することができれば,従来の方法と比較してよりすぐれた糖尿病の治療法を生みだすことが可能になると期待される.
腎臓の創出への応用の可能性を検討したところ,胎仔の腎臓原基より単離した細胞を血管内皮細胞,間葉系前駆細胞と共培養することにより,同様に細胞集合体を形成することに成功した.驚くべきことに,作製した腎臓原基は移植により数日で血液が血管に流入し移植21日目には血液を濾過する機能をもつ糸球体様の組織を再構成した.移植21日目に摘出した組織の遺伝子発現の解析,免疫染色,電子顕微鏡による解析の結果,濾過の機能に必須となる足細胞,基底膜,内皮細胞からなる三つ組構造が形成されていることが見い出された.興味深いことに,成体の腎臓に由来する細胞集合体は糸球体など機能的な腎組織を形成しなかった.このことから,成体の組織に由来する終末分化した細胞から組織を創出する手法と比較して,胎児期に相当する器官原基に由来する細胞集合体を用いたほうが,機能的な組織を効率的に創出できる可能性が示唆された.したがって,多能性幹細胞を用いて創出された組織の臨床への応用を想定した場合,終末分化した成熟細胞あるいは成熟組織を利用するよりも,器官原基に相当する未熟な組織を移植したほうが,機能性および治療の有効性にすぐれる可能性があると考えられた.
1960年代ごろから,ペレット培養などを用いて動物の胎仔の細胞から小型の細胞集合体を作製することにより,in vitroにおいても成体の組織に類似した構造を自律的に形成することが知られていた6).細胞の集合による自己組織化についてのこの古典的な知見は,再生医療分野におけるひとつの本質的な挑戦である,ヒトの幹細胞から器官の創出をめざすうえでもきわめて重要な原理であると考えられる.実際に,近年,ヒトの幹細胞から作製した小型の細胞集合体から,脳,眼杯,腎臓など,さまざまな微小組織を自己組織化させる試みが報告されつつある7).
一方で,従来の方法においては細胞集合体の作製法においていくつかの課題が存在していた.たとえば,多くの研究では比較的少数の多能性幹細胞から均質な細胞からなる細胞集合体(103~104細胞のオーダー)を作製し,その結果,高い自己組織化能をもつ外胚葉性組織および中胚葉性組織の形成にとどまっていた.しかし,肝臓などのような内胚葉に由来する器官の創出をめざすうえでは,より大きなスケールで異種の細胞のあいだでの相互作用を実現する細胞集合体の作製が必須と考えられる.筆者らの研究により明らかにされた間葉系細胞の収縮による細胞集合体の作製法は,この意味において重要な原則を提供すると考えられる.すなわち,任意の複数の種類の細胞から大規模な細胞の集合(105~106細胞オーダー)を人為的に形成させることにより,器官原基への自己組織化を評価するための細胞集合体を構築することが可能になった.実際,これまでに,活用方法の1例としてヒトの軟骨組織の形成に有用であることが示されている8).
この研究においては,実験的にさまざまな器官に由来する細胞に血管内皮細胞を組み込むことにより,機能的な血管網の迅速な形成と,それにつづく自己組織化をつうじた機能の発現が実現することが明らかにされた(図1).今後,この手法を活用することにより,いまだ評価のなされていない多様な支持細胞の自己組織化への寄与を評価することにより,複雑な器官の形成を担保する新規の培養系の開発につながるものと期待される.この研究が明らかにした間葉系細胞の凝集を活用した細胞集合体の作製は,多能性幹細胞を用いたヒト基礎生物学やヒト病理学を研究するための強力なツールとなるのみならず,治療の困難な疾患の治療をめざす次々世代の再生医療を実現する中核技術となるものと期待される.
略歴:横浜市立大学大学院医学研究科 准教授.科学技術振興機構さきがけ研究者 兼任.
研究テーマ:再生医学・広告医学.
吉川 洋史(Hiroshi Y. Yoshikawa)
埼玉大学大学院理工学研究科 准教授.
© 2015 武部貴則・吉川洋史 Licensed under CC 表示 2.1 日本
(1横浜市立大学大学院医学研究科 臓器再生医学,2埼玉大学大学院理工学研究科物質科学部門)
email:武部貴則
DOI: 10.7875/first.author.2015.059
Vascularized and complex organ buds from diverse tissues via mesenchymal cell-driven condensation.
Takanori Takebe, Masahiro Enomura, Emi Yoshizawa, Masaki Kimura, Hiroyuki Koike, Yasuharu Ueno, Takahisa Matsuzaki, Takashi Yamazaki, Takafumi Toyohara, Kenji Osafune, Hiromitsu Nakauchi, Hiroshi Y. Yoshikawa, Hideki Taniguchi
Cell Stem Cell, 16, 556-565 (2015)
要 約
近年,筆者らは,器官形成期に生じる細胞間相互作用を再現する特殊な培養法により,ヒトのiPS細胞に由来する肝臓の内胚葉細胞から巨大な肝臓原基が自律的に形成されることを発見した.この現象においては,まず,多数の細胞が巨大な集合体を形成し,そののち,器官原基が自己組織化する.この分子機構を詳細に解析したところ,立体的な肝臓原基の作製には,間葉系幹細胞を起点とした細胞集合体の力学的な収縮,および,硬さ環境など最適な物理因子をもつ外部環境の設計が必要なことが明らかにされた.さらに,この方法をほかの器官原基の作製に応用した結果,肝臓のみならず,膵臓,腎臓,腸,肺,心臓,脳,がん細胞などを含む複数の種類の細胞から,立体的な複合組織を創出することに成功した.創出された器官原基は,移植ののちすみやかに血流をもつ血管網を再構成するのみならず,機能的な組織を自律的に形成した.なかでも,腎臓原基や膵臓原基の移植では,最終的に尿を産生する腎臓の組織や糖尿病の治療効果をもつ膵臓の組織を生みだすことが示された.この方法は,複雑な構造をもつ組織の形成を実現する画期的な技術基盤であり,さまざまな器官の再生医療への応用のみならず,新たな医薬品の開発のためのツールとして応用が強く期待される.
はじめに
人工多能性幹細胞(induced pluripotent stem cell,iPS細胞)などの幹細胞を用いた再生医療の実現をめざすうえでは,目的とする細胞のみならず,血管,血液,間質,神経などの支持細胞を含む立体的な構造の時間変化および空間変化を再現することが必要であるという仮説が有力になりつつある.これらを実現するために,多能性幹細胞に由来する器官の創出に多種多様な細胞間相互作用を応用する革新的な3次元(4次元)培養系が待望されていた.
近年,筆者らは,胎内において器官原基が形成される過程を模倣する新規の細胞培養技術である器官原基法を開発し,試験管内においてヒトのiPS細胞から立体的な肝臓原基の自律的な自己組織化(self-organization)が起こることを示した1,2).すなわち,前腸内胚葉からの肝臓原基の形成に必要な,間葉系前駆細胞および血管内皮前駆細胞と肝内胚葉細胞との細胞間相互作用を模倣する培養系を確立した.この方法により,特別な条件において未分化な内胚葉細胞,血管内皮細胞,間葉系細胞を共培養すると,約48時間の培養により細胞が集合し(self-condensation),数日間の培養により立体的な肝臓原基が形成された3).一方,肝臓原基が形成される分子機構に関しては未解明な点が多く,ほかの器官原基への応用が可能であるかどうかは不明であった.
そこで,この研究では,器官原基の形成機構の解明をめざし,内胚葉細胞,血管内皮細胞,間葉系細胞を用いたiPS細胞に由来する肝臓原基の形成を,分子細胞生物学的な手法や細胞動態の数理モデルなどにより解析し,器官原基法のために必須となる細胞の外部環境および内部環境の解明を試みた.さらに,この動作原理がほかの器官の再構成のための手法として利用可能であるかどうか検討した.
1.細胞集合体の収縮を利用した間葉系細胞の凝集
タイムラプスイメージング解析により細胞の動態を追跡するため,各種の細胞を蛍光で標識し器官原基法により共培養した.その結果,迅速な集合により細胞集合体が形成されたのち,内皮細胞によるネットワークの形成といった自己組織化をつうじた空間の再構成が起こり,器官原基が形成されることを見い出した.このような初期の過程に生じる細胞集合のダイナミクスをより詳細に解析するため,細胞集合体の平均半径および円形度の経時変化を計測した.その結果,細胞集合体は,播種ののち約10時間までは50μm/h以下の速度で中心にむかってゆるやかに収縮し,そののちの数時間で最大で1 mm/hに達するほどに急速に収縮したのち,収縮の速度は指数関数的に低下することがわかった.一方,円形度は細胞の播種ののちほぼ単調に低下し,細胞集合体の急激な収縮がはじまる10~13時間のちに約0.5という最小値を示した.そののち上昇に転じ,20時間のちには約0.85とほぼ一定値に収束した.
以上の結果から,器官原基の形成の初期過程では多細胞系の急速な力学的な収縮が起こっていることを示唆された.実際,走化性などを介した細胞遊走からは1 mm/hに達するような速い細胞の移動を説明することはできない.また,播種ののち10~13時間でみられた急激な細胞集合体の収縮のダイナミクスは,指数関数により示される粘弾性体の収縮モデル(Kelvin-Voigt model)により近似できることもわかった.つまり,細胞集合体の形成および収縮は個々の細胞の自律的な遊走ではなく,多数の細胞系における力学的な収縮によるものであることが示唆された.この現象においては,このような収縮力が等方的に作用した結果,表面エネルギーが最小となる球状(円形度は1)の集合体が形成したと考えられた.一方,収縮の初期にみられた円形度の低下から,収縮の初期においては細胞集合体の収縮力は細胞と基板との接着力と均衡していることが示唆された.
では,何がこの収縮力を発生させているのだろうか? 力学的な組織形成の過程は原腸陥入においても報告されており,細胞骨格系タンパク質の収縮力が関与していることが示されている.そこで,細胞骨格系タンパク質の活性化を阻害する薬剤ブレビスタチンを添加したところ細胞集合体の形成が阻害されたことから,アクトミオシン系による収縮力が重要な役割をはたしていることがわかった.また実際に,アクトミオシンの発現の経時変化をみたところ,播種ののち数時間で発現量は最大になった.これは,さきに示した,大きな収縮がはじまる時間スケールとほぼ一致した.さらに,細胞集合体の形成に必要な細胞種を検討したところ,間葉系前駆細胞が欠けた場合にのみ細胞集合体の形成が阻害されることがわかった.以上の結果から,間葉系前駆細胞の骨格系タンパク質の収縮力が,力学的な細胞集合体の形成の駆動源である可能性が示された.
2.細胞集合体の形成に最適な硬さ環境の決定
以上のように,力学的な細胞集合体の形成には細胞のあいだの相互作用,とくに,収縮力と接着力が重要であることがわかった.一方,この現象はマトリゲルのうえで効率的に生じることがわかっているが,細胞とマトリゲルとのあいだの相互作用がどのくらい影響をあたえるかはわかっていなかった.近年の研究により,基板の硬さ(ヤング率)が細胞の接着力や収縮力など力学的な相互作用に強く影響をあたえることが単一種の細胞を観察した系において報告されている.そこで,多細胞系から器官原基が形成される過程において基板の硬さがどのような影響をあたえるかを検証した.具体的には,硬さを自在に制御することの可能なヒドロゲルの基板を構築し,さまざまな硬さ条件の基板のうえに細胞を播種した.その結果,細胞集合体はヤング約10 kPaという硬さ条件において効率的に形成されることがわかった.また,細胞集合体を形成する間葉系前駆細胞の運動を追跡しその速度および運動配向性を解析したところ,ともに同じ硬さ条件において極大を示すことが明らかにされた.これは,細胞集合体の形成に最適な細胞外環境の硬さが存在することを明確に示した.また一般に,100μm以下の小型のスフェロイドなどの形成においては,細胞と細胞のあいだの接着力が細胞と細胞外との接着力をうわまわることが必要であることが知られている4).今回の結果は,ミリメートルにわたる大きなサイズスケールの場合でも,細胞と細胞のあいだの収縮力および接着力と,細胞と細胞外との接着力とのあいだに力の競争が存在し,ゲル基板の硬さがその制御因子であることを示したものと考えられた.実際,収縮力の源である間葉系前駆細胞は,周辺の環境の硬さに敏感に応答してその機能を発現することが知られており5),今回の実験においても,ゲル基板の硬さの影響を強くうけていることが考えられた.以上の結果から,最適な力学的な条件をもつゲル基板の設計が器官原基法における鍵になることが明らかにされた.
3.細胞集合体の形成を用いたさまざまな器官への応用
最適な硬さ環境における間葉系前駆細胞を起点とした収縮が自律的な細胞集合体の形成に重要であるならば,器官原基法は胚葉の由来に関係なくほかの器官原基に拡張できるものと考えられた.そこで,さらなる汎用性を評価するため,マウスの胚および成体の複数の器官から細胞を単離し,器官原基法により共培養した.驚くべきことに,細胞集合体の形成による複合組織の形成は,肝臓のみならず,膵臓,腸,肺,心臓,腎臓,脳,さらには,がん細胞を含むすべての細胞種において保たれていた.すなわち,移植手術にたえうる力学的な強度をもつ細胞集合体が形成されることが判明した.実際,血管内皮細胞を含む組織を再構成して移植することにより,従来の組織工学的なアプローチと比べ,移植ののちはるかに短い時間で血液の再灌流が生じた.したがって,器官原基法は任意の種類および量の多細胞系から複合組織を形成するうえで汎用的な基盤技術になると考えられた.
4.細胞集合体の形成を用いた機能的な膵島の創出
単離されたマウスの膵β細胞株,血管内皮細胞,間葉系前駆細胞の共培養により細胞集合体を形成し生体へ移植したところ,迅速に血液に再灌流が生じ,生着したβ細胞は最終的に豊富な微小血管ネットワークをもつ膵島様の組織を形成した.さらに,疾患モデルに対する治療の有効性を評価するため,1型劇症糖尿病モデルマウスの腎臓の被膜下に細胞集合体を移植した.対照となるマウスでは糖尿病を誘導したのち6日目に死亡したのに対し,細胞集合体を移植したマウスは早期に血糖値が正常化し生存した.今後,ヒトiPS細胞などに由来する膵臓原基を再構成することができれば,従来の方法と比較してよりすぐれた糖尿病の治療法を生みだすことが可能になると期待される.
5.試験管内において再構成した腎臓原基の移植による機能的な糸球体の創出
腎臓の創出への応用の可能性を検討したところ,胎仔の腎臓原基より単離した細胞を血管内皮細胞,間葉系前駆細胞と共培養することにより,同様に細胞集合体を形成することに成功した.驚くべきことに,作製した腎臓原基は移植により数日で血液が血管に流入し移植21日目には血液を濾過する機能をもつ糸球体様の組織を再構成した.移植21日目に摘出した組織の遺伝子発現の解析,免疫染色,電子顕微鏡による解析の結果,濾過の機能に必須となる足細胞,基底膜,内皮細胞からなる三つ組構造が形成されていることが見い出された.興味深いことに,成体の腎臓に由来する細胞集合体は糸球体など機能的な腎組織を形成しなかった.このことから,成体の組織に由来する終末分化した細胞から組織を創出する手法と比較して,胎児期に相当する器官原基に由来する細胞集合体を用いたほうが,機能的な組織を効率的に創出できる可能性が示唆された.したがって,多能性幹細胞を用いて創出された組織の臨床への応用を想定した場合,終末分化した成熟細胞あるいは成熟組織を利用するよりも,器官原基に相当する未熟な組織を移植したほうが,機能性および治療の有効性にすぐれる可能性があると考えられた.
おわりに
1960年代ごろから,ペレット培養などを用いて動物の胎仔の細胞から小型の細胞集合体を作製することにより,in vitroにおいても成体の組織に類似した構造を自律的に形成することが知られていた6).細胞の集合による自己組織化についてのこの古典的な知見は,再生医療分野におけるひとつの本質的な挑戦である,ヒトの幹細胞から器官の創出をめざすうえでもきわめて重要な原理であると考えられる.実際に,近年,ヒトの幹細胞から作製した小型の細胞集合体から,脳,眼杯,腎臓など,さまざまな微小組織を自己組織化させる試みが報告されつつある7).
一方で,従来の方法においては細胞集合体の作製法においていくつかの課題が存在していた.たとえば,多くの研究では比較的少数の多能性幹細胞から均質な細胞からなる細胞集合体(103~104細胞のオーダー)を作製し,その結果,高い自己組織化能をもつ外胚葉性組織および中胚葉性組織の形成にとどまっていた.しかし,肝臓などのような内胚葉に由来する器官の創出をめざすうえでは,より大きなスケールで異種の細胞のあいだでの相互作用を実現する細胞集合体の作製が必須と考えられる.筆者らの研究により明らかにされた間葉系細胞の収縮による細胞集合体の作製法は,この意味において重要な原則を提供すると考えられる.すなわち,任意の複数の種類の細胞から大規模な細胞の集合(105~106細胞オーダー)を人為的に形成させることにより,器官原基への自己組織化を評価するための細胞集合体を構築することが可能になった.実際,これまでに,活用方法の1例としてヒトの軟骨組織の形成に有用であることが示されている8).
この研究においては,実験的にさまざまな器官に由来する細胞に血管内皮細胞を組み込むことにより,機能的な血管網の迅速な形成と,それにつづく自己組織化をつうじた機能の発現が実現することが明らかにされた(図1).今後,この手法を活用することにより,いまだ評価のなされていない多様な支持細胞の自己組織化への寄与を評価することにより,複雑な器官の形成を担保する新規の培養系の開発につながるものと期待される.この研究が明らかにした間葉系細胞の凝集を活用した細胞集合体の作製は,多能性幹細胞を用いたヒト基礎生物学やヒト病理学を研究するための強力なツールとなるのみならず,治療の困難な疾患の治療をめざす次々世代の再生医療を実現する中核技術となるものと期待される.
文 献
- Takebe, T., Sekine, K., Enomura, M. et al.: Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature, 499, 481-484 (2013)[PubMed]
- Takebe, T., Sekine, K., Suzuki, Y. et al.: Self-organization of human hepatic organoid by recapitulating organogenesis in vitro. Transplant. Proc., 44, 1018-1020 (2012)[PubMed]
- Takebe, T., Zhang, R. R., Koike, H. et al.: Generation of a vascularized and functional human liver from an iPSC-derived organ bud transplant. Nat. Protoc. 9, 396-409 (2014)[PubMed]
- Steinberg, M. S.: On the mechanism of tissue reconstruction by dissociated cells, III. Free energy relations and the reorganization of fused, heteronomic tissue fragments. Proc. Natl. Acad. Sci. USA, 48, 1769-1776 (1962)[PubMed]
- Engler, A. J., Sen, S., Sweeney, H. L. et al.: Matrix elasticity directs stem cell lineage specification. Cell, 126, 677-689 (2006)[PubMed]
- Takeichi, M.: Self-organization of animal tissues: cadherin-mediated processes. Dev. Cell, 21, 24-26 (2011)[PubMed]
- Sasai, Y.: Cytosystems dynamics in self-organization of tissue architecture. Nature, 493, 318-326 (2013)[PubMed]
- Takebe, T., Kobayashi, S., Suzuki, H. et al.: Transient vascularization of transplanted human adult-derived progenitors promotes self-organizing cartilage. J. Clin. Invest., 124, 4325-4334 (2014)[PubMed]
著者プロフィール
略歴:横浜市立大学大学院医学研究科 准教授.科学技術振興機構さきがけ研究者 兼任.
研究テーマ:再生医学・広告医学.
吉川 洋史(Hiroshi Y. Yoshikawa)
埼玉大学大学院理工学研究科 准教授.
© 2015 武部貴則・吉川洋史 Licensed under CC 表示 2.1 日本