多能性幹細胞の異種間の胚盤胞注入によりマウス生体内にラット膵臓を作製する
小林俊寛・中内啓光
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:小林俊寛
DOI: 10.7875/first.author.2010.025
Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells.
Toshihiro Kobayashi, Tomoyuki Yamaguchi, Sanae Hamanaka, Megumi Kato-Itoh, Yuji Yamazaki, Makoto Ibata, Hideyuki Sato, Youn-Su Lee, Jo-ichi Usui, A.S. Knisely, Masumi Hirabayashi, Hiromitsu Nakauchi
Cell, 142, 787-799 (2010)
多能性幹細胞からin vitroで臓器を作製することは再生医療における究極的な目標であるが,構成細胞の多様性や3次元的な立体構造を再現する必要があるため非常に困難であるとされている.そこで筆者らは,膵臓欠損を示すPdx1ノックアウトマウスの胚盤胞にマウス多能性幹細胞を注入することで,発生段階における膵臓の空きを補完し,完全に多能性幹細胞に由来する細胞から構成される膵臓をマウス生体内に作製することに成功した.また,この”胚盤胞補完法”の原理が異種間でも成立するためには多能性幹細胞が異種における胚発生に寄与できなくてはならない.そこで,マウス多能性幹細胞をラットの胚盤胞へ,あるいは,ラットの多能性幹細胞をマウスの胚盤胞へ注入し,マウス-ラット異種間キメラの作製を試みた.その結果,異種間キメラはどちらの方法でも成立し,とくに,大きさや種特異的な特徴は胚盤胞および子宮を由来とする種に依存することがわかった.最後に,以上の知見を組み合わせて,Pdx1ノックアウトマウスの胚盤胞にラットの多能性幹細胞を注入すると機能的なラットの膵臓がマウスの生体内に作製できた.これらの結果は,異種の生体内の環境を利用して多能性幹細胞に由来する臓器を作製することが可能であることを示すものである.
患者自身の細胞から移植可能な臓器をつくることは再生医療の究極的な目標のひとつである.そのための細胞として期待されているのが生体内のすべての細胞に分化可能な多能性幹細胞である.多能性幹細胞である胚性幹細胞(embryonic stem cell,ES細胞)がヒト受精卵から樹立されて以来1),臨床応用をめざした多くの研究が進められてきた.とくに近年,誘導型多能性幹細胞(induced pluripotent stem cell,iPS細胞)の技術の開発により,終末分化した体細胞をES細胞とほぼ同等の能力をもつ多能性幹細胞に簡便かつ再現性よく転換することが可能になった2,3).これにより,”自身の多能性幹細胞”からin vitroで望みの細胞をつくることへの道が開け,糖尿病やパーキンソン病などさまざまな治療に応用されようとしている.しかし,臓器をつくるとなると3次元的な構造や多岐にわたる構成細胞をin vitroで再現する必要がありきわめて困難であるとされている.そこで筆者らは,多能性幹細胞のもつキメラ形成能を利用した”胚盤胞補完法”(blastocyst complementation)の技術に注目した.胚盤胞補完法とは,特定の細胞系譜を欠損したマウスの胚盤胞に正常な多能性幹細胞を注入しキメラが成立すると欠損した細胞が完全に多能性幹細胞に由来するものに置き換えられるというもので,1993年,Chenらによって,リンパ球を欠損したRag2ノックアウトマウスを用いてその原理が報告された4).筆者らは,この原理を応用し,遺伝的に特定の臓器を欠損したマウスの胚盤胞に多能性幹細胞を注入することでin vivoで多能性幹細胞に由来する臓器がつくれないかと考えた.
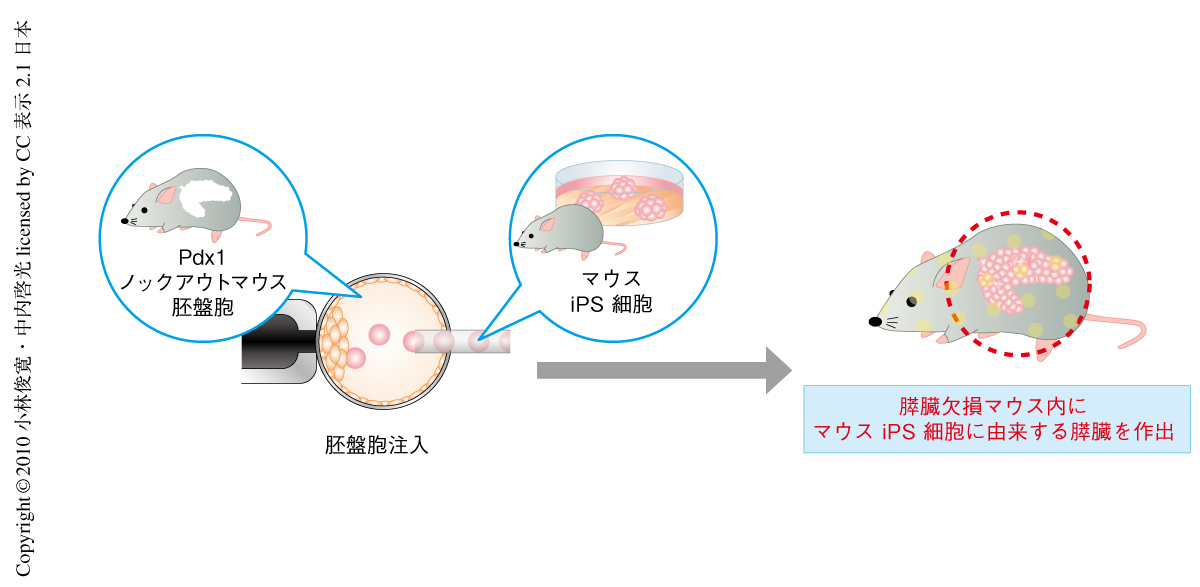
まず,胚盤胞補完法により臓器がつくれるかどうかを明らかにするため,マウスの多能性幹細胞と膵臓欠損の表現型を示すPdx1ノックアウトマウスを用い5),同種間で多能性幹細胞に由来する膵臓をつくることを試みた(図1).Pdx1は胎仔期における膵臓形成の初期から必須な転写因子として知られ,このノックアウトマウスは膵臓を完全に欠損することから,膵臓という臓器レベルでの空きを多能性幹細胞に由来する細胞に供給できると考えたのである.
Pdx1ノックアウトマウスの胚盤胞に全身でEGFPを発現するEGFPトランスジェニックマウスから樹立したiPS細胞を注入して,仮親の子宮へ移植し,妊娠満期で取り出した新生仔を解析した.その結果,iPS細胞の寄与が認められたPdx1ノックアウトマウスには一様にEGFP蛍光を示す膵臓が存在していた.EGFP陽性細胞の分布と構成細胞の機能マーカーとの相関を組織学的に確認したところ,膵臓を構成する外分泌組織,内分泌組織,膵管のそれぞれがすべてEGFP陽性のiPS細胞に由来する細胞から構成されていた.一方,血管や間質をはじめとしたPdx1遺伝子欠損の影響をうけない組織は,注入した細胞に由来する細胞と胚盤胞に由来する細胞とが混ざったキメラ状態になっていた.
そのような膵臓をもったPdx1ノックアウトマウスは,本来ならば膵臓の欠損により産後1週間以内に致死を示すのに対し,高血糖などの症状を示すことなく成体まで発育した.また,糖負荷試験の結果から正常な耐糖能も獲得しており,iPS細胞に由来する膵臓が生体内で正常に機能していることが明らかとなった.これまでの結果は,EGFPで標識したES細胞を用いた場合でも同様であった.
また,マウスiPS細胞に由来する膵臓から単離した膵島をストレプトゾトシン投与により高血糖を誘発した糖尿病モデルマウスに移植すると2ヶ月以上にわたる長期の生着が認められ,それにともない高血糖症の回復が認められた.さらに,移植後のマウスは糖負荷に対しインスリン分泌による血糖値の回復をみせたことから,移植された膵島が正常な糖応答性をもった機能的なものであることが示唆された.
以上より,マウスを用いた同種間の胚盤胞補完法により,多能性幹細胞に由来する機能的な臓器を作製できることが明らかとなった.
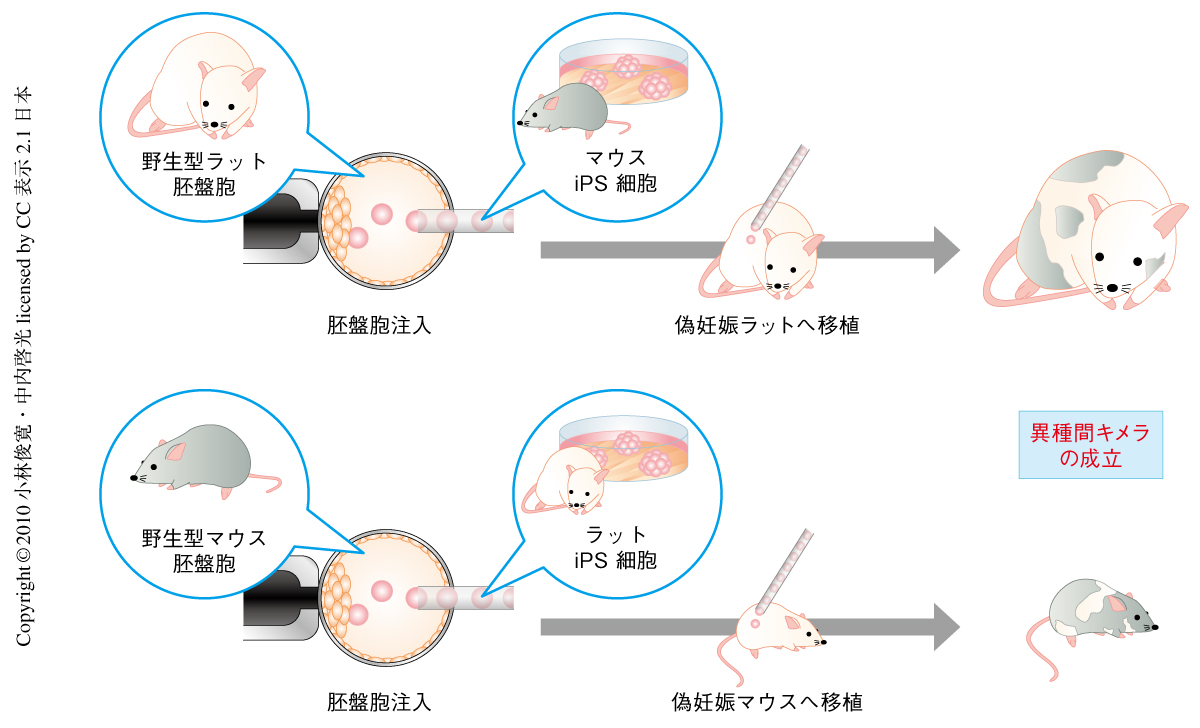
筆者らの研究の究極的な目標は,ここで示した原理を応用して特定の臓器を欠損させた大型動物の生体内にヒト多能性幹細胞に由来する臓器を作製することである.そのためには,注入された多能性幹細胞が異種における胚発生に同調・寄与し,その生体内において機能的な組織や臓器をつくりだせるかどうかが重要になる.そこでつぎに,異種間でのキメラ形成能を確認するため,多能性幹細胞を用いたマウス-ラット間の異種間キメラの作製を試みた(図2).
異種間キメラは家畜を用いた先行研究においてその存在が古くから確認されている.たとえば,着床前受精卵を凝集させて作製されたヤギとヒツジのキメラである”ギープ”(geep)は有名な例のひとつである6).一方,マウス-ラット間においては,両者とももっとも汎用な実験動物であり古くから研究がなされていたにもかかわらず,生存可能なキメラ個体の作製には誰も成功していなかった.その理由のひとつに,作製方法として受精卵の凝集法を用いることが不適当であった可能性がある.その方法を用いると栄養外胚葉や原始内胚葉といった胚体外組織もキメラ状態になり,それが子宮内での着床阻害や,のちの胚発生に悪影響をあたえたのかもしれない.しかし,多能性幹細胞は通常の同種間キメラの作製においては胚体外組織への寄与は認められないことから,異種間キメラの作製に適していると考えた.
さきのEGFP標識したマウスiPS細胞をラットの胚盤胞に注入しラットの仮親へ移植,あるいは逆に,新規に樹立したEGFP標識したラットiPS細胞をマウスの胚盤胞に注入しマウスの仮親に移植した.すると,マウスおよびラットのiPS細胞は互いの胚発生に寄与し,出生後も生存可能な異種間キメラの作製に成功した.同じく多能性幹細胞であるES細胞でも同様の結果が得られた.EGFP蛍光を指標に異種のiPS細胞に由来する細胞の分布を確認したところ,ほぼすべての組織においてEGFP陽性細胞の存在が確認された.また,これらキメラの個体サイズは,出生時およびその発育段階において寄与率に応じ多少の影響をうけるものの,おおむね胚盤胞および仮親と同等であった.このことから,胚盤胞に由来する胚体外組織もしくは子宮は個体のサイズをある程度まで制御している可能性が示唆された.
以上より,多能性幹細胞を用いることで世界初のマウス-ラット異種間キメラを双方向から作製することに成功した.そして,注入された多能性幹細胞は異種の環境においても正常に胚発生をへて全身の機能的な細胞に分化できることがわかった.
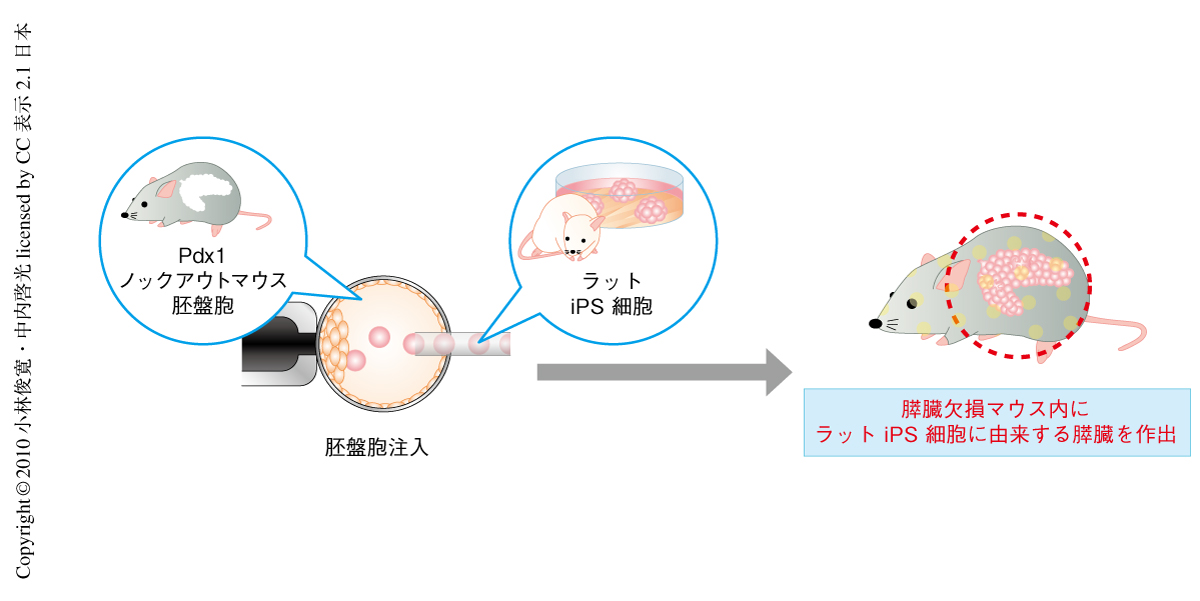
以上の2つの知見を組み合わせ,ラットiPS細胞をPdx1ノックアウトマウスの胚盤胞に注入することで,異種間の胚盤胞補完法を介してラットの膵臓をマウスの生体内に作製しようと試みた(図3).その結果,Pdx1ノックアウトマウス生体内に一様にEGFP蛍光を示すラットiPS細胞に由来する膵臓を作製することに成功した.それらは組織学的な解析においても一様にEGFP蛍光を示す細胞で構成されており,膵臓の機能マーカーの発現も認められた.また,このラットiPS細胞に由来する膵臓をもったPdx1ノックアウトマウスは成体まで発育し,正常な耐糖能を獲得していることがわかった.
以上より,筆者らは,異種間の胚盤胞補完法により異種の生体内に多能性幹細胞に由来する機能的な臓器をつくるという原理を証明することに成功した.
この研究では,胚盤胞補完法を用いた機能的な臓器の作製,多能性幹細胞を用いたマウス-ラット異種間キメラの成立,この2つを組み合わせることで異種間の胚盤胞補完法を用いたマウス生体内におけるラット膵臓の作製,の3点を示すことができた.これらのことから,多能性幹細胞と胚盤胞のように用いる細胞と胚が時間的・空間的に同期すれば,たとえ異種の環境であっても,発生過程を利用して外から入れた細胞に由来する臓器をつくりだせることがわかった.この原理を応用すれば,患者に由来する多能性幹細胞やそこからin vitroで分化させた細胞を大型動物の個体のなかに適切なタイミングと場所に移植することで,自身の臓器をつくることが可能であると思われる.この研究で証明した原理が臓器再生といった究極的な再生医療ための最初のステップとなることを期待したい.
略歴:2010年 東京大学大学院新領域創成科学研究科博士課程 修了,同年より科学技術振興機構 中内幹細胞制御プロジェクト 研究員.
研究テーマ:多能性幹細胞からの臓器再生.
抱負:ラットの膵臓がマウスのなかで光っているのを初めて見たとき,解析する手が震えました.日々の研究生活のなかでごくごくまれに存在するそんな感動を追い求めて,これからも研究を続けていきたいと思います.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2010 小林俊寛・中内啓光 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:小林俊寛
DOI: 10.7875/first.author.2010.025
Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells.
Toshihiro Kobayashi, Tomoyuki Yamaguchi, Sanae Hamanaka, Megumi Kato-Itoh, Yuji Yamazaki, Makoto Ibata, Hideyuki Sato, Youn-Su Lee, Jo-ichi Usui, A.S. Knisely, Masumi Hirabayashi, Hiromitsu Nakauchi
Cell, 142, 787-799 (2010)
要 約
多能性幹細胞からin vitroで臓器を作製することは再生医療における究極的な目標であるが,構成細胞の多様性や3次元的な立体構造を再現する必要があるため非常に困難であるとされている.そこで筆者らは,膵臓欠損を示すPdx1ノックアウトマウスの胚盤胞にマウス多能性幹細胞を注入することで,発生段階における膵臓の空きを補完し,完全に多能性幹細胞に由来する細胞から構成される膵臓をマウス生体内に作製することに成功した.また,この”胚盤胞補完法”の原理が異種間でも成立するためには多能性幹細胞が異種における胚発生に寄与できなくてはならない.そこで,マウス多能性幹細胞をラットの胚盤胞へ,あるいは,ラットの多能性幹細胞をマウスの胚盤胞へ注入し,マウス-ラット異種間キメラの作製を試みた.その結果,異種間キメラはどちらの方法でも成立し,とくに,大きさや種特異的な特徴は胚盤胞および子宮を由来とする種に依存することがわかった.最後に,以上の知見を組み合わせて,Pdx1ノックアウトマウスの胚盤胞にラットの多能性幹細胞を注入すると機能的なラットの膵臓がマウスの生体内に作製できた.これらの結果は,異種の生体内の環境を利用して多能性幹細胞に由来する臓器を作製することが可能であることを示すものである.
はじめに
患者自身の細胞から移植可能な臓器をつくることは再生医療の究極的な目標のひとつである.そのための細胞として期待されているのが生体内のすべての細胞に分化可能な多能性幹細胞である.多能性幹細胞である胚性幹細胞(embryonic stem cell,ES細胞)がヒト受精卵から樹立されて以来1),臨床応用をめざした多くの研究が進められてきた.とくに近年,誘導型多能性幹細胞(induced pluripotent stem cell,iPS細胞)の技術の開発により,終末分化した体細胞をES細胞とほぼ同等の能力をもつ多能性幹細胞に簡便かつ再現性よく転換することが可能になった2,3).これにより,”自身の多能性幹細胞”からin vitroで望みの細胞をつくることへの道が開け,糖尿病やパーキンソン病などさまざまな治療に応用されようとしている.しかし,臓器をつくるとなると3次元的な構造や多岐にわたる構成細胞をin vitroで再現する必要がありきわめて困難であるとされている.そこで筆者らは,多能性幹細胞のもつキメラ形成能を利用した”胚盤胞補完法”(blastocyst complementation)の技術に注目した.胚盤胞補完法とは,特定の細胞系譜を欠損したマウスの胚盤胞に正常な多能性幹細胞を注入しキメラが成立すると欠損した細胞が完全に多能性幹細胞に由来するものに置き換えられるというもので,1993年,Chenらによって,リンパ球を欠損したRag2ノックアウトマウスを用いてその原理が報告された4).筆者らは,この原理を応用し,遺伝的に特定の臓器を欠損したマウスの胚盤胞に多能性幹細胞を注入することでin vivoで多能性幹細胞に由来する臓器がつくれないかと考えた.
1.胚盤胞補完法を利用した多能性幹細胞からの臓器の作製
まず,胚盤胞補完法により臓器がつくれるかどうかを明らかにするため,マウスの多能性幹細胞と膵臓欠損の表現型を示すPdx1ノックアウトマウスを用い5),同種間で多能性幹細胞に由来する膵臓をつくることを試みた(図1).Pdx1は胎仔期における膵臓形成の初期から必須な転写因子として知られ,このノックアウトマウスは膵臓を完全に欠損することから,膵臓という臓器レベルでの空きを多能性幹細胞に由来する細胞に供給できると考えたのである.
Pdx1ノックアウトマウスの胚盤胞に全身でEGFPを発現するEGFPトランスジェニックマウスから樹立したiPS細胞を注入して,仮親の子宮へ移植し,妊娠満期で取り出した新生仔を解析した.その結果,iPS細胞の寄与が認められたPdx1ノックアウトマウスには一様にEGFP蛍光を示す膵臓が存在していた.EGFP陽性細胞の分布と構成細胞の機能マーカーとの相関を組織学的に確認したところ,膵臓を構成する外分泌組織,内分泌組織,膵管のそれぞれがすべてEGFP陽性のiPS細胞に由来する細胞から構成されていた.一方,血管や間質をはじめとしたPdx1遺伝子欠損の影響をうけない組織は,注入した細胞に由来する細胞と胚盤胞に由来する細胞とが混ざったキメラ状態になっていた.
そのような膵臓をもったPdx1ノックアウトマウスは,本来ならば膵臓の欠損により産後1週間以内に致死を示すのに対し,高血糖などの症状を示すことなく成体まで発育した.また,糖負荷試験の結果から正常な耐糖能も獲得しており,iPS細胞に由来する膵臓が生体内で正常に機能していることが明らかとなった.これまでの結果は,EGFPで標識したES細胞を用いた場合でも同様であった.
また,マウスiPS細胞に由来する膵臓から単離した膵島をストレプトゾトシン投与により高血糖を誘発した糖尿病モデルマウスに移植すると2ヶ月以上にわたる長期の生着が認められ,それにともない高血糖症の回復が認められた.さらに,移植後のマウスは糖負荷に対しインスリン分泌による血糖値の回復をみせたことから,移植された膵島が正常な糖応答性をもった機能的なものであることが示唆された.
以上より,マウスを用いた同種間の胚盤胞補完法により,多能性幹細胞に由来する機能的な臓器を作製できることが明らかとなった.
2.マウスおよびラット多能性幹細胞を用いた異種間キメラの成立
筆者らの研究の究極的な目標は,ここで示した原理を応用して特定の臓器を欠損させた大型動物の生体内にヒト多能性幹細胞に由来する臓器を作製することである.そのためには,注入された多能性幹細胞が異種における胚発生に同調・寄与し,その生体内において機能的な組織や臓器をつくりだせるかどうかが重要になる.そこでつぎに,異種間でのキメラ形成能を確認するため,多能性幹細胞を用いたマウス-ラット間の異種間キメラの作製を試みた(図2).
異種間キメラは家畜を用いた先行研究においてその存在が古くから確認されている.たとえば,着床前受精卵を凝集させて作製されたヤギとヒツジのキメラである”ギープ”(geep)は有名な例のひとつである6).一方,マウス-ラット間においては,両者とももっとも汎用な実験動物であり古くから研究がなされていたにもかかわらず,生存可能なキメラ個体の作製には誰も成功していなかった.その理由のひとつに,作製方法として受精卵の凝集法を用いることが不適当であった可能性がある.その方法を用いると栄養外胚葉や原始内胚葉といった胚体外組織もキメラ状態になり,それが子宮内での着床阻害や,のちの胚発生に悪影響をあたえたのかもしれない.しかし,多能性幹細胞は通常の同種間キメラの作製においては胚体外組織への寄与は認められないことから,異種間キメラの作製に適していると考えた.
さきのEGFP標識したマウスiPS細胞をラットの胚盤胞に注入しラットの仮親へ移植,あるいは逆に,新規に樹立したEGFP標識したラットiPS細胞をマウスの胚盤胞に注入しマウスの仮親に移植した.すると,マウスおよびラットのiPS細胞は互いの胚発生に寄与し,出生後も生存可能な異種間キメラの作製に成功した.同じく多能性幹細胞であるES細胞でも同様の結果が得られた.EGFP蛍光を指標に異種のiPS細胞に由来する細胞の分布を確認したところ,ほぼすべての組織においてEGFP陽性細胞の存在が確認された.また,これらキメラの個体サイズは,出生時およびその発育段階において寄与率に応じ多少の影響をうけるものの,おおむね胚盤胞および仮親と同等であった.このことから,胚盤胞に由来する胚体外組織もしくは子宮は個体のサイズをある程度まで制御している可能性が示唆された.
以上より,多能性幹細胞を用いることで世界初のマウス-ラット異種間キメラを双方向から作製することに成功した.そして,注入された多能性幹細胞は異種の環境においても正常に胚発生をへて全身の機能的な細胞に分化できることがわかった.
3.異種間の胚盤胞補完法を用いたマウス生体内へのラット膵臓の作製
以上の2つの知見を組み合わせ,ラットiPS細胞をPdx1ノックアウトマウスの胚盤胞に注入することで,異種間の胚盤胞補完法を介してラットの膵臓をマウスの生体内に作製しようと試みた(図3).その結果,Pdx1ノックアウトマウス生体内に一様にEGFP蛍光を示すラットiPS細胞に由来する膵臓を作製することに成功した.それらは組織学的な解析においても一様にEGFP蛍光を示す細胞で構成されており,膵臓の機能マーカーの発現も認められた.また,このラットiPS細胞に由来する膵臓をもったPdx1ノックアウトマウスは成体まで発育し,正常な耐糖能を獲得していることがわかった.
以上より,筆者らは,異種間の胚盤胞補完法により異種の生体内に多能性幹細胞に由来する機能的な臓器をつくるという原理を証明することに成功した.
おわりに
この研究では,胚盤胞補完法を用いた機能的な臓器の作製,多能性幹細胞を用いたマウス-ラット異種間キメラの成立,この2つを組み合わせることで異種間の胚盤胞補完法を用いたマウス生体内におけるラット膵臓の作製,の3点を示すことができた.これらのことから,多能性幹細胞と胚盤胞のように用いる細胞と胚が時間的・空間的に同期すれば,たとえ異種の環境であっても,発生過程を利用して外から入れた細胞に由来する臓器をつくりだせることがわかった.この原理を応用すれば,患者に由来する多能性幹細胞やそこからin vitroで分化させた細胞を大型動物の個体のなかに適切なタイミングと場所に移植することで,自身の臓器をつくることが可能であると思われる.この研究で証明した原理が臓器再生といった究極的な再生医療ための最初のステップとなることを期待したい.
文 献
- Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S. et al.: Embryonic stem cell lines derived from human blastocysts. Science, 282, 1145-1147 (1998)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Takahashi, K., Tanabe, K., Ohnuki, M. et a.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131, 861-872 (2007)[PubMed]
- Chen, J., Lansford, R., Stewart, V. et al.: RAG-2-deficient blastocyst complementation: an assay of gene function in lymphocyte development. Proc. Natl. Acad. Sci. USA, 90, 4528-4532 (1993)[PubMed]
- Offield, M. F., Jetton, T. L., Labosky, P. A. et al.: PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum. Development, 122, 983-995 (1996)[PubMed]
- Fehilly, C. B., Willadsen, S. M. & Tucker, E. M.: Interspecific chimaerism between sheep and goat. Nature, 307, 634-636 (1984)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院新領域創成科学研究科博士課程 修了,同年より科学技術振興機構 中内幹細胞制御プロジェクト 研究員.
研究テーマ:多能性幹細胞からの臓器再生.
抱負:ラットの膵臓がマウスのなかで光っているのを初めて見たとき,解析する手が震えました.日々の研究生活のなかでごくごくまれに存在するそんな感動を追い求めて,これからも研究を続けていきたいと思います.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2010 小林俊寛・中内啓光 Licensed under CC 表示 2.1 日本