低悪性度のグリオーマにおける遺伝子変異の全体像およびクローン構造の変化
鈴木啓道1・夏目敦至2・小川誠司1
(1京都大学大学院医学研究科 腫瘍生物学講座,2名古屋大学大学院医学系研究科脳神経外科学)
email:鈴木啓道,小川誠司
DOI: 10.7875/first.author.2015.057
Mutational landscape and clonal architecture in grade II and III gliomas.
Hiromichi Suzuki, Kosuke Aoki, Kenichi Chiba, Yusuke Sato, Yusuke Shiozawa, Yuichi Shiraishi, Teppei Shimamura, Atsushi Niida, Kazuya Motomura, Fumiharu Ohka, Takashi Yamamoto, Kuniaki Tanahashi, Melissa Ranjit, Toshihiko Wakabayashi, Tetsuichi Yoshizato, Keisuke Kataoka, Kenichi Yoshida, Yasunobu Nagata, Aiko Sato-Otsubo, Hiroko Tanaka, Masashi Sanada, Yutaka Kondo, Hideo Nakamura, Masahiro Mizoguchi, Tatsuya Abe, Yoshihiro Muragaki, Reiko Watanabe, Ichiro Ito, Satoru Miyano, Atsushi Natsume, Seishi Ogawa
Nature Genetics, 47, 458-468 (2015)
低悪性度のグリオーマは成人に発生する頻度の高い悪性腫瘍である.さまざまな治療法を組み合わせても完治はむずかしく,新規の治療法の開発が望まれているが,遺伝子変異の全体像は解明されていなかった.今回,筆者らは,低悪性度のグリオーマ757例について網羅的に遺伝子変異を解析しその全体像を明らかにした.その結果,遺伝子変異により異なる特徴をもつ3つのタイプに明確に分類されることがわかった.また,腫瘍は高い多様性をもち,複数のサブクローンが独立して進展していた.しかしながら,ドライバー変異の生じる順番にはヒエラルキーが存在し規則性がみられた.
低悪性度のグリオーマは脳に原発する悪性腫瘍の1/4をしめる,頻度の高い悪性の脳腫瘍である.若年者に発症し,緩徐に進行するが浸潤性に増殖するため完治は困難である.初回の治療の数年から十数年のちに悪性度の高い腫瘍として再発し致死的となる.TP53遺伝子変異および第1染色体の短腕と第19染色体の長腕の共欠失が高い頻度で生じるが,これらは排他的に起こることが報告されている.さらに,IDH1遺伝子変異およびIDH2遺伝子変異が約80%に生じることが報告されている1).IDH1遺伝子変異およびIDH2遺伝子変異はもっとも悪性のグリオーマであるグリオブラストーマにおいてはまれであり,同じグリオーマでも生じる遺伝子変異は異なるものと考えられたが,低悪性度のグリオーマにおける遺伝子変異の全体像はこれまで報告されていなかった.今回,筆者らは,日本の332症例に対し網羅的に遺伝子変異を解析し,米国のThe Cancer Genome Atlasが公開している425症例のデータをくわえて合計757症例の低悪性度のグリオーマを解析することにより,遺伝子変異の全体像を明らかにした.さらに,初発および再発の経時的な検体,および,ひとつの腫瘍の空間的に異なる複数の部位からのマルチサンプリング検体も解析することにより,低悪性度のグリオーマの多様性および進展におけるクローン構造の変化も解明した.
すべてのエキソン領域において1症例あたり平均25個の遺伝子変異が確認された.遺伝子変異のパターンはCpG部位におけるCからTへの変異がほとんどをしめた.このパターンはほとんどの悪性腫瘍において認められるもっとも頻度の高いパターンであり,加齢が関与すると考えられている.一部の再発検体ではすべてのエキソン領域に数千個も変異が認められ,これらの検体における変異のパターンはCpT部位あるいはCpC部位におけるCからTへの変異がほとんどをしめていた.これは,悪性の脳腫瘍の治療において第1の選択となる化学療法薬テモゾロマイドによる作用と考えられた2).
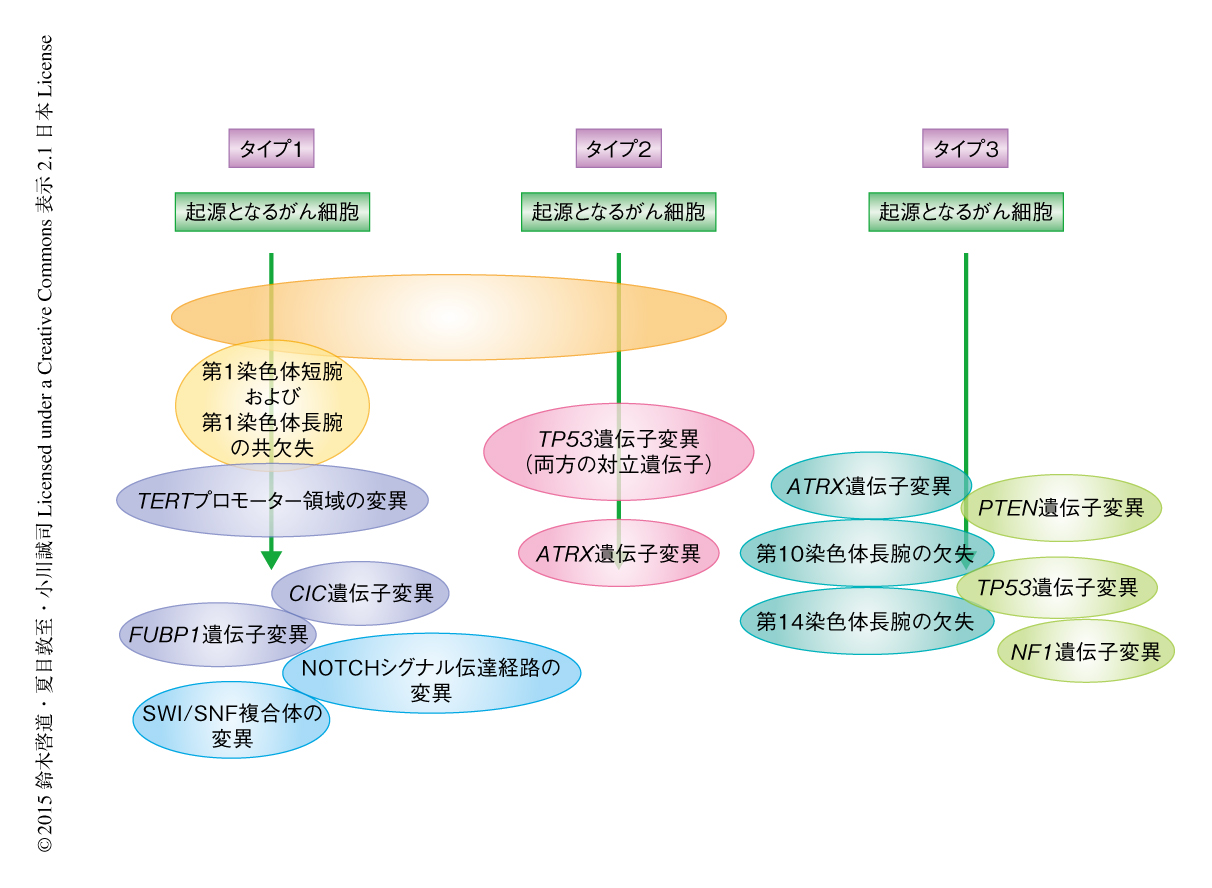
IDH1遺伝子変異およびIDH2遺伝子変異はすべての症例の79%に認められ,過去の報告と同様の結果であった.しかしながら従来は,IDH1遺伝子変異あるいはIDH2遺伝子変異をもつ低悪性度のグリオーマの4~24%ではTP53遺伝子変異と第1染色体短腕と第19染色体長腕の共欠失のどちらも認められないという報告されていた3-5).今回,詳細な解析により従来の手法では同定が困難な構造の異常やイントロン領域の長い欠失を同定することができ,TP53遺伝子変異が感度よく同定された.さらに,第1染色体短腕と第19染色体長腕の共欠失に関しても,第1染色体短腕のセントロメア側と第19染色体長腕のテロメア側の一部のみが欠失する亜型のあることがわかった.これらの結果,IDH1変異あるいはIDH2変異をもつ低悪性度のグリオーマのうち99.7%の症例において,TP53遺伝子変異あるいは第1染色体短腕と第19染色体長腕の共欠失のどちらかが同定された.さらに,第1染色体短腕と第19染色体長腕の共欠失をもたないIDH1遺伝子変異あるいはIDH2遺伝子変異をもつ低悪性度のグリオーマでは98.0%というきわめて高い頻度でTP53遺伝子変異が両方の対立遺伝子に生じていた.TP53遺伝子変異は多くの悪性腫瘍において報告されているが,両方の対立遺伝子での変異がここまで高い頻度で認められる腫瘍はなかった.そして,低悪性度のグリオーマは,タイプ1:IDH1遺伝子変異あるいはIDH2遺伝子変異および第1染色体短腕と第19染色体長腕の共欠失がともに認められる,タイプ2:IDH1遺伝子変異あるいはIDH2遺伝子変異は認められるが第1染色体短腕と第19染色体長腕の共欠失は認められない,タイプ3:IDH1遺伝子変異あるいはIDH2遺伝子変異が認められない,の3つに明確に分けられた.
おのおののタイプで共存しやすい遺伝子変異は異なっていた(図1).さらに,あるタイプに生じやすい遺伝子変異はほかのタイプには生じにくく,相互排他の関係が認められた.既存の報告のとおり,タイプ1ではCIC遺伝子変異,FUBP1遺伝子変異,TERTプロモーター領域の変異が高い頻度で認められた.さらに,NOTCHシグナル伝達経路の構成タンパク質,SWI/SNF複合体,ヒストンメチル化酵素をコードする遺伝子に変異が認められた.過去の報告と同様に,タイプ2ではATRX遺伝子変異が高い頻度で認められた.タイプ3では受容体型チロシンキナーゼをはじめとするRTK-PI3K-mTORシグナル伝達経路の構成タンパク質をコードする遺伝子に変異が多く認められた.発症年齢はタイプ2,タイプ1,タイプ3の順に若く,生命予後はタイプ1,タイプ2,タイプ3の順に良好であり,おのおののタイプのあいだで有意差をもって異なる結果であった.DNAメチル化のパターンは3つのグループに明確に分けられ,遺伝子変異によるタイプと強く相関した.一方,遺伝子発現のパターンは4つのグループに分けられ,そのうち3つのグループは遺伝子変異によるタイプとよく一致した.残るグループにはおのおののタイプが混在し,遺伝子の発現パターンについては神経前駆細胞において高く発現している遺伝子が同様に高く発現していた.タイプ3の遺伝子変異のパターンはグリオブラストーマとよく似ていたが,発症年齢は若く生命予後も有意差をもって良好であった.タイプ3のうち病理学的により悪性度の高いグレード3のみをグリオブラストーマと比較しても有意差が認められた.また,グリオブラストーマも含め遺伝子の発現パターンをクラスタリングしたところ,一定の数のタイプ3だけでクラスターを形成した.病理学的な診断の限界から,タイプ3はグリオブラストーマが混入している可能性は否定できないが,タイプ3はグリオブラストーマとは異なる特徴をもつと考えられた.
このように,遺伝子変異による3つのタイプはそれぞれの特徴をよく反映し,病理学的には同じグリオーマと分類されているが分子生物学的な背景はまったく異なるかのような性質を示すことが明らかにされた.
おのおのの症例においてそれぞれの遺伝子変異の詳細なアレル頻度を比較し,Bradley-Terryモデルを用いることにより遺伝子変異の生じる順番を推測した6)(図1).その結果,タイプ1ではIDH1遺伝子変異およびIDH2遺伝子変異,TERTプロモーター領域の変異,第1染色体短腕と第19染色体長腕の共欠失は初期に生じ,腫瘍の発生において重要な役割をもつ遺伝子変異と考えられた.一方,FUBP1遺伝子変異,CIC遺伝子変異,NOTCH1遺伝子変異,SWI/SNF複合体をコードする遺伝子の変異および,ヒストンメチル化酵素をコードする遺伝子の変異はそれよりのちに生じていると考えられ,腫瘍の進展に重要な役割をもつと考えられた.同様に,タイプ2ではIDH1遺伝子変異およびIDH2遺伝子変異,TP53遺伝子変異は早期に生じており,ATRX遺伝子変異はそれよりもあとに生じていた.タイプ3では症例数の少なさから明確な傾向は得られなかったが,PTEN遺伝子変異,ATRX遺伝子変異,第10染色体長腕の欠失などが比較的早く生じるという結果であった.
このように,低悪性度のグリオーマにおいて,おのおののタイプにおいて遺伝子変異の起こる順番には一定の規則性が認められ,ヒエラルキーの存在することが明らかにされた.
初発および再発の経時的な検体の解析から,遺伝子変異の起こる順番についてはアレル頻度による解析と同様の傾向が認められた.一方,タイプ2の経時的な検体1例において,TP53遺伝子変異がIDH1遺伝子変異より遅れて生じていることが確認された.この結果は,ほかの研究グループからも報告されており,タイプ2においてTP53遺伝子変異はIDH1遺伝子変異およびIDH2遺伝子変異より遅れて生じると考えられた2).
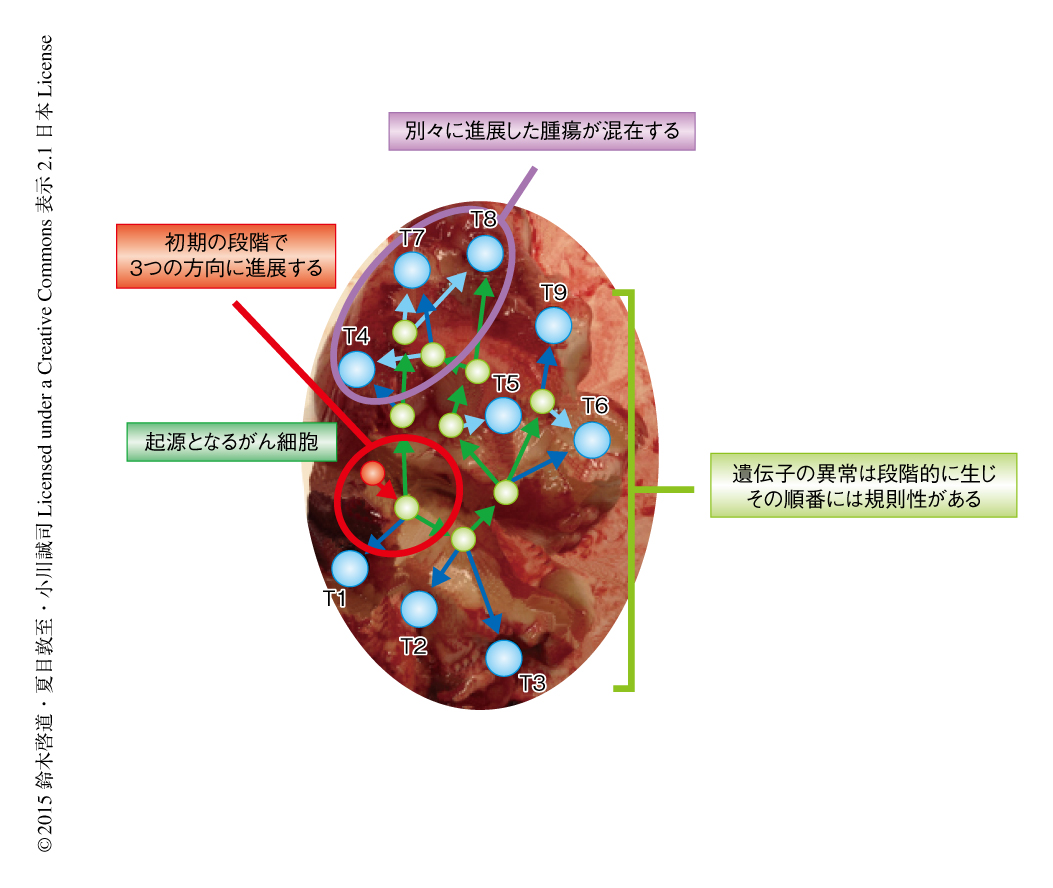
マルチサンプリング検体の解析から,低悪性度のグリオーマは高い多様性をもつことが明らかにされた.ひとつの腫瘍においてすべての部位で確認できる共通の遺伝子変異は全体のたった9.2%しかなく,60%は1箇所でしか確認されない遺伝子変異であり,すでに報告されている腎細胞がんや肺がんと比較しても高い多様性をもつことが確認された7-9).ひとつの腫瘍のなかで同じ遺伝子ではあるが複数の異なった塩基に変異が生じるパラレル変異がCIC遺伝子,FUBP1遺伝子,NOTCH1遺伝子に認められた.一例を示すと,IDH1遺伝子変異,TERTプロモーター領域の変異,第1染色体短腕と第19染色体長腕の共欠失が起こることにより腫瘍が発生し,その直後に,すぐに異なる3つのサブクローンが別々の変異を獲得して進展していた(図2).腫瘍はかなり初期の段階から多様性をもちはじめ,これらのサブクローンはそれぞれ独立してドライバー変異を獲得しながら空間的に連続して進展していた.腫瘍の末梢では異なる進展の形式をとった複数のサブクローンが混在していた.この腫瘍ではCIC遺伝子に5箇所のパラレル変異,FUBP1遺伝子に2箇所のパラレル変異が認められ,複雑な構成をもつ腫瘍であることがわかった.
この研究においては,世界で最大の規模で網羅的に遺伝子変異を解析することにより,低悪性度のグリオーマにおける遺伝子変異の全体像を明らかにした.近年,遺伝子解析技術の革新的な進歩により悪性腫瘍における遺伝子変異が大規模に解析されているが,報告のほとんどは欧米の大規模なセンターからであり,わが国からこのような最大規模の網羅的な遺伝子解析が発信されることは意義深い.低悪性度のグリオーマはいまだ治療が困難な疾患であるが,今回,遺伝子変異の全体像が明らかにされ,それぞれの遺伝子変異の役割が解明されたことは,今後のあらゆる研究のいしずえとなり,新たな分類方法や治療法の開発はもちろん,ゲノム変異にもとづいた治療法や薬剤の選択,すなわち,オーダーメイド医療の実現がより進むことが期待されると考えている.
略歴:京都大学大学院医学研究科 研究員.
研究テーマ:悪性脳腫瘍.
夏目 敦至(Atsushi Natsume)
名古屋大学大学院医学系研究科 准教授.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
© 2015 鈴木啓道・夏目敦至・小川誠司 Licensed under CC 表示 2.1 日本
(1京都大学大学院医学研究科 腫瘍生物学講座,2名古屋大学大学院医学系研究科脳神経外科学)
email:鈴木啓道,小川誠司
DOI: 10.7875/first.author.2015.057
Mutational landscape and clonal architecture in grade II and III gliomas.
Hiromichi Suzuki, Kosuke Aoki, Kenichi Chiba, Yusuke Sato, Yusuke Shiozawa, Yuichi Shiraishi, Teppei Shimamura, Atsushi Niida, Kazuya Motomura, Fumiharu Ohka, Takashi Yamamoto, Kuniaki Tanahashi, Melissa Ranjit, Toshihiko Wakabayashi, Tetsuichi Yoshizato, Keisuke Kataoka, Kenichi Yoshida, Yasunobu Nagata, Aiko Sato-Otsubo, Hiroko Tanaka, Masashi Sanada, Yutaka Kondo, Hideo Nakamura, Masahiro Mizoguchi, Tatsuya Abe, Yoshihiro Muragaki, Reiko Watanabe, Ichiro Ito, Satoru Miyano, Atsushi Natsume, Seishi Ogawa
Nature Genetics, 47, 458-468 (2015)
要 約
低悪性度のグリオーマは成人に発生する頻度の高い悪性腫瘍である.さまざまな治療法を組み合わせても完治はむずかしく,新規の治療法の開発が望まれているが,遺伝子変異の全体像は解明されていなかった.今回,筆者らは,低悪性度のグリオーマ757例について網羅的に遺伝子変異を解析しその全体像を明らかにした.その結果,遺伝子変異により異なる特徴をもつ3つのタイプに明確に分類されることがわかった.また,腫瘍は高い多様性をもち,複数のサブクローンが独立して進展していた.しかしながら,ドライバー変異の生じる順番にはヒエラルキーが存在し規則性がみられた.
はじめに
低悪性度のグリオーマは脳に原発する悪性腫瘍の1/4をしめる,頻度の高い悪性の脳腫瘍である.若年者に発症し,緩徐に進行するが浸潤性に増殖するため完治は困難である.初回の治療の数年から十数年のちに悪性度の高い腫瘍として再発し致死的となる.TP53遺伝子変異および第1染色体の短腕と第19染色体の長腕の共欠失が高い頻度で生じるが,これらは排他的に起こることが報告されている.さらに,IDH1遺伝子変異およびIDH2遺伝子変異が約80%に生じることが報告されている1).IDH1遺伝子変異およびIDH2遺伝子変異はもっとも悪性のグリオーマであるグリオブラストーマにおいてはまれであり,同じグリオーマでも生じる遺伝子変異は異なるものと考えられたが,低悪性度のグリオーマにおける遺伝子変異の全体像はこれまで報告されていなかった.今回,筆者らは,日本の332症例に対し網羅的に遺伝子変異を解析し,米国のThe Cancer Genome Atlasが公開している425症例のデータをくわえて合計757症例の低悪性度のグリオーマを解析することにより,遺伝子変異の全体像を明らかにした.さらに,初発および再発の経時的な検体,および,ひとつの腫瘍の空間的に異なる複数の部位からのマルチサンプリング検体も解析することにより,低悪性度のグリオーマの多様性および進展におけるクローン構造の変化も解明した.
1.低悪性度のグリオーマにおける遺伝子変異
すべてのエキソン領域において1症例あたり平均25個の遺伝子変異が確認された.遺伝子変異のパターンはCpG部位におけるCからTへの変異がほとんどをしめた.このパターンはほとんどの悪性腫瘍において認められるもっとも頻度の高いパターンであり,加齢が関与すると考えられている.一部の再発検体ではすべてのエキソン領域に数千個も変異が認められ,これらの検体における変異のパターンはCpT部位あるいはCpC部位におけるCからTへの変異がほとんどをしめていた.これは,悪性の脳腫瘍の治療において第1の選択となる化学療法薬テモゾロマイドによる作用と考えられた2).
IDH1遺伝子変異およびIDH2遺伝子変異はすべての症例の79%に認められ,過去の報告と同様の結果であった.しかしながら従来は,IDH1遺伝子変異あるいはIDH2遺伝子変異をもつ低悪性度のグリオーマの4~24%ではTP53遺伝子変異と第1染色体短腕と第19染色体長腕の共欠失のどちらも認められないという報告されていた3-5).今回,詳細な解析により従来の手法では同定が困難な構造の異常やイントロン領域の長い欠失を同定することができ,TP53遺伝子変異が感度よく同定された.さらに,第1染色体短腕と第19染色体長腕の共欠失に関しても,第1染色体短腕のセントロメア側と第19染色体長腕のテロメア側の一部のみが欠失する亜型のあることがわかった.これらの結果,IDH1変異あるいはIDH2変異をもつ低悪性度のグリオーマのうち99.7%の症例において,TP53遺伝子変異あるいは第1染色体短腕と第19染色体長腕の共欠失のどちらかが同定された.さらに,第1染色体短腕と第19染色体長腕の共欠失をもたないIDH1遺伝子変異あるいはIDH2遺伝子変異をもつ低悪性度のグリオーマでは98.0%というきわめて高い頻度でTP53遺伝子変異が両方の対立遺伝子に生じていた.TP53遺伝子変異は多くの悪性腫瘍において報告されているが,両方の対立遺伝子での変異がここまで高い頻度で認められる腫瘍はなかった.そして,低悪性度のグリオーマは,タイプ1:IDH1遺伝子変異あるいはIDH2遺伝子変異および第1染色体短腕と第19染色体長腕の共欠失がともに認められる,タイプ2:IDH1遺伝子変異あるいはIDH2遺伝子変異は認められるが第1染色体短腕と第19染色体長腕の共欠失は認められない,タイプ3:IDH1遺伝子変異あるいはIDH2遺伝子変異が認められない,の3つに明確に分けられた.
2.統合的な解析およびおのおののタイプの特徴
おのおののタイプで共存しやすい遺伝子変異は異なっていた(図1).さらに,あるタイプに生じやすい遺伝子変異はほかのタイプには生じにくく,相互排他の関係が認められた.既存の報告のとおり,タイプ1ではCIC遺伝子変異,FUBP1遺伝子変異,TERTプロモーター領域の変異が高い頻度で認められた.さらに,NOTCHシグナル伝達経路の構成タンパク質,SWI/SNF複合体,ヒストンメチル化酵素をコードする遺伝子に変異が認められた.過去の報告と同様に,タイプ2ではATRX遺伝子変異が高い頻度で認められた.タイプ3では受容体型チロシンキナーゼをはじめとするRTK-PI3K-mTORシグナル伝達経路の構成タンパク質をコードする遺伝子に変異が多く認められた.発症年齢はタイプ2,タイプ1,タイプ3の順に若く,生命予後はタイプ1,タイプ2,タイプ3の順に良好であり,おのおののタイプのあいだで有意差をもって異なる結果であった.DNAメチル化のパターンは3つのグループに明確に分けられ,遺伝子変異によるタイプと強く相関した.一方,遺伝子発現のパターンは4つのグループに分けられ,そのうち3つのグループは遺伝子変異によるタイプとよく一致した.残るグループにはおのおののタイプが混在し,遺伝子の発現パターンについては神経前駆細胞において高く発現している遺伝子が同様に高く発現していた.タイプ3の遺伝子変異のパターンはグリオブラストーマとよく似ていたが,発症年齢は若く生命予後も有意差をもって良好であった.タイプ3のうち病理学的により悪性度の高いグレード3のみをグリオブラストーマと比較しても有意差が認められた.また,グリオブラストーマも含め遺伝子の発現パターンをクラスタリングしたところ,一定の数のタイプ3だけでクラスターを形成した.病理学的な診断の限界から,タイプ3はグリオブラストーマが混入している可能性は否定できないが,タイプ3はグリオブラストーマとは異なる特徴をもつと考えられた.
このように,遺伝子変異による3つのタイプはそれぞれの特徴をよく反映し,病理学的には同じグリオーマと分類されているが分子生物学的な背景はまったく異なるかのような性質を示すことが明らかにされた.
3.遺伝子変異の生じる順番
おのおのの症例においてそれぞれの遺伝子変異の詳細なアレル頻度を比較し,Bradley-Terryモデルを用いることにより遺伝子変異の生じる順番を推測した6)(図1).その結果,タイプ1ではIDH1遺伝子変異およびIDH2遺伝子変異,TERTプロモーター領域の変異,第1染色体短腕と第19染色体長腕の共欠失は初期に生じ,腫瘍の発生において重要な役割をもつ遺伝子変異と考えられた.一方,FUBP1遺伝子変異,CIC遺伝子変異,NOTCH1遺伝子変異,SWI/SNF複合体をコードする遺伝子の変異および,ヒストンメチル化酵素をコードする遺伝子の変異はそれよりのちに生じていると考えられ,腫瘍の進展に重要な役割をもつと考えられた.同様に,タイプ2ではIDH1遺伝子変異およびIDH2遺伝子変異,TP53遺伝子変異は早期に生じており,ATRX遺伝子変異はそれよりもあとに生じていた.タイプ3では症例数の少なさから明確な傾向は得られなかったが,PTEN遺伝子変異,ATRX遺伝子変異,第10染色体長腕の欠失などが比較的早く生じるという結果であった.
このように,低悪性度のグリオーマにおいて,おのおののタイプにおいて遺伝子変異の起こる順番には一定の規則性が認められ,ヒエラルキーの存在することが明らかにされた.
4.腫瘍のなかでの多様性およびクローン構造の変化
初発および再発の経時的な検体の解析から,遺伝子変異の起こる順番についてはアレル頻度による解析と同様の傾向が認められた.一方,タイプ2の経時的な検体1例において,TP53遺伝子変異がIDH1遺伝子変異より遅れて生じていることが確認された.この結果は,ほかの研究グループからも報告されており,タイプ2においてTP53遺伝子変異はIDH1遺伝子変異およびIDH2遺伝子変異より遅れて生じると考えられた2).
マルチサンプリング検体の解析から,低悪性度のグリオーマは高い多様性をもつことが明らかにされた.ひとつの腫瘍においてすべての部位で確認できる共通の遺伝子変異は全体のたった9.2%しかなく,60%は1箇所でしか確認されない遺伝子変異であり,すでに報告されている腎細胞がんや肺がんと比較しても高い多様性をもつことが確認された7-9).ひとつの腫瘍のなかで同じ遺伝子ではあるが複数の異なった塩基に変異が生じるパラレル変異がCIC遺伝子,FUBP1遺伝子,NOTCH1遺伝子に認められた.一例を示すと,IDH1遺伝子変異,TERTプロモーター領域の変異,第1染色体短腕と第19染色体長腕の共欠失が起こることにより腫瘍が発生し,その直後に,すぐに異なる3つのサブクローンが別々の変異を獲得して進展していた(図2).腫瘍はかなり初期の段階から多様性をもちはじめ,これらのサブクローンはそれぞれ独立してドライバー変異を獲得しながら空間的に連続して進展していた.腫瘍の末梢では異なる進展の形式をとった複数のサブクローンが混在していた.この腫瘍ではCIC遺伝子に5箇所のパラレル変異,FUBP1遺伝子に2箇所のパラレル変異が認められ,複雑な構成をもつ腫瘍であることがわかった.
おわりに
この研究においては,世界で最大の規模で網羅的に遺伝子変異を解析することにより,低悪性度のグリオーマにおける遺伝子変異の全体像を明らかにした.近年,遺伝子解析技術の革新的な進歩により悪性腫瘍における遺伝子変異が大規模に解析されているが,報告のほとんどは欧米の大規模なセンターからであり,わが国からこのような最大規模の網羅的な遺伝子解析が発信されることは意義深い.低悪性度のグリオーマはいまだ治療が困難な疾患であるが,今回,遺伝子変異の全体像が明らかにされ,それぞれの遺伝子変異の役割が解明されたことは,今後のあらゆる研究のいしずえとなり,新たな分類方法や治療法の開発はもちろん,ゲノム変異にもとづいた治療法や薬剤の選択,すなわち,オーダーメイド医療の実現がより進むことが期待されると考えている.
文 献
- Yan, H., Parsons, D. W., Jin, G. et al.: IDH1 and IDH2 mutations in gliomas. N. Engl. J. Med., 360, 765-773 (2009)[PubMed]
- Johnson, B. E., Mazor, T., Hong, C. et al.: Mutational analysis reveals the origin and therapy-driven evolution of recurrent glioma. Science, 343, 189-193 (2014)[PubMed]
- Jiao, Y., Killela, P. J., Reitman, Z. J. et al.: Frequent ATRX, CIC, FUBP1 and IDH1 mutations refine the classification of malignant gliomas. Oncotarget, 3, 709-722 (2012)[PubMed]
- Watanabe, T., Nobusawa, S., Kleihues, P. et al.: IDH1 mutations are early events in the development of astrocytomas and oligodendrogliomas. Am. J. Pathol., 174, 1149-1153 (2009)[PubMed]
- Killela, P. J., Reitman, Z. J., Jiao, Y. et al.: TERT promoter mutations occur frequently in gliomas and a subset of tumors derived from cells with low rates of self-renewal. Proc. Natl. Acad. Sci. USA, 110, 6021-6026 (2013)[PubMed]
- Lancaster, J. F. & Quade, D.: Random effects in paired-comparison experiments using the Bradley-Terry model. Biometrics, 39, 245-249 (1983)[PubMed]
- Gerlinger, M., Horswell, S., Larkin, J. et al.: Genomic architecture and evolution of clear cell renal cell carcinomas defined by multiregion sequencing. Nat. Genet., 46, 225-233 (2014)[PubMed]
- Zhang, J., Fujimoto, J., Zhang, J. et al.: Intratumor heterogeneity in localized lung adenocarcinomas delineated by multiregion sequencing. Science, 346, 256-259 (2014)[PubMed]
- de Bruin, E. C., McGranahan, N., Mitter, R. et al.: Spatial and temporal diversity in genomic instability processes defines lung cancer evolution. Science, 346, 251-256 (2014)[PubMed]
著者プロフィール
略歴:京都大学大学院医学研究科 研究員.
研究テーマ:悪性脳腫瘍.
夏目 敦至(Atsushi Natsume)
名古屋大学大学院医学系研究科 准教授.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
© 2015 鈴木啓道・夏目敦至・小川誠司 Licensed under CC 表示 2.1 日本