後シナプスニューロンの神経活動に依存的なフィードバックシグナルを介したショウジョウバエの視細胞における活性帯の構成タンパク質の再編成
杉江 淳1・Gaia Tavosanis 1・鈴木崇之2
(1ドイツGerman Center for Neurodegenerative Diseases,Dendrite Differentiation,2東京工業大学大学院生命理工学研究科 発生神経遺伝学)
email:杉江 淳,鈴木崇之
DOI: 10.7875/first.author.2015.056
Molecular remodeling of the presynaptic active zone of Drosophila photoreceptors via activity-dependent feedback.
Atsushi Sugie, Satoko Hakeda-Suzuki, Emiko Suzuki, Marion Silies, Mai Shimozono, Christoph Möhl, Takashi Suzuki, Gaia Tavosanis
Neuron, 86, 711-725 (2015)
生物はシナプスの可塑的な変化により神経ネットワークのあいだの結びつきや強度を変えることで異なる環境に適応している.しかしながら,シナプスの可塑性を獲得するため前シナプスにおいて神経伝達物質の放出量やタイミングを制御すると考えられている活性帯において,何が起こっているのかはほとんど知られていない.筆者らは,この研究において,ショウジョウバエの視細胞において自然光の長時間の曝露により活性帯が可逆的に解体されることを発見した.この活性帯の解体においては,活性帯を構成する主要なタンパク質であるBrpを含む3つのタンパク質の局在は低下しシナプスの数は減少したが,ほかの2つのタンパク質の局在に変化はなかった.この現象は可逆的であるため,シナプスの解体を部分的にとどめることにより再編成を容易にしていると考えられた.そして,活性帯の再編成には視細胞の発火だけでなく後シナプスニューロンにおける神経活動の有無が重要であったことから,フィードバックシグナルの存在が示唆された.このフィードバックシグナルを探索したところ,細胞骨格である微小管を制御することが知られている分岐型古典的Wnt経路が神経活動のもとでの活性帯の再編成に必要であることを特定した.さらに,Kinesin-3/Unc-104のショウジョウバエにおけるホモログであるImacが微小管のダイナミックな再構成および活性帯の再編成に関与する可能性が示唆された.
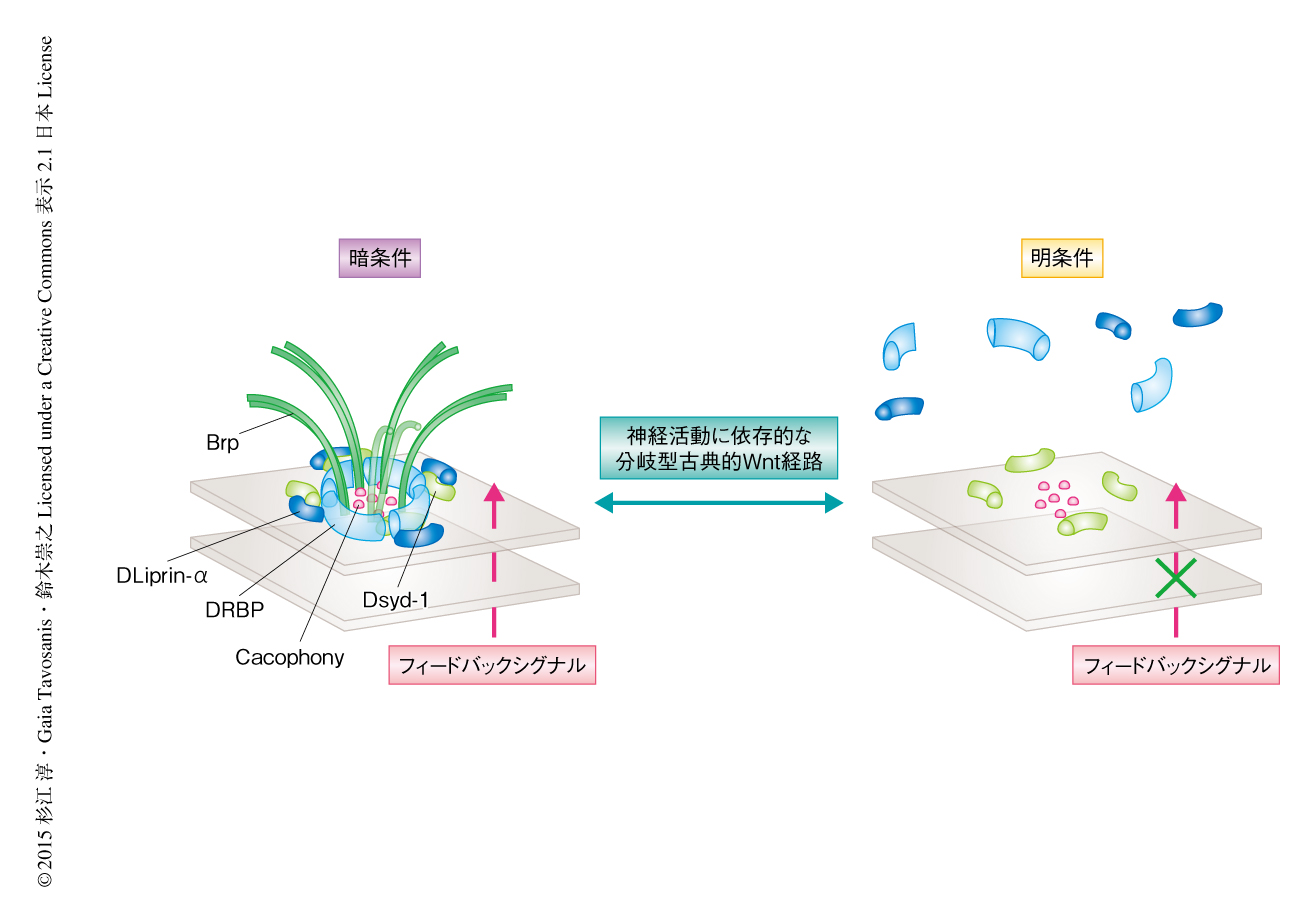
脳が活動するために必要なシグナル伝達はニューロンどうしをつなぐシナプスにおいて神経伝達物質を介し行われている.神経伝達物質は前シナプスに集積するシナプス小胞に含まれ,シナプス小胞は細胞膜に融合すると神経伝達物質を放出する.前シナプスの細胞膜において電子顕微鏡により高い電子密度の観察される特殊な場は活性帯とよばれ,シナプスにおけるシグナル伝達の場所とタイミングを決める重要な構造であると考えられている.活性帯には神経伝達物質の放出を制御するのに重要なタンパク質が局在し複合体を形成している.Brp/CAST/ELKSファミリーのBrpは活性帯を構成する主要なタンパク質であり,シナプス小胞をC末端につなぎとめる役割をもつ1).Brpの機能を欠失した変異体ではCa2+チャネルのサブユニットであるCacophonyの活性帯における濃度が低下し神経伝達物質の放出が減少する2).そのほかの活性帯の構成タンパク質としては,RBPのショウジョウバエにおけるホモログであるDRBPや3),Syd-1のショウジョウバエにおけるホモログであるDSyd-1が知られている4).とくに,DSyd-1は活性帯の形成において早い段階で局在しはじめ,Brpだけでなく,活性帯の大きさの決定に重要なDLiprin-αもリクルートする5).
最近,マウスあるいはラットの培養神経細胞系での実験などにおいて,神経活動のレベルがこれら活性帯の構成タンパク質を変化させシナプスの機能を制御することが示唆されている6-8).筆者らは,この神経活動に依存的に活性帯の構成タンパク質を制御しシナプスの可塑性を誘導する現象が実際に自然な刺激に対し生体において起こることを示し,さらに,それを制御する分子機構を解明することをめざした.実験対象として,ひとつひとつの活性帯を観察でき神経活動を簡便に操作できるショウジョウバエのR8視細胞を用いた.
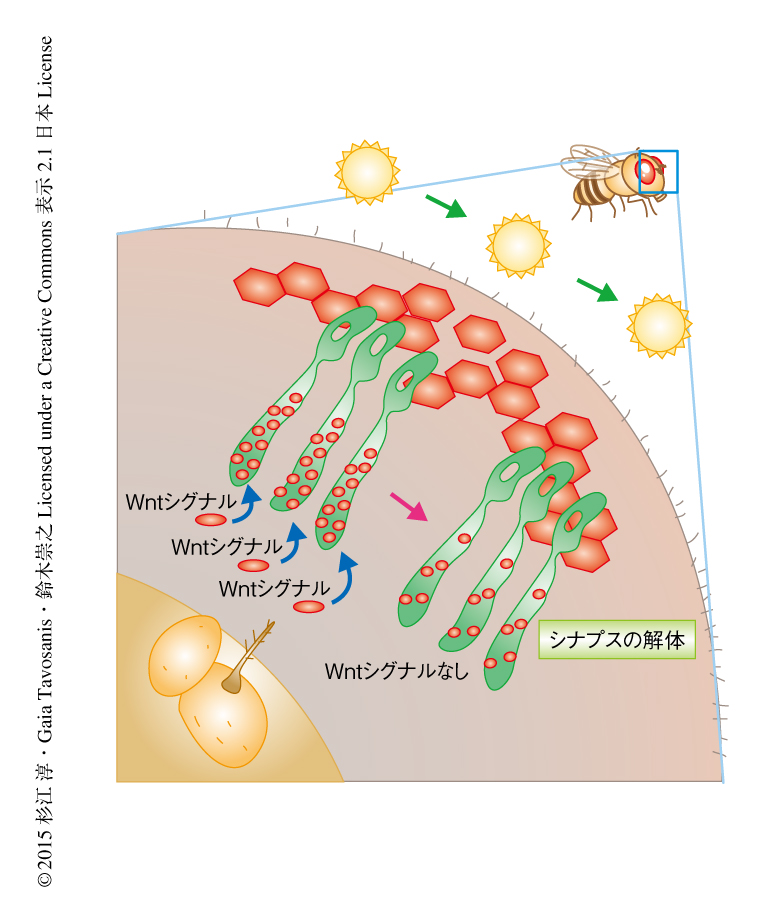
ひとつの神経軸索の終末が容易に観察できるR8視細胞に着目し,STaR(synaptic tagging with recombination)系を用い9),GFPにより活性帯の主要な構成タンパク質であるBrpを標識することで可視化した.このSTaR系によりはじめて,特異的な細胞において内在性の発現レベルでシナプスを観察することができるようになった. R8視細胞の軸索終末においてBrpはドット状に局在し,R8視細胞の1本1本の軸索末端の活性帯の数を定量することが可能になった(図1).視細胞は感覚ニューロンであるため,異なる光環境におくだけで神経活動のレベルを操作することができる.視細胞の活性帯の構成タンパク質が自然光の長時間の曝露によりうける影響について調べるため,羽化したショウジョウバエを暗条件,12時間の明条件-12時間の暗条件,明条件の異なる光条件に1~3日間おいた.その結果,暗条件あるいは12時間の明条件-12時間の暗条件と比べ,明条件においてBrpを含む活性帯の数は減少していた(図1).明条件から暗条件に12時間おくことにより減少したBrpの数はもとにもどったことから,継続的な光の刺激はBrpの局在と解離を可逆的に制御することが明らかにされた.
長時間の光の刺激によるBrpの局在の変化は,そのほかの活性帯の構成タンパク質にも起こっている可能性が考えられた.そのため,活性帯の構成タンパク質であるDLiprin-α,DRBP,DSyd-1,CacophonyをGFPにより標識しR8視細胞において観察した.その結果,どのタンパク質も12時間の明条件-12時間の暗条件においてBrpと基本的に共局在した.そして,明条件においてはDLiprin-αあるいはDRBPを含む活性帯の数が減少した.対照的に,DSyd-1およびCacophonyは長時間の光の刺激においても局在のパターンは変化しなかった(図2).以上から,継続的な自然光への曝露は視細胞における活性帯の解体をひき起こすことが明らかにされた.
光の刺激がどのような過程をへて視細胞における活性帯の解体につながるのかを調べるため,光に対する視細胞の反応を阻害したときの影響について調べた.その結果,視細胞における神経活動は活性帯からのBrpの解離に必要かつ十分であることが示された.R8視細胞において神経伝達物質の放出を阻害するダイナミンの温度感受性優勢変異体を発現させると,明条件におけるBrpの解離が抑制された.この状況では視細胞における神経活動は操作されていないため,後シナプスニューロンにおける神経活動の活性帯の再編成に対する関与が示唆された.視細胞はヒスタミンを神経伝達物質として利用することから,その受容体であるヒスタミンCl-チャネルの変異体を観察した結果,明条件における活性帯の解体は抑制されていた.ヒスタミンCl-チャネルはヒスタミンを受容すると過分極が促進される.そのことから,後シナプスニューロンの強制的な脱分極により視細胞における明条件での活性帯の解体が抑制されるのではないかと仮説をたてた.実際に,ヒスタミンCl-チャネルをもつニューロンを活性化すると,視細胞において明条件でも活性帯に局在するBrpの数が維持された.これらの結果から,後シナプスニューロンのフィードバックシグナルが視細胞における活性帯の再編成を制御することが示された(図2).
視細胞において活性帯の構成タンパク質を制御するフィードバックシグナルを探索したところ,分岐型古典的Wnt経路10) が特定された.分岐型古典的Wnt経路は,Wnt受容体からGSK3βまでは標準的な古典的Wnt経路を介するが,βカテニンなどにより核を介すことなく直接に微小管結合タンパク質に作用する.機能欠失変異体などにより分岐型古典的Wnt経路を阻害した結果,12時間の明条件-12時間の暗条件においても活性帯の解体が起こったことから,分岐型古典的Wnt経路は視細胞の活性帯においてBrpの局在を維持するはたらきをもつと考えられた.分岐型古典的Wnt経路が光の刺激の下流においてはたらくかどうかを調べるため,活性帯の解体が起こる明条件において分岐型古典的Wnt経路を強制的に活性化したところ,活性帯からのBrpの解離は抑制された.さらに,ヒスタミンCl-チャネルをもつニューロンを活性化させると,WNT1のショウジョウバエにおけるホモログであるWinglessの,視細胞にそうような内在性のシグナルが検出された.以上の結果から,光の刺激による神経活動に依存的な分岐型古典的Wnt経路は,視細胞における活性帯の再編成において重要な役割を担うことが明らかにされた(図2).
分岐型古典的Wnt経路の下流にある,MAP1BのショウジョウバエにおけるホモログであるFutschは,チューブリンに結合し微小管の安定性を高める.そこで,微小管の状態が活性帯の再編成に影響をあたえる可能性について考えた.この仮説を検証するため,R8視細胞において微小管を切断するSpastinを発現させたところ,微小管を不安定化させるだけで活性帯からのBrpの解離が誘導されることがわかった.R8視細胞においてKinesin-3/Unc-104のショウジョウバエにおけるホモログであるImacを過剰に発現させることによっても活性帯の解体は誘導され,また,RNAi法によるImacのノックダウンにより視細胞における明条件での活性帯の解体が抑制されたことから,Imacが微小管の制御および活性帯の可逆的な再編成に関与していることが示唆された.
中枢シナプスの可塑性の分子機構のひとつがWnt経路だとわかったことにより,ニューロンの細胞死からの保護への道がひらけてきたと期待している.継続的な神経活動によりニューロンにおけるCa2+の濃度が上昇し,その結果,神経変性をまねくことが知られている11).しかしながら,慢性的なストレスから起こる興奮毒性からニューロンを保護する機構についてはわかっていない.また,神経変性疾患においても,異常なタンパク質の凝集が起こるずっとまえからシナプスには異常が発生していると考えられはじめている.可塑的な活性帯の再編成はニューロンを持続的な興奮毒性から保護する役割をもつ可能性があるため,この分子機構を利用しニューロンの細胞死の抑制を試みようと考えている.
略歴:2010年 東京大学大学院理学系研究科 修了,同年 ドイツMax Planck Institute of Neurobiologyポスドクを経て,2011年よりドイツGerman Center for Neurodegenerative Diseasesポスドク.
研究テーマ:シナプスの可塑性の機構.
Gaia Tavosanis
ドイツGerman Center for Neurodegenerative Diseasesにてグループリーダー.
研究室URL:http://www.dzne.de/en/sites/bonn/research-groups/tavosanis.html
鈴木 崇之(Takashi Suzuki)
東京工業大学大学院生命理工学研究科 准教授.
研究室URL:http://www.suzukit.bio.titech.ac.jp/japanese/index.html
© 2015 杉江 淳・Gaia Tavosanis・鈴木崇之 Licensed under CC 表示 2.1 日本
(1ドイツGerman Center for Neurodegenerative Diseases,Dendrite Differentiation,2東京工業大学大学院生命理工学研究科 発生神経遺伝学)
email:杉江 淳,鈴木崇之
DOI: 10.7875/first.author.2015.056
Molecular remodeling of the presynaptic active zone of Drosophila photoreceptors via activity-dependent feedback.
Atsushi Sugie, Satoko Hakeda-Suzuki, Emiko Suzuki, Marion Silies, Mai Shimozono, Christoph Möhl, Takashi Suzuki, Gaia Tavosanis
Neuron, 86, 711-725 (2015)
要 約
生物はシナプスの可塑的な変化により神経ネットワークのあいだの結びつきや強度を変えることで異なる環境に適応している.しかしながら,シナプスの可塑性を獲得するため前シナプスにおいて神経伝達物質の放出量やタイミングを制御すると考えられている活性帯において,何が起こっているのかはほとんど知られていない.筆者らは,この研究において,ショウジョウバエの視細胞において自然光の長時間の曝露により活性帯が可逆的に解体されることを発見した.この活性帯の解体においては,活性帯を構成する主要なタンパク質であるBrpを含む3つのタンパク質の局在は低下しシナプスの数は減少したが,ほかの2つのタンパク質の局在に変化はなかった.この現象は可逆的であるため,シナプスの解体を部分的にとどめることにより再編成を容易にしていると考えられた.そして,活性帯の再編成には視細胞の発火だけでなく後シナプスニューロンにおける神経活動の有無が重要であったことから,フィードバックシグナルの存在が示唆された.このフィードバックシグナルを探索したところ,細胞骨格である微小管を制御することが知られている分岐型古典的Wnt経路が神経活動のもとでの活性帯の再編成に必要であることを特定した.さらに,Kinesin-3/Unc-104のショウジョウバエにおけるホモログであるImacが微小管のダイナミックな再構成および活性帯の再編成に関与する可能性が示唆された.
はじめに
脳が活動するために必要なシグナル伝達はニューロンどうしをつなぐシナプスにおいて神経伝達物質を介し行われている.神経伝達物質は前シナプスに集積するシナプス小胞に含まれ,シナプス小胞は細胞膜に融合すると神経伝達物質を放出する.前シナプスの細胞膜において電子顕微鏡により高い電子密度の観察される特殊な場は活性帯とよばれ,シナプスにおけるシグナル伝達の場所とタイミングを決める重要な構造であると考えられている.活性帯には神経伝達物質の放出を制御するのに重要なタンパク質が局在し複合体を形成している.Brp/CAST/ELKSファミリーのBrpは活性帯を構成する主要なタンパク質であり,シナプス小胞をC末端につなぎとめる役割をもつ1).Brpの機能を欠失した変異体ではCa2+チャネルのサブユニットであるCacophonyの活性帯における濃度が低下し神経伝達物質の放出が減少する2).そのほかの活性帯の構成タンパク質としては,RBPのショウジョウバエにおけるホモログであるDRBPや3),Syd-1のショウジョウバエにおけるホモログであるDSyd-1が知られている4).とくに,DSyd-1は活性帯の形成において早い段階で局在しはじめ,Brpだけでなく,活性帯の大きさの決定に重要なDLiprin-αもリクルートする5).
最近,マウスあるいはラットの培養神経細胞系での実験などにおいて,神経活動のレベルがこれら活性帯の構成タンパク質を変化させシナプスの機能を制御することが示唆されている6-8).筆者らは,この神経活動に依存的に活性帯の構成タンパク質を制御しシナプスの可塑性を誘導する現象が実際に自然な刺激に対し生体において起こることを示し,さらに,それを制御する分子機構を解明することをめざした.実験対象として,ひとつひとつの活性帯を観察でき神経活動を簡便に操作できるショウジョウバエのR8視細胞を用いた.
1.自然光の長時間の曝露による活性帯構成タンパク質の局在の変化
ひとつの神経軸索の終末が容易に観察できるR8視細胞に着目し,STaR(synaptic tagging with recombination)系を用い9),GFPにより活性帯の主要な構成タンパク質であるBrpを標識することで可視化した.このSTaR系によりはじめて,特異的な細胞において内在性の発現レベルでシナプスを観察することができるようになった. R8視細胞の軸索終末においてBrpはドット状に局在し,R8視細胞の1本1本の軸索末端の活性帯の数を定量することが可能になった(図1).視細胞は感覚ニューロンであるため,異なる光環境におくだけで神経活動のレベルを操作することができる.視細胞の活性帯の構成タンパク質が自然光の長時間の曝露によりうける影響について調べるため,羽化したショウジョウバエを暗条件,12時間の明条件-12時間の暗条件,明条件の異なる光条件に1~3日間おいた.その結果,暗条件あるいは12時間の明条件-12時間の暗条件と比べ,明条件においてBrpを含む活性帯の数は減少していた(図1).明条件から暗条件に12時間おくことにより減少したBrpの数はもとにもどったことから,継続的な光の刺激はBrpの局在と解離を可逆的に制御することが明らかにされた.
長時間の光の刺激によるBrpの局在の変化は,そのほかの活性帯の構成タンパク質にも起こっている可能性が考えられた.そのため,活性帯の構成タンパク質であるDLiprin-α,DRBP,DSyd-1,CacophonyをGFPにより標識しR8視細胞において観察した.その結果,どのタンパク質も12時間の明条件-12時間の暗条件においてBrpと基本的に共局在した.そして,明条件においてはDLiprin-αあるいはDRBPを含む活性帯の数が減少した.対照的に,DSyd-1およびCacophonyは長時間の光の刺激においても局在のパターンは変化しなかった(図2).以上から,継続的な自然光への曝露は視細胞における活性帯の解体をひき起こすことが明らかにされた.
2.後シナプスニューロンの興奮によるフィードバックシグナル
光の刺激がどのような過程をへて視細胞における活性帯の解体につながるのかを調べるため,光に対する視細胞の反応を阻害したときの影響について調べた.その結果,視細胞における神経活動は活性帯からのBrpの解離に必要かつ十分であることが示された.R8視細胞において神経伝達物質の放出を阻害するダイナミンの温度感受性優勢変異体を発現させると,明条件におけるBrpの解離が抑制された.この状況では視細胞における神経活動は操作されていないため,後シナプスニューロンにおける神経活動の活性帯の再編成に対する関与が示唆された.視細胞はヒスタミンを神経伝達物質として利用することから,その受容体であるヒスタミンCl-チャネルの変異体を観察した結果,明条件における活性帯の解体は抑制されていた.ヒスタミンCl-チャネルはヒスタミンを受容すると過分極が促進される.そのことから,後シナプスニューロンの強制的な脱分極により視細胞における明条件での活性帯の解体が抑制されるのではないかと仮説をたてた.実際に,ヒスタミンCl-チャネルをもつニューロンを活性化すると,視細胞において明条件でも活性帯に局在するBrpの数が維持された.これらの結果から,後シナプスニューロンのフィードバックシグナルが視細胞における活性帯の再編成を制御することが示された(図2).
3.分岐型古典的Wnt経路による活性帯の再編成
視細胞において活性帯の構成タンパク質を制御するフィードバックシグナルを探索したところ,分岐型古典的Wnt経路10) が特定された.分岐型古典的Wnt経路は,Wnt受容体からGSK3βまでは標準的な古典的Wnt経路を介するが,βカテニンなどにより核を介すことなく直接に微小管結合タンパク質に作用する.機能欠失変異体などにより分岐型古典的Wnt経路を阻害した結果,12時間の明条件-12時間の暗条件においても活性帯の解体が起こったことから,分岐型古典的Wnt経路は視細胞の活性帯においてBrpの局在を維持するはたらきをもつと考えられた.分岐型古典的Wnt経路が光の刺激の下流においてはたらくかどうかを調べるため,活性帯の解体が起こる明条件において分岐型古典的Wnt経路を強制的に活性化したところ,活性帯からのBrpの解離は抑制された.さらに,ヒスタミンCl-チャネルをもつニューロンを活性化させると,WNT1のショウジョウバエにおけるホモログであるWinglessの,視細胞にそうような内在性のシグナルが検出された.以上の結果から,光の刺激による神経活動に依存的な分岐型古典的Wnt経路は,視細胞における活性帯の再編成において重要な役割を担うことが明らかにされた(図2).
分岐型古典的Wnt経路の下流にある,MAP1BのショウジョウバエにおけるホモログであるFutschは,チューブリンに結合し微小管の安定性を高める.そこで,微小管の状態が活性帯の再編成に影響をあたえる可能性について考えた.この仮説を検証するため,R8視細胞において微小管を切断するSpastinを発現させたところ,微小管を不安定化させるだけで活性帯からのBrpの解離が誘導されることがわかった.R8視細胞においてKinesin-3/Unc-104のショウジョウバエにおけるホモログであるImacを過剰に発現させることによっても活性帯の解体は誘導され,また,RNAi法によるImacのノックダウンにより視細胞における明条件での活性帯の解体が抑制されたことから,Imacが微小管の制御および活性帯の可逆的な再編成に関与していることが示唆された.
おわりに
中枢シナプスの可塑性の分子機構のひとつがWnt経路だとわかったことにより,ニューロンの細胞死からの保護への道がひらけてきたと期待している.継続的な神経活動によりニューロンにおけるCa2+の濃度が上昇し,その結果,神経変性をまねくことが知られている11).しかしながら,慢性的なストレスから起こる興奮毒性からニューロンを保護する機構についてはわかっていない.また,神経変性疾患においても,異常なタンパク質の凝集が起こるずっとまえからシナプスには異常が発生していると考えられはじめている.可塑的な活性帯の再編成はニューロンを持続的な興奮毒性から保護する役割をもつ可能性があるため,この分子機構を利用しニューロンの細胞死の抑制を試みようと考えている.
文 献
- Hallermann, S., Kittel, R. J., Wichmann, C. et al.: Naked dense bodies provoke depression. J. Neurosci., 30, 14340-14345 (2010)[PubMed]
- Kittel, R. J., Wichmann, C., Rasse, T. M. et al.: Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science, 312, 1051-1054 (2006)[PubMed]
- Liu, K. S., Siebert, M., Mertel, S. et al.: RIM-binding protein, a central part of the active zone, is essential for neurotransmitter release. Science, 334, 1565-1569 (2011)[PubMed]
- Owald, D., Fouquet, W., Schmidt, M. et al.: A Syd-1 homologue regulates pre- and postsynaptic maturation in Drosophila. J. Cell Biol., 188, 565-579 (2010)[PubMed]
- Kaufmann, N., DeProto, J., Ranjan, R. et al.: Drosophila liprin-α and the receptor phosphatase Dlar control synapse morphogenesis. Neuron, 34, 27-38 (2002)[PubMed]
- Lazarevic, V., Schone, C., Heine, M. et al.: Extensive remodeling of the presynaptic cytomatrix upon homeostatic adaptation to network activity silencing. J. Neurosci., 31, 10189-10200 (2011)[PubMed]
- Matz, J., Gilyan, A., Kolar, A. et al.: Rapid structural alterations of the active zone lead to sustained changes in neurotransmitter release. Proc. Natl. Acad. Sci. USA, 107, 8836-8841 (2010)[PubMed]
- Spangler, S. A., Schmitz, S. K., Kevenaar, J. T. et al.: Liprin-α2 promotes the presynaptic recruitment and turnover of RIM1/CASK to facilitate synaptic transmission. J Cell Biol., 201, 915-928 (2013)[PubMed]
- Chen, Y., Akin, O., Nern, A. et al.: Cell-type-specific labeling of synapses in vivo through synaptic tagging with recombination. Neuron, 81, 280-293 (2014)[PubMed]
- Miech, C., Pauer, H. U., He, X. et al.: Presynaptic local signaling by a canonical wingless pathway regulates development of the Drosophila neuromuscular junction. J. Neurosci., 28, 10875-10884 (2008)[PubMed]
- Arundine, M. & Tymianski, M.: Molecular mechanisms of calcium-dependent neurodegeneration in excitotoxicity. Cell Calcium, 34, 325-337 (2003)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院理学系研究科 修了,同年 ドイツMax Planck Institute of Neurobiologyポスドクを経て,2011年よりドイツGerman Center for Neurodegenerative Diseasesポスドク.
研究テーマ:シナプスの可塑性の機構.
Gaia Tavosanis
ドイツGerman Center for Neurodegenerative Diseasesにてグループリーダー.
研究室URL:http://www.dzne.de/en/sites/bonn/research-groups/tavosanis.html
鈴木 崇之(Takashi Suzuki)
東京工業大学大学院生命理工学研究科 准教授.
研究室URL:http://www.suzukit.bio.titech.ac.jp/japanese/index.html
© 2015 杉江 淳・Gaia Tavosanis・鈴木崇之 Licensed under CC 表示 2.1 日本