マウスの肢芽において異方性の応力が上皮細胞層の再構成の方向性を決定づける
田尾嘉誉・Sevan Hopyan
(カナダHospital for Sick Children,Research Institute,Program in Developmental and Stem Cell Biology)
email:田尾嘉誉
DOI: 10.7875/first.author.2015.055
Anisotropic stress orients remodelling of mammalian limb bud ectoderm.
Kimberly Lau, Hirotaka Tao, Haijiao Liu, Jun Wen, Kendra Sturgeon, Natalie Sorfazlian, Savo Lazic, Jeffrey T. A. Burrows, Michael D. Wong, Danyi Li, Steven Deimling, Brian Ciruna, Ian Scott, Craig Simmons, R. Mark Henkelman, Trevor Williams, Anna-Katerina Hadjantonakis, Rodrigo Fernandez-Gonzalez, Yu Sun, Sevan Hopyan
Nature Cell Biology, 17, 569-579 (2015)
物理学的な力は形態形成を制御すると考えられるが,現在まで,生体において組織のレベルあるいは細胞のレベルでのかたちの変化については理解されていなかった.今回,ライブイメージング技術により,マウスの肢芽の初期形成における背腹軸の境界での外胚葉性頂堤の前駆細胞の滑り込み運動および上皮細胞の集団のダイナミックな動態を追跡することに成功した.また,原子間力顕微鏡およびレーザーアブレーション法を用いて物理的な力を定量化したところ,上皮細胞の挙動および再編成に異方的な応力がはたらいていることを見い出した.一方で,有限要素モデリング法により,上皮細胞層において生みだされる応力および間葉組織からの圧力が適切な肢芽の形態を維持するために必要であることが示された.さらに,上皮細胞に特異的なβカテニンノックアウトマウスの肢芽では上皮細胞の挙動および再構成がいちじるしく乱れ,また,応力の勾配が破綻するという結果が得られた.このことは,古典的Wntシグナル伝達系が物理的な力に対し深く関与していることを示唆した.今回の解析は,肢芽の形成の過程において生みだされる物理的な力と上皮細胞の集団の挙動および再編成との関連とを結びつけるはじめての報告となった.
われわれのからだはさまざまな特徴をもつ細胞が複雑かつ多岐にわたり秩序を保ち協力しあうことによりかたちづくられている.近年の研究により,個々の細胞の一挙手一投足がじつは組織全体の形態形成の原動力になることが明らかにされてきている1,2).しかしながら,いったい,いつ,どこで,どのような行程をへてその原動力のひとつである物理的な力が形態形成にはたらいているのかについてはいまだ不明な点が多い.今回,胎生期のマウスをモデルとして,手足の初期形成の過程で生まれる物理的な力の役割を見い出した.
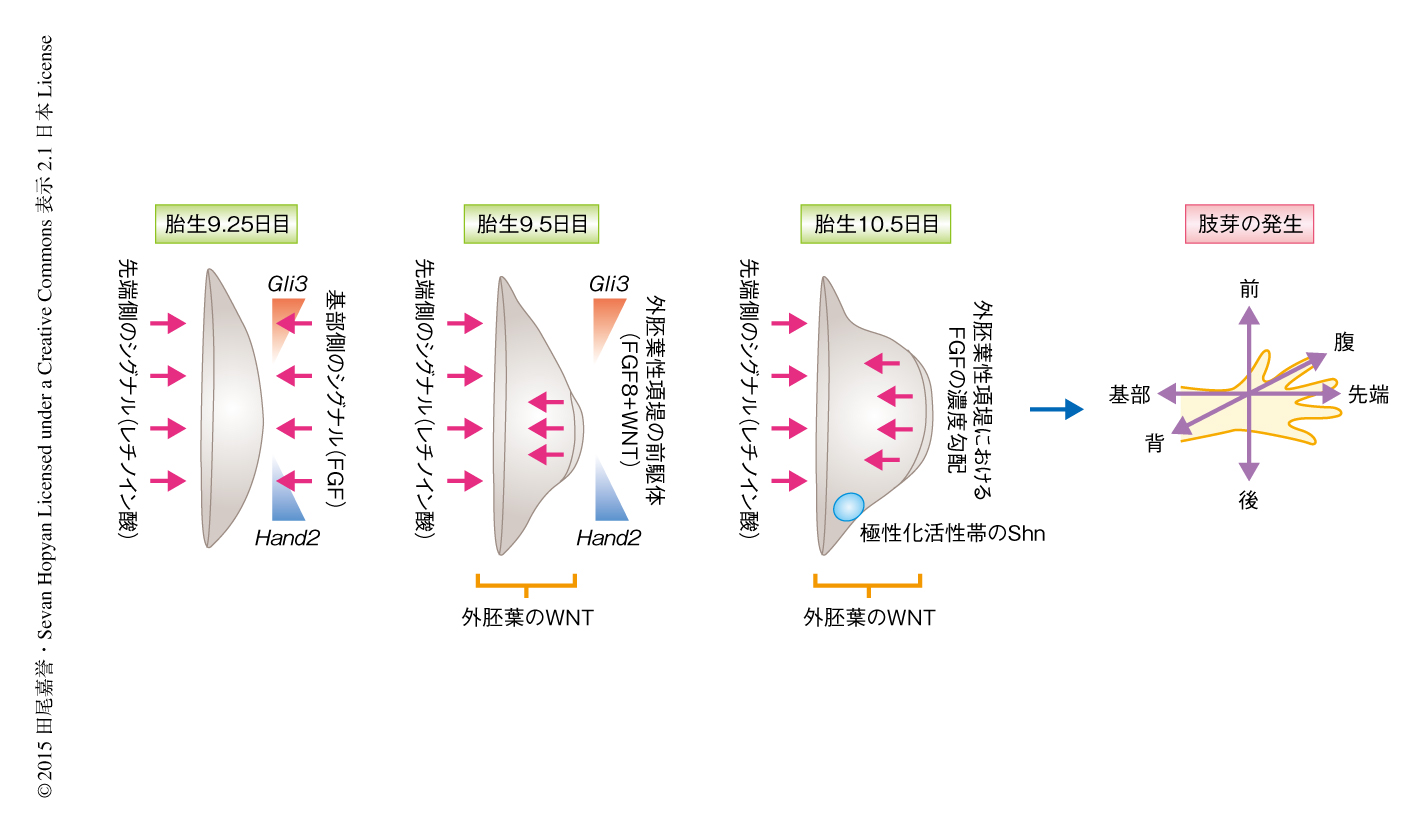
脊椎動物の四肢の原基(肢芽)は胚発生の初期に側板中胚葉の一部に由来し,単層の上皮細胞が間葉組織をおおい外側にふくらんでいくことにより形成される3,4).また,肢芽には明確な前後軸,背腹軸,基部先端部軸があり,この3つの軸にそって形態形成の起こることが知られている4,5)(図1).一方で,先端部の背腹軸の境界領域には外胚葉性頂堤,後側には極性化活性帯が存在し,適切な肢芽の伸長に対しシグナル伝達センターとして重要な機能をもつことが知られている4,5)(図1).しかしながら,肢芽の形成を担う個々の細胞がどのようにふるまい,それぞれの軸にそったシグナル伝達系からの位置情報をうけ,それを四肢の形態に具現化していくのかについてはいまだ不明な点が多い.そこでこの研究では,肢芽の初期形成における上皮細胞の挙動に着目し解析した.
肢芽の予定領域において,外胚葉性頂堤の形成のまえの上皮細胞は幾何学的に互いに入り組んだ配置をとっている.また,肢芽が伸長するにしたがい背腹軸にそって細長い形態をとる.この観察より,肢芽の初期形成において上皮細胞には物理的な力がかかっていると判断された.古典的Wntシグナル伝達系が外胚葉性頂堤の形成に必要不可欠であることから6),その活性のマーカーであるTcf/Lefレポーターをもつマウスを用いたライブイメージング法により,肢芽の初期形成における外胚葉性頂堤の前駆細胞の動態を追跡した.その結果,発生が進むにつれTcf/Lef陽性の細胞の数は増加し,背腹軸にそった外胚葉性頂堤の予定領域に集積した.さらに,Tcf/Lef陽性細胞どうしが背腹軸にそって滑り込み運動(インターカレーション)をすることが明らかにされた.このことから,この時期は単層である上皮細胞は平面的に極性をもって運動していると判断された.
現在までの知見として,アクチン線維やミオシンの極性をもった集積が細胞の挙動を方向づけることが知られている7-9).肢芽の初期形成において,アクチン線維の極性をもった集積は背腹軸に直交するかたちで起こる.肢芽の初期形成において,平面内細胞極性(planar cell polarity:PCP)経路あるいは細胞膜におけるリン酸化ミオシンの極性をもった集積は観察されなかった.さらに,細胞膜をモザイク状に標識するトランスジェニックマウスを用いて外胚葉性頂堤の予定領域を観察したところ,上皮細胞の移動先端部の細胞膜が背腹軸にそって仮足を形成していることが観察された.これらの結果から,上皮細胞の先端部への移動,および,外胚葉性頂堤の前駆細胞の背腹軸の境界領域における滑り込み運動が外胚葉性頂堤の形成を起こすと考えられた.
肢芽の初期形成において間葉組織の拡大が上皮細胞にどのように作用しているか,側板中胚葉にゲルを埋め込むことで上皮細胞層を人為的に押し上げることにより検証した.その結果,埋め込むゲルの剛性に関係なく,ゲルにより押し出された上皮細胞層においてTcf/Lef陽性細胞の数の増加およびアクチン線維の極性化が観察された.この結果は,正常な肢芽の形成において外側にむかった間葉組織の拡大が上皮細胞層における古典的Wntシグナル伝達系を活性化し,背腹軸にそったアクチン線維の極性化に寄与していることを意味した.
隣接する上皮細胞のあいだの相互作用を調べる目的で,細胞膜をモザイク状に標識するトランスジェニックマウスを用いてライブイメージング法により観察した.その結果,外胚葉性頂堤の形成のまえの上皮細胞層において,同心円状にならんだロゼット構造のダイナミックな再編成が観察された.いちど細胞分裂を起こした娘細胞が隣接する細胞の集団に滑り込みを起こし多細胞性のロゼット構造を形成することも観察された.この上皮細胞の再編成はショウジョウバエやほかの生物種ではみられない現象であった.これら多細胞性のロゼット構造の再編成は基部の側では前後軸に対し扁平になる傾向が強く,先端部の側では基部先端部軸に対し扁平になる傾向が強かった.以上の結果から,領域に特異的な多細胞性のロゼット構造の再編成の様式の相違は,肢芽の正常な形態である基部先端部軸の方向へ収斂(convergence)および前後軸にそった伸長(extension)を促進するために起こると考え,基部先端部軸の方向へなんらかの力学的な外因要素がはたらいているとの仮説をたてた.
先端部の背腹軸にそって起こる上皮細胞の滑り込み運動は肢芽の全体にどのような物理的な変形を生みだすのか調べるため,有限要素モデリング法を用いた.その際には,以前に報告のある粘弾性パラメーター10) および原子間力顕微鏡から得られた実測値を用いた.その結果,間葉組織の拡大だけでは本来の肢芽の形態は再現されなかったのに対し,パラメーターとして上皮細胞層における滑り込み運動により生みだされる応力を入力すると上皮細胞層において基部先端部軸にそった力学的なストレスパターンが生じ,本来の肢芽の形態が再現された.つまり,間葉組織の伸長と上皮細胞層において局所的に生みだされる応力の組合せが 基部先端部軸にそったストレスパターンをつくりだすことが理論的に示唆された.
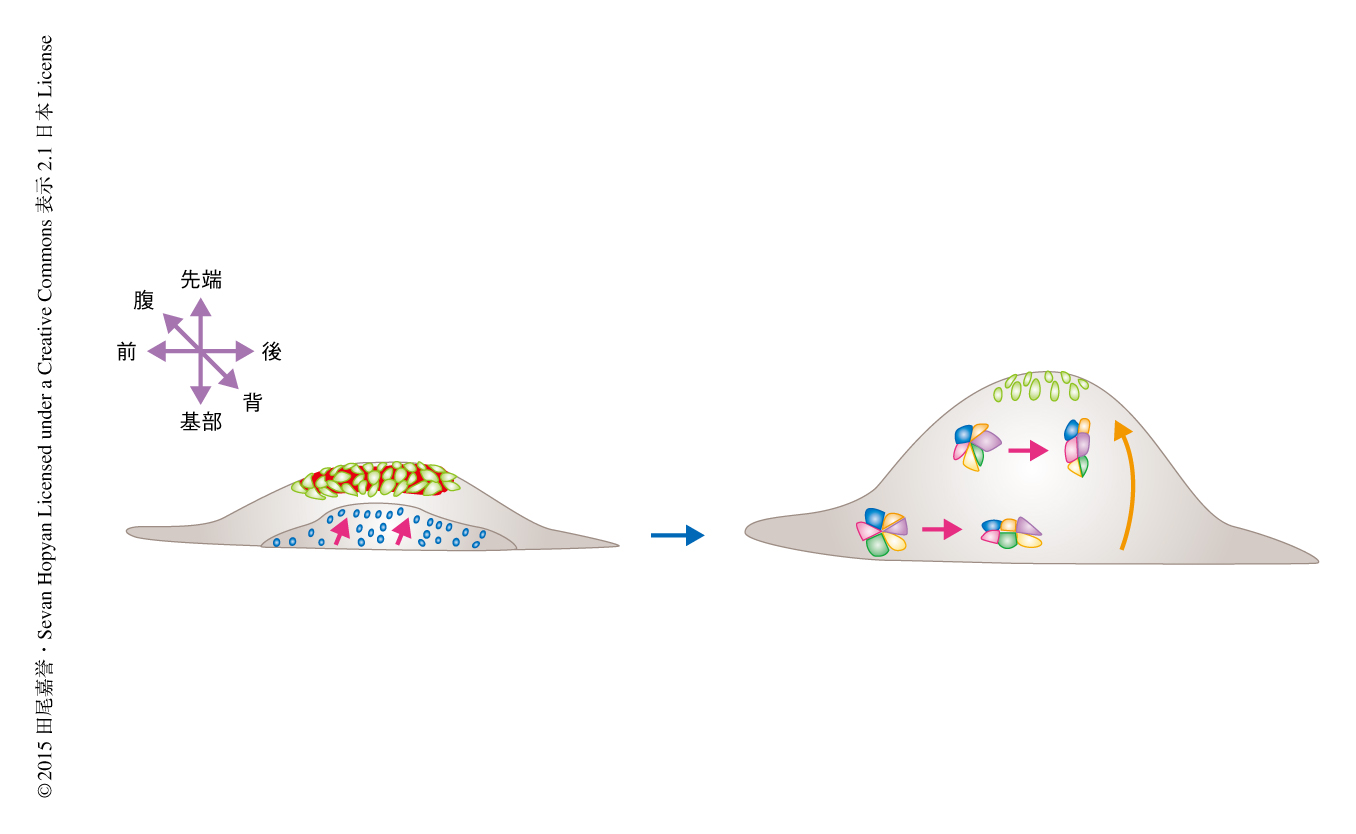
原子間力顕微鏡を用いて生体において上皮細胞層のもつ剛性を測定した.その結果,剛性は先端部においてもっとも高く,基部先端部軸にそって低くなることがわかった.この結果は,有限要素モデリング法による解析と一致した.上皮細胞層における応力の方向性を調べるため,外胚葉性頂堤の予定領域において上皮細胞の細胞膜の一部を一定のパルスレーザー光により切断する方法(レーザーアブレーション法)により,生じる張力の程度を評価した.その結果,細胞膜を前後軸にそって切断した場合に比べ,基部先端部軸にそって切断した場合のほうが張力は高いことがわかった.以上の結果より,上皮細胞層の先端部において生み出される応力の勾配が肢芽の形成の伸長の方向にそって存在することが示唆された(図2).
上皮細胞の特徴と古典的Wntシグナル伝達系との関連性について調べるため,上皮細胞において特異的にβカテニンを欠損するマウスを作製し解析した.この上皮細胞に特異的なβカテニンノックアウトマウスにおいて外胚葉性頂堤は形成されず,また,肢芽の形態が異常であった.外胚葉性頂堤の形成のまえの時期において上皮細胞層および間葉組織における細胞の増殖あるいは細胞死に影響はなかった.また,間葉組織におけるFGF10の発現は正常な胚と変わらなかったことから,上皮細胞の挙動に異常があると推測された.そこで,各種のレポーター遺伝子を導入した上皮細胞に特異的なβカテニンノックアウトマウスを作製した.その結果,ライブイメージング法により,背腹軸にそった滑り込み運動は起こらないこと,また,多細胞性のロゼット構造の数は正常な胚と比較して違いはないがその再構成は起こらないことが観察された.また,レーザーアブレーション法により,前後軸にそった細胞膜にはたらく張力と基部先端部軸にそった細胞膜にはたらく張力に有意な差はみられないことがわかった.原子間力顕微鏡を用いて剛性を測定したところ,正常な胚にみられる先端部から基部へのストレスパターンは破綻していた.以上の結果より,βカテニンは上皮細胞において異方性をもつ応力の維持に深く関与していることが示唆された.
上皮細胞に特異的なβカテニンノックアウトマウスにおいて,細胞接着因子であるEカドヘリンの細胞膜における局在に変化はなかったが,アクチン線維の極性のパターンは乱れていた.また,ライブイメージング法によりアクチンの動態を追跡したところ,小胞状のすきまをもつアクチンリングが多く観察された.このことから,βカテニンはアクチンを細胞膜につなぎとめておくために必要であることが明らかにされた.さらに,古典的Wntシグナル伝達系の阻害剤であるIWR1を添加した培地で胚を培養したところ,培養2時間ではアクチン線維の極性に影響はみられなかったが,培養6時間ではアクチン線維の極性が消失していた.この結果より,βカテニンは上皮細胞の再構成に関与するアクチン線維の極性の維持に間接的に必要であることが示唆された.
古典的Wntシグナル伝達系とともに上皮細胞においてフィードバックループ経路に関与するFGF受容体2についても,上皮細胞において特異的な欠損マウスを作製し同様に検証した.その結果,上皮細胞に特異的なβカテニンノックアウトマウスと同様に先端部から基部へのストレスパターンは破綻していたが,細胞膜におけるβカテニンの局在に変化はみられなかった.したがって,上皮細胞におけるFGF受容体2の機能はβカテニンには非依存的であると考えられた.以上の結果から,上皮細胞層において生じる応力の勾配の形成および維持にはβカテニンおよびFGF受容体2に対し依存的な機能が必要であることが示唆された.
この研究のインパクトは,高次の脊椎動物における肢芽の形成において生みだされる物理的な力がかたちづくりにかかわる上皮細胞の集団の再編成にいかにかかわるかという形態学的な機構を同定した点,また,マウスにおける肢芽の形成においてもショウジョウバエあるいはアフリカツメガエルの胚発生にみられる上皮細胞の集団の再編成と共通するロゼット構造を生みだす機構が存在し,一方で,平面内細胞極性経路やミオシンによる制御をともなわない上皮細胞の集団の再編成を発見した点にある.今後は,生物物理学的あるいは数理学的な技術の導入により,脊椎動物の発生の過程のかたちづくりにおいて,個々の細胞の挙動がいかに組織全体のかたちに寄与するかを提示することにより,普遍的な発生の機構を明らかにしていくことをめざしている.
略歴:2005年 徳島大学大学院工学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2009年 理化学研究所発生再生総合科学センター 研究員を経て,2012年よりカナダHospital for Sick Childrenポストドクトラルフェロー.
研究テーマ:四肢の形成における細胞の挙動および分子経路の相互理解.
関心事:いっけん無秩序にふるまっているようにみえるひとつひとつの細胞の挙動と組織あるいは器官の形成との関連性.
Sevan Hopyan
カナダHospital for Sick ChildrenにてSenior Scientist.
© 2015 田尾嘉誉・Sevan Hopyan Licensed under CC 表示 2.1 日本
(カナダHospital for Sick Children,Research Institute,Program in Developmental and Stem Cell Biology)
email:田尾嘉誉
DOI: 10.7875/first.author.2015.055
Anisotropic stress orients remodelling of mammalian limb bud ectoderm.
Kimberly Lau, Hirotaka Tao, Haijiao Liu, Jun Wen, Kendra Sturgeon, Natalie Sorfazlian, Savo Lazic, Jeffrey T. A. Burrows, Michael D. Wong, Danyi Li, Steven Deimling, Brian Ciruna, Ian Scott, Craig Simmons, R. Mark Henkelman, Trevor Williams, Anna-Katerina Hadjantonakis, Rodrigo Fernandez-Gonzalez, Yu Sun, Sevan Hopyan
Nature Cell Biology, 17, 569-579 (2015)
要 約
物理学的な力は形態形成を制御すると考えられるが,現在まで,生体において組織のレベルあるいは細胞のレベルでのかたちの変化については理解されていなかった.今回,ライブイメージング技術により,マウスの肢芽の初期形成における背腹軸の境界での外胚葉性頂堤の前駆細胞の滑り込み運動および上皮細胞の集団のダイナミックな動態を追跡することに成功した.また,原子間力顕微鏡およびレーザーアブレーション法を用いて物理的な力を定量化したところ,上皮細胞の挙動および再編成に異方的な応力がはたらいていることを見い出した.一方で,有限要素モデリング法により,上皮細胞層において生みだされる応力および間葉組織からの圧力が適切な肢芽の形態を維持するために必要であることが示された.さらに,上皮細胞に特異的なβカテニンノックアウトマウスの肢芽では上皮細胞の挙動および再構成がいちじるしく乱れ,また,応力の勾配が破綻するという結果が得られた.このことは,古典的Wntシグナル伝達系が物理的な力に対し深く関与していることを示唆した.今回の解析は,肢芽の形成の過程において生みだされる物理的な力と上皮細胞の集団の挙動および再編成との関連とを結びつけるはじめての報告となった.
はじめに
われわれのからだはさまざまな特徴をもつ細胞が複雑かつ多岐にわたり秩序を保ち協力しあうことによりかたちづくられている.近年の研究により,個々の細胞の一挙手一投足がじつは組織全体の形態形成の原動力になることが明らかにされてきている1,2).しかしながら,いったい,いつ,どこで,どのような行程をへてその原動力のひとつである物理的な力が形態形成にはたらいているのかについてはいまだ不明な点が多い.今回,胎生期のマウスをモデルとして,手足の初期形成の過程で生まれる物理的な力の役割を見い出した.
脊椎動物の四肢の原基(肢芽)は胚発生の初期に側板中胚葉の一部に由来し,単層の上皮細胞が間葉組織をおおい外側にふくらんでいくことにより形成される3,4).また,肢芽には明確な前後軸,背腹軸,基部先端部軸があり,この3つの軸にそって形態形成の起こることが知られている4,5)(図1).一方で,先端部の背腹軸の境界領域には外胚葉性頂堤,後側には極性化活性帯が存在し,適切な肢芽の伸長に対しシグナル伝達センターとして重要な機能をもつことが知られている4,5)(図1).しかしながら,肢芽の形成を担う個々の細胞がどのようにふるまい,それぞれの軸にそったシグナル伝達系からの位置情報をうけ,それを四肢の形態に具現化していくのかについてはいまだ不明な点が多い.そこでこの研究では,肢芽の初期形成における上皮細胞の挙動に着目し解析した.
1.外胚葉性頂堤の前駆細胞および肢芽上皮細胞の特徴
肢芽の予定領域において,外胚葉性頂堤の形成のまえの上皮細胞は幾何学的に互いに入り組んだ配置をとっている.また,肢芽が伸長するにしたがい背腹軸にそって細長い形態をとる.この観察より,肢芽の初期形成において上皮細胞には物理的な力がかかっていると判断された.古典的Wntシグナル伝達系が外胚葉性頂堤の形成に必要不可欠であることから6),その活性のマーカーであるTcf/Lefレポーターをもつマウスを用いたライブイメージング法により,肢芽の初期形成における外胚葉性頂堤の前駆細胞の動態を追跡した.その結果,発生が進むにつれTcf/Lef陽性の細胞の数は増加し,背腹軸にそった外胚葉性頂堤の予定領域に集積した.さらに,Tcf/Lef陽性細胞どうしが背腹軸にそって滑り込み運動(インターカレーション)をすることが明らかにされた.このことから,この時期は単層である上皮細胞は平面的に極性をもって運動していると判断された.
現在までの知見として,アクチン線維やミオシンの極性をもった集積が細胞の挙動を方向づけることが知られている7-9).肢芽の初期形成において,アクチン線維の極性をもった集積は背腹軸に直交するかたちで起こる.肢芽の初期形成において,平面内細胞極性(planar cell polarity:PCP)経路あるいは細胞膜におけるリン酸化ミオシンの極性をもった集積は観察されなかった.さらに,細胞膜をモザイク状に標識するトランスジェニックマウスを用いて外胚葉性頂堤の予定領域を観察したところ,上皮細胞の移動先端部の細胞膜が背腹軸にそって仮足を形成していることが観察された.これらの結果から,上皮細胞の先端部への移動,および,外胚葉性頂堤の前駆細胞の背腹軸の境界領域における滑り込み運動が外胚葉性頂堤の形成を起こすと考えられた.
2.間葉組織による上皮細胞層への関与
肢芽の初期形成において間葉組織の拡大が上皮細胞にどのように作用しているか,側板中胚葉にゲルを埋め込むことで上皮細胞層を人為的に押し上げることにより検証した.その結果,埋め込むゲルの剛性に関係なく,ゲルにより押し出された上皮細胞層においてTcf/Lef陽性細胞の数の増加およびアクチン線維の極性化が観察された.この結果は,正常な肢芽の形成において外側にむかった間葉組織の拡大が上皮細胞層における古典的Wntシグナル伝達系を活性化し,背腹軸にそったアクチン線維の極性化に寄与していることを意味した.
3.外胚葉性頂堤の形成のまえの上皮細胞の再編成と細胞分裂との関連性
隣接する上皮細胞のあいだの相互作用を調べる目的で,細胞膜をモザイク状に標識するトランスジェニックマウスを用いてライブイメージング法により観察した.その結果,外胚葉性頂堤の形成のまえの上皮細胞層において,同心円状にならんだロゼット構造のダイナミックな再編成が観察された.いちど細胞分裂を起こした娘細胞が隣接する細胞の集団に滑り込みを起こし多細胞性のロゼット構造を形成することも観察された.この上皮細胞の再編成はショウジョウバエやほかの生物種ではみられない現象であった.これら多細胞性のロゼット構造の再編成は基部の側では前後軸に対し扁平になる傾向が強く,先端部の側では基部先端部軸に対し扁平になる傾向が強かった.以上の結果から,領域に特異的な多細胞性のロゼット構造の再編成の様式の相違は,肢芽の正常な形態である基部先端部軸の方向へ収斂(convergence)および前後軸にそった伸長(extension)を促進するために起こると考え,基部先端部軸の方向へなんらかの力学的な外因要素がはたらいているとの仮説をたてた.
4.背腹軸の境界領域における細胞どうしの滑り込み運動は肢芽に応力の勾配をつくりだす
先端部の背腹軸にそって起こる上皮細胞の滑り込み運動は肢芽の全体にどのような物理的な変形を生みだすのか調べるため,有限要素モデリング法を用いた.その際には,以前に報告のある粘弾性パラメーター10) および原子間力顕微鏡から得られた実測値を用いた.その結果,間葉組織の拡大だけでは本来の肢芽の形態は再現されなかったのに対し,パラメーターとして上皮細胞層における滑り込み運動により生みだされる応力を入力すると上皮細胞層において基部先端部軸にそった力学的なストレスパターンが生じ,本来の肢芽の形態が再現された.つまり,間葉組織の伸長と上皮細胞層において局所的に生みだされる応力の組合せが 基部先端部軸にそったストレスパターンをつくりだすことが理論的に示唆された.
原子間力顕微鏡を用いて生体において上皮細胞層のもつ剛性を測定した.その結果,剛性は先端部においてもっとも高く,基部先端部軸にそって低くなることがわかった.この結果は,有限要素モデリング法による解析と一致した.上皮細胞層における応力の方向性を調べるため,外胚葉性頂堤の予定領域において上皮細胞の細胞膜の一部を一定のパルスレーザー光により切断する方法(レーザーアブレーション法)により,生じる張力の程度を評価した.その結果,細胞膜を前後軸にそって切断した場合に比べ,基部先端部軸にそって切断した場合のほうが張力は高いことがわかった.以上の結果より,上皮細胞層の先端部において生み出される応力の勾配が肢芽の形成の伸長の方向にそって存在することが示唆された(図2).
5.上皮細胞層において生じる応力の勾配はβカテニンおよびFGF受容体2に依存的である
上皮細胞の特徴と古典的Wntシグナル伝達系との関連性について調べるため,上皮細胞において特異的にβカテニンを欠損するマウスを作製し解析した.この上皮細胞に特異的なβカテニンノックアウトマウスにおいて外胚葉性頂堤は形成されず,また,肢芽の形態が異常であった.外胚葉性頂堤の形成のまえの時期において上皮細胞層および間葉組織における細胞の増殖あるいは細胞死に影響はなかった.また,間葉組織におけるFGF10の発現は正常な胚と変わらなかったことから,上皮細胞の挙動に異常があると推測された.そこで,各種のレポーター遺伝子を導入した上皮細胞に特異的なβカテニンノックアウトマウスを作製した.その結果,ライブイメージング法により,背腹軸にそった滑り込み運動は起こらないこと,また,多細胞性のロゼット構造の数は正常な胚と比較して違いはないがその再構成は起こらないことが観察された.また,レーザーアブレーション法により,前後軸にそった細胞膜にはたらく張力と基部先端部軸にそった細胞膜にはたらく張力に有意な差はみられないことがわかった.原子間力顕微鏡を用いて剛性を測定したところ,正常な胚にみられる先端部から基部へのストレスパターンは破綻していた.以上の結果より,βカテニンは上皮細胞において異方性をもつ応力の維持に深く関与していることが示唆された.
上皮細胞に特異的なβカテニンノックアウトマウスにおいて,細胞接着因子であるEカドヘリンの細胞膜における局在に変化はなかったが,アクチン線維の極性のパターンは乱れていた.また,ライブイメージング法によりアクチンの動態を追跡したところ,小胞状のすきまをもつアクチンリングが多く観察された.このことから,βカテニンはアクチンを細胞膜につなぎとめておくために必要であることが明らかにされた.さらに,古典的Wntシグナル伝達系の阻害剤であるIWR1を添加した培地で胚を培養したところ,培養2時間ではアクチン線維の極性に影響はみられなかったが,培養6時間ではアクチン線維の極性が消失していた.この結果より,βカテニンは上皮細胞の再構成に関与するアクチン線維の極性の維持に間接的に必要であることが示唆された.
古典的Wntシグナル伝達系とともに上皮細胞においてフィードバックループ経路に関与するFGF受容体2についても,上皮細胞において特異的な欠損マウスを作製し同様に検証した.その結果,上皮細胞に特異的なβカテニンノックアウトマウスと同様に先端部から基部へのストレスパターンは破綻していたが,細胞膜におけるβカテニンの局在に変化はみられなかった.したがって,上皮細胞におけるFGF受容体2の機能はβカテニンには非依存的であると考えられた.以上の結果から,上皮細胞層において生じる応力の勾配の形成および維持にはβカテニンおよびFGF受容体2に対し依存的な機能が必要であることが示唆された.
おわりに
この研究のインパクトは,高次の脊椎動物における肢芽の形成において生みだされる物理的な力がかたちづくりにかかわる上皮細胞の集団の再編成にいかにかかわるかという形態学的な機構を同定した点,また,マウスにおける肢芽の形成においてもショウジョウバエあるいはアフリカツメガエルの胚発生にみられる上皮細胞の集団の再編成と共通するロゼット構造を生みだす機構が存在し,一方で,平面内細胞極性経路やミオシンによる制御をともなわない上皮細胞の集団の再編成を発見した点にある.今後は,生物物理学的あるいは数理学的な技術の導入により,脊椎動物の発生の過程のかたちづくりにおいて,個々の細胞の挙動がいかに組織全体のかたちに寄与するかを提示することにより,普遍的な発生の機構を明らかにしていくことをめざしている.
文 献
- Keller, R.: Physical biology returns to morphogenesis. Science, 338, 201-203 (2012)[PubMed]
- Heisenberg, C. P. & Bellaiche, Y.: Force in tissue morphogenesis and patterning. Cell, 153, 948-962 (2013)[PubMed]
- Hopyan, S., Sharpe, J. & Yang, Y.: Budding behaviors: growth of the limb bud as a model of morphogenesis. Dev. Dyn., 240, 1054-1062 (2011)[PubMed]
- Zeller, R., Lopez-Rios, J. & Zuniga, A.: Vertebrate limb bud development: moving towards integrative analysis of organogenesis. Nat. Rev. Genet., 10, 845-858 (2009)[PubMed]
- Allard, P. & Tabin, C. J.: Achieving bilateral symmetry during vertebrate limb development. Semin. Cell Dev. Biol., 20, 479-484 (2009)[PubMed]
- Geetha-Loganathan, P., Nimmagadda, S. & Scaal, M.: Wnt signaling in limb organogenesis. Organogenesis, 4, 109-115 (2008)[PubMed]
- Bertet, C., Sulak, L. & Lecuit, T.: Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature, 429, 667-671 (2007)[PubMed]
- Blankenship, J. T., Backovic, S. T., Sanny, J. S. et al.: Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev. Cell, 11, 459-470 (2006)[PubMed]
- Galkin, V. E., Orlova, A. & Egelman, E. H.: Actin filaments as tension sensors. Curr. Biol., 22, R96-R101 (2012)[PubMed]
- Forgacs, G., Foty, R. A., Shafrir, Y. et al.: Visoelastic properties of living embryonic tissues: a quantitative study. Biophys. J., 74, 2227-2234 (1998)[PubMed]
著者プロフィール
略歴:2005年 徳島大学大学院工学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2009年 理化学研究所発生再生総合科学センター 研究員を経て,2012年よりカナダHospital for Sick Childrenポストドクトラルフェロー.
研究テーマ:四肢の形成における細胞の挙動および分子経路の相互理解.
関心事:いっけん無秩序にふるまっているようにみえるひとつひとつの細胞の挙動と組織あるいは器官の形成との関連性.
Sevan Hopyan
カナダHospital for Sick ChildrenにてSenior Scientist.
© 2015 田尾嘉誉・Sevan Hopyan Licensed under CC 表示 2.1 日本