サイクリン依存性キナーゼCdk1による染色体パッセンジャー複合体のリン酸化は染色体の2方向性を促進する
塚原達也・丹野悠司・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:塚原達也
DOI: 10.7875/first.author.2010.028
Phosphorylation of the CPC by Cdk1 promotes chromosome bi-orientation.
Tatsuya Tsukahara, Yuji Tanno, Yoshinori Watanabe
Nature, 467, 719-723 (2010)
細胞分裂の際,複製した染色体を2つの娘細胞に均等に分配するためには,ペアをなす姉妹染色分体それぞれが反対極から伸びたスピンドル微小管によって別々に捕らえられる必要がある.しかし,分裂期の初期においては,1本の染色分体が両側からのスピンドル微小管によって捕えられるなど,間違った結合が存在する.染色体パッセンジャー複合体は分裂期に姉妹動原体のあいだに位置するセントロメア領域に局在し,これら間違った結合を特異的に不安定化することで染色体が正しい方向から捕らえられることを保証する役割をはたしている.筆者らは,分裂酵母およびヒト培養細胞を用いた解析から,Cdk1-サイクリンB複合体が分裂期に染色体パッセンジャー複合体のサブユニットをリン酸化することでセントロメアタンパク質Shugoshinとの結合を促進し,染色体パッセンジャー複合体をセントロメアへと局在させていることを明らかにした.これは,これまで細胞周期進行の制御因子と考えられていたCdk1が,染色体の2方向性という染色体分配に必須な過程を染色体パッセンジャー複合体のリン酸化により制御していることをはじめて示したものである.
真核生物は増殖や発生の過程で細胞分裂をくり返すが,このとき,複製した染色体を2つの娘細胞に均等に分配する必要がある.染色体の分配ミスはがん化やがんの悪性化,細胞死の原因となることから,その過程は精巧に制御されている.なかでも,分裂期において姉妹染色分体のペアがスピンドル微小管によって両側から捕らえられる過程(染色体の2方向性)は,正確な染色体分配に必須であることが知られている.
細胞が染色体の2方向性を確立するためには,分裂期の初期において頻繁に生じる,染色体とスピンドル微小管との間違った結合を修正する必要がある(図1).間違った結合には,1本の染色分体が両側からのスピンドル微小管にとらえられる結合や,姉妹染色分体の双方が同一の極から捕えられる1方向性の結合などがあげられる.染色体パッセンジャー複合体(chromosomal passenger complex:CPC)はAurora B,INCENP,Survivin,Borealinの4者からなる進化的に保存されたタンパク質複合体で,動原体とスピンドル微小管との結合を不安定化する活性をもつ1).分裂期に姉妹動原体(スピンドル微小管の結合部位)のあいだに位置するセントロメア領域に局在するため,間違った結合を特異的に不安定化することができる.染色体の2方向性が確立するとセントロメアと動原体の距離が離れるため,動原体とスピンドル微小管との結合が安定化されるものと考えられている2).このように,染色体の2方向性を確立するためには染色体パッセンジャー複合体がセントロメアへと局在することが重要である.しかし,このセントロメア局在を制御する分子機構はよく理解されていなかった.
サイクリン依存性キナーゼ(cyclin-dependent kinase:Cdk)とサイクリンとの複合体は細胞周期進行のマスターレギュレーターとして知られている3).なかでも,Cdk1-サイクリンB複合体は分裂期への進行に必須の役割をはたすが,分裂期においても特異的な機能をもつことが示唆されていた4).今回,筆者らは,Cdk1-サイクリンB複合体の分裂期における新たな機能を探索するため,分裂酵母cdc13遺伝子(サイクリンBをコードする)にランダムに変異を導入し,染色体分配に特異的な欠損を示す変異株をスクリーニングした.興味深いことに,得られた変異株のひとつcdc13-M7は,細胞周期の進行にはほとんど欠損を示さなかったが,染色体の2方向性の確立に著しい欠損を示した(染色体の2方向性確立の欠損は,分配ミスや遅滞染色体,分裂後期に染色体が紡錘体の中央部に取り残される状態,として観察される).そこで,染色体パッセンジャー複合体のサブユニットをin vitroでCdk1-サイクリンB複合体によりリン酸化したところ,Bir1-Survivinとよばれるサブユニットがもっともよい基質となること,また,実際に細胞内で分裂期に特異的にBir1がリン酸化されることを見い出した.さらに,cdc13-M7変異株においてBir1のリン酸化レベルが低下していたことからも,Cdk1-サイクリンB複合体がBir1のリン酸化を介して染色体の2方向性の確立に寄与していることが示唆された.
bir1非リン酸化型変異株bir1-8Aは染色体パッセンジャー複合体のセントロメア局在に著しい欠損を示し,染色体の2方向性確立に異常を生じた.また,cdc13-M7変異株においても染色体パッセンジャー複合体のセントロメア局在レベルが低下していた.cdc13-M7変異とbir1リン酸化模倣型変異の二重変異株においては,染色体パッセンジャー複合体のセントロメア局在および染色体分配の欠損が回復した.したがって,cdc13-M7変異株における染色体の2方向性確立の欠損がBir1のリン酸化レベルの低下により生じていることが強く示唆された.これらの結果から,Cdk1-サイクリンB複合体によるBir1のリン酸化が染色体パッセンジャー複合体のセントロメア局在に重要な役割をはたすことが明らかになった.
筆者らのグループは,分裂酵母を用いた解析から,進化的に保存されたセントロメアタンパク質Shugoshin(シュゴシン)のひとつSgo2が,Bir1との相互作用を介して染色体パッセンジャー複合体のセントロメア局在を促進することを示していた5).そこで,Cdk1-サイクリンB複合体によるBir1のリン酸化がSgo2との相互作用に必要であるかどうかを検討したところ,ツーハイブリッド解析および免疫沈降の双方において,両者の直接的な結合がCdk1-サイクリンB複合体によるリン酸化に依存することを見い出した.したがって,Cdk1-サイクリンB複合体は染色体パッセンジャー複合体をリン酸化することでShugoshinとの相互作用を促進し,セントロメア局在を制御することが明らかになった.
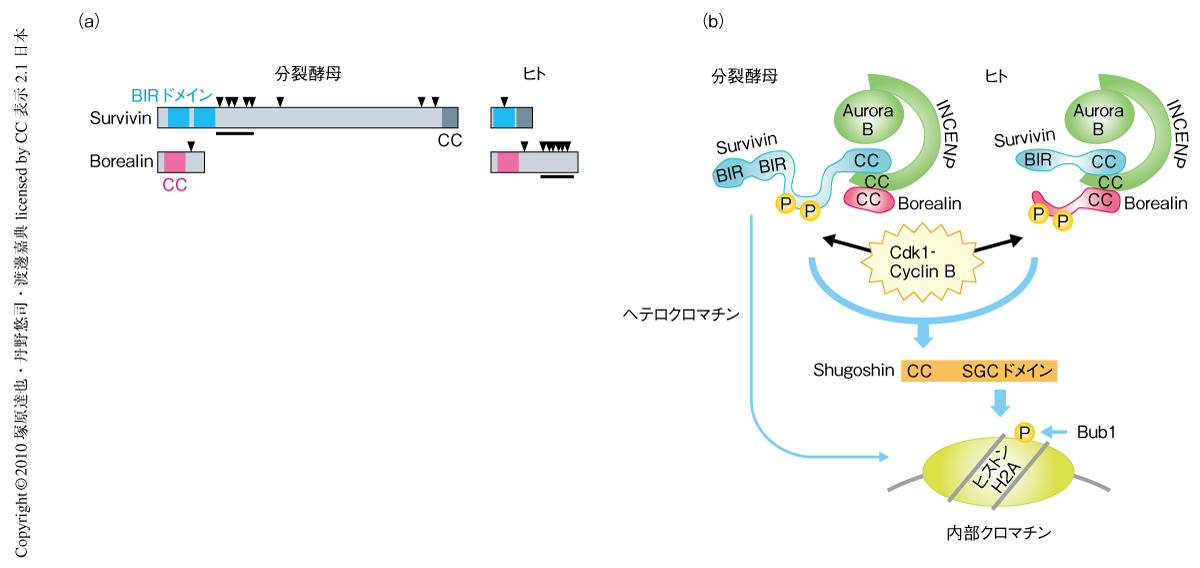
Cdk1,染色体パッセンジャー複合体,Shugoshinは,いずれも進化的に保存された因子であることから,分裂酵母で見い出した機構がヒト培養細胞においても保存されているかどうか検討した.はじめに,ヒトにおいてもShugoshinが染色体パッセンジャー複合体のセントロメア局在に必要であるかどうかについて検討したところ,hSgo1およびhSgo2の単独のノックダウン(RNAi)では染色体パッセンジャー複合体のセントロメア局在に顕著な減少はみられなかったが,両者を同時にノックダウンしたところ著しい減少が観察された.つぎに,ツーハイブリッド解析によりヒトShugoshinと相互作用する染色体パッセンジャー複合体のサブユニットを検討したところ,hBorealinがhSgo1およびhSgo2と特異的に相互作用することが明らかになった.さらに,hBorealinがCdk1-サイクリンB複合体の基質となること,また,分裂期特異的にリン酸化されることも見い出した.内在性のhBorealinをノックダウンして非リン酸化型hBorealin(hBorealin-7A)を発現させたところ,染色体パッセンジャー複合体のセントロメア局在および染色体の2方向性の確立に顕著な欠損を示した.さらに,分裂期に同調した細胞をCdk1の活性阻害剤roscovitineで処理すると,染色体パッセンジャー複合体のセントロメア局在レベルが減少し,hBorealinとhSgo1およびhSgo2との相互作用も消失した.これらの結果から,Cdk1-サイクリンB複合体による染色体パッセンジャー複合体のリン酸化が,染色体パッセンジャー複合体のセントロメア局在制御における進化的に保存された中心的な機構であることが明らかになった(図2).
Cdk1-サイクリンB複合体によるリン酸化を介した染色体パッセンジャー複合体のセントロメア局在の制御機構は分裂酵母からヒトにまで保存されているが,リン酸化されるサブユニットは分裂酵母ではBir1-Survivinであるのに対し,ヒトではhBorealinである.分裂酵母Bir1およびヒトhBorealinには進化的に保存されたドメイン以外に構造的に不安定な領域が存在し,そのなかにCdk1-サイクリンB複合体によるリン酸化コンセンサス配列のクラスターをもつ(図2a).一方,分裂酵母BorealinおよびヒトSurvivinは保存されたドメイン以外の配列をほとんどもたず,Cdk1-サイクリンB複合体によるリン酸化コンセンサスのクラスターをもたない.後生動物においてはSurvivinとBorealinの構造がヒトに近く,Borealinに存在するリン酸化コンセンサスのクラスターは保存されている.一方,いくつかの種類の分裂酵母においては,いずれもBir1にリン酸化コンセンサスのクラスターが存在する.これらの知見から,進化の過程でCdk1-サイクリンB複合体によるリン酸化コンセンサスのクラスターがBir1-SurvivinからBorealinへと変化したものと考えられる.サブユニットが変化してもCdk1-サイクリンB複合体によるリン酸化コンセンサスが保存されていることは,このリン酸化制御機構の重要性を示唆していると考えられる.
今回,筆者らは,Cdk1-サイクリンB複合体による染色体パッセンジャー複合体のリン酸化がShugoshinとの相互作用を促進することで染色体パッセンジャー複合体のセントロメア局在を制御することを明らかにしたが,bir1非リン酸化型変異株やsgo2破壊株においても染色体パッセンジャー複合体のセントロメア局在がわずかながら観察される.これは,セントロメア領域に形成されるヘテロクロマチン構造がCdk1 -Shugoshin経路とは独立に染色体パッセンジャー複合体のセントロメア局在を促進しているためである(図2b).実際,ヘテロクロマチン形成に欠損を生じるswi6遺伝子(ヘテロクロマチンタンパク質HP1をコードする)の破壊株はbir1非リン酸化型変異と合成致死の表現型を示す.最近,筆者らのグループは,このヘテロクロマチン経路がヒストンH3の3番目のスレオニン残基をリン酸化するキナーゼHaspinをセントロメアへと局在化し,Survivinがリン酸化ヒストンH3と直接に結合することで染色体パッセンジャー複合体のセントロメア局在を促進することを見い出した6)(新着論文レビュー でも掲載).一方,Shugoshinは動原体キナーゼBub1によりヒストンH2Aの121番目のセリン残基がリン酸化されたヌクレオソームに結合することでセントロメアに局在することから7),セントロメアに存在するリン酸化ヌクレオソームに結合した染色体パッセンジャー複合体とShugoshinとがCdk1-サイクリンB複合体によるリン酸化に依存して結合するという制御機構が明らかになった.
この研究は,染色体パッセンジャー複合体という染色体の2方向性の確立に必須の機能をはたす複合体がセントロメアに局在する機構を分子レベルで明らかにしたものである.さらに,これまで細胞周期の進行を制御すると考えられていたCdk1が染色体の2方向性確立の機能をもつことをはじめて明らかにしたという意味において重要な発見と考えられる.染色体パッセンジャー複合体は分裂後期においては紡錘体へと局在を変化させ,細胞質分裂に必須の役割をはたすことが知られている.染色体パッセンジャー複合体の紡錘体局在にはCdk1-サイクリンB複合体の不活性化が必要であることが示されており8-10),この研究とあわせ,細胞周期に依存的な染色体パッセンジャー複合体のダイナミックな局在の変化がCdk1-サイクリンB複合体の活性レベルにより総合的に制御されていることが明らかになった.このように,Cdk1-サイクリンB複合体は分裂期においてさまざまな因子の細胞周期に依存的な局在の変化や活性の変化を制御する可能性があるものと考えられる.
略歴:2010年 東京大学大学院理学系研究科博士課程 修了,同年より同 助教.
研究テーマ:脊椎動物の発生分化過程におけるクロマチン修飾の制御機構の解析.
抱負:今年から発生生物学に研究テーマを変えました.メダカとマウスを用い,クロマチン修飾を切り口にさまざまな発生現象にチャレンジしていきたいと思います.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2010 塚原達也・丹野悠司・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:塚原達也
DOI: 10.7875/first.author.2010.028
Phosphorylation of the CPC by Cdk1 promotes chromosome bi-orientation.
Tatsuya Tsukahara, Yuji Tanno, Yoshinori Watanabe
Nature, 467, 719-723 (2010)
要 約
細胞分裂の際,複製した染色体を2つの娘細胞に均等に分配するためには,ペアをなす姉妹染色分体それぞれが反対極から伸びたスピンドル微小管によって別々に捕らえられる必要がある.しかし,分裂期の初期においては,1本の染色分体が両側からのスピンドル微小管によって捕えられるなど,間違った結合が存在する.染色体パッセンジャー複合体は分裂期に姉妹動原体のあいだに位置するセントロメア領域に局在し,これら間違った結合を特異的に不安定化することで染色体が正しい方向から捕らえられることを保証する役割をはたしている.筆者らは,分裂酵母およびヒト培養細胞を用いた解析から,Cdk1-サイクリンB複合体が分裂期に染色体パッセンジャー複合体のサブユニットをリン酸化することでセントロメアタンパク質Shugoshinとの結合を促進し,染色体パッセンジャー複合体をセントロメアへと局在させていることを明らかにした.これは,これまで細胞周期進行の制御因子と考えられていたCdk1が,染色体の2方向性という染色体分配に必須な過程を染色体パッセンジャー複合体のリン酸化により制御していることをはじめて示したものである.
はじめに
真核生物は増殖や発生の過程で細胞分裂をくり返すが,このとき,複製した染色体を2つの娘細胞に均等に分配する必要がある.染色体の分配ミスはがん化やがんの悪性化,細胞死の原因となることから,その過程は精巧に制御されている.なかでも,分裂期において姉妹染色分体のペアがスピンドル微小管によって両側から捕らえられる過程(染色体の2方向性)は,正確な染色体分配に必須であることが知られている.
1.染色体パッセンジャー複合体は染色体の2方向性の結合に必須の役割をはたす
細胞が染色体の2方向性を確立するためには,分裂期の初期において頻繁に生じる,染色体とスピンドル微小管との間違った結合を修正する必要がある(図1).間違った結合には,1本の染色分体が両側からのスピンドル微小管にとらえられる結合や,姉妹染色分体の双方が同一の極から捕えられる1方向性の結合などがあげられる.染色体パッセンジャー複合体(chromosomal passenger complex:CPC)はAurora B,INCENP,Survivin,Borealinの4者からなる進化的に保存されたタンパク質複合体で,動原体とスピンドル微小管との結合を不安定化する活性をもつ1).分裂期に姉妹動原体(スピンドル微小管の結合部位)のあいだに位置するセントロメア領域に局在するため,間違った結合を特異的に不安定化することができる.染色体の2方向性が確立するとセントロメアと動原体の距離が離れるため,動原体とスピンドル微小管との結合が安定化されるものと考えられている2).このように,染色体の2方向性を確立するためには染色体パッセンジャー複合体がセントロメアへと局在することが重要である.しかし,このセントロメア局在を制御する分子機構はよく理解されていなかった.
2.染色体の2方向性に特異的な欠損を示す分裂酵母サイクリンB変異株
サイクリン依存性キナーゼ(cyclin-dependent kinase:Cdk)とサイクリンとの複合体は細胞周期進行のマスターレギュレーターとして知られている3).なかでも,Cdk1-サイクリンB複合体は分裂期への進行に必須の役割をはたすが,分裂期においても特異的な機能をもつことが示唆されていた4).今回,筆者らは,Cdk1-サイクリンB複合体の分裂期における新たな機能を探索するため,分裂酵母cdc13遺伝子(サイクリンBをコードする)にランダムに変異を導入し,染色体分配に特異的な欠損を示す変異株をスクリーニングした.興味深いことに,得られた変異株のひとつcdc13-M7は,細胞周期の進行にはほとんど欠損を示さなかったが,染色体の2方向性の確立に著しい欠損を示した(染色体の2方向性確立の欠損は,分配ミスや遅滞染色体,分裂後期に染色体が紡錘体の中央部に取り残される状態,として観察される).そこで,染色体パッセンジャー複合体のサブユニットをin vitroでCdk1-サイクリンB複合体によりリン酸化したところ,Bir1-Survivinとよばれるサブユニットがもっともよい基質となること,また,実際に細胞内で分裂期に特異的にBir1がリン酸化されることを見い出した.さらに,cdc13-M7変異株においてBir1のリン酸化レベルが低下していたことからも,Cdk1-サイクリンB複合体がBir1のリン酸化を介して染色体の2方向性の確立に寄与していることが示唆された.
3.染色体パッセンジャー複合体のリン酸化はShugoshinとの相互作用の促進によりセントロメア局在を制御する
bir1非リン酸化型変異株bir1-8Aは染色体パッセンジャー複合体のセントロメア局在に著しい欠損を示し,染色体の2方向性確立に異常を生じた.また,cdc13-M7変異株においても染色体パッセンジャー複合体のセントロメア局在レベルが低下していた.cdc13-M7変異とbir1リン酸化模倣型変異の二重変異株においては,染色体パッセンジャー複合体のセントロメア局在および染色体分配の欠損が回復した.したがって,cdc13-M7変異株における染色体の2方向性確立の欠損がBir1のリン酸化レベルの低下により生じていることが強く示唆された.これらの結果から,Cdk1-サイクリンB複合体によるBir1のリン酸化が染色体パッセンジャー複合体のセントロメア局在に重要な役割をはたすことが明らかになった.
筆者らのグループは,分裂酵母を用いた解析から,進化的に保存されたセントロメアタンパク質Shugoshin(シュゴシン)のひとつSgo2が,Bir1との相互作用を介して染色体パッセンジャー複合体のセントロメア局在を促進することを示していた5).そこで,Cdk1-サイクリンB複合体によるBir1のリン酸化がSgo2との相互作用に必要であるかどうかを検討したところ,ツーハイブリッド解析および免疫沈降の双方において,両者の直接的な結合がCdk1-サイクリンB複合体によるリン酸化に依存することを見い出した.したがって,Cdk1-サイクリンB複合体は染色体パッセンジャー複合体をリン酸化することでShugoshinとの相互作用を促進し,セントロメア局在を制御することが明らかになった.
4.Cdk1-サイクリンB複合体による局在制御機構はヒト培養細胞においても保存されている
Cdk1,染色体パッセンジャー複合体,Shugoshinは,いずれも進化的に保存された因子であることから,分裂酵母で見い出した機構がヒト培養細胞においても保存されているかどうか検討した.はじめに,ヒトにおいてもShugoshinが染色体パッセンジャー複合体のセントロメア局在に必要であるかどうかについて検討したところ,hSgo1およびhSgo2の単独のノックダウン(RNAi)では染色体パッセンジャー複合体のセントロメア局在に顕著な減少はみられなかったが,両者を同時にノックダウンしたところ著しい減少が観察された.つぎに,ツーハイブリッド解析によりヒトShugoshinと相互作用する染色体パッセンジャー複合体のサブユニットを検討したところ,hBorealinがhSgo1およびhSgo2と特異的に相互作用することが明らかになった.さらに,hBorealinがCdk1-サイクリンB複合体の基質となること,また,分裂期特異的にリン酸化されることも見い出した.内在性のhBorealinをノックダウンして非リン酸化型hBorealin(hBorealin-7A)を発現させたところ,染色体パッセンジャー複合体のセントロメア局在および染色体の2方向性の確立に顕著な欠損を示した.さらに,分裂期に同調した細胞をCdk1の活性阻害剤roscovitineで処理すると,染色体パッセンジャー複合体のセントロメア局在レベルが減少し,hBorealinとhSgo1およびhSgo2との相互作用も消失した.これらの結果から,Cdk1-サイクリンB複合体による染色体パッセンジャー複合体のリン酸化が,染色体パッセンジャー複合体のセントロメア局在制御における進化的に保存された中心的な機構であることが明らかになった(図2).
5.Cdk1-サイクリンB複合体にリン酸化される染色体パッセンジャー複合体のサブユニットは進化の過程で変化した
Cdk1-サイクリンB複合体によるリン酸化を介した染色体パッセンジャー複合体のセントロメア局在の制御機構は分裂酵母からヒトにまで保存されているが,リン酸化されるサブユニットは分裂酵母ではBir1-Survivinであるのに対し,ヒトではhBorealinである.分裂酵母Bir1およびヒトhBorealinには進化的に保存されたドメイン以外に構造的に不安定な領域が存在し,そのなかにCdk1-サイクリンB複合体によるリン酸化コンセンサス配列のクラスターをもつ(図2a).一方,分裂酵母BorealinおよびヒトSurvivinは保存されたドメイン以外の配列をほとんどもたず,Cdk1-サイクリンB複合体によるリン酸化コンセンサスのクラスターをもたない.後生動物においてはSurvivinとBorealinの構造がヒトに近く,Borealinに存在するリン酸化コンセンサスのクラスターは保存されている.一方,いくつかの種類の分裂酵母においては,いずれもBir1にリン酸化コンセンサスのクラスターが存在する.これらの知見から,進化の過程でCdk1-サイクリンB複合体によるリン酸化コンセンサスのクラスターがBir1-SurvivinからBorealinへと変化したものと考えられる.サブユニットが変化してもCdk1-サイクリンB複合体によるリン酸化コンセンサスが保存されていることは,このリン酸化制御機構の重要性を示唆していると考えられる.
6.染色体パッセンジャー複合体のセントロメア局在化機構の全体像
今回,筆者らは,Cdk1-サイクリンB複合体による染色体パッセンジャー複合体のリン酸化がShugoshinとの相互作用を促進することで染色体パッセンジャー複合体のセントロメア局在を制御することを明らかにしたが,bir1非リン酸化型変異株やsgo2破壊株においても染色体パッセンジャー複合体のセントロメア局在がわずかながら観察される.これは,セントロメア領域に形成されるヘテロクロマチン構造がCdk1 -Shugoshin経路とは独立に染色体パッセンジャー複合体のセントロメア局在を促進しているためである(図2b).実際,ヘテロクロマチン形成に欠損を生じるswi6遺伝子(ヘテロクロマチンタンパク質HP1をコードする)の破壊株はbir1非リン酸化型変異と合成致死の表現型を示す.最近,筆者らのグループは,このヘテロクロマチン経路がヒストンH3の3番目のスレオニン残基をリン酸化するキナーゼHaspinをセントロメアへと局在化し,Survivinがリン酸化ヒストンH3と直接に結合することで染色体パッセンジャー複合体のセントロメア局在を促進することを見い出した6)(新着論文レビュー でも掲載).一方,Shugoshinは動原体キナーゼBub1によりヒストンH2Aの121番目のセリン残基がリン酸化されたヌクレオソームに結合することでセントロメアに局在することから7),セントロメアに存在するリン酸化ヌクレオソームに結合した染色体パッセンジャー複合体とShugoshinとがCdk1-サイクリンB複合体によるリン酸化に依存して結合するという制御機構が明らかになった.
おわりに
この研究は,染色体パッセンジャー複合体という染色体の2方向性の確立に必須の機能をはたす複合体がセントロメアに局在する機構を分子レベルで明らかにしたものである.さらに,これまで細胞周期の進行を制御すると考えられていたCdk1が染色体の2方向性確立の機能をもつことをはじめて明らかにしたという意味において重要な発見と考えられる.染色体パッセンジャー複合体は分裂後期においては紡錘体へと局在を変化させ,細胞質分裂に必須の役割をはたすことが知られている.染色体パッセンジャー複合体の紡錘体局在にはCdk1-サイクリンB複合体の不活性化が必要であることが示されており8-10),この研究とあわせ,細胞周期に依存的な染色体パッセンジャー複合体のダイナミックな局在の変化がCdk1-サイクリンB複合体の活性レベルにより総合的に制御されていることが明らかになった.このように,Cdk1-サイクリンB複合体は分裂期においてさまざまな因子の細胞周期に依存的な局在の変化や活性の変化を制御する可能性があるものと考えられる.
文 献
- Ruchaud, S., Carmena, M. & Earnshaw, W. C.: Chromosomal passengers:conducting cell division. Nature Rev. Mol. Cell Biol., 8, 798-812 (2007)[PubMed]
- Liu, D., Vader, G., Vromans, M. J. et al.: Sensing chromosome bi-orientation by spatial separation of aurora B kinase from kinetochore substrates. Science, 323, 1350-1353 (2009)[PubMed]
- Nurse, P.: Cyclin dependent kinases and cell cycle control (nobel lecture). Chembiochem, 3, 596-603 (2002)[PubMed]
- Nasmyth, K. & Nurse, P.: Cell division cycle mutants altered in DNA replication and mitosis in the fission yeast Schizosaccharomyces pombe. Mol. Gen. Genet., 182, 119-124 (1981)[PubMed]
- Kawashima, S. A., Tsukahara, T., Langegger, M. et al.: Shugoshin enables tension-generating attachment of kinetochores by loading Aurora to centromeres. Genes Dev., 21, 420-435 (2007)[PubMed]
- Yamagishi, Y., Honda, T., Tanno, Y. et al.: Two histone marks establish the inner centromere and chromosome bi-orientation. Science, 330, 239-243 (2010)[PubMed] [新着論文レビュー]
- Kawashima, S. A., Yamagishi, Y., Honda, T. et al.: Phosphorylation of H2A by Bub1 prevents chromosomal instability through localizing shugoshin. Science, 327, 172-177 (2010)[PubMed]
- Oliveira, R. A., Hamilton, R. S., Pauli, A. et al.: Cohesin cleavage and Cdk inhibition trigger formation of daughter nuclei. Nat. Cell Biol., 12, 185-192 (2010)[PubMed]
- Parry, D. H., Hickson, G. R. & O’Farrell, P. H.: Cyclin B destruction triggers changes in kinetochore behavior essential for successful anaphase. Curr. Biol., 13, 647-653 (2003)[PubMed]
- Pereira, G. & Schiebel, E.: Separase regulates INCENP-Aurora B anaphase spindle function through Cdc14. Science, 302, 2120-2124 (2003)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院理学系研究科博士課程 修了,同年より同 助教.
研究テーマ:脊椎動物の発生分化過程におけるクロマチン修飾の制御機構の解析.
抱負:今年から発生生物学に研究テーマを変えました.メダカとマウスを用い,クロマチン修飾を切り口にさまざまな発生現象にチャレンジしていきたいと思います.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2010 塚原達也・丹野悠司・渡邊嘉典 Licensed under CC 表示 2.1 日本