コンデンシンIによる染色体の軸構造の形成機構
木下和久・平野達也
(理化学研究所 平野染色体ダイナミクス研究室)
email:木下和久,平野達也
DOI: 10.7875/first.author.2015.047
Balancing acts of two HEAT subunits of condensin I support dynamic assembly of chromosome axes.
Kazuhisa Kinoshita, Tetsuya J. Kobayashi, Tatsuya Hirano
Developmental Cell, 33, 94-106 (2015)
コンデンシンIは真核生物においてM期染色体の形成に中心的な役割をはたすタンパク質複合体である.筆者らは,その作用機序を明らかにする目的で,組換え体を用いて野生型のコンデンシンIおよび変異型のコンデンシンIを再構成した.この再構成コンデンシンIとアフリカツメガエル卵抽出液の無細胞系を組み合わせたアッセイ系を確立し,SMCサブユニットによるATPとの結合およびATPの加水分解がコンデンシンIの機能に対し異なる貢献をすること,ATP加水分解サイクルがM期染色体の形成だけでなくその構造の維持にも必要であることを明らかにした.また,2つのHEATサブユニットは異なる機能をもち,染色体の軸構造の形成において拮抗的にはたらくことを見い出した.以上の結果から,コンデンシンIはSMCサブユニットのATP加水分解サイクル,および,2つのHEATサブユニットの拮抗的な作用をとおして,M期染色体におけるダイナミックな軸構造の形成および維持を担うと考えられた.
真核生物におけるM期染色体の形成の過程は,早くも19世紀後半の細胞学者により詳細に観察されており,130年以上の長きにわたり科学者たちを魅了しつづけてきた生物学における大きな問題のひとつである1).その長い研究の歴史にもかかわらず,長大なDNAからいかにして棒状の染色体が形成されるのか,その分子機構はいまだ多くの謎につつまれている.しかし,近年の研究により,コンデンシンIとよばれるタンパク質複合体がこの過程において中心的な役割を担うというコンセンサスが確立しつつある2).コンデンシンIはもともとアフリカツメガエルの卵抽出液から同定されたものであるが,のちの生化学的および遺伝学的な研究から,あらゆる真核生物におけるM期染色体の形成に必須であることが示されている.
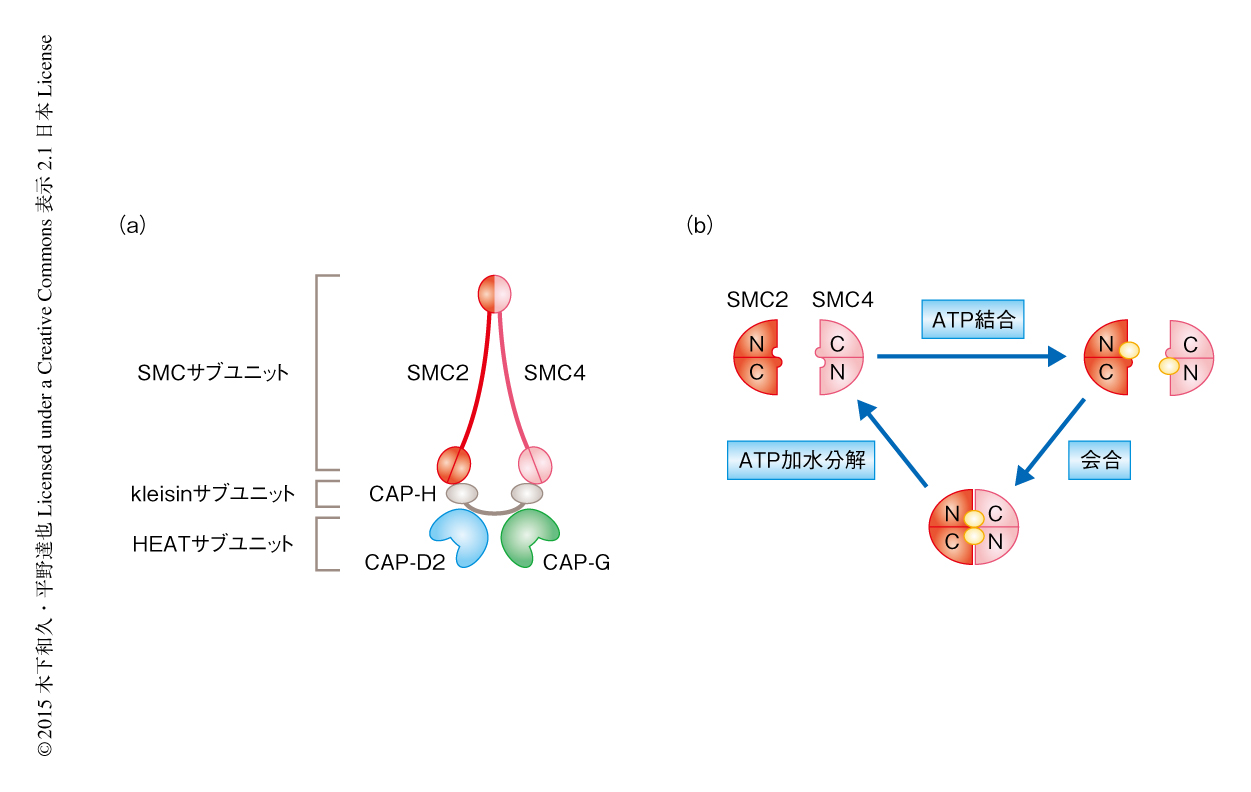
コンデンシンIはユニークな性質をもつ5つのサブユニットから構成されている(図1a).2つのSMCサブユニットSMC2およびSMC4はV字型のコア二量体を形成する.SMCサブユニットはヘッドドメインにABC型のATP結合部位をもつATPaseである(図1b).SMC2とSMC4のそれぞれのヘッドドメインを橋渡しするようにkleisinサブユニットCAP-Hが結合する3).CAP-Hには2つのHEATサブユニットCAP-D2およびCAP-Gが結合する.HEATサブユニットのもつリピート配列は可塑的なソレノイド状の構造を形成し,結合パートナーや環境に応じてそのコンホメーションを大きく変化させるユニークな両親媒性の性質をもつと考えられている4-6).このように,興味深いサブユニット構成およびジオメトリーが明らかにされているものの,コンデンシンIがいかにしてM期染色体の形成にかかわるのか,その作用機序についてはよくわかっていない.これは,コンデンシンIのおのおののサブユニットが細胞の生育に必須であり,ひとつのサブユニットに変異を導入するとコンデンシンIの全体としての安定性が低下してしまうため,通常の遺伝学的な解析により個々のサブユニットの機能を検定するのが困難だからである.
筆者らは,この技術的な困難をのりこえるため,組換え体のサブユニットからなるコンデンシンIをアフリカツメガエルの卵抽出液に導入することにより,変異型のサブユニットを含むコンデンシンIによるM期染色体の形成能を検定することのできる強力なアッセイ系を確立することに成功した.この系では,変異型サブユニットを含むコンデンシンIも野生型のコンデンシンIと同様に卵抽出液において安定に存在するため,個々のサブユニットの機能や点変異の影響を組織的に調べることが可能になる.その結果,これまで未知であったSMCサブユニットによるATPとの結合およびATP加水分解のコンデンシンIの作用への貢献,および,M期染色体のダイナミックな軸構造の形成における2つのHEATサブユニットの役割が明らかにされた.
コンデンシンIを構成する個々のサブユニットの分子機能を理解するためには,組換え体のサブユニットから出発して機能的なコンデンシンIを再構成することが必須である.以前に筆者らは,バキュロウイルスの昆虫細胞発現系を用いて組換え体のサブユニットからヒトのコンデンシンIを再構成した7).しかし,この系ではSMCサブユニットの発現量が乏しく生化学的なアッセイに用いるのに十分な量のコンデンシンIを再構成することができなかった.そこで,異なる生物種のSMCサブユニットの発現コンストラクトを再設計した結果,マウスのSMC2とSMC4の遺伝子を1つの発現用コンストラクトから共発現させる方法により,SMCサブユニットの発現を劇的に改善できることを見い出した.この共発現コンストラクトを用いて発現および精製の方法を最適化した結果,高純度かつ高収量のコンデンシンIの再構成に成功した.さらに,マウスに由来するSMC2およびSMC4とヒトに由来するCAP-D2,CAP-G,CAP-HからなるコンデンシンIが実際に生理的な活性をもつことは,アフリカツメガエル卵抽出液の無細胞系を用いた機能アッセイ系により確かめられた.このアッセイ系では,内在性のコンデンシンIを完全に除去した卵抽出液に再構成されたコンデンシンIを添加し,精子核のクロマチンがM期染色体を形成できるかどうか検定する.この結果,再構成されたコンデンシンIは内在性のコンデンシンIと同じ程度のM期染色体の形成能をもつことが確かめられた.
SMCサブユニットによるATPとの結合とATP加水分解の役割について調べた.SMCコア二量体のヘッドドメインはABC型ATPaseの触媒するATP加水分解により会合と解離のサイクルをくり返す(図1b).SMCサブユニットのヘッドドメインにATP結合のステップを阻害する変異,あるいは,ATP加水分解のステップを遅延させる変異を導入し,2種類の変異型コンデンシンIを再構成した.この再構成コンデンシンIをさきに述べたアッセイ系により調べてみると,いずれの変異型コンデンシンIもM期染色体を形成する能力を失っていた.しかし,ATP結合のステップを阻害する変異を導入したコンデンシンIはクロマチンにほとんど局在しなかったのに対し,ATP加水分解のステップを遅延させる変異を導入したコンデンシンIは野生型のコンデンシンIと同様にクロマチンに局在しており,ATPとの結合のステップとATP加水分解のステップはコンデンシンIの機能に対し異なる貢献をしていることが示唆された.
SMCサブユニットのもつATPase活性の機能についてさらに調べるため,さきのアッセイ系を拡張し新たな実験系を構築した.逐次添加法とよぶこのアッセイ系では,蛍光タンパク質mCherryあるいはEGFPをCAP-Hに融合させた2種類の再構成コンデンシンIを用いる.mCherryにより標識した第1のコンデンシンIの存在のもとでM期染色体を形成させ,そこにEGFPにより標識した第2のコンデンシンIをあとから添加することにより,2種類のコンデンシンIのふるまいを同一の試料において追跡することができる.興味深いことに,野生型のコンデンシンIにより形成させた正常なM期染色体にあとからATP加水分解のステップを遅延させる変異を導入したコンデンシンIを添加すると,染色体の構造が崩壊していくことが観察された.すなわち,ATP加水分解のステップを遅延させる変異をもつコンデンシンIは,染色体においてはたらく野生型のコンデンシンIに対し強いドミナントネガティブ効果をもつと考えられた.この結果から,コンデンシンIのATP加水分解サイクルは染色体の形成のみならず,のちの染色体の構造の維持においても必須であることが示された.
コンデンシンIを構成するおのおののサブユニットの機能について調べるため,1つまたは複数のサブユニットを欠失させたコンデンシンIを再構成した.これら4種類の再構成コンデンシンIを内在性のコンデンシンIを除去したアフリカツメガエル卵抽出液に添加しても,いずれも正常なM期染色体は形成されなかった.2つのHEATサブユニットのいずれか一方を欠失したコンデンシンIはそれぞれ特徴的なふるまいを示したため,これらに注目して解析を進めた.CAP-D2を欠くコンデンシンIはわずかにクロマチンに形態変化を起こしたが明確な1本の染色体の構造を形成することはできず,クロマチンに点状にランダムに分布した(図2).一方,CAP-Gを欠くコンデンシンIはきわめて特徴的な異常な染色体の構造を形成した.すなわち,DAPI染色により,雲状のクロマチン領域の中心に,よりDNA密度の高い軸様の構造が観察されたが,CAP-Gを欠くコンデンシンIは,まさにこの構造に集中して局在した(図2).クロマチンループの形成が不完全な状況においても軸構造は独立に形成されるという意味において,この表現型は興味深いものであった.
2つのHEATサブユニットの役割をさらに調べるため逐次添加法により調べたところ,CAP-D2を欠くコンデンシンIおよびCAP-Gを欠くコンデンシンIは,野生型のコンデンシンIの形成する染色体の軸構造に対しきわめて対照的な効果を及ぼすことがわかった.あとから添加したCAP-Gを欠くコンデンシンIは染色体の軸構造に選択的に取り込まれ,その結果,染色体は全体が劇的に伸長した(図2).一方,CAP-D2を欠くコンデンシンIをあとから添加すると染色体の軸構造が崩壊してしまったことから,CAP-D2を欠くコンデンシンIは野生型のコンデンシンIに対しドミナントネガティブな効果を及ぼしていると考えられた(図2).
以上の結果から,コンデンシンIの作用において,CAP-D2が染色体の軸構造を安定化させる方向にはたらくのに対し,CAP-Gは染色体の軸構造を不安定化する方向にはたらくことが示唆された.これらのことから,この2つのHEATサブユニットが拮抗してはたらくことにより,はじめて染色体においてダイナミックな軸構造が形成され維持されるというモデルを提唱した(図2).
コンデンシンIの2つのHEATサブユニットが染色体の軸構造の形成に必須であるという知見は,M期染色体の形態を進化的な観点から考えるうえできわめて重要である.細菌のコンデンシン様複合体にはSMCサブユニットおよびkleisinサブユニットは保存されているが,HEATサブユニットに相当するサブユニットは存在しない.すなわち,真核生物はコンデンシンがHEATサブユニットを獲得したことにより染色体の軸構造を形成できるようになり,その結果,真核生物に特有の細長い棒状のM期染色体の構造が実現したのではないかと推測された.HEATサブユニットのはたらきにより形成される染色体の軸構造を理解することは,真核生物におけるM期染色体の形成を理解するためのまさに本質である.今後は,さらにこのアッセイ系を駆使してコンデンシンIおよびHEATサブユニットの作用機序を明らかにし,染色体の軸構造の分子的な実体を解明したい.
略歴:1998年 京都大学大学院理学研究科 修了,同年 ドイツEuropean Molecular Biology Laboratory,2000年 ドイツMax Planck Institute of Molecular Cell Biology and Genetics,2006年 京都大学大学院生命科学研究科を経て,2007年より理化学研究所 専任研究員.
平野 達也(Tatsuya Hirano)
理化学研究所 主任研究員.
研究室URL:http://www.riken.jp/chromdyna/index.html
© 2015 木下和久・平野達也 Licensed under CC 表示 2.1 日本
(理化学研究所 平野染色体ダイナミクス研究室)
email:木下和久,平野達也
DOI: 10.7875/first.author.2015.047
Balancing acts of two HEAT subunits of condensin I support dynamic assembly of chromosome axes.
Kazuhisa Kinoshita, Tetsuya J. Kobayashi, Tatsuya Hirano
Developmental Cell, 33, 94-106 (2015)
要 約
コンデンシンIは真核生物においてM期染色体の形成に中心的な役割をはたすタンパク質複合体である.筆者らは,その作用機序を明らかにする目的で,組換え体を用いて野生型のコンデンシンIおよび変異型のコンデンシンIを再構成した.この再構成コンデンシンIとアフリカツメガエル卵抽出液の無細胞系を組み合わせたアッセイ系を確立し,SMCサブユニットによるATPとの結合およびATPの加水分解がコンデンシンIの機能に対し異なる貢献をすること,ATP加水分解サイクルがM期染色体の形成だけでなくその構造の維持にも必要であることを明らかにした.また,2つのHEATサブユニットは異なる機能をもち,染色体の軸構造の形成において拮抗的にはたらくことを見い出した.以上の結果から,コンデンシンIはSMCサブユニットのATP加水分解サイクル,および,2つのHEATサブユニットの拮抗的な作用をとおして,M期染色体におけるダイナミックな軸構造の形成および維持を担うと考えられた.
はじめに
真核生物におけるM期染色体の形成の過程は,早くも19世紀後半の細胞学者により詳細に観察されており,130年以上の長きにわたり科学者たちを魅了しつづけてきた生物学における大きな問題のひとつである1).その長い研究の歴史にもかかわらず,長大なDNAからいかにして棒状の染色体が形成されるのか,その分子機構はいまだ多くの謎につつまれている.しかし,近年の研究により,コンデンシンIとよばれるタンパク質複合体がこの過程において中心的な役割を担うというコンセンサスが確立しつつある2).コンデンシンIはもともとアフリカツメガエルの卵抽出液から同定されたものであるが,のちの生化学的および遺伝学的な研究から,あらゆる真核生物におけるM期染色体の形成に必須であることが示されている.
コンデンシンIはユニークな性質をもつ5つのサブユニットから構成されている(図1a).2つのSMCサブユニットSMC2およびSMC4はV字型のコア二量体を形成する.SMCサブユニットはヘッドドメインにABC型のATP結合部位をもつATPaseである(図1b).SMC2とSMC4のそれぞれのヘッドドメインを橋渡しするようにkleisinサブユニットCAP-Hが結合する3).CAP-Hには2つのHEATサブユニットCAP-D2およびCAP-Gが結合する.HEATサブユニットのもつリピート配列は可塑的なソレノイド状の構造を形成し,結合パートナーや環境に応じてそのコンホメーションを大きく変化させるユニークな両親媒性の性質をもつと考えられている4-6).このように,興味深いサブユニット構成およびジオメトリーが明らかにされているものの,コンデンシンIがいかにしてM期染色体の形成にかかわるのか,その作用機序についてはよくわかっていない.これは,コンデンシンIのおのおののサブユニットが細胞の生育に必須であり,ひとつのサブユニットに変異を導入するとコンデンシンIの全体としての安定性が低下してしまうため,通常の遺伝学的な解析により個々のサブユニットの機能を検定するのが困難だからである.
筆者らは,この技術的な困難をのりこえるため,組換え体のサブユニットからなるコンデンシンIをアフリカツメガエルの卵抽出液に導入することにより,変異型のサブユニットを含むコンデンシンIによるM期染色体の形成能を検定することのできる強力なアッセイ系を確立することに成功した.この系では,変異型サブユニットを含むコンデンシンIも野生型のコンデンシンIと同様に卵抽出液において安定に存在するため,個々のサブユニットの機能や点変異の影響を組織的に調べることが可能になる.その結果,これまで未知であったSMCサブユニットによるATPとの結合およびATP加水分解のコンデンシンIの作用への貢献,および,M期染色体のダイナミックな軸構造の形成における2つのHEATサブユニットの役割が明らかにされた.
1.組換え体のサブユニットからなる機能的なコンデンシンIの再構成
コンデンシンIを構成する個々のサブユニットの分子機能を理解するためには,組換え体のサブユニットから出発して機能的なコンデンシンIを再構成することが必須である.以前に筆者らは,バキュロウイルスの昆虫細胞発現系を用いて組換え体のサブユニットからヒトのコンデンシンIを再構成した7).しかし,この系ではSMCサブユニットの発現量が乏しく生化学的なアッセイに用いるのに十分な量のコンデンシンIを再構成することができなかった.そこで,異なる生物種のSMCサブユニットの発現コンストラクトを再設計した結果,マウスのSMC2とSMC4の遺伝子を1つの発現用コンストラクトから共発現させる方法により,SMCサブユニットの発現を劇的に改善できることを見い出した.この共発現コンストラクトを用いて発現および精製の方法を最適化した結果,高純度かつ高収量のコンデンシンIの再構成に成功した.さらに,マウスに由来するSMC2およびSMC4とヒトに由来するCAP-D2,CAP-G,CAP-HからなるコンデンシンIが実際に生理的な活性をもつことは,アフリカツメガエル卵抽出液の無細胞系を用いた機能アッセイ系により確かめられた.このアッセイ系では,内在性のコンデンシンIを完全に除去した卵抽出液に再構成されたコンデンシンIを添加し,精子核のクロマチンがM期染色体を形成できるかどうか検定する.この結果,再構成されたコンデンシンIは内在性のコンデンシンIと同じ程度のM期染色体の形成能をもつことが確かめられた.
2.コンデンシンIの作用におけるSMCサブユニットによるATP加水分解サイクルの貢献
SMCサブユニットによるATPとの結合とATP加水分解の役割について調べた.SMCコア二量体のヘッドドメインはABC型ATPaseの触媒するATP加水分解により会合と解離のサイクルをくり返す(図1b).SMCサブユニットのヘッドドメインにATP結合のステップを阻害する変異,あるいは,ATP加水分解のステップを遅延させる変異を導入し,2種類の変異型コンデンシンIを再構成した.この再構成コンデンシンIをさきに述べたアッセイ系により調べてみると,いずれの変異型コンデンシンIもM期染色体を形成する能力を失っていた.しかし,ATP結合のステップを阻害する変異を導入したコンデンシンIはクロマチンにほとんど局在しなかったのに対し,ATP加水分解のステップを遅延させる変異を導入したコンデンシンIは野生型のコンデンシンIと同様にクロマチンに局在しており,ATPとの結合のステップとATP加水分解のステップはコンデンシンIの機能に対し異なる貢献をしていることが示唆された.
SMCサブユニットのもつATPase活性の機能についてさらに調べるため,さきのアッセイ系を拡張し新たな実験系を構築した.逐次添加法とよぶこのアッセイ系では,蛍光タンパク質mCherryあるいはEGFPをCAP-Hに融合させた2種類の再構成コンデンシンIを用いる.mCherryにより標識した第1のコンデンシンIの存在のもとでM期染色体を形成させ,そこにEGFPにより標識した第2のコンデンシンIをあとから添加することにより,2種類のコンデンシンIのふるまいを同一の試料において追跡することができる.興味深いことに,野生型のコンデンシンIにより形成させた正常なM期染色体にあとからATP加水分解のステップを遅延させる変異を導入したコンデンシンIを添加すると,染色体の構造が崩壊していくことが観察された.すなわち,ATP加水分解のステップを遅延させる変異をもつコンデンシンIは,染色体においてはたらく野生型のコンデンシンIに対し強いドミナントネガティブ効果をもつと考えられた.この結果から,コンデンシンIのATP加水分解サイクルは染色体の形成のみならず,のちの染色体の構造の維持においても必須であることが示された.
3.染色体の軸構造の形成および維持における2つのHEATサブユニットのもつ役割
コンデンシンIを構成するおのおののサブユニットの機能について調べるため,1つまたは複数のサブユニットを欠失させたコンデンシンIを再構成した.これら4種類の再構成コンデンシンIを内在性のコンデンシンIを除去したアフリカツメガエル卵抽出液に添加しても,いずれも正常なM期染色体は形成されなかった.2つのHEATサブユニットのいずれか一方を欠失したコンデンシンIはそれぞれ特徴的なふるまいを示したため,これらに注目して解析を進めた.CAP-D2を欠くコンデンシンIはわずかにクロマチンに形態変化を起こしたが明確な1本の染色体の構造を形成することはできず,クロマチンに点状にランダムに分布した(図2).一方,CAP-Gを欠くコンデンシンIはきわめて特徴的な異常な染色体の構造を形成した.すなわち,DAPI染色により,雲状のクロマチン領域の中心に,よりDNA密度の高い軸様の構造が観察されたが,CAP-Gを欠くコンデンシンIは,まさにこの構造に集中して局在した(図2).クロマチンループの形成が不完全な状況においても軸構造は独立に形成されるという意味において,この表現型は興味深いものであった.
2つのHEATサブユニットの役割をさらに調べるため逐次添加法により調べたところ,CAP-D2を欠くコンデンシンIおよびCAP-Gを欠くコンデンシンIは,野生型のコンデンシンIの形成する染色体の軸構造に対しきわめて対照的な効果を及ぼすことがわかった.あとから添加したCAP-Gを欠くコンデンシンIは染色体の軸構造に選択的に取り込まれ,その結果,染色体は全体が劇的に伸長した(図2).一方,CAP-D2を欠くコンデンシンIをあとから添加すると染色体の軸構造が崩壊してしまったことから,CAP-D2を欠くコンデンシンIは野生型のコンデンシンIに対しドミナントネガティブな効果を及ぼしていると考えられた(図2).
以上の結果から,コンデンシンIの作用において,CAP-D2が染色体の軸構造を安定化させる方向にはたらくのに対し,CAP-Gは染色体の軸構造を不安定化する方向にはたらくことが示唆された.これらのことから,この2つのHEATサブユニットが拮抗してはたらくことにより,はじめて染色体においてダイナミックな軸構造が形成され維持されるというモデルを提唱した(図2).
おわりに
コンデンシンIの2つのHEATサブユニットが染色体の軸構造の形成に必須であるという知見は,M期染色体の形態を進化的な観点から考えるうえできわめて重要である.細菌のコンデンシン様複合体にはSMCサブユニットおよびkleisinサブユニットは保存されているが,HEATサブユニットに相当するサブユニットは存在しない.すなわち,真核生物はコンデンシンがHEATサブユニットを獲得したことにより染色体の軸構造を形成できるようになり,その結果,真核生物に特有の細長い棒状のM期染色体の構造が実現したのではないかと推測された.HEATサブユニットのはたらきにより形成される染色体の軸構造を理解することは,真核生物におけるM期染色体の形成を理解するためのまさに本質である.今後は,さらにこのアッセイ系を駆使してコンデンシンIおよびHEATサブユニットの作用機序を明らかにし,染色体の軸構造の分子的な実体を解明したい.
文 献
- Flemming, W.: Zellsubstantz, Kern und Zelltheilung. F. C. W. Vogel, Leipzig (1882)
- Hirano, T.: Condensins: universal organizers of chromosomes with diverse functions. Genes Dev., 26, 1659-1678 (2012)[PubMed]
- Schleiffer, A., Kaitna, S., Maurer-Stroh, S. et al.: Kleisins: a superfamily of bacterial and eukaryotic SMC protein partners. Mol. Cell, 11, 571-575 (2003)[PubMed]
- Forwood, J. K., Lange, A., Zachariae, U. et al.: Quantitative structural analysis of importin-β flexibility: paradigm for solenoid protein structures. Structure, 18, 1171-1183 (2010)[PubMed]
- Grinthal, A., Adamovic, I., Weiner, B. et al.: PR65, the HEAT-repeat scaffold of phosphatase PP2A, is an elastic connector that links force and catalysis. Proc. Natl. Acad. Sci. USA, 107, 2467-2472 (2011)[PubMed]
- Yoshimura, S. H., Kumeta, M. & Takeyasu, K.: Structural mechanism of nuclear transport mediated by importin β and flexible amphiphilic proteins. Structure, 22, 1699-1710 (2014)[PubMed]
- Onn, I., Aono, N., Hirano, M. et al.: Reconstitution and subunit geometry of human condensin complexes. EMBO J., 26, 1024-1034 (2007)[PubMed]
著者プロフィール
略歴:1998年 京都大学大学院理学研究科 修了,同年 ドイツEuropean Molecular Biology Laboratory,2000年 ドイツMax Planck Institute of Molecular Cell Biology and Genetics,2006年 京都大学大学院生命科学研究科を経て,2007年より理化学研究所 専任研究員.
平野 達也(Tatsuya Hirano)
理化学研究所 主任研究員.
研究室URL:http://www.riken.jp/chromdyna/index.html
© 2015 木下和久・平野達也 Licensed under CC 表示 2.1 日本