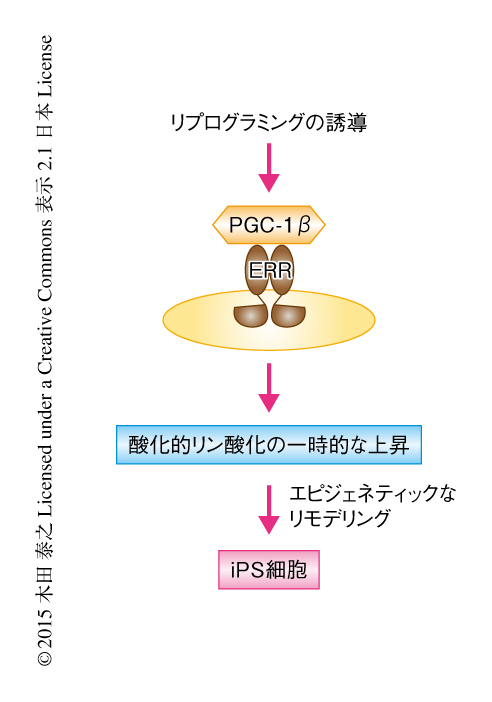
体細胞の初期化の過程において核内受容体型の転写因子ERRによるメタボリックスイッチによりiPS細胞が誘導される
木田 泰之
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:木田泰之
DOI: 10.7875/first.author.2015.046
ERRs mediate a metabolic switch required for somatic cell reprogramming to pluripotency.
Yasuyuki S. Kida, Teruhisa Kawamura, Zong Wei, Takahiro Sogo, Sandra Jacinto, Asako Shigeno, Hiroko Kushige, Eiji Yoshihara, Christopher Liddle, Joseph R. Ecker, Ruth T. Yu, Annette R. Atkins, Michael Downes, Ronald M. Evans
Cell Stem Cell, 16, 547-555 (2015)
筆者らは,細胞におけるエネルギー代謝に着目し,iPS細胞の誘導の過程における細胞内代謝の変化およびその制御遺伝子の同定を試みた.体細胞の初期化の過程にある細胞において,解糖系のレベル,酸化的リン酸化のレベル,ATP産生能を測定した.iPS細胞はその強い増殖能のため解糖系の代謝経路が強くはたらいており,ミトコンドリアにおける酸化的リン酸化の代謝経路は抑制されている.しかし,体細胞の初期化の過程においては,解糖系の代謝経路の強い誘導と同時に,一時的な酸化的リン酸化の上昇がみられた.さらに,これら細胞内代謝の変換は核内受容体型の転写因子であるERRに依存しており,その機能の阻害により細胞内代謝の変換は起こらなくなりiPS細胞への誘導は完全に阻害された.さらに,ERRが強く発現する細胞を分取することのできる細胞表面抗原を見い出し,それを指標として細胞を分取することによりiPS細胞の作製効率を飛躍的に上昇させることに成功した.
多能性幹細胞や体性幹細胞は再生医療への応用が期待されている.線維芽細胞などの体細胞に4つの転写因子Oct4,Sox2,Klf4,c-Mycを強制発現させることにより樹立されるiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)は1,2),ES細胞のもつ倫理的な問題や移植の際の免疫拒絶の問題を克服し,再生医療,薬剤スクリーニング,オーダーメード医療といった先進医療の有効なツールとして世界的に注目されている.筆者らも,脂肪組織の体性幹細胞から高い効率でiPS細胞を誘導する技術を開発している3,4).しかし,細胞種や方法によらず低いiPS細胞の樹立の効率や細胞株のあいだでの質の不均一性,とくに,一定しない分化の効率,移植ののちの腫瘍の形成など,実用化にむけて克服すべき課題も多い.
体細胞の初期化の過程においては,DNAの損傷や変異,エピジェネティクスの変化,遺伝子発現の変化など,さまざまな現象がひき起こされることが知られている.筆者らは,体細胞はどのように初期化されるのか,その分子機構に興味をもってきた.以前に筆者らは,iPS細胞とその材料になった細胞とのあいだに生じたDNAメチル化の変化および転写の状態の変化から,iPS細胞におけるプロモーター配列のCG含量,メチル化シトシンの割合,その遺伝子の発現を指標としたエピゲノムのプロファイリングを行った5,6).また,体細胞とiPS細胞とのあいだには細胞における代謝経路に大きな違いのあることを見い出した7).しかし,このような大きな変化が,いつどのように,どういったシグナルにより制御されているのか,体細胞の初期化の分子機構やその責任遺伝子は明らかにされていない.この研究は,細胞内代謝の変動および遺伝子発現の変化について解明し,体細胞の初期化の機構の一端を明らかにすることを目的にした.
細胞におけるエネルギー代謝は,細胞の外部のさまざまな環境に順応し特異的な変化を誘導することにより細胞の分化を制御している.また,細胞におけるエネルギー代謝は約50個の核内受容体型の転写因子により厳密に制御されていることが知られている8).そこで,核内受容体の転写因子をコードする遺伝子に着目し,それらのうちマウスおよびヒトの体細胞の初期化において,その初期に発現の大きく変動する遺伝子を抽出した.その結果,マウスおよびヒトにおいて共通する5個の核内受容体の転写因子をコードする遺伝子がみつかり,そのうち,ERRαをコードする遺伝子およびERRγをコードする遺伝子に着目した.これらの遺伝子のノックアウトマウスは胎生致死ではないが,驚いたことに,機能の阻害あるいは欠損によりiPS細胞はまったくできなくなることがわかった.
ERRαおよびERRγは骨格筋や心筋においてミトコンドリアの量を増加させ活性化させることが知られており,細胞における代謝経路を制御するマスター転写因子のひとつである9).体細胞の初期化の過程にある細胞において生体エネルギーアッセイを行い解糖系のレベルおよび酸化的リン酸化のレベルを測定した.iPS細胞およびES細胞はその強い増殖能のため解糖系の代謝経路が強くはたらいており,ミトコンドリアにおける酸化的リン酸化の代謝経路は抑制されている.しかし,体細胞の初期化の過程においては解糖系の代謝経路の強い誘導と同時に,酸化的リン酸化の一時的な上昇が認められ,高いエネルギー状態にあることがわかった.そして,この酸化的リン酸化の一時的な上昇はERRαおよびERRγの制御のもとにあり,ERRαおよびERRγの発現,および,酸化的リン酸化の一時的な上昇が認められた時期にのみ,酸化的リン酸化の阻害剤により阻害されることがわかった.
これまでの一般的なiPS細胞の作製法ではiPS細胞は数%しか誘導されないことから,体細胞の初期化の過程においてほんの一部の細胞のみがiPS細胞の前駆細胞になることが予想された.そこで,ERRαおよびERRγが介する高いエネルギー状態にある細胞の分取を試みた.さまざまな細胞表面抗原について検討したところ,Sca1陰性CD34陰性の画分にはERRγおよびその補因子であるPGC-1βが強く発現しており,解糖系の代謝経路が活性化し酸化的リン酸化が上昇している高いエネルギー状態にあることがわかった.そして,この画分からのiPS細胞の誘導の効率は35%をこえた.この画分から作製されたiPS細胞はキメラマウスの作製や生殖細胞系譜への分化が可能であったことから,分化万能性を獲得していることが確認された.ほかの画分からはiPS細胞はあまり誘導されなかったことから,ERRαおよびERRγの介する高いエネルギー状態にある細胞の集団にiPS細胞の前駆細胞が多く含まれると考えられた.
以上の結果から,体細胞の初期化の過程にある細胞は,ERRαおよびERRγを介する解糖系の代謝経路の持続的な誘導,および,酸化的リン酸化の代謝経路の一時的な活性化というメタボリックスイッチにより,iPS細胞へと誘導されることが明らかにされた(図1).
iPS細胞は無限の自己複製能と多分化能をもつため,再生医療への実用化が期待される一方,その安全性に関する基礎的な検証が今後の課題とされている.体細胞が初期化され多能性を獲得する過程において,転写の起こる環境,すなわち,エピジェネティクスの変化にともない遺伝子発現のグローバルな変化が起こる.同時に,細胞においては,増殖,細胞死,老化,DNAの損傷,上皮様の形態の変化といった種々の重要なイベントが生じる.この研究により,これまで困難とされた,体細胞の初期化の過程において将来的にiPS細胞になる可能性の高い細胞にしぼった解析が可能になった.
ERRαおよびERRγはとくに心筋や骨格筋においてミトコンドリアにおける酸化的リン酸化を制御している.この酸化的リン酸化,すなわち,酸素を消費するATPの産生は,同時に酸化ストレスの原因になる活性酸素をも生じ,この機構によりiPS細胞においてはDNAの損傷が起こっていると予想される.よって,ERRαおよびERRγの介する高いエネルギー状態にある細胞を制御することにより,より安全なiPS細胞の作製法を開発することが可能かもしれない.また,その成果はiPS細胞を用いた安全性の高い再生医療の実用化だけでなく,生体において細胞が大きく変化するがんやメタボリック症候群などに対する新たな治療法の開発にも貢献すると考えられる.
略歴:2004年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 東北大学加齢医学研究所 助教,2008年 米国Salk Institute for Biological StudiesにてResearch Associateを経て,2012年より産業技術総合研究所幹細胞工学研究センター 主任研究員.
研究テーマ:細胞の分化,初期化,がん化を制御する分子機構.
関心事:間葉系幹細胞の可塑性.
© 2015 木田 泰之 Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:木田泰之
DOI: 10.7875/first.author.2015.046
ERRs mediate a metabolic switch required for somatic cell reprogramming to pluripotency.
Yasuyuki S. Kida, Teruhisa Kawamura, Zong Wei, Takahiro Sogo, Sandra Jacinto, Asako Shigeno, Hiroko Kushige, Eiji Yoshihara, Christopher Liddle, Joseph R. Ecker, Ruth T. Yu, Annette R. Atkins, Michael Downes, Ronald M. Evans
Cell Stem Cell, 16, 547-555 (2015)
要 約
筆者らは,細胞におけるエネルギー代謝に着目し,iPS細胞の誘導の過程における細胞内代謝の変化およびその制御遺伝子の同定を試みた.体細胞の初期化の過程にある細胞において,解糖系のレベル,酸化的リン酸化のレベル,ATP産生能を測定した.iPS細胞はその強い増殖能のため解糖系の代謝経路が強くはたらいており,ミトコンドリアにおける酸化的リン酸化の代謝経路は抑制されている.しかし,体細胞の初期化の過程においては,解糖系の代謝経路の強い誘導と同時に,一時的な酸化的リン酸化の上昇がみられた.さらに,これら細胞内代謝の変換は核内受容体型の転写因子であるERRに依存しており,その機能の阻害により細胞内代謝の変換は起こらなくなりiPS細胞への誘導は完全に阻害された.さらに,ERRが強く発現する細胞を分取することのできる細胞表面抗原を見い出し,それを指標として細胞を分取することによりiPS細胞の作製効率を飛躍的に上昇させることに成功した.
はじめに
多能性幹細胞や体性幹細胞は再生医療への応用が期待されている.線維芽細胞などの体細胞に4つの転写因子Oct4,Sox2,Klf4,c-Mycを強制発現させることにより樹立されるiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)は1,2),ES細胞のもつ倫理的な問題や移植の際の免疫拒絶の問題を克服し,再生医療,薬剤スクリーニング,オーダーメード医療といった先進医療の有効なツールとして世界的に注目されている.筆者らも,脂肪組織の体性幹細胞から高い効率でiPS細胞を誘導する技術を開発している3,4).しかし,細胞種や方法によらず低いiPS細胞の樹立の効率や細胞株のあいだでの質の不均一性,とくに,一定しない分化の効率,移植ののちの腫瘍の形成など,実用化にむけて克服すべき課題も多い.
体細胞の初期化の過程においては,DNAの損傷や変異,エピジェネティクスの変化,遺伝子発現の変化など,さまざまな現象がひき起こされることが知られている.筆者らは,体細胞はどのように初期化されるのか,その分子機構に興味をもってきた.以前に筆者らは,iPS細胞とその材料になった細胞とのあいだに生じたDNAメチル化の変化および転写の状態の変化から,iPS細胞におけるプロモーター配列のCG含量,メチル化シトシンの割合,その遺伝子の発現を指標としたエピゲノムのプロファイリングを行った5,6).また,体細胞とiPS細胞とのあいだには細胞における代謝経路に大きな違いのあることを見い出した7).しかし,このような大きな変化が,いつどのように,どういったシグナルにより制御されているのか,体細胞の初期化の分子機構やその責任遺伝子は明らかにされていない.この研究は,細胞内代謝の変動および遺伝子発現の変化について解明し,体細胞の初期化の機構の一端を明らかにすることを目的にした.
1.ERRは体細胞の初期化の過程において細胞に高いエネルギー状態を誘導する
細胞におけるエネルギー代謝は,細胞の外部のさまざまな環境に順応し特異的な変化を誘導することにより細胞の分化を制御している.また,細胞におけるエネルギー代謝は約50個の核内受容体型の転写因子により厳密に制御されていることが知られている8).そこで,核内受容体の転写因子をコードする遺伝子に着目し,それらのうちマウスおよびヒトの体細胞の初期化において,その初期に発現の大きく変動する遺伝子を抽出した.その結果,マウスおよびヒトにおいて共通する5個の核内受容体の転写因子をコードする遺伝子がみつかり,そのうち,ERRαをコードする遺伝子およびERRγをコードする遺伝子に着目した.これらの遺伝子のノックアウトマウスは胎生致死ではないが,驚いたことに,機能の阻害あるいは欠損によりiPS細胞はまったくできなくなることがわかった.
ERRαおよびERRγは骨格筋や心筋においてミトコンドリアの量を増加させ活性化させることが知られており,細胞における代謝経路を制御するマスター転写因子のひとつである9).体細胞の初期化の過程にある細胞において生体エネルギーアッセイを行い解糖系のレベルおよび酸化的リン酸化のレベルを測定した.iPS細胞およびES細胞はその強い増殖能のため解糖系の代謝経路が強くはたらいており,ミトコンドリアにおける酸化的リン酸化の代謝経路は抑制されている.しかし,体細胞の初期化の過程においては解糖系の代謝経路の強い誘導と同時に,酸化的リン酸化の一時的な上昇が認められ,高いエネルギー状態にあることがわかった.そして,この酸化的リン酸化の一時的な上昇はERRαおよびERRγの制御のもとにあり,ERRαおよびERRγの発現,および,酸化的リン酸化の一時的な上昇が認められた時期にのみ,酸化的リン酸化の阻害剤により阻害されることがわかった.
2.ERRγの発現が高くiPS細胞の前駆細胞が多く含まれる細胞の分取
これまでの一般的なiPS細胞の作製法ではiPS細胞は数%しか誘導されないことから,体細胞の初期化の過程においてほんの一部の細胞のみがiPS細胞の前駆細胞になることが予想された.そこで,ERRαおよびERRγが介する高いエネルギー状態にある細胞の分取を試みた.さまざまな細胞表面抗原について検討したところ,Sca1陰性CD34陰性の画分にはERRγおよびその補因子であるPGC-1βが強く発現しており,解糖系の代謝経路が活性化し酸化的リン酸化が上昇している高いエネルギー状態にあることがわかった.そして,この画分からのiPS細胞の誘導の効率は35%をこえた.この画分から作製されたiPS細胞はキメラマウスの作製や生殖細胞系譜への分化が可能であったことから,分化万能性を獲得していることが確認された.ほかの画分からはiPS細胞はあまり誘導されなかったことから,ERRαおよびERRγの介する高いエネルギー状態にある細胞の集団にiPS細胞の前駆細胞が多く含まれると考えられた.
おわりに
以上の結果から,体細胞の初期化の過程にある細胞は,ERRαおよびERRγを介する解糖系の代謝経路の持続的な誘導,および,酸化的リン酸化の代謝経路の一時的な活性化というメタボリックスイッチにより,iPS細胞へと誘導されることが明らかにされた(図1).
iPS細胞は無限の自己複製能と多分化能をもつため,再生医療への実用化が期待される一方,その安全性に関する基礎的な検証が今後の課題とされている.体細胞が初期化され多能性を獲得する過程において,転写の起こる環境,すなわち,エピジェネティクスの変化にともない遺伝子発現のグローバルな変化が起こる.同時に,細胞においては,増殖,細胞死,老化,DNAの損傷,上皮様の形態の変化といった種々の重要なイベントが生じる.この研究により,これまで困難とされた,体細胞の初期化の過程において将来的にiPS細胞になる可能性の高い細胞にしぼった解析が可能になった.
ERRαおよびERRγはとくに心筋や骨格筋においてミトコンドリアにおける酸化的リン酸化を制御している.この酸化的リン酸化,すなわち,酸素を消費するATPの産生は,同時に酸化ストレスの原因になる活性酸素をも生じ,この機構によりiPS細胞においてはDNAの損傷が起こっていると予想される.よって,ERRαおよびERRγの介する高いエネルギー状態にある細胞を制御することにより,より安全なiPS細胞の作製法を開発することが可能かもしれない.また,その成果はiPS細胞を用いた安全性の高い再生医療の実用化だけでなく,生体において細胞が大きく変化するがんやメタボリック症候群などに対する新たな治療法の開発にも貢献すると考えられる.
文 献
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Takahashi, K., Tanabe, K., Ohnuki, M. et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131, 861-872 (2007)[PubMed]
- Sugii, S., Kida, Y., Kawamura, T. et al.: Human and mouse adipose-derived cells support feeder-independent induction of pluripotent stem cells. Proc. Natl. Acad. Sci. USA, 107, 3558-3563 (2010)[PubMed]
- Sugii, S., Kida, Y., Berggren, W. T. et al.: Feeder-dependent and feeder-independent iPS cell derivation from human and mouse adipose stem cells. Nat. Protoc., 6, 346-358 (2011)[PubMed]
- Lister, R., Pelizzola, M., Kida, Y. S. et al.: Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells. Nature, 471, 68-73 (2011)[PubMed]
- Takada, H., Saito, Y., Mituyama, T. et al.: Methylome, transcriptome, and PPARγ cistrome analyses reveal two epigenetic transitions in fat cells. Epigenetics, 9, 1195-1206 (2014)[PubMed]
- Panopoulos, A. D., Yanes, O., Ruiz, S. et al.: The metabolome of induced pluripotent stem cells reveals metabolic changes occurring in somatic cell reprogramming. Cell Res., 22, 168-177 (2012)[PubMed]
- Bookout, A. L., Jeong, Y., Downes, M. et al.: Anatomical profiling of nuclear receptor expression reveals a hierarchical transcriptional network. Cell, 126, 789-799 (2006)[PubMed]
- Dufour, C. R., Wilson, B. J., Huss, L. M. et al.: Genome-wide orchestration of cardiac functions by the orphan nuclear receptors ERRα and γ. Cell Metab., 5, 345-356 (2007)[PubMed]
著者プロフィール
略歴:2004年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 東北大学加齢医学研究所 助教,2008年 米国Salk Institute for Biological StudiesにてResearch Associateを経て,2012年より産業技術総合研究所幹細胞工学研究センター 主任研究員.
研究テーマ:細胞の分化,初期化,がん化を制御する分子機構.
関心事:間葉系幹細胞の可塑性.
© 2015 木田 泰之 Licensed under CC 表示 2.1 日本