転写共役因子YAPは脊椎動物の3次元的な形態を生み出す組織張力の制御に必要不可欠である
浅岡洋一1・古谷-清木 誠2・Carl-Philipp Heisenberg 3・仁科博史1
(1東京医科歯科大学難治疾患研究所 発生再生生物学分野,2英国Bath大学Department of Biology and Biochemistry,3オーストリアInstitute of Science and Technology)
email:浅岡洋一,古谷-清木 誠,仁科博史
DOI: 10.7875/first.author.2015.038
YAP is essential for tissue tension to ensure vertebrate 3D body shape.
Sean Porazinski, Huijia Wang, Yoichi Asaoka, Martin Behrndt, Tatsuo Miyamoto, Hitoshi Morita, Shoji Hata, Takashi Sasaki, S. F. Gabriel Krens, Yumi Osada, Satoshi Asaka, Akihiro Momoi, Sarah Linton, Joel B. Miesfeld, Brian A. Link, Takeshi Senga, Atahualpa Castillo-Morales, Araxi O. Urrutia, Nobuyoshi Shimizu, Hideaki Nagase, Shinya Matsuura, Stefan Bagby, Hisato Kondoh, Hiroshi Nishina, Carl-Philipp Heisenberg, Makoto Furutani-Seiki
Nature, 521,217-221 (2015)
脊椎動物のからだは3次元的な形態をもち,組織や器官が正しくかたちづくられ適切に配置されることにより,はじめて機能を発揮する.こうした3次元的な形態形成の場において組織張力の制御は不可欠であるが,その詳細な分子機構については不明な点が多い.この研究において,筆者らは,hirame(hir)変異体と命名したメダカの変異体を解析した.hir変異体はその名のとおりユニークな扁平の形態を示すが,これは器官の大きさを制御するHippoシグナル伝達系の核における標的タンパク質である転写共役因子YAPの変異が原因であった.詳細な解析の結果,hir変異体はアクトミオシンを介した組織張力が低下することにより重力に耐えられなくなり,組織の扁平をきたし配置もくずれていることが判明した.さらに,ヒトの培養細胞を用いた解析から,YAPの下流においてはたらくタンパク質のひとつとしてARHGAP18を同定した.以上の結果から,YAPの3次元的な器官構築への関与が明らかにされた.YAPの機能についてさらに理解が進めば,ES細胞やiPS細胞を用いた3次元的な器官構築に役だつことが期待される.
いまから約1世紀まえ,地球上の生物のかたちは重力の影響を強く反映していることが予言された1).しかしながら,生物がどのようにして重力にあらがい3次元的な形態を生み出すのかについては,依然として謎につつまれている.また,おのおのの組織は整然と配置されることによりはじめて正常な機能を発揮する.たとえば,眼の発生においては,レンズが網膜との協調的な形態形成をつうじて網膜の中心に正しく配置されることにより,はじめて物を見ることが可能になる.こうした3次元的な器官構築の場においては,細胞の増殖や分化をはじめ細胞張力など多くの細胞応答の関与が知られているが,その詳細な分子機構については不明な点が多い.
このような形態形成における基本的かつ本質的な問題にせまるためには,適切なモデル生物を用いることが重要である.メダカは日本が世界にほこるモデル生物であり,多くの特徴を兼ね備えている.たとえば,1)卵生で胚が透明なため組織や器官の形成過程の観察が容易である,2)細胞の動態のライブイメージングや細胞の移植実験が可能である,3)アンチセンスモルフォリノオリゴヌクレオチドやTALENあるいはCRISPRを用いた遺伝子機能阻害実験あるいは遺伝子破壊実験が可能である,4)体長もゲノムサイズも小さく飼育の場所や経費を節約できるため変異体の大規模スクリーニングに有利である,など,メダカは多くの利点をもち,脊椎動物の器官形成におけるモデル生物として,基礎生物学のみならずヒトの疾患の研究においても大いに利用されている2).
こうした背景のもと,筆者らを含めた国内外の約10の研究グループは,メダカを用いた大規模な変異体スクリーニングを実施した.変異体の作出にあたり変異原としてエチルニトロソ尿素を用いた3世代スクリーニング法を採用し,器官の形成に不全をしめす変異体を300あまり単離することに成功した3,4).これらのなかに,これまでの発生の分子機構では説明のつかないような,からだ全体が扁平のユニークな表現型を呈する変異体を見い出し,これをhirame(hir)変異体と命名した.
体節形成初期(受精ののち27時間)において,hir変異体の胚は野生型の胚と同様に背腹軸の方向に組織が構築され厚みをもつことが観察された.しかしそののち,野生型はさらに背腹軸の方向の厚みが増すのに対し,hir変異体は発生の進行とともに組織が扁平になっていくようすが観察された.詳細な解析の結果,hir変異体は神経管や体節などの上皮組織が大きく崩壊しており,発生の進行につれて組織の形態を維持できなくなることが明らかにされた.また,野生型においては受精ののち34時間までに眼のレンズが分化してそののち網膜神経上皮に陥入するが,hir変異体ではレンズの正常な分化は確認されたものの,そののちレンズが網膜神経上皮に陥入することなく網膜から外れていくようすがとらえられた.このことから,hir変異体は3次元的な形状を示さないだけでなく,レンズや網膜などの組織の配置も異常になることが示された.
ポジショナルクローニングの結果,hir変異体の原因遺伝子は転写共役因子YAPをコードすることが判明した.YAPは核において細胞の増殖に関連する遺伝子の発現を誘導することにより,器官の大きさを制御するHippoシグナル伝達系のエフェクタータンパク質として機能することが知られていた5,6).しかしながら,hir変異体と野生型とのあいだには細胞増殖の程度に有意な差は認められなかった.一方,YAPのパラログとして知られるTAZをノックダウンした胚では細胞の増殖が顕著に抑制されていた7).このことから,少なくともメダカではTAZがおもに細胞増殖の制御を担っており,YAPの機能は3次元的な組織構築の制御に特化していると考えられた.
hir変異体のユニークな表現型は細胞増殖の観点からは説明がつかなかったことから,ほかの細胞応答の関与が示唆された.そこで,hir変異体を地球の重力に対しさまざまな方向にむけて詳細に観察したところ,hir変異体の組織はつねに重力の方向へと崩壊することが見い出された.これは,重力が生物の形態形成に大きく影響を及ぼす1) ことを如実に物語った.さらに,ピペット吸引法により神経管の力学的な特性を測定した結果,hir変異体は野生型と比べ外部からの力に対する耐性が顕著に低下しており,組織張力の低下が示唆された.実際,hir変異体では組織張力の発生に関与するアクトミオシンの活性が野生型と比較して大きく低下していた.以上の結果から,YAPは重力に対抗するための組織張力の形成に重要な役割をはたしていると考えられた.
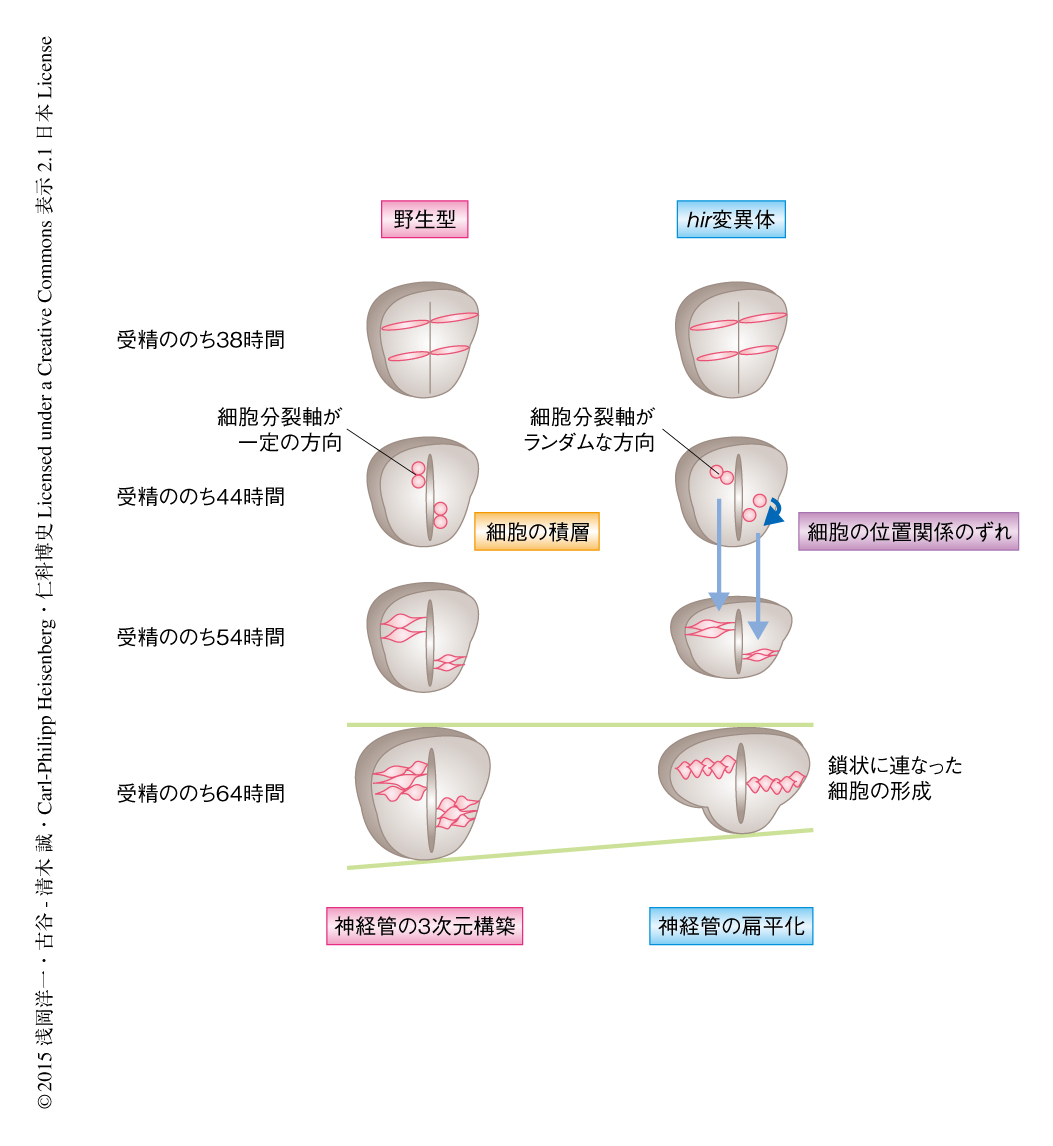
神経管形成期における単一の細胞の挙動の時空間パターンをリアルタイムで解析した(図1).野生型において背腹軸の方向に分裂した神経上皮細胞は,2つの娘細胞がその位置関係を保持したまま積層することにより神経管の3次元的な構築に寄与した.一方,hir変異体においては細胞分裂軸が不安定であり,分裂ののちに娘細胞の相互の位置関係にずれが生じ,最終的に鎖状に連なった細胞が形成されて神経管が扁平化するようすが観察された.以上の結果から,hir変異体では組織張力の異常により細胞の積層が正常に起こらないため,神経管の構築が破綻したと考えられた.
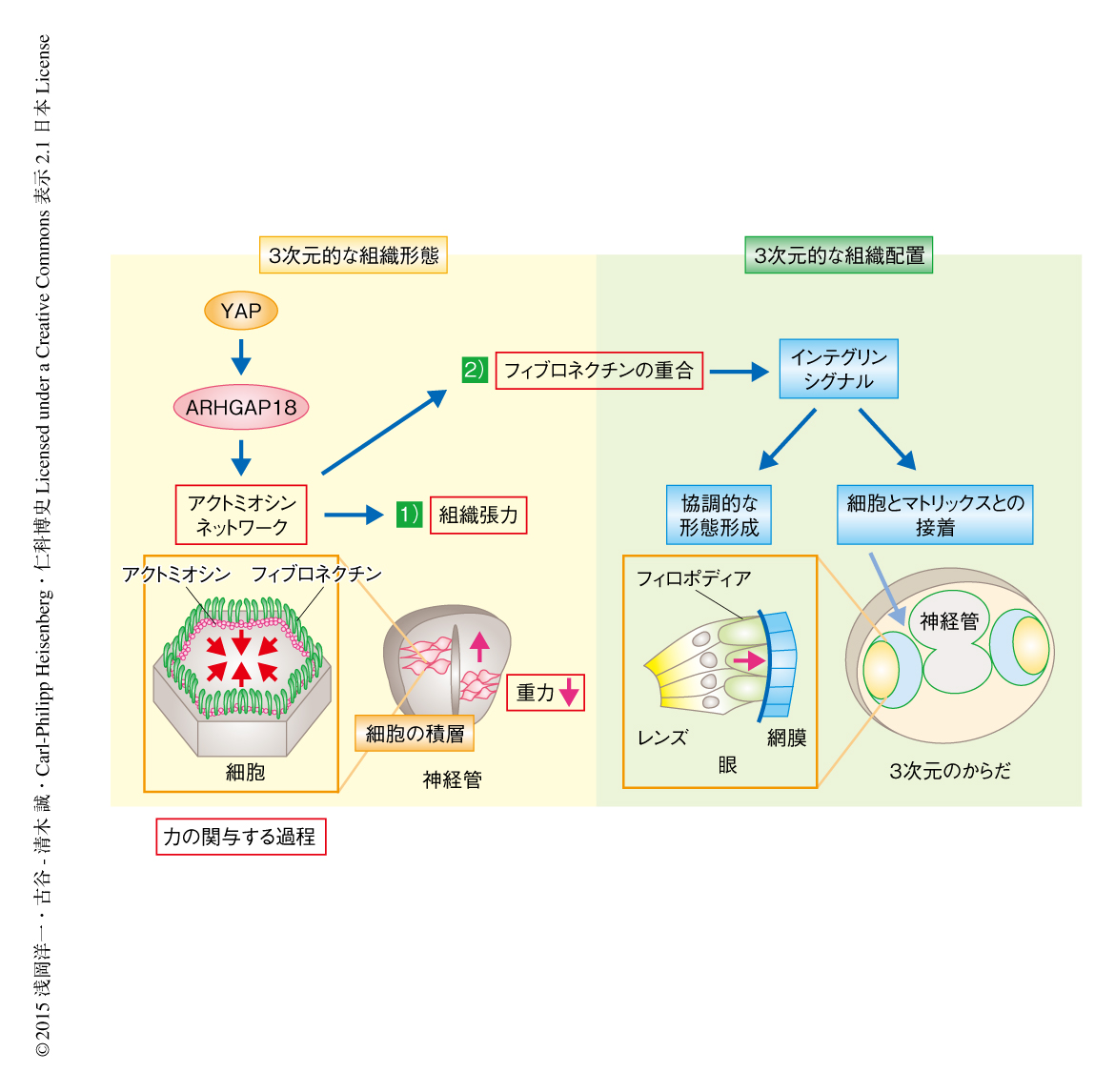
眼のレンズと網膜の協調的な形態形成においてはレンズにおけるフィロポディアの形成が重要な役割をはたすことが知られている8).そこで,hir変異体のレンズを詳細に観察したところ,フィロポディアの形成はほとんど認められなかった.レンズにおけるフィロポディアの形成には,アクトミオシンにくわえフィブロネクチンなどの細胞外基質の関与が示唆されていたことから8),免疫組織染色法により野生型とhir変異体とのあいだでフィブロネクチンの発現パターンを比較した.その結果,野生型のレンズと網膜とのあいだには重合したフィブロネクチンの細線維が確認されたが,hir変異体ではフィブロネクチンの正常な重合は認められずドット状の異常な染色像のみが観察された.このhir変異体の染色像は,フィブロネクチンのN末端の部分断片を発現させてフィブロネクチンの正常な重合を阻害した胚の染色像と酷似していた9).実際,フィブロネクチンのN末端の部分断片を導入した胚ではレンズにおけるフィロポディアの形成が低下しており,hir変異体と同様にレンズが網膜から外れるようすが確認された.さらに,フィブロネクチン受容体を形成するインテグリンβ1サブユニットの発現パターンを免疫組織染色法により解析した.その結果,野生型において認められるレンズと網膜とのあいだのインテグリンβ1の局在がhir変異体においては消失していた.以上の結果から,YAPはアクトミオシンの活性の制御をつうじフィブロネクチンの重合およびインテグリンシグナルの活性化をひき起こし,レンズと網膜の正常な組織配置に関与していると考えられた.
YAPの下流においてアクトミオシンネットワークを制御する遺伝子を同定するため,ヒトの網膜色素上皮に由来するhTERT-RPE1細胞の3次元スフェロイド培養系を用いた.その結果,YAPをノックダウンしたスフェロイドは対照と比較してアクトミオシンの活性が低下しており,hir変異体と同様に外力に対する耐性が低く,フィブロネクチンの染色パターンに異常を示すことが明らかにされた.そこで,マイクロアレイ法により発現の変動した遺伝子を網羅的に解析した結果,YAPをノックダウンしたスフェロイドにおいて40個の遺伝子の発現が顕著に低下していることが見い出された.これらの遺伝子にはRho GTPase活性化タンパク質をコードするARHGAP18遺伝子が含まれていた10).ARHGAP18をノックダウンしたスフェロイドを作製したところ,YAPをノックダウンしたスフェロイドと同様にアクトミオシンの活性の低下およびフィブロネクチンの染色パターンの異常が認められた.以上の結果から,YAPはARHGAP18を介してアクトミオシンネットワークの活性を制御し,組織張力の制御とフィブロネクチンの重合に必須の役割をはたしていると考えられた(図2).
今回の研究から,脊椎動物の器官が重力のもとで押しつぶされることなく3次元的な構造を構築する分子機構の一端が明らかにされた.この分子機構が,魚類からヒトにいたるまで広く保存されている点は意義深い.また,メダカが3次元的な器官形成における分子機構の解明のためにすぐれたモデル生物であることが示された点も強調したい.現在,ES細胞やiPS細胞を用いて器官を作製する研究が世界中でさかんであるが,立体的かつ機能的な器官の構築はいまだ困難な状況である.最近,試験管内においてES細胞から網膜原基の眼杯組織を立体構築する画期的な自己組織化技術が報告されたが11),今回の研究成果をもとに,YAPによる組織張力の制御を考慮した研究がさらに進めば,3次元的な構造をもつ機能的な眼の開発に役だつことが期待される.
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年より東京医科歯科大学難治疾患研究所 助教.
研究テーマ:メダカの変異体を用いた初期胚における器官形成.
古谷-清木 誠(Makoto Furutani-Seiki)
英国Bath大学 研究室長.
Carl-Philipp Heisenberg
オーストリアInstitute of Science and Technology教授.
仁科 博史(Hiroshi Nishina)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/dbio/
© 2015 浅岡洋一・古谷-清木 誠・Carl-Philipp Heisenberg・仁科博史 Licensed under CC 表示 2.1 日本
(1東京医科歯科大学難治疾患研究所 発生再生生物学分野,2英国Bath大学Department of Biology and Biochemistry,3オーストリアInstitute of Science and Technology)
email:浅岡洋一,古谷-清木 誠,仁科博史
DOI: 10.7875/first.author.2015.038
YAP is essential for tissue tension to ensure vertebrate 3D body shape.
Sean Porazinski, Huijia Wang, Yoichi Asaoka, Martin Behrndt, Tatsuo Miyamoto, Hitoshi Morita, Shoji Hata, Takashi Sasaki, S. F. Gabriel Krens, Yumi Osada, Satoshi Asaka, Akihiro Momoi, Sarah Linton, Joel B. Miesfeld, Brian A. Link, Takeshi Senga, Atahualpa Castillo-Morales, Araxi O. Urrutia, Nobuyoshi Shimizu, Hideaki Nagase, Shinya Matsuura, Stefan Bagby, Hisato Kondoh, Hiroshi Nishina, Carl-Philipp Heisenberg, Makoto Furutani-Seiki
Nature, 521,217-221 (2015)
要 約
脊椎動物のからだは3次元的な形態をもち,組織や器官が正しくかたちづくられ適切に配置されることにより,はじめて機能を発揮する.こうした3次元的な形態形成の場において組織張力の制御は不可欠であるが,その詳細な分子機構については不明な点が多い.この研究において,筆者らは,hirame(hir)変異体と命名したメダカの変異体を解析した.hir変異体はその名のとおりユニークな扁平の形態を示すが,これは器官の大きさを制御するHippoシグナル伝達系の核における標的タンパク質である転写共役因子YAPの変異が原因であった.詳細な解析の結果,hir変異体はアクトミオシンを介した組織張力が低下することにより重力に耐えられなくなり,組織の扁平をきたし配置もくずれていることが判明した.さらに,ヒトの培養細胞を用いた解析から,YAPの下流においてはたらくタンパク質のひとつとしてARHGAP18を同定した.以上の結果から,YAPの3次元的な器官構築への関与が明らかにされた.YAPの機能についてさらに理解が進めば,ES細胞やiPS細胞を用いた3次元的な器官構築に役だつことが期待される.
はじめに
いまから約1世紀まえ,地球上の生物のかたちは重力の影響を強く反映していることが予言された1).しかしながら,生物がどのようにして重力にあらがい3次元的な形態を生み出すのかについては,依然として謎につつまれている.また,おのおのの組織は整然と配置されることによりはじめて正常な機能を発揮する.たとえば,眼の発生においては,レンズが網膜との協調的な形態形成をつうじて網膜の中心に正しく配置されることにより,はじめて物を見ることが可能になる.こうした3次元的な器官構築の場においては,細胞の増殖や分化をはじめ細胞張力など多くの細胞応答の関与が知られているが,その詳細な分子機構については不明な点が多い.
このような形態形成における基本的かつ本質的な問題にせまるためには,適切なモデル生物を用いることが重要である.メダカは日本が世界にほこるモデル生物であり,多くの特徴を兼ね備えている.たとえば,1)卵生で胚が透明なため組織や器官の形成過程の観察が容易である,2)細胞の動態のライブイメージングや細胞の移植実験が可能である,3)アンチセンスモルフォリノオリゴヌクレオチドやTALENあるいはCRISPRを用いた遺伝子機能阻害実験あるいは遺伝子破壊実験が可能である,4)体長もゲノムサイズも小さく飼育の場所や経費を節約できるため変異体の大規模スクリーニングに有利である,など,メダカは多くの利点をもち,脊椎動物の器官形成におけるモデル生物として,基礎生物学のみならずヒトの疾患の研究においても大いに利用されている2).
こうした背景のもと,筆者らを含めた国内外の約10の研究グループは,メダカを用いた大規模な変異体スクリーニングを実施した.変異体の作出にあたり変異原としてエチルニトロソ尿素を用いた3世代スクリーニング法を採用し,器官の形成に不全をしめす変異体を300あまり単離することに成功した3,4).これらのなかに,これまでの発生の分子機構では説明のつかないような,からだ全体が扁平のユニークな表現型を呈する変異体を見い出し,これをhirame(hir)変異体と命名した.
1.hir変異体は上皮組織の構築が破綻している
体節形成初期(受精ののち27時間)において,hir変異体の胚は野生型の胚と同様に背腹軸の方向に組織が構築され厚みをもつことが観察された.しかしそののち,野生型はさらに背腹軸の方向の厚みが増すのに対し,hir変異体は発生の進行とともに組織が扁平になっていくようすが観察された.詳細な解析の結果,hir変異体は神経管や体節などの上皮組織が大きく崩壊しており,発生の進行につれて組織の形態を維持できなくなることが明らかにされた.また,野生型においては受精ののち34時間までに眼のレンズが分化してそののち網膜神経上皮に陥入するが,hir変異体ではレンズの正常な分化は確認されたものの,そののちレンズが網膜神経上皮に陥入することなく網膜から外れていくようすがとらえられた.このことから,hir変異体は3次元的な形状を示さないだけでなく,レンズや網膜などの組織の配置も異常になることが示された.
ポジショナルクローニングの結果,hir変異体の原因遺伝子は転写共役因子YAPをコードすることが判明した.YAPは核において細胞の増殖に関連する遺伝子の発現を誘導することにより,器官の大きさを制御するHippoシグナル伝達系のエフェクタータンパク質として機能することが知られていた5,6).しかしながら,hir変異体と野生型とのあいだには細胞増殖の程度に有意な差は認められなかった.一方,YAPのパラログとして知られるTAZをノックダウンした胚では細胞の増殖が顕著に抑制されていた7).このことから,少なくともメダカではTAZがおもに細胞増殖の制御を担っており,YAPの機能は3次元的な組織構築の制御に特化していると考えられた.
2.hir変異体は組織張力の形成に異常を示す
hir変異体のユニークな表現型は細胞増殖の観点からは説明がつかなかったことから,ほかの細胞応答の関与が示唆された.そこで,hir変異体を地球の重力に対しさまざまな方向にむけて詳細に観察したところ,hir変異体の組織はつねに重力の方向へと崩壊することが見い出された.これは,重力が生物の形態形成に大きく影響を及ぼす1) ことを如実に物語った.さらに,ピペット吸引法により神経管の力学的な特性を測定した結果,hir変異体は野生型と比べ外部からの力に対する耐性が顕著に低下しており,組織張力の低下が示唆された.実際,hir変異体では組織張力の発生に関与するアクトミオシンの活性が野生型と比較して大きく低下していた.以上の結果から,YAPは重力に対抗するための組織張力の形成に重要な役割をはたしていると考えられた.
神経管形成期における単一の細胞の挙動の時空間パターンをリアルタイムで解析した(図1).野生型において背腹軸の方向に分裂した神経上皮細胞は,2つの娘細胞がその位置関係を保持したまま積層することにより神経管の3次元的な構築に寄与した.一方,hir変異体においては細胞分裂軸が不安定であり,分裂ののちに娘細胞の相互の位置関係にずれが生じ,最終的に鎖状に連なった細胞が形成されて神経管が扁平化するようすが観察された.以上の結果から,hir変異体では組織張力の異常により細胞の積層が正常に起こらないため,神経管の構築が破綻したと考えられた.
3.hir変異体はレンズと網膜の配置に重要なフィブロネクチンの重合に異常を生じる
眼のレンズと網膜の協調的な形態形成においてはレンズにおけるフィロポディアの形成が重要な役割をはたすことが知られている8).そこで,hir変異体のレンズを詳細に観察したところ,フィロポディアの形成はほとんど認められなかった.レンズにおけるフィロポディアの形成には,アクトミオシンにくわえフィブロネクチンなどの細胞外基質の関与が示唆されていたことから8),免疫組織染色法により野生型とhir変異体とのあいだでフィブロネクチンの発現パターンを比較した.その結果,野生型のレンズと網膜とのあいだには重合したフィブロネクチンの細線維が確認されたが,hir変異体ではフィブロネクチンの正常な重合は認められずドット状の異常な染色像のみが観察された.このhir変異体の染色像は,フィブロネクチンのN末端の部分断片を発現させてフィブロネクチンの正常な重合を阻害した胚の染色像と酷似していた9).実際,フィブロネクチンのN末端の部分断片を導入した胚ではレンズにおけるフィロポディアの形成が低下しており,hir変異体と同様にレンズが網膜から外れるようすが確認された.さらに,フィブロネクチン受容体を形成するインテグリンβ1サブユニットの発現パターンを免疫組織染色法により解析した.その結果,野生型において認められるレンズと網膜とのあいだのインテグリンβ1の局在がhir変異体においては消失していた.以上の結果から,YAPはアクトミオシンの活性の制御をつうじフィブロネクチンの重合およびインテグリンシグナルの活性化をひき起こし,レンズと網膜の正常な組織配置に関与していると考えられた.
4.YAPはARHGAP18を介して組織張力とフィブロネクチンの重合を制御する
YAPの下流においてアクトミオシンネットワークを制御する遺伝子を同定するため,ヒトの網膜色素上皮に由来するhTERT-RPE1細胞の3次元スフェロイド培養系を用いた.その結果,YAPをノックダウンしたスフェロイドは対照と比較してアクトミオシンの活性が低下しており,hir変異体と同様に外力に対する耐性が低く,フィブロネクチンの染色パターンに異常を示すことが明らかにされた.そこで,マイクロアレイ法により発現の変動した遺伝子を網羅的に解析した結果,YAPをノックダウンしたスフェロイドにおいて40個の遺伝子の発現が顕著に低下していることが見い出された.これらの遺伝子にはRho GTPase活性化タンパク質をコードするARHGAP18遺伝子が含まれていた10).ARHGAP18をノックダウンしたスフェロイドを作製したところ,YAPをノックダウンしたスフェロイドと同様にアクトミオシンの活性の低下およびフィブロネクチンの染色パターンの異常が認められた.以上の結果から,YAPはARHGAP18を介してアクトミオシンネットワークの活性を制御し,組織張力の制御とフィブロネクチンの重合に必須の役割をはたしていると考えられた(図2).
おわりに
今回の研究から,脊椎動物の器官が重力のもとで押しつぶされることなく3次元的な構造を構築する分子機構の一端が明らかにされた.この分子機構が,魚類からヒトにいたるまで広く保存されている点は意義深い.また,メダカが3次元的な器官形成における分子機構の解明のためにすぐれたモデル生物であることが示された点も強調したい.現在,ES細胞やiPS細胞を用いて器官を作製する研究が世界中でさかんであるが,立体的かつ機能的な器官の構築はいまだ困難な状況である.最近,試験管内においてES細胞から網膜原基の眼杯組織を立体構築する画期的な自己組織化技術が報告されたが11),今回の研究成果をもとに,YAPによる組織張力の制御を考慮した研究がさらに進めば,3次元的な構造をもつ機能的な眼の開発に役だつことが期待される.
文 献
- Thompson, D. W.: On Growth and Form. Cambridge University Press, Cambridge (1917)
- Asaoka, Y., Terai, S., Sakaida, I. et al.: The expanding role of fish models in understanding non-alcoholic fatty liver disease. Dis. Model. Mech., 6, 905-914 (2013)[PubMed]
- Furutani-Seiki, M., Sasado, T., Morinaga, C. et al.: A systematic genome-wide screen for mutations affecting organogenesis in medaka, Oryzias latipes. Mech. Dev., 121, 647-658 (2004)[PubMed]
- Watanabe, T., Asaka, S., Kitagawa, D. et al.: Mutations affecting liver development and function in Medaka, Oryzias latipes, screened by multiple criteria. Mech. Dev., 121, 791-802 (2004)[PubMed]
- Zhao, B., Tumaneng, K. & Guan, K. L.: The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nat. Cell Biol., 13, 877-883 (2011)[PubMed]
- Asaoka, Y., Hata, S., Namae, M. et al.: The Hippo pathway controls a switch between retinal progenitor cell proliferation and photoreceptor cell differentiation in zebrafish. PLoS One, 9, e97365 (2014)[PubMed]
- Lei, Q. Y., Zhang, H., Zhao, B. et al.: TAZ promotes cell proliferation and epithelial-mesenchymal transition and is inhibited by the hippo pathway. Mol. Cell. Biol., 28, 2426-2436 (2008)[PubMed]
- Chauhan, B. K., Disanza, A., Choi, S. Y. et al.: Cdc42- and IRSp53-dependent contractile filopodia tether presumptive lens and retina to coordinate epithelial invagination. Development, 136, 3657-3667 (2009)[PubMed]
- McDonald, J. A., Quade, B. J., Broekelmann, T. J. et al.: Fibronectin’s cell-adhesive domain and an amino-terminal matrix assembly domain participate in its assembly into fibroblast pericellular matrix. J. Biol. Chem., 262, 2957-2967 (1987)[PubMed]
- Maeda, M., Hasegawa, H., Hyodo, T. et al.: ARHGAP18, a GTPase-activating protein for RhoA, controls cell shape, spreading, and motility. Mol. Biol. Cell, 22, 3840-3852 (2011)[PubMed]
- Sasai, Y.: Cytosystems dynamics in self-organization of tissue architecture. Nature, 493, 318-326 (2013)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年より東京医科歯科大学難治疾患研究所 助教.
研究テーマ:メダカの変異体を用いた初期胚における器官形成.
古谷-清木 誠(Makoto Furutani-Seiki)
英国Bath大学 研究室長.
Carl-Philipp Heisenberg
オーストリアInstitute of Science and Technology教授.
仁科 博史(Hiroshi Nishina)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/dbio/
© 2015 浅岡洋一・古谷-清木 誠・Carl-Philipp Heisenberg・仁科博史 Licensed under CC 表示 2.1 日本