SCML2はヒストンH2Aのユビキチン化を介してオスの生殖細胞系列において特異的なエピゲノムを形成する
長谷川和輝・前澤 創・行川 賢
(米国Cincinnati Children's Hospital Medical Center,Division of Reproductive Sciences)
email:行川 賢
DOI: 10.7875/first.author.2015.032
SCML2 establishes the male germline epigenome through regulation of histone H2A ubiquitination.
Kazuteru Hasegawa, Ho-Su Sin, So Maezawa, Tyler J. Broering, Andrey V. Kartashov, Kris G. Alavattam, Yosuke Ichijima, Fan Zhang, W. Clark Bacon, Kenneth D. Greis, Paul R. Andreassen, Artem Barski, Satoshi H. Namekawa
Developmental Cell, 32, 574-588 (2015)
配偶子の形成は生殖細胞系列に特異的な遺伝子の発現により規定される.しかしながら,生殖細胞系列に特異的なエピゲノムがどのように体細胞系列と区別され形成されるかについては明らかにされていない.この研究において,筆者らは,体細胞系列および精子形成期の前駆細胞に発現する遺伝子が精子形成期においてゲノムワイドに抑制されていることを見い出し,その制御機構を明らかにした.SCML2はPolycomb抑制複合体1の生殖細胞に特異的なサブユニットであり,2つの相対する機能により生殖細胞のエピゲノムを規定する.つまり,常染色体においては,SCML2はPolycomb抑制複合体1のサブユニットであるRNF2によるヒストンH2AのLys119のユビキチン化を促進することにより,常染色体の体細胞系列および精子形成期の前駆細胞に発現する遺伝子を抑制していた.一方で,減数分裂期の性染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を抑制することにより,性染色体のエピジェネティックなプログラミングを制御していた.
生殖細胞系列は世代をこえて受け継がれ生命の永続性を担う.さまざまな生物において生殖細胞を規定する機構は異なるが,共通している特徴は体細胞型の遺伝子発現の抑制である.これまで,哺乳動物の生殖細胞系列において特異的なエピジェネティック制御の起こることが知られてきたが,生殖細胞に特異的なエピゲノムがどのように体細胞系列と区別され形成されるかについては明らかにされていない.
生殖細胞において特異的に体細胞型の遺伝子発現の抑制を担うタンパク質の候補として,Polycomb複合体が考えられる.Polycomb複合体は発生の段階において特異的に遺伝子の不活性化を担うことが知られている.最近の研究により,Polycomb複合体はその構成サブユニットを交換して異なる複合体を形成し異なる機能を担うことが明らかにされた.そのため,生殖細胞に特異的なPolycomb複合体のサブユニットが存在すれば,生殖細胞に特異的な機能を担うことが考えられる.最近,メスの始原生殖細胞においてPolycomb抑制複合体1が性分化のタイミングを規定していることが報告された1).しかし,精子形成期におけるPolycomb複合体の機能は不明であり,生殖細胞に特異的なサブユニットが存在するのかどうかは明らかにされていなかった.
精子形成期における遺伝子発現パターンの特徴について調べるため,精巣から,精子幹細胞を含む未分化型の精原細胞,減数分裂期の精母細胞,減数分裂の完了した円形精子細胞,を単離するとともに,培養した精子幹細胞も用いてRNA-seq法により解析し,ほかの組織や幹細胞の遺伝子発現パターンと比較した.興味深いことに,精母細胞および円形精子細胞の遺伝子発現パターンは体細胞および精子形成の前駆細胞とは大きく異なることがわかった.つまり,精母細胞および円形精子細胞においては,体細胞および精子形成の前駆細胞において発現の高い遺伝子が強く抑制されていたのに対し,精子の分化にかかわる特異的な遺伝子が特異的に活性化されていた.これらの結果から,精子の形成の後期において特異的な遺伝子発現パターンが確立されていることが示された.
オスの減数分裂期においてX染色体およびY染色体には相同染色体が存在しないため,それら染色体の対合は起こらず不活性化される.これは減数分裂期の性染色体不活性化とよばれる2).筆者らのこれまでの研究により,体細胞においてDNA損傷応答を担うSer139がリン酸化されたヒストンH2AXおよびその結合タンパク質であるMDC1が,減数分裂期の性染色体不活性化の開始を制御することが明らかにされていた3).そこで,減数分裂期の性染色体不活性化にかかわる新規のタンパク質を探索するため,精巣からSer139がリン酸化されたヒストンH2AXを含むヌクレオソームを精製し,免疫沈降法および質量分析法を用いてそれと結合するタンパク質を網羅的に解析したところ,SCML2が同定された.SCML2に対する抗体を作製しその局在パターンを調べたところ,体細胞にはほとんど局在せず,生殖細胞の特定の分化の段階のみに局在していた.SCML2の局在は胎仔期の生殖腺に入ったあとの生殖細胞にはじまり,生後の精巣では精子幹細胞を含む未分化型の精原細胞に強く局在していた.また,分化が開始すると一時的に局在がみられなくなったが,減数分裂になると精母細胞のパキテン期の性染色体に強く局在した.RNA-seq法によりX染色体に位置するScml2遺伝子の発現を調べたところ,未分化型の精原細胞において強く発現していたが,減数分裂期においては減数分裂期の性染色体不活性化により発現は抑制されていた.つまり,減数分裂期においてはScml2遺伝子の転写が抑制されているにもかかわらず,SCML2は性染色体に局在していた.
Scml2ノックアウトマウスを作製したところ,精子の形成,とくに,減数分裂ののちの分化に異常が生じ不妊であることが判明した.その原因を明らかにするため,Scml2ノックアウトマウスからおのおののステージの細胞を精製し遺伝子発現パターンの変化を調べた.その結果,Scml2ノックアウトマウスの精母細胞および円形精子細胞では,体細胞系列および精子前駆細胞に発現する遺伝子が抑制されておらず,精子の分化にかかわる特異的な遺伝子の活性化も起こっていなかった.その一方で,未分化型の精原細胞における遺伝子発現パターンの変化はそれほど顕著ではなかった.この結果と一致して,Scml2ノックアウトマウスにおいて未分化型の精原細胞の数に差はみられなかったが,減数分裂期の細胞が減少していたとともに,減数分裂ののちの成熟の過程において起こる細胞核の凝縮に異常がみられた.さらに,TUNEL染色により,精子形成期において断続的にアポトーシスの起こっていることも判明した.これらの結果から,SCML2は精子の形成に必須であるとともに,オスの生殖細胞において特異的な遺伝子発現パターンを確立していることが明らかにされた.
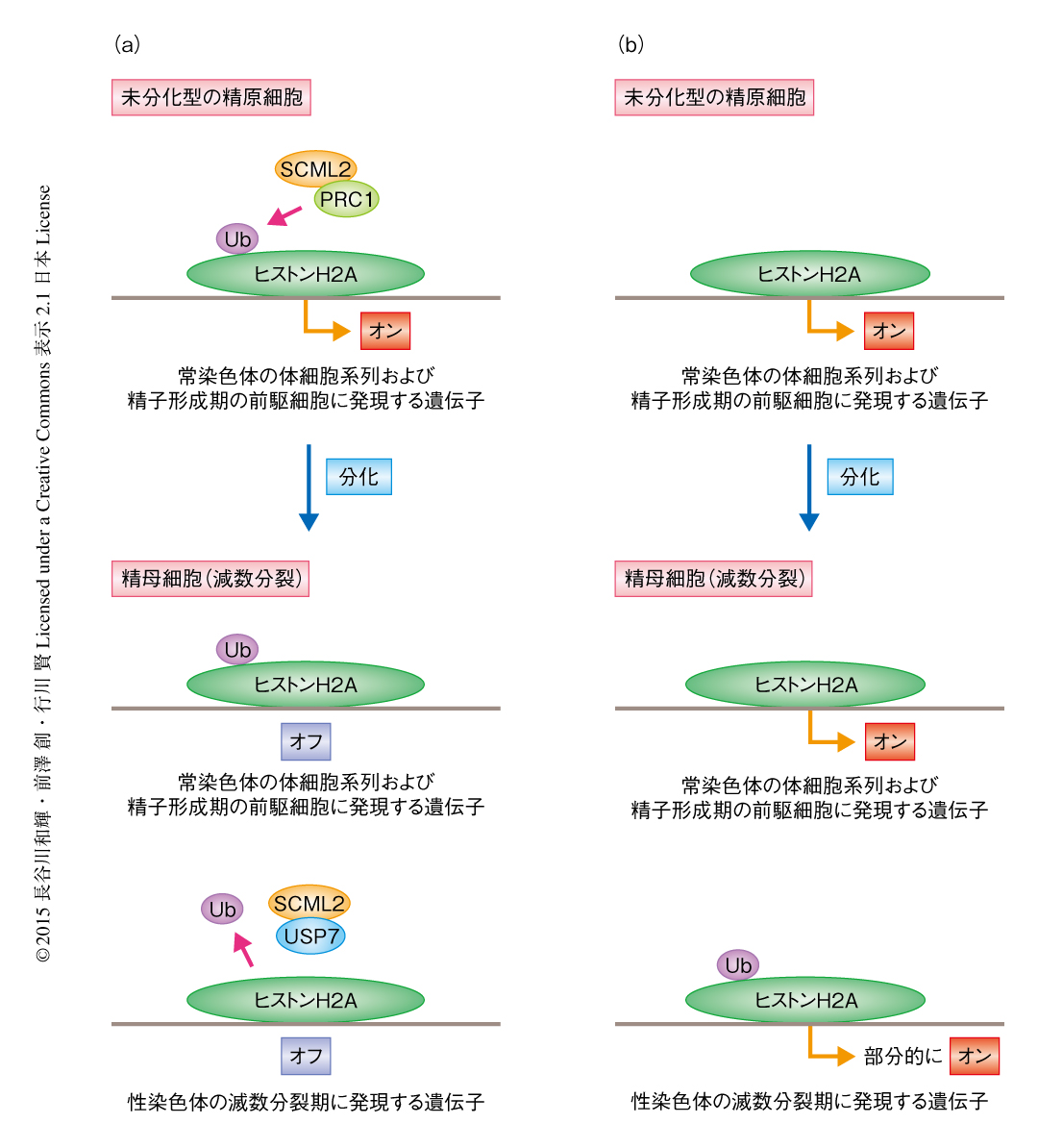
これまでの報告から,SCML2がPolycomb抑制複合体1の構成サブユニットである可能性が示唆されていた4).Polycomb抑制複合体1はヒストンH2AのLys119のユビキチン化を介し遺伝子の発現をおもに抑制し,サブユニットのひとつRNF2がその活性を担っている.そこで,SCML2がPolycomb抑制複合体1の機能を介して精子の形成の後期における遺伝子発現パターンを制御しているのではないかと考えた.免疫沈降法によりSCML2とRNF2との結合を調べてみると,精巣において複合体を形成していることがわかった.さらに,培養した精子幹細胞を用いてChIP-seq法により解析したところ,SCML2はRNF2と共通する多くの標的遺伝子に結合するとともに,それら遺伝子の転写開始領域の付近にはヒストンH2AのLys119のユビキチン化が集積していた.Scml2ノックアウトマウスの精母細胞および円形精子細胞において発現の亢進している体細胞および精子形成の前駆細胞において発現の高い遺伝子について,培養した精子幹細胞におけるSCML2,RNF2,ヒストンH2AのLys119のユビキチン化の局在を調べたところ,これら遺伝子の転写開始領域の付近に集積する傾向が認められた.また,精母細胞においてSCML2は性染色体に局在し常染色体には結合していなかったことから,体細胞系列および精子形成期の前駆細胞において共通して発現している遺伝子におけるヒストンH2AのLys119のユビキチン化の集積は,未分化型の精原細胞などの分化のまえの段階で起こっていると考えられた.つまり,未分化型の精原細胞においてSCML2およびRNF2が体細胞系列および精子形成期の前駆細胞において共通して発現している遺伝子に結合し,ヒストンH2AのLys119のユビキチン化を集積することにより,分化ののちに体細胞系列および精子形成期の前駆細胞に発現する遺伝子を抑制するための免疫記憶の形成されていることが示唆された(図1).
SCML2による減数分裂期の性染色体の制御について調べた.免疫染色により,Scml2ノックアウトマウスでは性染色体においてヒストンH2AのLys119のユビキチン化が異常に集積していたことから,SCML2が性染色体においてヒストンH2AのLys119のユビキチン化を抑制していることが明らかにされた.筆者らのこれまでの研究により,体細胞においてDNA損傷応答を担うタンパク質のひとつであるRNF8が減数分裂期の性染色体においてユビキチン化およびそののちの遺伝子の活性化を制御していることが明らかにされていたが5),SCML2とRNF8は性染色体において異なるユビキチン化の制御に関与していることもわかった.
脱ユビキチン化酵素USP7はSCML2に依存的に性染色体に局在すること,また,免疫沈降法によりSCML2はUSP7と結合することが明らかにされた.USP7はin vitroにおいてヒストンH2Aを脱ユビキチン化することが報告されていたことから,SCML2がUSP7とともに機能し減数分裂期の性染色体においてヒストンH2AのLys119を脱ユビキチン化していることが示唆された(図1).減数分裂期の性染色体は特異的なエピジェネティックな制御をうけている.そこで,SCML2の欠損によるヒストンH2AのLys119のユビキチン化の異常な集積が,ほかのヒストン修飾にどのように影響をあたえるか調べた.その結果,Scml2ノックアウトマウスでは,野生型マウスに比べ減数分裂期の性染色体におけるヒストンH3のLys9ジメチル化およびトリメチル化に変化はなかったものの,ヒストンH3のLys9のモノメチル化が上昇していた.また,Scml2ノックアウトマウスでは,ヒストンバリアントのひとつであるmacroH2A1が減数分裂期の性染色体において過剰に集積していた.これらの異常と対応して,RNA-seq法による解析において,Scml2ノックアウトマウスの精母細胞において減数分裂期の性染色体不活性化の部分的な脱抑制がみられた.また,円形精子細胞では精子の形成に関与する遺伝子が性染色体不活性化をまぬがれて活性化されるが5,6),この活性化の一部がScml2ノックアウトマウスでは阻害されていた.これらの結果から,SCML2はオスの生殖細胞において精子の形成に必須の性染色体におけるエピジェネティックなプログラミングを制御すると結論づけられた.
この研究において,精子形成期において分化ののちにゲノムワイドな遺伝子発現の変化が起こり,体細胞系列および精子形成期の前駆細胞に発現する遺伝子の抑制,および,精子の分化にかかわる特異的な遺伝子の活性化の起こることが明らかにされた.また,精子形成期のエピゲノムの形成を制御するタンパク質としてSCML2を同定し,生殖細胞における相対する2つの機能を明らかにした.常染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を促進することにより,体細胞系列および精子形成期の前駆細胞に発現する遺伝子を精子形成期において分化ののちに抑制する.ChIP-seq法による解析の結果から,精子形成期において分化ののちに遺伝子発現を抑制するための細胞記憶は,未分化型の精原細胞においてすでに形成されていることが示唆され,SCML2がその制御機構を担っていることが考えられた.一方で,減数分裂期の性染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を抑制することにより,エピジェネティックなプログラミングを制御する.この2つの機能はそれぞれが独立していると考えられた.また,減数分裂期にSCML2が脱ユビキチン化酵素USP7と結合し性染色体においてヒストンH2AのLys119のユビキチン化を抑制していることは,この研究と同じ時期に,ほかの研究グループからも報告されている7).筆者らの結果では,減数分裂期にSCML2はUSP7と結合するものの,そのほかのPolycomb抑制複合体1の構成サブユニットは性染色体に特異的には集積しないことが明らかにされており,この機能はPolycomb抑制複合体1とは独立したものであると考えられた.
この研究では,Polycombタンパク質が生殖細胞系列において体細胞型の遺伝子の発現を抑制することにより特異的なエピゲノムを形成することが明らかにされた.この研究とは対照的に,ショウジョウバエではSCML2と同じくMBTドメインをもつL(3)mbtが体細胞において生殖細胞型の遺伝子の発現を抑制することが明らかにされている8).また,ショウジョウバエではほかのPolycombタンパク質であるE(z) が生殖細胞における体細胞型の遺伝子の発現の抑制にかかわることが明らかにされており9),Polycombにもとづく機構が体細胞と生殖細胞とを区別していると考えられた.これら,体細胞と生殖細胞を区別する機構の解明は進化の点からも考察する価値がある.哺乳動物において,オスの後期の生殖細胞のトランスクリプトームは体細胞型のトランスクリプトームと大きく異なり種間で多様化していることが知られている.進化の過程においてこのような多様化を促進してきた駆動力は,この研究において同定されたエピゲノムを規定する機構である可能性がある.このように,この研究の成果が今後の生殖細胞の研究の礎となることを期待している.
米国Cincinnati Children's Hospital Medical CenterにてPostdoctoral Fellow.
前澤 創(So Maezawa)
米国Cincinnati Children's Hospital Medical CenterにてResearch Associate.
行川 賢(Satoshi H. Namekawa)
略歴:2005年 東京理科大学大学院理工学研究科博士課程 修了,同年 米国Harvard Medical Schoolポスドクを経て,2009年より米国Cincinnati Children's Hospital Medical Center助教授.
研究テーマ:哺乳類の生殖細胞におけるエピジェネティックな制御,とくに,性染色体の制御.
抱負:この研究の成果をもとに,後期の生殖細胞におけるエピゲノムの形成と,のちの初期胚への世代間でのエピジェネティックな伝達について解明していきたい.
研究室URL:http://www.cincinnatichildrens.org/research/divisions/r/reproductive-sciences/labs/namekawa/default/
© 2015 長谷川和輝・前澤 創・行川 賢 Licensed under CC 表示 2.1 日本
(米国Cincinnati Children's Hospital Medical Center,Division of Reproductive Sciences)
email:行川 賢
DOI: 10.7875/first.author.2015.032
SCML2 establishes the male germline epigenome through regulation of histone H2A ubiquitination.
Kazuteru Hasegawa, Ho-Su Sin, So Maezawa, Tyler J. Broering, Andrey V. Kartashov, Kris G. Alavattam, Yosuke Ichijima, Fan Zhang, W. Clark Bacon, Kenneth D. Greis, Paul R. Andreassen, Artem Barski, Satoshi H. Namekawa
Developmental Cell, 32, 574-588 (2015)
要 約
配偶子の形成は生殖細胞系列に特異的な遺伝子の発現により規定される.しかしながら,生殖細胞系列に特異的なエピゲノムがどのように体細胞系列と区別され形成されるかについては明らかにされていない.この研究において,筆者らは,体細胞系列および精子形成期の前駆細胞に発現する遺伝子が精子形成期においてゲノムワイドに抑制されていることを見い出し,その制御機構を明らかにした.SCML2はPolycomb抑制複合体1の生殖細胞に特異的なサブユニットであり,2つの相対する機能により生殖細胞のエピゲノムを規定する.つまり,常染色体においては,SCML2はPolycomb抑制複合体1のサブユニットであるRNF2によるヒストンH2AのLys119のユビキチン化を促進することにより,常染色体の体細胞系列および精子形成期の前駆細胞に発現する遺伝子を抑制していた.一方で,減数分裂期の性染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を抑制することにより,性染色体のエピジェネティックなプログラミングを制御していた.
はじめに
生殖細胞系列は世代をこえて受け継がれ生命の永続性を担う.さまざまな生物において生殖細胞を規定する機構は異なるが,共通している特徴は体細胞型の遺伝子発現の抑制である.これまで,哺乳動物の生殖細胞系列において特異的なエピジェネティック制御の起こることが知られてきたが,生殖細胞に特異的なエピゲノムがどのように体細胞系列と区別され形成されるかについては明らかにされていない.
生殖細胞において特異的に体細胞型の遺伝子発現の抑制を担うタンパク質の候補として,Polycomb複合体が考えられる.Polycomb複合体は発生の段階において特異的に遺伝子の不活性化を担うことが知られている.最近の研究により,Polycomb複合体はその構成サブユニットを交換して異なる複合体を形成し異なる機能を担うことが明らかにされた.そのため,生殖細胞に特異的なPolycomb複合体のサブユニットが存在すれば,生殖細胞に特異的な機能を担うことが考えられる.最近,メスの始原生殖細胞においてPolycomb抑制複合体1が性分化のタイミングを規定していることが報告された1).しかし,精子形成期におけるPolycomb複合体の機能は不明であり,生殖細胞に特異的なサブユニットが存在するのかどうかは明らかにされていなかった.
1.精子形成期には特異的な遺伝子発現パターンが確立される
精子形成期における遺伝子発現パターンの特徴について調べるため,精巣から,精子幹細胞を含む未分化型の精原細胞,減数分裂期の精母細胞,減数分裂の完了した円形精子細胞,を単離するとともに,培養した精子幹細胞も用いてRNA-seq法により解析し,ほかの組織や幹細胞の遺伝子発現パターンと比較した.興味深いことに,精母細胞および円形精子細胞の遺伝子発現パターンは体細胞および精子形成の前駆細胞とは大きく異なることがわかった.つまり,精母細胞および円形精子細胞においては,体細胞および精子形成の前駆細胞において発現の高い遺伝子が強く抑制されていたのに対し,精子の分化にかかわる特異的な遺伝子が特異的に活性化されていた.これらの結果から,精子の形成の後期において特異的な遺伝子発現パターンが確立されていることが示された.
2.SCML2は体細胞および精子形成の前駆細胞にみられる遺伝子の発現を抑制し精子の形成に必須な遺伝子の発現を誘導する
オスの減数分裂期においてX染色体およびY染色体には相同染色体が存在しないため,それら染色体の対合は起こらず不活性化される.これは減数分裂期の性染色体不活性化とよばれる2).筆者らのこれまでの研究により,体細胞においてDNA損傷応答を担うSer139がリン酸化されたヒストンH2AXおよびその結合タンパク質であるMDC1が,減数分裂期の性染色体不活性化の開始を制御することが明らかにされていた3).そこで,減数分裂期の性染色体不活性化にかかわる新規のタンパク質を探索するため,精巣からSer139がリン酸化されたヒストンH2AXを含むヌクレオソームを精製し,免疫沈降法および質量分析法を用いてそれと結合するタンパク質を網羅的に解析したところ,SCML2が同定された.SCML2に対する抗体を作製しその局在パターンを調べたところ,体細胞にはほとんど局在せず,生殖細胞の特定の分化の段階のみに局在していた.SCML2の局在は胎仔期の生殖腺に入ったあとの生殖細胞にはじまり,生後の精巣では精子幹細胞を含む未分化型の精原細胞に強く局在していた.また,分化が開始すると一時的に局在がみられなくなったが,減数分裂になると精母細胞のパキテン期の性染色体に強く局在した.RNA-seq法によりX染色体に位置するScml2遺伝子の発現を調べたところ,未分化型の精原細胞において強く発現していたが,減数分裂期においては減数分裂期の性染色体不活性化により発現は抑制されていた.つまり,減数分裂期においてはScml2遺伝子の転写が抑制されているにもかかわらず,SCML2は性染色体に局在していた.
Scml2ノックアウトマウスを作製したところ,精子の形成,とくに,減数分裂ののちの分化に異常が生じ不妊であることが判明した.その原因を明らかにするため,Scml2ノックアウトマウスからおのおののステージの細胞を精製し遺伝子発現パターンの変化を調べた.その結果,Scml2ノックアウトマウスの精母細胞および円形精子細胞では,体細胞系列および精子前駆細胞に発現する遺伝子が抑制されておらず,精子の分化にかかわる特異的な遺伝子の活性化も起こっていなかった.その一方で,未分化型の精原細胞における遺伝子発現パターンの変化はそれほど顕著ではなかった.この結果と一致して,Scml2ノックアウトマウスにおいて未分化型の精原細胞の数に差はみられなかったが,減数分裂期の細胞が減少していたとともに,減数分裂ののちの成熟の過程において起こる細胞核の凝縮に異常がみられた.さらに,TUNEL染色により,精子形成期において断続的にアポトーシスの起こっていることも判明した.これらの結果から,SCML2は精子の形成に必須であるとともに,オスの生殖細胞において特異的な遺伝子発現パターンを確立していることが明らかにされた.
3.SCML2はPolycomb抑制複合体1の生殖細胞に特異的なサブユニットでありヒストンH2Aのユビキチン化を促進することによりオスの生殖細胞の遺伝子発現を制御する
これまでの報告から,SCML2がPolycomb抑制複合体1の構成サブユニットである可能性が示唆されていた4).Polycomb抑制複合体1はヒストンH2AのLys119のユビキチン化を介し遺伝子の発現をおもに抑制し,サブユニットのひとつRNF2がその活性を担っている.そこで,SCML2がPolycomb抑制複合体1の機能を介して精子の形成の後期における遺伝子発現パターンを制御しているのではないかと考えた.免疫沈降法によりSCML2とRNF2との結合を調べてみると,精巣において複合体を形成していることがわかった.さらに,培養した精子幹細胞を用いてChIP-seq法により解析したところ,SCML2はRNF2と共通する多くの標的遺伝子に結合するとともに,それら遺伝子の転写開始領域の付近にはヒストンH2AのLys119のユビキチン化が集積していた.Scml2ノックアウトマウスの精母細胞および円形精子細胞において発現の亢進している体細胞および精子形成の前駆細胞において発現の高い遺伝子について,培養した精子幹細胞におけるSCML2,RNF2,ヒストンH2AのLys119のユビキチン化の局在を調べたところ,これら遺伝子の転写開始領域の付近に集積する傾向が認められた.また,精母細胞においてSCML2は性染色体に局在し常染色体には結合していなかったことから,体細胞系列および精子形成期の前駆細胞において共通して発現している遺伝子におけるヒストンH2AのLys119のユビキチン化の集積は,未分化型の精原細胞などの分化のまえの段階で起こっていると考えられた.つまり,未分化型の精原細胞においてSCML2およびRNF2が体細胞系列および精子形成期の前駆細胞において共通して発現している遺伝子に結合し,ヒストンH2AのLys119のユビキチン化を集積することにより,分化ののちに体細胞系列および精子形成期の前駆細胞に発現する遺伝子を抑制するための免疫記憶の形成されていることが示唆された(図1).
4.SCML2は減数分裂期の性染色体においてヒストンH2Aのユビキチン化を抑制する
SCML2による減数分裂期の性染色体の制御について調べた.免疫染色により,Scml2ノックアウトマウスでは性染色体においてヒストンH2AのLys119のユビキチン化が異常に集積していたことから,SCML2が性染色体においてヒストンH2AのLys119のユビキチン化を抑制していることが明らかにされた.筆者らのこれまでの研究により,体細胞においてDNA損傷応答を担うタンパク質のひとつであるRNF8が減数分裂期の性染色体においてユビキチン化およびそののちの遺伝子の活性化を制御していることが明らかにされていたが5),SCML2とRNF8は性染色体において異なるユビキチン化の制御に関与していることもわかった.
5.SCML2はUSP7とともに機能し減数分裂期の性染色体のエピジェネティックなプログラミングに必要である
脱ユビキチン化酵素USP7はSCML2に依存的に性染色体に局在すること,また,免疫沈降法によりSCML2はUSP7と結合することが明らかにされた.USP7はin vitroにおいてヒストンH2Aを脱ユビキチン化することが報告されていたことから,SCML2がUSP7とともに機能し減数分裂期の性染色体においてヒストンH2AのLys119を脱ユビキチン化していることが示唆された(図1).減数分裂期の性染色体は特異的なエピジェネティックな制御をうけている.そこで,SCML2の欠損によるヒストンH2AのLys119のユビキチン化の異常な集積が,ほかのヒストン修飾にどのように影響をあたえるか調べた.その結果,Scml2ノックアウトマウスでは,野生型マウスに比べ減数分裂期の性染色体におけるヒストンH3のLys9ジメチル化およびトリメチル化に変化はなかったものの,ヒストンH3のLys9のモノメチル化が上昇していた.また,Scml2ノックアウトマウスでは,ヒストンバリアントのひとつであるmacroH2A1が減数分裂期の性染色体において過剰に集積していた.これらの異常と対応して,RNA-seq法による解析において,Scml2ノックアウトマウスの精母細胞において減数分裂期の性染色体不活性化の部分的な脱抑制がみられた.また,円形精子細胞では精子の形成に関与する遺伝子が性染色体不活性化をまぬがれて活性化されるが5,6),この活性化の一部がScml2ノックアウトマウスでは阻害されていた.これらの結果から,SCML2はオスの生殖細胞において精子の形成に必須の性染色体におけるエピジェネティックなプログラミングを制御すると結論づけられた.
おわりに
この研究において,精子形成期において分化ののちにゲノムワイドな遺伝子発現の変化が起こり,体細胞系列および精子形成期の前駆細胞に発現する遺伝子の抑制,および,精子の分化にかかわる特異的な遺伝子の活性化の起こることが明らかにされた.また,精子形成期のエピゲノムの形成を制御するタンパク質としてSCML2を同定し,生殖細胞における相対する2つの機能を明らかにした.常染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を促進することにより,体細胞系列および精子形成期の前駆細胞に発現する遺伝子を精子形成期において分化ののちに抑制する.ChIP-seq法による解析の結果から,精子形成期において分化ののちに遺伝子発現を抑制するための細胞記憶は,未分化型の精原細胞においてすでに形成されていることが示唆され,SCML2がその制御機構を担っていることが考えられた.一方で,減数分裂期の性染色体においては,SCML2はヒストンH2AのLys119のユビキチン化を抑制することにより,エピジェネティックなプログラミングを制御する.この2つの機能はそれぞれが独立していると考えられた.また,減数分裂期にSCML2が脱ユビキチン化酵素USP7と結合し性染色体においてヒストンH2AのLys119のユビキチン化を抑制していることは,この研究と同じ時期に,ほかの研究グループからも報告されている7).筆者らの結果では,減数分裂期にSCML2はUSP7と結合するものの,そのほかのPolycomb抑制複合体1の構成サブユニットは性染色体に特異的には集積しないことが明らかにされており,この機能はPolycomb抑制複合体1とは独立したものであると考えられた.
この研究では,Polycombタンパク質が生殖細胞系列において体細胞型の遺伝子の発現を抑制することにより特異的なエピゲノムを形成することが明らかにされた.この研究とは対照的に,ショウジョウバエではSCML2と同じくMBTドメインをもつL(3)mbtが体細胞において生殖細胞型の遺伝子の発現を抑制することが明らかにされている8).また,ショウジョウバエではほかのPolycombタンパク質であるE(z) が生殖細胞における体細胞型の遺伝子の発現の抑制にかかわることが明らかにされており9),Polycombにもとづく機構が体細胞と生殖細胞とを区別していると考えられた.これら,体細胞と生殖細胞を区別する機構の解明は進化の点からも考察する価値がある.哺乳動物において,オスの後期の生殖細胞のトランスクリプトームは体細胞型のトランスクリプトームと大きく異なり種間で多様化していることが知られている.進化の過程においてこのような多様化を促進してきた駆動力は,この研究において同定されたエピゲノムを規定する機構である可能性がある.このように,この研究の成果が今後の生殖細胞の研究の礎となることを期待している.
文 献
- Yokobayashi, S., Liang, C. Y., Kohler, H. et al.: PRC1 coordinates timing of sexual differentiation of female primordial germ cells. Nature, 495, 236-240 (2013)[PubMed] [新着論文レビュー]
- Ichijima, Y., Sin, H. S. & Namekawa, S. H.: Sex chromosome inactivation in germ cells: emerging roles of DNA damage response pathways. Cell. Mol. Life Sci., 69, 2559-2572 (2012)[PubMed]
- Ichijima, Y., Ichijima, M., Lou, Z. et al.: MDC1 directs chromosome-wide silencing of the sex chromosomes in male germ cells. Genes Dev., 25, 959-971 (2011)[PubMed]
- Gao, Z., Zhang, J., Bonasio, R. et al.: PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes. Mol. Cell, 45, 344-356 (2012)[PubMed]
- Sin, H. S., Barski, A., Zhang, F. et al.: RNF8 regulates active epigenetic modifications and escape gene activation from inactive sex chromosomes in post-meiotic spermatids. Genes Dev., 26, 2737-2748 (2012)[PubMed]
- Sin, H. S., Ichijima, Y., Koh, E. et al.: Human postmeiotic sex chromatin and its impact on sex chromosome evolution. Genome Res., 22, 827-836 (2012)[PubMed]
- Luo, M., Zhou, J., Leu, N. A. et al.: Polycomb protein SCML2 associates with USP7 and counteracts histone H2A ubiquitination in the XY chromatin during male meiosis. PLoS Genet., 11, e1004954 (2015)[PubMed]
- Janic, A., Mendizabal, L., Llamazares, S. et al.: Ectopic expression of germline genes drives malignant brain tumor growth in Drosophila. Science, 330, 1824-1827 (2010)[PubMed]
- Eun, S. H., Shi, Z., Cui, K. et al.: A non-cell autonomous role of E(z) to prevent germ cells from turning on a somatic cell marker. Science, 343, 1513-1516 (2014)[PubMed]
著者プロフィール
米国Cincinnati Children's Hospital Medical CenterにてPostdoctoral Fellow.
前澤 創(So Maezawa)
米国Cincinnati Children's Hospital Medical CenterにてResearch Associate.
行川 賢(Satoshi H. Namekawa)
略歴:2005年 東京理科大学大学院理工学研究科博士課程 修了,同年 米国Harvard Medical Schoolポスドクを経て,2009年より米国Cincinnati Children's Hospital Medical Center助教授.
研究テーマ:哺乳類の生殖細胞におけるエピジェネティックな制御,とくに,性染色体の制御.
抱負:この研究の成果をもとに,後期の生殖細胞におけるエピゲノムの形成と,のちの初期胚への世代間でのエピジェネティックな伝達について解明していきたい.
研究室URL:http://www.cincinnatichildrens.org/research/divisions/r/reproductive-sciences/labs/namekawa/default/
© 2015 長谷川和輝・前澤 創・行川 賢 Licensed under CC 表示 2.1 日本