CYLDによるMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖の特異的な切断の分子機構
佐藤裕介・深井周也
(東京大学放射光連携研究機構 生命科学部門構造生物学研究室)
email:佐藤裕介,深井周也
DOI: 10.7875/first.author.2015.031
Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity.
Yusuke Sato, Eiji Goto, Yuri Shibata, Yuji Kubota, Atsushi Yamagata, Sakurako Goto-Ito, Keiko Kubota, Jun-ichiro Inoue, Mutsuhiro Takekawa, Fuminori Tokunaga, Shuya Fukai
Nature Structural & Molecular Biology, 22, 222-229 (2015)
ユビキチンは標的タンパク質のLysと結合することによりタンパク質の機能をさまざまに制御する.また,結合したユビキチンのN末端のMetやLysにさらにユビキチンが付加することにより形成されるポリユビキチン鎖は,どの残基を用いてポリユビキチン鎖を形成したかによりその役割は異なっている.たとえば,TNFαなどの炎症性サイトカインによる刺激によりMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖が形成されるが,この2種類のユビキチン鎖はJNKシグナル伝達経路やNF-κBシグナル伝達経路の活性化シグナルとしてはたらく.家族性円柱腫症の原因遺伝子の産物として同定されたがん抑制タンパク質CYLDはUSPファミリーに属する脱ユビキチン化酵素であり,Met1ユビキチン鎖およびLys63ユビキチン鎖を特異的に切断することによりこれらのシグナル伝達経路の過剰な活性化を阻害し腫瘍や細胞のがん化を抑制する.この研究において,筆者らは,CYLDとMet1結合型ユビキチン二量体との複合体,および,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を決定した.その結果,CYLDは2つのユビキチンを同時に認識することによりユビキチン鎖を識別していること,CYLDの柔軟なβシートがMet1結合型ユビキチン二量体とLys63結合型ユビキチン二量体のわずかな構造の違いに対応して動き2種類のユビキチン鎖を切断すること,ユビキチン鎖に対する特異性のないUSPファミリーのほかのメンバーと比べCYLDには欠失領域および挿入領域がありこれらの領域がCYLDのユビキチン鎖に対する特異性に大きくかかわっていること,が明らかにされた.決定された結晶構造は,ポリユビキチン鎖によりひき起こされる免疫応答や炎症反応,腫瘍の形成,細胞のがん化の原因を解明する今後の研究の基盤になると期待される.
ユビキチンは酵母からヒトまで非常によく保存されている76残基からなる小さなタンパク質で,C末端のGly76が標的タンパク質のLysと結合することによりさまざまな生命現象を制御している.また,ユビキチンそれ自体にもLysが存在するため,標的タンパク質と結合したユビキチンにさらにユビキチンが結合することによりポリユビキチン鎖が形成される.ポリユビキチン鎖もまたさまざまな生体反応において重要なシグナルとしてはたらくが,ポリユビキチン鎖の形成に使われるユビキチンのLysは7つあるほか,N末端のMet1を用いてもポリユビキチン鎖が形成されるため,少なくとも8種類のポリユビキチン鎖が存在する(Lys6結合型,Lys11結合型,Lys27結合型,Lys29結合型,Lys33結合型,Lys48結合型,Lys63結合型,Met1結合型).使われる残基によりタンパク質の機能制御について異なる様式をもち,もっともよく知られるプロテアソーム分解シグナルとしての役割はおもにLys48結合型ユビキチン鎖が担っている.一方,細胞のアポトーシスや分化および増殖にかかわるJNKシグナル伝達経路においてはLys63結合型ユビキチン鎖が,免疫応答や炎症反応の過程で刺激により誘導される多くの遺伝子発現にかかわるNF-κBシグナル伝達経路においてはLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖が,活性化シグナルとして重要な役割をはたしている.
CYLDはUSPファミリーに属する脱ユビキチン化酵素であり,家族性円柱腫症(常染色体優性遺伝による疾患で,頭皮に円柱腫とよばれる良性腫瘍が生じる)の原因遺伝子の産物として同定された1,2).また,CYLDの変異は家族性円柱腫症のほかにもさまざまながんの原因になることが明らかにされている.これまでに活性の確認されたUSPファミリーの多くのメンバーはあらゆるユビキチン鎖を切断するのに対し,CYLDはLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖を特異的に切断する3,4).CYLDはこの2種類のユビキチン鎖を切断することによりJNKシグナル伝達経路およびNF-κBシグナル伝達経路の過剰な活性化を負に制御し,腫瘍の形成や細胞のがん化を抑制している.すでに,単体のCYLDの結晶構造は決定されていたが5),CYLDがLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖を特異的に認識する分子機構は明らかにされていなかった.今回,筆者らは,CYLDとMet1結合型ユビキチン二量体との複合体,および,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を決定し,CYLDによるユビキチン鎖の特異的な認識の機構を明らかにした.
数種の生物のCYLDを比較した結果,もっとも結晶化に適していたゼブラフィッシュのCYLDについて,ユビキチン鎖の切断活性にかかわるUSPドメイン(578~951アミノ酸残基の領域)を結晶化に用いた.また,結晶においてCYLDがユビキチン鎖を切断しないよう,切断反応に直接にかかわる残基Cys596をSerあるいはAlaに置換した.さらに,Bボックスドメイン(781~849アミノ酸残基の領域)は局在に関与するものの脱ユビキチン化活性には関与しないため欠失させた.また,Glu674はLys63結合型ユビキチン二量体との複合体においては溶媒に露出していた一方,Met1結合型ユビキチン二量体との複合体では結晶構造にてユビキチン鎖の切断部位が活性中心に接近するのを阻害していたことから,CYLDとMet1結合型ユビキチン二量体との複合体にかぎり,Glu674をGlnに置換したものを結晶化に用いた.
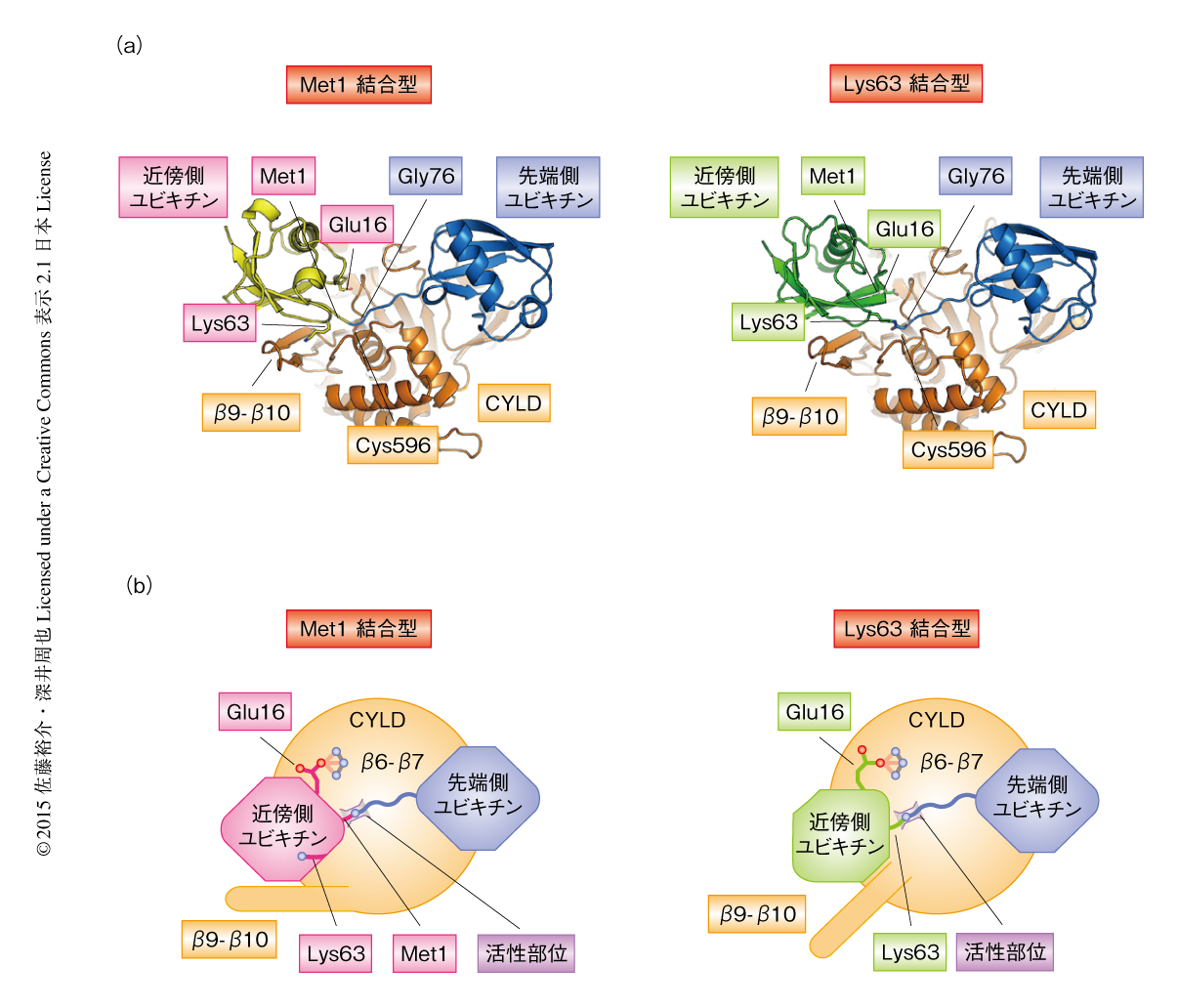
CYLDとMet1結合型ユビキチン二量体との複合体の結晶構造を分解能2.3Å(PDB ID:3WXF),また,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を分解能3.1Å(PDB ID:3WXG)で決定した(図1a).ユビキチン二量体の2つのユビキチンのうち,N末端のGly76にて結合しているほうを先端側ユビキチン,そうでないほうを近傍側ユビキチンとよぶが(つまり,実際にはたらく際に基質により近い側を近傍側,遠い側を先端側とよぶ),どちらの複合体でもCYLDは先端側ユビキチンと近傍側ユビキチンのかたちを同時に認識し,CYLDのCys596がユビキチン鎖の切断部位に接近していた(図1a).先端側ユビキチンとの相互作用および近傍側ユビキチンとの相互作用はどちらも重要で,これらの相互作用にかかわる残基に変異を導入するとCYLDの活性は大きく低下した.つまり,CYLDがユビキチン鎖を切断するためには,先端側ユビキチンおよび近傍側ユビキチンと同時に結合することが必要であった.どの残基を用いてユビキチン鎖を形成するかにより近傍側ユビキチンの配向は大きく変わる.したがって,Met1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のほかのユビキチン鎖では近傍側ユビキチンとCYLDは結合できず,先端側ユビキチンとCYLDとの結合だけでは不十分であるため,CYLDはMet1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のほかのユビキチン鎖を切断することができない.また,CYLDはMet1結合型ユビキチン鎖やLys63結合型ユビキチン鎖により活性化されたJNKシグナル伝達経路およびNF-κBシグナル伝達経路の活性を抑制するが,変異体を使った実験から,この抑制能はCYLDの脱ユビキチン化能に依存することが確かめられた.
CYLDのほかにも特異性をもつ脱ユビキチン化酵素の結晶構造は決定されていたが,その分子機構はCYLDと同様に,先端側ユビキチン,近傍側ユビキチン,切断部位を同時に認識して見分けるというものだった.しかし,これまでに構造の決定された脱ユビキチン化酵素はすべて1種類のユビキチン鎖を特異的に切断するのに対し6-8),CYLDはMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖の2種類のユビキチン鎖を特異的に切断するという点で大きく異なる.この2種類のユビキチン鎖を切断する分子機構を明らかにするため,CYLDとMet1結合型ユビキチン二量体との複合体とCYLDとLys63結合型ユビキチン二量体との複合体とを比較した(図1b).その結果,CYLDおよび先端側ユビキチンについては構造がよく一致したが,近傍側ユビキチンはやや異なる配向をとることがわかった.では,CYLDは近傍側ユビキチンの配向が違うにもかかわらず,なぜMet1結合型ユビキチン二量体およびLys63結合型ユビキチン二量体のどちらとも相互作用できるのだろうか? この理由のひとつとして,CYLDと近傍側ユビキチンとの相互作用が柔軟であることが結晶構造から示唆された.興味深いことに,近傍側ユビキチンとの相互作用にかかわるCYLDのβ9-β10シートは柔軟で,近傍側ユビキチンがMet1結合型ユビキチン鎖とLys63結合型ユビキチン鎖とで配向が変わってもCYLDのβ9-β10シートもその違いに対応して動くため,β9-β10シートはMet1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のどちらでも近傍側ユビキチンと相互作用できた.また,近傍側ユビキチンのGlu16もCYLDのβ6-β7との水素結合において重要であったが,こちらも近傍側ユビキチンの配向の違いに対応して柔軟に動くことがわかった(図1b).さらに,いくつかの水素結合はMet1結合型ユビキチン鎖とLys63結合型ユビキチン鎖とのあいだで切り替わり,どちらに対しても切断に必要なだけの親和性をもつことが明らかにされた.したがって,これまでに構造の決定された特異性のある脱ユビキチン化酵素は近傍側ユビキチンとの相互作用に柔軟性がなく1種類のユビキチン鎖を特異的に切断するが,CYLDと近傍側ユビキチンとの相互作用はある程度の柔軟さをもつため2種類のユビキチン鎖を特異的に切断すると考えられた.複数の種類のユビキチン鎖を選択的に切断する脱ユビキチン化酵素がCYLDのほかにもいくつか存在するが9),これらもCYLDと同様に柔軟な相互作用により複数の種類のユビキチン鎖を認識しているのかについては非常に興味深く,今後の報告が期待される.
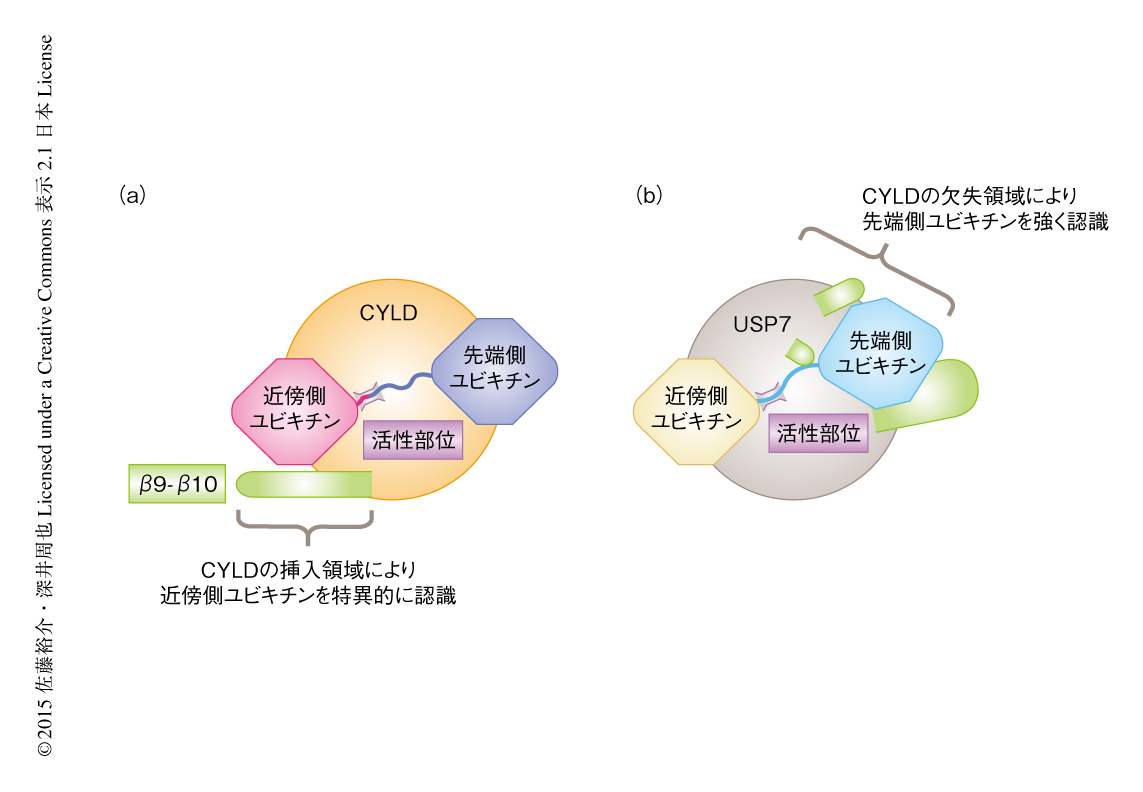
CYLDはUSPファミリーに属するが,ほかの多くのメンバーと異なり,Met1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖に対し強い特異性をもつ.この特異性の機構についてよりくわしく調べるため,特異性のないUSPファミリーのメンバーであるUSP7 10) とCYLDとを比較した(図2).その結果,CYLDはUSP7と比べ,先端側ユビキチンと相互作用する領域に欠失が3カ所あった一方,近傍側ユビキチンと相互作用する領域に挿入が1カ所あった.おそらく,USP7はCYLDと比較して先端側ユビキチンと相互作用する領域が大きく,先端側ユビキチンとの相互作用のみでユビキチン鎖の切断に十分な親和性をもつのであろう.その結果,近傍側ユビキチンとの相互作用を必要とせず,あらゆる種類のユビキチン鎖を切断することができると考えられた.一方,CYLDは先端側ユビキチンと相互作用する領域に欠失があるため,先端側ユビキチンとの相互作用のみでは十分な親和性をもたない.このため,CYLDには近傍側ユビキチンとの相互作用も必要であり,挿入領域であるβ9-β10シートがこの相互作用を強めていた.挿入領域を含めたCYLDの近傍側ユビキチンと相互作用する領域がMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖に最適化されているため,CYLDはこれら2種類のユビキチン鎖に対し特異性をもつと考えられた.
今回の結晶構造の決定にあたりもっとも苦労したのは,ユビキチン鎖の切断部位がCYLDの活性残基から離れた構造ばかりが得られ,なかなか反応中間体の構造が得られなかった点であった.これは,CYLDは2種類のユビキチン鎖を認識するため近傍側ユビキチンの認識が非常に柔軟で,近傍側ユビキチンが比較的自由な配向をとることができるためであった.CYLDの活性残基であるCys596をAlaあるいはSerに置換した変異体を用いたが,Lys63結合型ユビキチン二量体との複合体についてはCys596をAlaに置換した変異体においてのみ反応中間体の構造が得られた.また,Met1結合型ユビキチン二量体との複合体についてはCys596をSerに置換した変異にくわえGlu674をGlnに置換することにより反応中間体の構造が得られた.当初,ユビキチン鎖の切断部位がCYLDの活性残基から離れた構造について論文を投稿しリジェクトされたが,その1年後,最終的に反応中間体の構造について論文を投稿しアクセプトされた.時間はかかったものの,CYLDによるMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖の切断の機構についてかなりくわしいところまで明らかにすることのできた点は満足している.
略歴:2009年 東京工業大学大学院生命理工学研究科 修了,同年より東京大学放射光連携研究機構 助教.
研究テーマ:ユビキチン鎖の識別の機構.
抱負:積極的に共同研究をしていきたい.
深井 周也(Shuya Fukai)
東京大学放射光連携研究機構 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/srro/SRROLifeSciDivJp2
© 2015 佐藤裕介・深井周也 Licensed under CC 表示 2.1 日本
(東京大学放射光連携研究機構 生命科学部門構造生物学研究室)
email:佐藤裕介,深井周也
DOI: 10.7875/first.author.2015.031
Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity.
Yusuke Sato, Eiji Goto, Yuri Shibata, Yuji Kubota, Atsushi Yamagata, Sakurako Goto-Ito, Keiko Kubota, Jun-ichiro Inoue, Mutsuhiro Takekawa, Fuminori Tokunaga, Shuya Fukai
Nature Structural & Molecular Biology, 22, 222-229 (2015)
要 約
ユビキチンは標的タンパク質のLysと結合することによりタンパク質の機能をさまざまに制御する.また,結合したユビキチンのN末端のMetやLysにさらにユビキチンが付加することにより形成されるポリユビキチン鎖は,どの残基を用いてポリユビキチン鎖を形成したかによりその役割は異なっている.たとえば,TNFαなどの炎症性サイトカインによる刺激によりMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖が形成されるが,この2種類のユビキチン鎖はJNKシグナル伝達経路やNF-κBシグナル伝達経路の活性化シグナルとしてはたらく.家族性円柱腫症の原因遺伝子の産物として同定されたがん抑制タンパク質CYLDはUSPファミリーに属する脱ユビキチン化酵素であり,Met1ユビキチン鎖およびLys63ユビキチン鎖を特異的に切断することによりこれらのシグナル伝達経路の過剰な活性化を阻害し腫瘍や細胞のがん化を抑制する.この研究において,筆者らは,CYLDとMet1結合型ユビキチン二量体との複合体,および,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を決定した.その結果,CYLDは2つのユビキチンを同時に認識することによりユビキチン鎖を識別していること,CYLDの柔軟なβシートがMet1結合型ユビキチン二量体とLys63結合型ユビキチン二量体のわずかな構造の違いに対応して動き2種類のユビキチン鎖を切断すること,ユビキチン鎖に対する特異性のないUSPファミリーのほかのメンバーと比べCYLDには欠失領域および挿入領域がありこれらの領域がCYLDのユビキチン鎖に対する特異性に大きくかかわっていること,が明らかにされた.決定された結晶構造は,ポリユビキチン鎖によりひき起こされる免疫応答や炎症反応,腫瘍の形成,細胞のがん化の原因を解明する今後の研究の基盤になると期待される.
はじめに
ユビキチンは酵母からヒトまで非常によく保存されている76残基からなる小さなタンパク質で,C末端のGly76が標的タンパク質のLysと結合することによりさまざまな生命現象を制御している.また,ユビキチンそれ自体にもLysが存在するため,標的タンパク質と結合したユビキチンにさらにユビキチンが結合することによりポリユビキチン鎖が形成される.ポリユビキチン鎖もまたさまざまな生体反応において重要なシグナルとしてはたらくが,ポリユビキチン鎖の形成に使われるユビキチンのLysは7つあるほか,N末端のMet1を用いてもポリユビキチン鎖が形成されるため,少なくとも8種類のポリユビキチン鎖が存在する(Lys6結合型,Lys11結合型,Lys27結合型,Lys29結合型,Lys33結合型,Lys48結合型,Lys63結合型,Met1結合型).使われる残基によりタンパク質の機能制御について異なる様式をもち,もっともよく知られるプロテアソーム分解シグナルとしての役割はおもにLys48結合型ユビキチン鎖が担っている.一方,細胞のアポトーシスや分化および増殖にかかわるJNKシグナル伝達経路においてはLys63結合型ユビキチン鎖が,免疫応答や炎症反応の過程で刺激により誘導される多くの遺伝子発現にかかわるNF-κBシグナル伝達経路においてはLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖が,活性化シグナルとして重要な役割をはたしている.
CYLDはUSPファミリーに属する脱ユビキチン化酵素であり,家族性円柱腫症(常染色体優性遺伝による疾患で,頭皮に円柱腫とよばれる良性腫瘍が生じる)の原因遺伝子の産物として同定された1,2).また,CYLDの変異は家族性円柱腫症のほかにもさまざまながんの原因になることが明らかにされている.これまでに活性の確認されたUSPファミリーの多くのメンバーはあらゆるユビキチン鎖を切断するのに対し,CYLDはLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖を特異的に切断する3,4).CYLDはこの2種類のユビキチン鎖を切断することによりJNKシグナル伝達経路およびNF-κBシグナル伝達経路の過剰な活性化を負に制御し,腫瘍の形成や細胞のがん化を抑制している.すでに,単体のCYLDの結晶構造は決定されていたが5),CYLDがLys63結合型ユビキチン鎖およびMet1結合型ユビキチン鎖を特異的に認識する分子機構は明らかにされていなかった.今回,筆者らは,CYLDとMet1結合型ユビキチン二量体との複合体,および,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を決定し,CYLDによるユビキチン鎖の特異的な認識の機構を明らかにした.
1.CYLDとMet1結合型ユビキチン二量体との複合体およびCYLDとLys63結合型ユビキチン二量体との複合体の結晶構造
数種の生物のCYLDを比較した結果,もっとも結晶化に適していたゼブラフィッシュのCYLDについて,ユビキチン鎖の切断活性にかかわるUSPドメイン(578~951アミノ酸残基の領域)を結晶化に用いた.また,結晶においてCYLDがユビキチン鎖を切断しないよう,切断反応に直接にかかわる残基Cys596をSerあるいはAlaに置換した.さらに,Bボックスドメイン(781~849アミノ酸残基の領域)は局在に関与するものの脱ユビキチン化活性には関与しないため欠失させた.また,Glu674はLys63結合型ユビキチン二量体との複合体においては溶媒に露出していた一方,Met1結合型ユビキチン二量体との複合体では結晶構造にてユビキチン鎖の切断部位が活性中心に接近するのを阻害していたことから,CYLDとMet1結合型ユビキチン二量体との複合体にかぎり,Glu674をGlnに置換したものを結晶化に用いた.
CYLDとMet1結合型ユビキチン二量体との複合体の結晶構造を分解能2.3Å(PDB ID:3WXF),また,CYLDとLys63結合型ユビキチン二量体との複合体の結晶構造を分解能3.1Å(PDB ID:3WXG)で決定した(図1a).ユビキチン二量体の2つのユビキチンのうち,N末端のGly76にて結合しているほうを先端側ユビキチン,そうでないほうを近傍側ユビキチンとよぶが(つまり,実際にはたらく際に基質により近い側を近傍側,遠い側を先端側とよぶ),どちらの複合体でもCYLDは先端側ユビキチンと近傍側ユビキチンのかたちを同時に認識し,CYLDのCys596がユビキチン鎖の切断部位に接近していた(図1a).先端側ユビキチンとの相互作用および近傍側ユビキチンとの相互作用はどちらも重要で,これらの相互作用にかかわる残基に変異を導入するとCYLDの活性は大きく低下した.つまり,CYLDがユビキチン鎖を切断するためには,先端側ユビキチンおよび近傍側ユビキチンと同時に結合することが必要であった.どの残基を用いてユビキチン鎖を形成するかにより近傍側ユビキチンの配向は大きく変わる.したがって,Met1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のほかのユビキチン鎖では近傍側ユビキチンとCYLDは結合できず,先端側ユビキチンとCYLDとの結合だけでは不十分であるため,CYLDはMet1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のほかのユビキチン鎖を切断することができない.また,CYLDはMet1結合型ユビキチン鎖やLys63結合型ユビキチン鎖により活性化されたJNKシグナル伝達経路およびNF-κBシグナル伝達経路の活性を抑制するが,変異体を使った実験から,この抑制能はCYLDの脱ユビキチン化能に依存することが確かめられた.
2.CYLDの柔軟な相互作用による2種類のユビキチン鎖の認識の機構
CYLDのほかにも特異性をもつ脱ユビキチン化酵素の結晶構造は決定されていたが,その分子機構はCYLDと同様に,先端側ユビキチン,近傍側ユビキチン,切断部位を同時に認識して見分けるというものだった.しかし,これまでに構造の決定された脱ユビキチン化酵素はすべて1種類のユビキチン鎖を特異的に切断するのに対し6-8),CYLDはMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖の2種類のユビキチン鎖を特異的に切断するという点で大きく異なる.この2種類のユビキチン鎖を切断する分子機構を明らかにするため,CYLDとMet1結合型ユビキチン二量体との複合体とCYLDとLys63結合型ユビキチン二量体との複合体とを比較した(図1b).その結果,CYLDおよび先端側ユビキチンについては構造がよく一致したが,近傍側ユビキチンはやや異なる配向をとることがわかった.では,CYLDは近傍側ユビキチンの配向が違うにもかかわらず,なぜMet1結合型ユビキチン二量体およびLys63結合型ユビキチン二量体のどちらとも相互作用できるのだろうか? この理由のひとつとして,CYLDと近傍側ユビキチンとの相互作用が柔軟であることが結晶構造から示唆された.興味深いことに,近傍側ユビキチンとの相互作用にかかわるCYLDのβ9-β10シートは柔軟で,近傍側ユビキチンがMet1結合型ユビキチン鎖とLys63結合型ユビキチン鎖とで配向が変わってもCYLDのβ9-β10シートもその違いに対応して動くため,β9-β10シートはMet1結合型ユビキチン鎖あるいはLys63結合型ユビキチン鎖のどちらでも近傍側ユビキチンと相互作用できた.また,近傍側ユビキチンのGlu16もCYLDのβ6-β7との水素結合において重要であったが,こちらも近傍側ユビキチンの配向の違いに対応して柔軟に動くことがわかった(図1b).さらに,いくつかの水素結合はMet1結合型ユビキチン鎖とLys63結合型ユビキチン鎖とのあいだで切り替わり,どちらに対しても切断に必要なだけの親和性をもつことが明らかにされた.したがって,これまでに構造の決定された特異性のある脱ユビキチン化酵素は近傍側ユビキチンとの相互作用に柔軟性がなく1種類のユビキチン鎖を特異的に切断するが,CYLDと近傍側ユビキチンとの相互作用はある程度の柔軟さをもつため2種類のユビキチン鎖を特異的に切断すると考えられた.複数の種類のユビキチン鎖を選択的に切断する脱ユビキチン化酵素がCYLDのほかにもいくつか存在するが9),これらもCYLDと同様に柔軟な相互作用により複数の種類のユビキチン鎖を認識しているのかについては非常に興味深く,今後の報告が期待される.
3.CYLDの挿入領域と欠失領域によるユビキチン鎖に対する特異性
CYLDはUSPファミリーに属するが,ほかの多くのメンバーと異なり,Met1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖に対し強い特異性をもつ.この特異性の機構についてよりくわしく調べるため,特異性のないUSPファミリーのメンバーであるUSP7 10) とCYLDとを比較した(図2).その結果,CYLDはUSP7と比べ,先端側ユビキチンと相互作用する領域に欠失が3カ所あった一方,近傍側ユビキチンと相互作用する領域に挿入が1カ所あった.おそらく,USP7はCYLDと比較して先端側ユビキチンと相互作用する領域が大きく,先端側ユビキチンとの相互作用のみでユビキチン鎖の切断に十分な親和性をもつのであろう.その結果,近傍側ユビキチンとの相互作用を必要とせず,あらゆる種類のユビキチン鎖を切断することができると考えられた.一方,CYLDは先端側ユビキチンと相互作用する領域に欠失があるため,先端側ユビキチンとの相互作用のみでは十分な親和性をもたない.このため,CYLDには近傍側ユビキチンとの相互作用も必要であり,挿入領域であるβ9-β10シートがこの相互作用を強めていた.挿入領域を含めたCYLDの近傍側ユビキチンと相互作用する領域がMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖に最適化されているため,CYLDはこれら2種類のユビキチン鎖に対し特異性をもつと考えられた.
おわりに
今回の結晶構造の決定にあたりもっとも苦労したのは,ユビキチン鎖の切断部位がCYLDの活性残基から離れた構造ばかりが得られ,なかなか反応中間体の構造が得られなかった点であった.これは,CYLDは2種類のユビキチン鎖を認識するため近傍側ユビキチンの認識が非常に柔軟で,近傍側ユビキチンが比較的自由な配向をとることができるためであった.CYLDの活性残基であるCys596をAlaあるいはSerに置換した変異体を用いたが,Lys63結合型ユビキチン二量体との複合体についてはCys596をAlaに置換した変異体においてのみ反応中間体の構造が得られた.また,Met1結合型ユビキチン二量体との複合体についてはCys596をSerに置換した変異にくわえGlu674をGlnに置換することにより反応中間体の構造が得られた.当初,ユビキチン鎖の切断部位がCYLDの活性残基から離れた構造について論文を投稿しリジェクトされたが,その1年後,最終的に反応中間体の構造について論文を投稿しアクセプトされた.時間はかかったものの,CYLDによるMet1結合型ユビキチン鎖およびLys63結合型ユビキチン鎖の切断の機構についてかなりくわしいところまで明らかにすることのできた点は満足している.
文 献
- Blake, P. W. & Toro, J. R.: Update of cylindromatosis gene (CYLD) mutations in Brooke-Spiegler syndrome: novel insights into the role of deubiquitination in cell signaling. Hum. Mutat., 30, 1025-1036 (2009)[PubMed]
- van den Ouweland, A. M., Elfferich, P., Lamping, R. et al.: Identification of a large rearrangement in CYLD as a cause of familial cylindromatosis. Fam. Cancer, 10, 127-132 (2011)[PubMed]
- Virdee, S., Ye, Y., Nguyen, D. P. et al.: Engineered diubiquitin synthesis reveals Lys29-isopeptide specificity of an OTU deubiquitinase. Nat. Chem. Biol., 6, 750-757 (2010)[PubMed]
- Komander, D., Reyes-Turcu, F., Licchesi, J. D. et al.: Molecular discrimination of structurally equivalent Lys 63-linked and linear polyubiquitin chains. EMBO Rep., 10, 466-473 (2009)[PubMed]
- Komander, D., Lord, C. J., Scheel, H. et al.: The structure of the CYLD USP domain explains its specificity for Lys63-linked polyubiquitin and reveals a B Box module. Mol. Cell, 29, 451-464 (2008)[PubMed]
- Sato, Y., Yoshikawa, A., Yamagata, A. et al.: Structural basis for specific cleavage of Lys 63-linked polyubiquitin chains. Nature, 455, 358-362 (2008)[PubMed]
- Keusekotten, K., Elliott, P. R., Glockner, L. et al.: OTULIN antagonizes LUBAC signaling by specifically hydrolyzing Met1-linked polyubiquitin. Cell, 153, 1312-1326 (2013)[PubMed]
- Rivkin, E., Almeida, S. M., Ceccarelli, D. F. et al.: The linear ubiquitin-specific deubiquitinase gumby regulates angiogenesis. Nature, 498, 318-324 (2013)[PubMed]
- Licchesi, J. D., Mieszczanek, J., Mevissen, T. E. et al.: An ankyrin-repeat ubiquitin-binding domain determines TRABID's specificity for atypical ubiquitin chains. Nat. Struct. Mol. Biol., 19, 62-71 (2012)[PubMed]
- Hu, M., Li, P., Li, M. et al.: Crystal structure of a UBP-family deubiquitinating enzyme in isolation and in complex with ubiquitin aldehyde. Cell, 111, 1041-1054 (2002)[PubMed]
著者プロフィール
略歴:2009年 東京工業大学大学院生命理工学研究科 修了,同年より東京大学放射光連携研究機構 助教.
研究テーマ:ユビキチン鎖の識別の機構.
抱負:積極的に共同研究をしていきたい.
深井 周也(Shuya Fukai)
東京大学放射光連携研究機構 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/srro/SRROLifeSciDivJp2
© 2015 佐藤裕介・深井周也 Licensed under CC 表示 2.1 日本