CENP-Aのセントロメアへの局在はLys124のユビキチン化に依存する
新鞍陽平・北川理佐・北川克己
(米国Research Institute at Nationwide Children's Hospital,Center for Childhood Cancer and Blood Diseases)
email:北川克己
DOI: 10.7875/first.author.2015.029
CENP-A K124 ubiquitylation is required for CENP-A deposition at the centromere.
Yohei Niikura, Risa Kitagawa, Hiroo Ogi, Rashid Abdulle, Vishwajeeth Pagala, Katsumi Kitagawa
Developmental Cell, 32, 589-603 (2015)
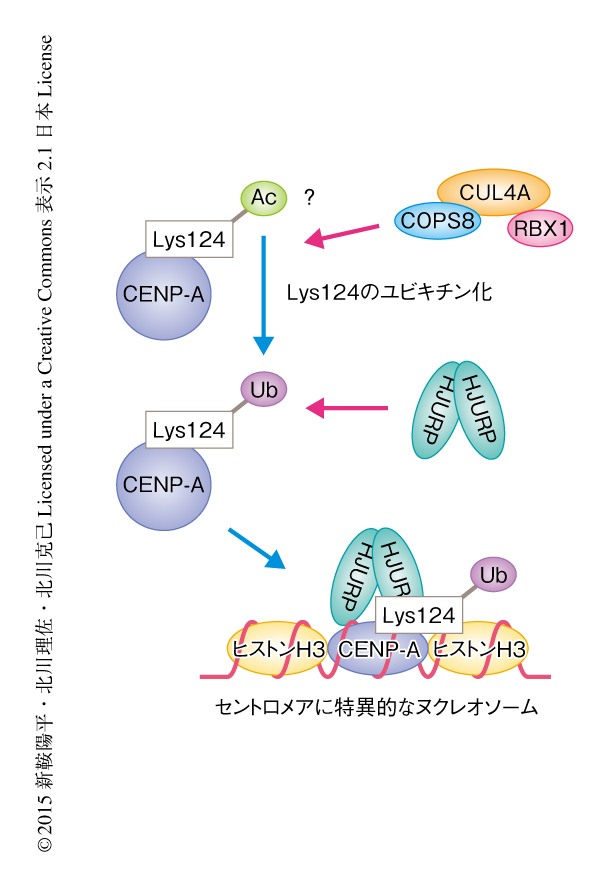
CENP-AはヒストンH3と相同性をもつセントロメアに特異的なヌクレオソームタンパク質である.ヒトの染色体においてセントロメアとしてのアイデンティティーは,そのDNA塩基配列ではなくエピジェネティックな機構により決定され,CENP-Aはそのエピジェネティックなマークとして重要な役割をはたしていると考えられている.しかし,CENP-Aがセントロメア領域のヘテロクロマチンに特異的に組み込まれる分子機構については明らかにされていない.筆者らは,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124をユビキチン化すること,さらに,このユビキチン化がセントロメアへの特異的な局在に必要であることを明らかにした.CENP-AのLys124をArgに置換するとCENP-Aに特異的なヒストンシャペロンであるHJURPとの結合能が低下し,セントロメアに特異的な局在が阻害された.さらに,この変異型CENP-Aにモノユビキチンを付加するとHJURPとの結合能およびセントロメアに特異的な局在が回復した.また,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体は,新規に生合成されたCENP-Aをセントロメア領域のクロマチンに組み込むステップと,セントロメア領域のクロマチンに組み込まれている既存のCENP-Aを維持するステップの両方に必要であることも明らかにされた.以上の結果から,CENP-AのLys124のユビキチン化はセントロメアに特異的な局在において重要な役割をはたしていることが示唆された.
S期に複製され倍加した染色体は,M期に細胞の両極から伸びる紡錘体微小管と結合することにより娘細胞に等分配される.微小管の結合するDNAの領域はセントロメアと定義され,そこに形成されるDNA-タンパク質複合体をキネトコアとよぶ.セントロメアはおのおのの染色体に1カ所存在し,M期における染色体の娘細胞への正確な等分配をつかさどる重要な役割を担っている.セントロメアの機能の欠損は,細胞の染色体数の異常と,それにともなうがん化をひき起こす.ヒトの染色体のセントロメアは171 bpのアルファサテライトDNAを単位とした高度に重複した反復配列から構成されている.しかし,セントロメアとしてのアイデンティティーはDNA塩基配列ではなくセントロメアに特異的なヌクレオソームに依存すると考えられている.CENP-AはヒストンH3と相同性をもち,ヒストンH2A,ヒストンH2B,ヒストンH4との複合体としてセントロメアに特異的なヌクレオソームを形成することから,セントロメアのエピジェネティックなマークとしての役割を担っていると考えられている1).CENP-Aに存在するCATD(centromere targeting domain)はセントロメアへの局在に必要十分なドメインであり,ヒストンH3の対応する領域をCATDと置換したキメラタンパク質はセントロメアに局在しCENP-Aのはたらきを相補することができる2).
新規に生合成されたCENP-Aは細胞分裂の直後のG1期の初期に,CENP-Aに特異的なヒストンシャペロンであるHJURPに依存的にセントロメア領域のクロマチンに組み込まれる3).HJURPもCENP-Aと同様にG1期の初期にセントロメアに局在する.Mis18複合体はセントロメア領域のヒストンおよびDNAのメチル化あるいはアセチル化などの修飾を制御すると考えられているが,セントロメアへのHJURPの局在にはこのMis18質複合体の活性が必要である.さらに,CENP-Aのセントロメアへの局在はPlk1キナーゼ,CDKキナーゼ,RSF複合体,MgcRacGAPなどを介したシグナル伝達経路により制御されている4-7).
CENP-Aはエピジェネティックな制御をうけていると考えられるが,セントロメアに特異的なヌクレオソームの形成における翻訳後修飾の機能については不明な点が多い.CENP-AのLys7,Lys16,Lys18はリン酸化,Gly1はメチル化をうけ,M期におけるそれら翻訳後修飾の機能が示唆されている.CENP-Aと同じくセントロメアに特異的なヒストンH3のホモログであるトウモロコシのCenH3や出芽酵母のCse4も翻訳後修飾をうけ,それらのセントロメアの機能におけるはたらきを示唆する報告もある.しかし,これまでに同定されている翻訳後修飾に関しては,CENP-Aのセントロメアに特異的な局在における機能に関与するという報告はない.
この研究において,筆者らは,CENP-AのLys124がCUL4-RBX1-COPS8ユビキチンリガーゼ複合体によりユビキチン化されること,そして,このユビキチン化がセントロメアに特異的な局在に必要であることを明らかにした.
これまでに,抗CENP-A抗体を用いたクロマチン免疫沈降により間期セントロメア複合体の構成タンパク質が同定されている8-10).筆者らは,そのなかにCENP-Aのセントロメアへの局在を制御するタンパク質が存在するという仮説をたて,発現の低下によりCENP-Aのセントロメアへの局在が阻害されるような間期セントロメア複合体の構成タンパク質を同定することを目的として,間期セントロメア複合体の構成タンパク質を標的としてsiRNAスクリーニングを行った.このスクリーニングによりCUL4Aが同定された.siRNAによりCUL4Aをノックダウンしたところ,セントロメアに局在するCENP-Aの顕著な減少がみられた.細胞の全体におけるCENP-Aの量は対照と比べ差がみられなかったことから,CUL4AはCENP-Aの安定性ではなく,セントロメアへの特異的な局在に必要であることが示唆された.さらに,CUL4Aとユビキチンリガーゼ複合体を形成するリングフィンガータンパク質であるRBX1の発現をsiRNAによりノックダウンしたところ,CUL4Aのノックダウンと同様にCENP-Aのセントロメアへの局在が特異的に阻害された.さらに,CUL4Aの免疫沈降によりCUL4AとCENP-Aとのアダプタータンパク質としてはたらくCOPS8が同定された.siRNAによりCOPS8をノックダウンしたところ,CENP-Aのセントロメアへの局在が特異的に阻害された.また,COPS8とCENP-Aとの相互作用も確認された.CUL4A-RBX1複合体はCOPS8のほか,DDB1,DDB2,WDR5,EEDといったアダプタータンパク質とユビキチンリガーゼ複合体を形成しそれぞれのアダプタータンパク質に特異的な基質をユビキチン化するが,それらのアダプタータンパク質をsiRNAによりノックダウンしてもCENP-Aのセントロメアへの局在は阻害されなかった.
in vivoおよび精製したタンパク質を用いたin vitro再構成系において,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124をユビキチン化することが確認された.in vitro再構成系において,CUL4A-RBX1複合体によるCENP-AのLys124のユビキチン化は野生型のCOPS8に依存しており,CENP-Aとの結合能を欠失した変異型COPS8をくわえた場合にはユビキチン化はみられなかった.これらの結果より,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124を特異的にユビキチン化することが明らかにされた.
CENP-AのLys124をArgに置換することによりCUL4A-RBX1-COPS8ユビキチンリガーゼ複合体によるユビキチン化が阻害されることがin vivoおよびin vitro再構成系において確認された.この変異型CENP-AをHeLa細胞において過剰に発現させたところ,野生型CENP-Aのようなセントロメアへの局在は示さず,核において拡散した分布を示した.さらに,この変異型CENP-AのHJURPとの結合能は野生型CENP-Aに比べいちじるしく低下していた.これらの結果から,CENP-AのLys124のユビキチン化はHJURPと効率よく結合するのに必要であり,HJURPとの効率のよい結合がCENP-Aのセントロメアへの特異的な局在を保証していることが示唆された.
Lys124をArgに置換した変異型CENPのC末端にモノユビキチンを付加すると,Lys124がユビキチン化されたCENP-Aと同様にセントロメアに局在した.また,この変異型CENP-AのHJURPとの結合能はモノユビキチンの付加により回復した.さらに,CUL4AあるいはRBX1をsiRNAによりノックダウンした細胞では野生型CENP-Aのセントロメアへの局在は阻害されたが,モノユビキチンを付加した変異型CENP-Aのセントロメアへの局在は阻害されなかったことから,CUL4AおよびRBX1はCENP-AのLys124をユビキチン化することによりセントロメアへの局在に必要とされていることが示唆された.
一定の時期に発現したCENP-AをSNAPタグによりパルスチェイス標識することにより,新規に生合成されたCENP-Aとセントロメア領域のクロマチンに組み込まれている既存のCENP-Aとを区別し,それぞれのセントロメアへの局在におけるCUL4A-RBX1ユビキチンリガーゼ複合体への依存性について調べた.CUL4AあるいはRBX1をsiRNAによりノックダウンすると,新規のCENP-Aおよび既存のCENP-Aのセントロメアへの局在が低下した.この結果により,CUL4A-RBX11-COPS8ユビキチンリガーゼ複合体によるCENP-AのLys124のユビキチン化は,新規に生合成されたCENP-Aのセントロメア領域のクロマチンへの組み込み,および,セントロメア領域のクロマチンに組み込まれている既存のCENP-Aの維持の両方を促進するはたらきをもつことが示された.
CENP-Aはセントロメアとしてのアイデンティティーを決定するエピジェネティックなマークとして重要な役割を担うと考えられているが,分子レベルでどのような制御をうけることによりセントロメアに特異的なヌクレオソームの形成を可能にしているのかについては不明であった.筆者らは,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体によりCENP-AのLys124がユビキチン化され,このユビキチン化がCENP-AのHJURPとの結合能を上昇させることによりセントロメアへの局在を促進することを明らかにした(図1).これは,CENP-Aの翻訳後修飾がCENP-Aのセントロメアへの局在に必要であることを示した最初の重要な発見である.今後は,この発見をもとに,CENP-AのLys124のユビキチン化がセントロメアのアイデンティティーを決定するエピジェネティックなマークとしてのはたらきにどのように関与しているかを明らかにし,生物学的に重要な問題であるセントロメアのアイデンティティーの決定の分子機構を解明していきたい.
略歴:2000年 イタリアFlorence大学にて博士号取得,2010年より米国Research Institute at Nationwide Children's HospitalにてResearch Scientist.
北川 理佐(Risa Kitagawa)
略歴:1997年 名古屋大学大学院理学研究科にて博士号取得,米国Johns Hopkins大学 ポストドクトラルフェロー,カナダBritish Columbia大学 ポストドクトラルフェロー,米国St. Jude Children's Research Hospitalポストドクトラルフェロー,2005年 同 アシスタントメンバー,2010年 米国Ohio州立大学 アシスタントプロフェッサーを経て,2012年より米国Research Institute at Nationwide Children's Hospitalシニア研究員.
北川 克己(Katsumi Kitagawa)
米国Research Institute at Nationwide Children's Hospital室長.
研究室URL:http://www.nationwidechildrens.org/k-kitagawa-lab
© 2015 新鞍陽平・北川理佐・北川克己 Licensed under CC 表示 2.1 日本
(米国Research Institute at Nationwide Children's Hospital,Center for Childhood Cancer and Blood Diseases)
email:北川克己
DOI: 10.7875/first.author.2015.029
CENP-A K124 ubiquitylation is required for CENP-A deposition at the centromere.
Yohei Niikura, Risa Kitagawa, Hiroo Ogi, Rashid Abdulle, Vishwajeeth Pagala, Katsumi Kitagawa
Developmental Cell, 32, 589-603 (2015)
要 約
CENP-AはヒストンH3と相同性をもつセントロメアに特異的なヌクレオソームタンパク質である.ヒトの染色体においてセントロメアとしてのアイデンティティーは,そのDNA塩基配列ではなくエピジェネティックな機構により決定され,CENP-Aはそのエピジェネティックなマークとして重要な役割をはたしていると考えられている.しかし,CENP-Aがセントロメア領域のヘテロクロマチンに特異的に組み込まれる分子機構については明らかにされていない.筆者らは,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124をユビキチン化すること,さらに,このユビキチン化がセントロメアへの特異的な局在に必要であることを明らかにした.CENP-AのLys124をArgに置換するとCENP-Aに特異的なヒストンシャペロンであるHJURPとの結合能が低下し,セントロメアに特異的な局在が阻害された.さらに,この変異型CENP-Aにモノユビキチンを付加するとHJURPとの結合能およびセントロメアに特異的な局在が回復した.また,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体は,新規に生合成されたCENP-Aをセントロメア領域のクロマチンに組み込むステップと,セントロメア領域のクロマチンに組み込まれている既存のCENP-Aを維持するステップの両方に必要であることも明らかにされた.以上の結果から,CENP-AのLys124のユビキチン化はセントロメアに特異的な局在において重要な役割をはたしていることが示唆された.
はじめに
S期に複製され倍加した染色体は,M期に細胞の両極から伸びる紡錘体微小管と結合することにより娘細胞に等分配される.微小管の結合するDNAの領域はセントロメアと定義され,そこに形成されるDNA-タンパク質複合体をキネトコアとよぶ.セントロメアはおのおのの染色体に1カ所存在し,M期における染色体の娘細胞への正確な等分配をつかさどる重要な役割を担っている.セントロメアの機能の欠損は,細胞の染色体数の異常と,それにともなうがん化をひき起こす.ヒトの染色体のセントロメアは171 bpのアルファサテライトDNAを単位とした高度に重複した反復配列から構成されている.しかし,セントロメアとしてのアイデンティティーはDNA塩基配列ではなくセントロメアに特異的なヌクレオソームに依存すると考えられている.CENP-AはヒストンH3と相同性をもち,ヒストンH2A,ヒストンH2B,ヒストンH4との複合体としてセントロメアに特異的なヌクレオソームを形成することから,セントロメアのエピジェネティックなマークとしての役割を担っていると考えられている1).CENP-Aに存在するCATD(centromere targeting domain)はセントロメアへの局在に必要十分なドメインであり,ヒストンH3の対応する領域をCATDと置換したキメラタンパク質はセントロメアに局在しCENP-Aのはたらきを相補することができる2).
新規に生合成されたCENP-Aは細胞分裂の直後のG1期の初期に,CENP-Aに特異的なヒストンシャペロンであるHJURPに依存的にセントロメア領域のクロマチンに組み込まれる3).HJURPもCENP-Aと同様にG1期の初期にセントロメアに局在する.Mis18複合体はセントロメア領域のヒストンおよびDNAのメチル化あるいはアセチル化などの修飾を制御すると考えられているが,セントロメアへのHJURPの局在にはこのMis18質複合体の活性が必要である.さらに,CENP-Aのセントロメアへの局在はPlk1キナーゼ,CDKキナーゼ,RSF複合体,MgcRacGAPなどを介したシグナル伝達経路により制御されている4-7).
CENP-Aはエピジェネティックな制御をうけていると考えられるが,セントロメアに特異的なヌクレオソームの形成における翻訳後修飾の機能については不明な点が多い.CENP-AのLys7,Lys16,Lys18はリン酸化,Gly1はメチル化をうけ,M期におけるそれら翻訳後修飾の機能が示唆されている.CENP-Aと同じくセントロメアに特異的なヒストンH3のホモログであるトウモロコシのCenH3や出芽酵母のCse4も翻訳後修飾をうけ,それらのセントロメアの機能におけるはたらきを示唆する報告もある.しかし,これまでに同定されている翻訳後修飾に関しては,CENP-Aのセントロメアに特異的な局在における機能に関与するという報告はない.
この研究において,筆者らは,CENP-AのLys124がCUL4-RBX1-COPS8ユビキチンリガーゼ複合体によりユビキチン化されること,そして,このユビキチン化がセントロメアに特異的な局在に必要であることを明らかにした.
1.CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体はin vivoおよびin vitroにおいてCENP-AのLys124をユビキチン化する
これまでに,抗CENP-A抗体を用いたクロマチン免疫沈降により間期セントロメア複合体の構成タンパク質が同定されている8-10).筆者らは,そのなかにCENP-Aのセントロメアへの局在を制御するタンパク質が存在するという仮説をたて,発現の低下によりCENP-Aのセントロメアへの局在が阻害されるような間期セントロメア複合体の構成タンパク質を同定することを目的として,間期セントロメア複合体の構成タンパク質を標的としてsiRNAスクリーニングを行った.このスクリーニングによりCUL4Aが同定された.siRNAによりCUL4Aをノックダウンしたところ,セントロメアに局在するCENP-Aの顕著な減少がみられた.細胞の全体におけるCENP-Aの量は対照と比べ差がみられなかったことから,CUL4AはCENP-Aの安定性ではなく,セントロメアへの特異的な局在に必要であることが示唆された.さらに,CUL4Aとユビキチンリガーゼ複合体を形成するリングフィンガータンパク質であるRBX1の発現をsiRNAによりノックダウンしたところ,CUL4Aのノックダウンと同様にCENP-Aのセントロメアへの局在が特異的に阻害された.さらに,CUL4Aの免疫沈降によりCUL4AとCENP-Aとのアダプタータンパク質としてはたらくCOPS8が同定された.siRNAによりCOPS8をノックダウンしたところ,CENP-Aのセントロメアへの局在が特異的に阻害された.また,COPS8とCENP-Aとの相互作用も確認された.CUL4A-RBX1複合体はCOPS8のほか,DDB1,DDB2,WDR5,EEDといったアダプタータンパク質とユビキチンリガーゼ複合体を形成しそれぞれのアダプタータンパク質に特異的な基質をユビキチン化するが,それらのアダプタータンパク質をsiRNAによりノックダウンしてもCENP-Aのセントロメアへの局在は阻害されなかった.
in vivoおよび精製したタンパク質を用いたin vitro再構成系において,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124をユビキチン化することが確認された.in vitro再構成系において,CUL4A-RBX1複合体によるCENP-AのLys124のユビキチン化は野生型のCOPS8に依存しており,CENP-Aとの結合能を欠失した変異型COPS8をくわえた場合にはユビキチン化はみられなかった.これらの結果より,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体がCENP-AのLys124を特異的にユビキチン化することが明らかにされた.
2.CENP-AのLys124のユビキチン化はセントロメアへの局在に必要である
CENP-AのLys124をArgに置換することによりCUL4A-RBX1-COPS8ユビキチンリガーゼ複合体によるユビキチン化が阻害されることがin vivoおよびin vitro再構成系において確認された.この変異型CENP-AをHeLa細胞において過剰に発現させたところ,野生型CENP-Aのようなセントロメアへの局在は示さず,核において拡散した分布を示した.さらに,この変異型CENP-AのHJURPとの結合能は野生型CENP-Aに比べいちじるしく低下していた.これらの結果から,CENP-AのLys124のユビキチン化はHJURPと効率よく結合するのに必要であり,HJURPとの効率のよい結合がCENP-Aのセントロメアへの特異的な局在を保証していることが示唆された.
3.Lys124をArgに置換した変異型CENP-Aにモノユビキチンを付加するとHJURPとの結合能およびセントロメアへの局在が回復する
Lys124をArgに置換した変異型CENPのC末端にモノユビキチンを付加すると,Lys124がユビキチン化されたCENP-Aと同様にセントロメアに局在した.また,この変異型CENP-AのHJURPとの結合能はモノユビキチンの付加により回復した.さらに,CUL4AあるいはRBX1をsiRNAによりノックダウンした細胞では野生型CENP-Aのセントロメアへの局在は阻害されたが,モノユビキチンを付加した変異型CENP-Aのセントロメアへの局在は阻害されなかったことから,CUL4AおよびRBX1はCENP-AのLys124をユビキチン化することによりセントロメアへの局在に必要とされていることが示唆された.
4.CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体は新規のCENP-Aのセントロメアへの組み込みおよび既存のCENP-Aの維持の両方に必要である
一定の時期に発現したCENP-AをSNAPタグによりパルスチェイス標識することにより,新規に生合成されたCENP-Aとセントロメア領域のクロマチンに組み込まれている既存のCENP-Aとを区別し,それぞれのセントロメアへの局在におけるCUL4A-RBX1ユビキチンリガーゼ複合体への依存性について調べた.CUL4AあるいはRBX1をsiRNAによりノックダウンすると,新規のCENP-Aおよび既存のCENP-Aのセントロメアへの局在が低下した.この結果により,CUL4A-RBX11-COPS8ユビキチンリガーゼ複合体によるCENP-AのLys124のユビキチン化は,新規に生合成されたCENP-Aのセントロメア領域のクロマチンへの組み込み,および,セントロメア領域のクロマチンに組み込まれている既存のCENP-Aの維持の両方を促進するはたらきをもつことが示された.
おわりに
CENP-Aはセントロメアとしてのアイデンティティーを決定するエピジェネティックなマークとして重要な役割を担うと考えられているが,分子レベルでどのような制御をうけることによりセントロメアに特異的なヌクレオソームの形成を可能にしているのかについては不明であった.筆者らは,CUL4A-RBX1-COPS8ユビキチンリガーゼ複合体によりCENP-AのLys124がユビキチン化され,このユビキチン化がCENP-AのHJURPとの結合能を上昇させることによりセントロメアへの局在を促進することを明らかにした(図1).これは,CENP-Aの翻訳後修飾がCENP-Aのセントロメアへの局在に必要であることを示した最初の重要な発見である.今後は,この発見をもとに,CENP-AのLys124のユビキチン化がセントロメアのアイデンティティーを決定するエピジェネティックなマークとしてのはたらきにどのように関与しているかを明らかにし,生物学的に重要な問題であるセントロメアのアイデンティティーの決定の分子機構を解明していきたい.
文 献
- Karpen, G. H. & Allshire, R. C.: The case for epigenetic effects on centromere identity and function. Trends Genet., 13, 489-496 (1997)[PubMed]
- Black, B. E., Foltz, D. R., Chakravarthy, S. et al.: Structural determinants for generating centromeric chromatin. Nature, 430, 578-582 (2004)[PubMed]
- Stellfox, M. E., Bailey, A. O. & Foltz, D. R.: Putting CENP-A in its place. Cell. Mol. Life Sci., 70, 387-406 (2013)[PubMed]
- Lagana, A., Dorn, J. F., De Rop, V. et al.: A small GTPase molecular switch regulates epigenetic centromere maintenance by stabilizing newly incorporated CENP-A. Nat. Cell Biol., 12, 1186-1193 (2010)[PubMed]
- McKinley, K. L. & Cheeseman, I. M.: Polo-like kinase 1 licenses CENP-A deposition at centromeres. Cell, 158, 397-411 (2014)[PubMed]
- Perpelescu, M., Nozaki, N., Obuse, C. et al.: Active establishment of centromeric CENP-A chromatin by RSF complex. J. Cell Biol., 185, 397-407 (2009)[PubMed]
- Prendergast, L. & Sullivan, K. F.: A GTPase switch maintains CENP-A at centromeric chromatin. Nat. Cell Biol., 12, 1128-1130 (2010)[PubMed]
- Ando, S., Yang, H., Nozaki, N. et al.: CENP-A, -B, and -C chromatin complex that contains the I-type alpha-satellite array constitutes the prekinetochore in HeLa cells. Mol. Cell. Biol., 22, 2229-2241 (2002)[PubMed]
- Izuta, H., Ikeno, M., Suzuki, N. et al.: Comprehensive analysis of the ICEN (Interphase Centromere Complex) components enriched in the CENP-A chromatin of human cells. Genes Cells, 11, 673-684 (2006)[PubMed]
- Obuse, C., Yang, H., Nozaki, N. et al.: Proteomics analysis of the centromere complex from HeLa interphase cells: UV-damaged DNA binding protein 1 (DDB-1) is a component of the CEN-complex, while BMI-1 is transiently co-localized with the centromeric region in interphase. Genes Cells, 9, 105-120 (2004)[PubMed]
著者プロフィール
略歴:2000年 イタリアFlorence大学にて博士号取得,2010年より米国Research Institute at Nationwide Children's HospitalにてResearch Scientist.
北川 理佐(Risa Kitagawa)
略歴:1997年 名古屋大学大学院理学研究科にて博士号取得,米国Johns Hopkins大学 ポストドクトラルフェロー,カナダBritish Columbia大学 ポストドクトラルフェロー,米国St. Jude Children's Research Hospitalポストドクトラルフェロー,2005年 同 アシスタントメンバー,2010年 米国Ohio州立大学 アシスタントプロフェッサーを経て,2012年より米国Research Institute at Nationwide Children's Hospitalシニア研究員.
北川 克己(Katsumi Kitagawa)
米国Research Institute at Nationwide Children's Hospital室長.
研究室URL:http://www.nationwidechildrens.org/k-kitagawa-lab
© 2015 新鞍陽平・北川理佐・北川克己 Licensed under CC 表示 2.1 日本