ヒドロゲナーゼによる触媒サイクルにおける水素原子の検出
西川幸志・Wolfgang Lubitz・緒方英明
(ドイツMax Planck Institute for Chemical Energy Conversion,Department Biophysical Chemistry)
email:緒方英明
DOI: 10.7875/first.author.2015.025
Hydrogens detected by subatomic resolution protein crystallography in a [NiFe] hydrogenase.
Hideaki Ogata, Koji Nishikawa, Wolfgang Lubitz
Nature, 520, 571-574 (2015)
タンパク質の構造-機能相関を理解するうえで,タンパク質を構成する原子の約半数をしめる水素原子の同定は重要である.たとえば,ヒドロゲナーゼは水素分子の酸化還元反応を可逆的に触媒する酵素であり,その反応機構を理解するためには水素原子の検出および同定が不可欠である.しかしながら,タンパク質のX線結晶構造解析において水素原子の位置の決定は非常に困難をきわめる.今回,筆者らは,培養から結晶の調製まですべての実験操作を嫌気的に行うことにより良質の結晶を作製し,硫酸還元細菌に由来する[NiFe]ヒドロゲナーゼの還元型の構造を0.89Å分解能で解析することに成功した.その結果,水素分子のヘテロリティックな開裂により生じたH-がNi原子とFe原子に架橋配位していること,また,H+が活性中心に配位しているCysの硫黄原子に結合していることが直接的に観測された.このヘテロリティックな水素分子の分解反応が検出されたことは,ヒドロゲナーゼの触媒機構の解明に大きく貢献すると考えられる.
ヒドロゲナーゼは水素分子の酸化還元反応を可逆的に触媒する酵素であり,その触媒能は高価なプラチナなどを用いた化学触媒と同等以上の効率をもつとされている.そのため,ヒドロゲナーゼを模範にした水素分子を合成する人工触媒や新規の燃料電池の開発への応用も含め,基礎研究が活発に進められている.
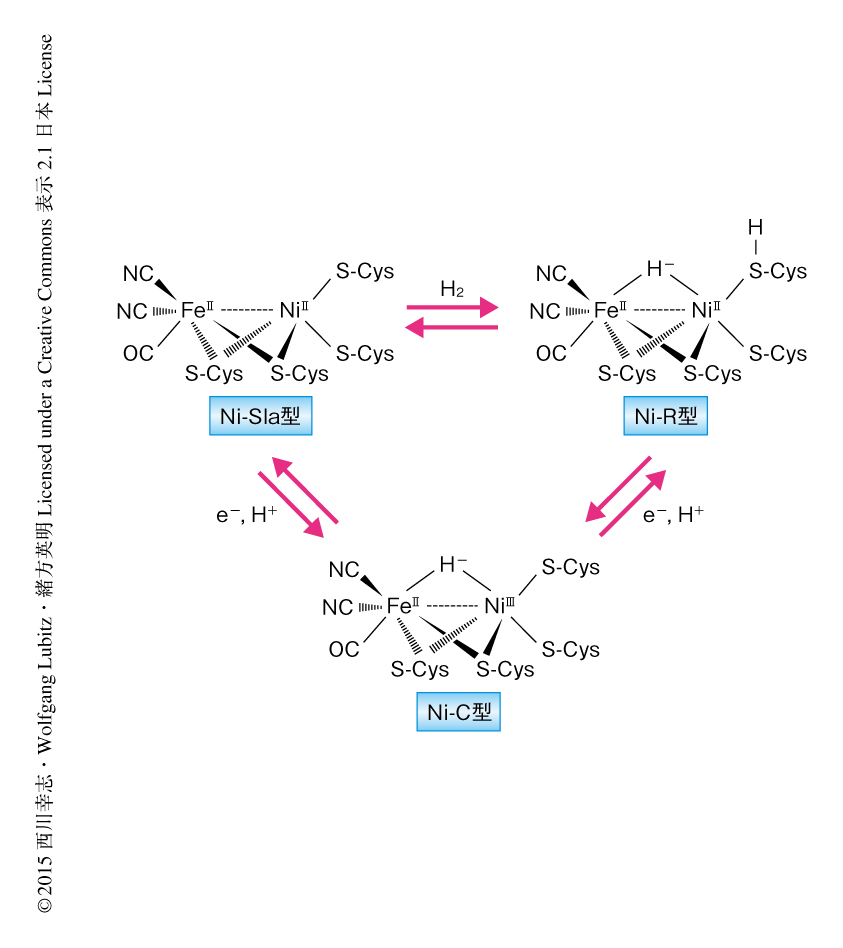
この研究に用いた硫酸還元細菌Desulfovibrio vulgaris Miyazaki F株に由来する[NiFe]ヒドロゲナーゼは28.8 kDaおよび62.5 kDaの2つのサブユニットから構成され,[NiFe]活性中心や3つの[FeS]クラスターなどいくつかの金属クラスターをもつ.活性中心はFe原子とNi原子を1つずつもち,それらをとりかこむ4つのCysによりヒドロゲナーゼの中心に保持されている1,2).このうち2つのCysはFe原子とNi原子を架橋している.さらに,Fe原子には2つのCN-と1つのCOが配位している(図1).
[NiFe]ヒドロゲナーゼはさまざまな酸化還元状態をとることが知られている.Fe原子とNi原子の第3架橋配位子にはこれらの状態に応じて異なる原子が結合している3).酸素により不活性化された酸化型では架橋配位子はOH-である.水素分子により還元されて活性化するとNi-SIa型,Ni-C型,Ni-R型とよばれる状態をとることが知られており,これらは水素分子を分解あるいは合成する触媒サイクルを構成している3,4)(図1).これまでに,1.4Å分解能のX線結晶構造解析により,[NiFe]ヒドロゲナーゼの酸化型が水素分子により還元され活性化されるとOH-配位子が活性中心から外れることが示されている5).しかし,この比較的高分解能の解析によっても反応中の水素原子を電子密度図としてとらえることはできなかった.また,反応中間体であるNi-C型では,Ni原子とFe原子のあいだにH-が架橋していることが電子スピン共鳴法により確認されている6).このNi-C型からさらに1電子が還元されるともっとも還元されたNi-R型になる.このNi-R型ではNi原子は2価イオンになるため電子スピン共鳴法などでは観測できず,活性中心がどのような構造をとっているのかは長いあいだ不明であった.
ヒドロゲナーゼの触媒機構を理解するためには,このもっとも還元されたNi-R型の詳細な立体構造を知ることが重要である.今回,筆者らは,[NiFe]ヒドロゲナーゼのNi-R型のX線結晶構造を0.89Å分解能で解析することに成功した.このような1Åをこえる超高分解能のデータを用いるときわめて詳細な構造解析を行うことができ,電子数の少ない水素原子についても位置の決定が可能になる.
解析に用いた硫酸還元細菌Desulfovibrio vulgaris Miyazaki F株に由来する[NiFe]ヒドロゲナーゼは,標準型とよばれる酸素により容易に不活性化されるタイプのヒドロゲナーゼである.この酸化による酵素の不活性化をさけるため,培養から結晶化までのすべての実験操作を嫌気的に行った.その結果,精製された標品およびヒドロゲナーゼの結晶の酸化還元状態をフーリエ変換赤外分光法により同定したところ,いずれももっとも還元されたNi-R型になっていた.
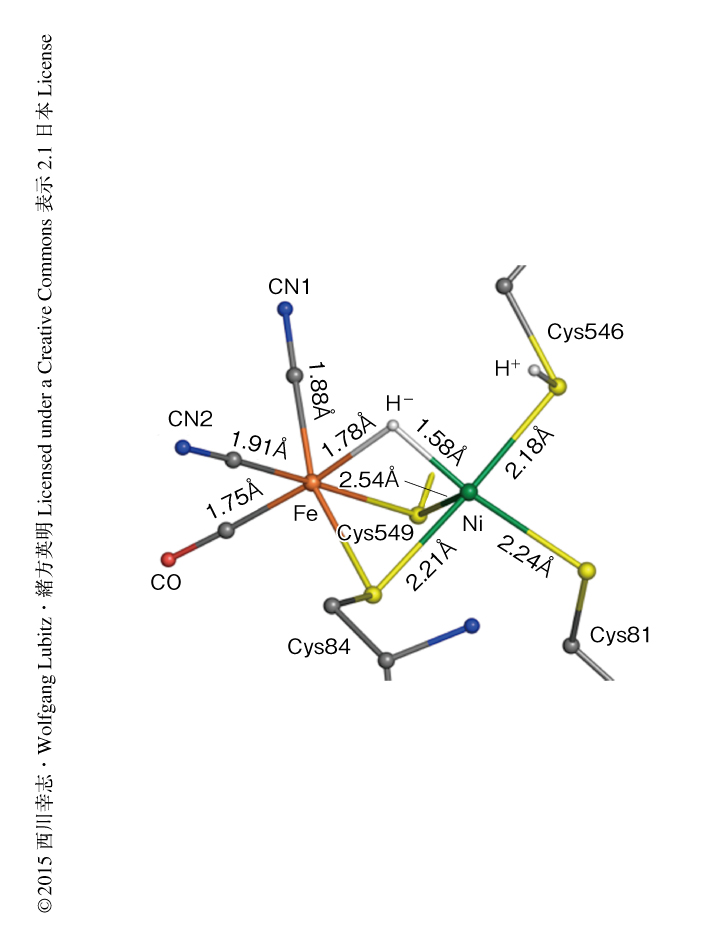
一般に,X線結晶構造解析において金属原子の近傍にある水素原子の検出は電子密度図に現われる重原子のフーリエ変換の副極大の影響をうけるため困難であり,その影響の程度はデータの分解能および原子の熱運動によるゆらぎを表す温度因子に依存することが知られている.それゆえ,分解能の異なる0.89Å分解能のデータと1.06Å分解能のデータについて独立に解析を行い,2つのデータからほぼ同一の電子密度図が得られた(PDB ID:4U9H,4U9I).水素原子を除く活性中心の原子の結合距離は0.002~0.007Åの誤差で決定された.これまで,電子数が等しいため電子密度図からは区別できなかったCO配位子と2つのCN-配位子の結合距離を比べたところ,Fe原子と炭素原子との結合距離は,CO配位子では1.75Å,CN-配位子では1.88Åおよび1.91Åと有意な違いがあり,この2種類の配位子がどのようにFe原子に配位しているかはじめて明らかにされた(図2).また,Ni原子とFe原子との結合距離は2.57Åであり,弱い金属-金属結合を形成していることが示唆された.
活性中心のNi原子の近傍にあるアミノ酸残基の水素原子のうち,90%以上が電子密度図において確認された.また,タンパク質の内部に存在する124個の水分子の水素原子についても同定された.活性中心についても,Ni原子とFe原子を架橋している第3架橋配位子に相当する位置,および,Cys546の硫黄原子の付近にそれぞれ小さな電子密度があり,これらがH-およびH+であることを見い出した(図2).Ni原子とH-との結合距離は1.58Å,また,Fe原子とH-との結合距離は1.78Åであり,H-架橋配位子は非対称に配位していることが確認された.電子スピン共鳴法によると,Ni-C型においても非対称なH-架橋配位子が存在し,Ni原子とH-との結合距離は1.59ÅでFe原子とH-との結合距離よりも短く,Ni-R型とほぼ同様であった6).一方,ヒドロゲナーゼをモデルとしたモデル錯体ではH-はNi原子よりもFe原子の側により強く結合しており,ヒドロゲナーゼとはこの点が異なっていた7).
これまで,Ni-R型のNi原子のスピン状態が低スピン状態であるのか高スピン状態であるのかは明らかでなかった.Ni原子に配位している硫黄原子との結合距離をみると,4つの硫黄原子のうちCys549の硫黄原子のみ結合距離が長くなっていた(図2).これは,Ni原子の配位子場は四角錐型であるためと考えられ,Ni原子のスピン状態は低スピン状態であることが示唆された.
水素分子が分解されて生じたH+は活性中心からヒドロゲナーゼの表面へと輸送されると考えられる.Ni原子に配位している4つのCysのうちのひとつがこのH+の最初の受容体であると予想されていた.さきに述べたように,分解能の異なる2つのデータともに,Cys546の硫黄原子の近傍に電子密度のピークが観測された.このピークと硫黄原子との距離は1.1~1.3Åであり,S-H結合のX線構造解析における理論値1.2Åと近い値であった.さらに,Cys546の硫黄原子はほかの3つのCysの硫黄原子と比べ熱振動の大きさを表す温度因子が大きく,この硫黄原子がH+の受容基であることが強く示唆された.超高分解能の解析により明らかにされたこれらの活性中心の詳細な立体構造は,これまでに報告されていた密度汎関数理論計算による理論計算値と非常によく合致した8).
Cys546につづく第2のH+の受容基はCys546の近傍のGluであろうと予想されていた9).Cys546ともっとも近いGlu34のカルボン酸基は,一方がC-OH(1.29Å)で他方がC=O(1.22Å)と結合距離に差異がありプロトン化していることが確認された.このGlu34のOH基はThr18との結合距離が2.58Åと短く,さらに,Thr18はGlu16と結合距離2.62Åで隣接しており,どちらも低障壁の水素結合を形成していることが示唆された.これらをあわせると,活性中心において生じたH+はCys546-Glu34-Thr18-Glu16という経路でヒドロゲナーゼの表面へと輸送されると考えられた.
今回の結果は,[NiFe]ヒドロゲナーゼにより触媒されるヘテロリティックな水素分子の開裂反応,あるいは,電子やH+の移動についての重要な構造的な知見をあたえるものであった.これらの知見は,天然の酵素が行う巧妙な水素分子の酸化還元の機構を明らかにするのみならず,将来,持続可能な水素(エネルギー)社会をささえる人工触媒や燃料電池などのバイオデバイスを設計するのにも役だつものと期待される.
略歴:2010年 兵庫県立大学大学院生命理学研究科博士課程 修了,同年 ドイツMax Planck Institute for Chemical Energy Conversion博士研究員を経て,2012年より兵庫県立大学大学院生命理学研究科 特任助教.
Wolfgang Lubitz
ドイツMax Planck Institute for Chemical Energy Conversion教授.
緒方 英明(Hideaki Ogata)
ドイツMax Planck Institute for Chemical Energy Conversionグループリーダー.
© 2015 西川幸志・Wolfgang Lubitz・緒方英明 Licensed under CC 表示 2.1 日本
(ドイツMax Planck Institute for Chemical Energy Conversion,Department Biophysical Chemistry)
email:緒方英明
DOI: 10.7875/first.author.2015.025
Hydrogens detected by subatomic resolution protein crystallography in a [NiFe] hydrogenase.
Hideaki Ogata, Koji Nishikawa, Wolfgang Lubitz
Nature, 520, 571-574 (2015)
要 約
タンパク質の構造-機能相関を理解するうえで,タンパク質を構成する原子の約半数をしめる水素原子の同定は重要である.たとえば,ヒドロゲナーゼは水素分子の酸化還元反応を可逆的に触媒する酵素であり,その反応機構を理解するためには水素原子の検出および同定が不可欠である.しかしながら,タンパク質のX線結晶構造解析において水素原子の位置の決定は非常に困難をきわめる.今回,筆者らは,培養から結晶の調製まですべての実験操作を嫌気的に行うことにより良質の結晶を作製し,硫酸還元細菌に由来する[NiFe]ヒドロゲナーゼの還元型の構造を0.89Å分解能で解析することに成功した.その結果,水素分子のヘテロリティックな開裂により生じたH-がNi原子とFe原子に架橋配位していること,また,H+が活性中心に配位しているCysの硫黄原子に結合していることが直接的に観測された.このヘテロリティックな水素分子の分解反応が検出されたことは,ヒドロゲナーゼの触媒機構の解明に大きく貢献すると考えられる.
はじめに
ヒドロゲナーゼは水素分子の酸化還元反応を可逆的に触媒する酵素であり,その触媒能は高価なプラチナなどを用いた化学触媒と同等以上の効率をもつとされている.そのため,ヒドロゲナーゼを模範にした水素分子を合成する人工触媒や新規の燃料電池の開発への応用も含め,基礎研究が活発に進められている.
この研究に用いた硫酸還元細菌Desulfovibrio vulgaris Miyazaki F株に由来する[NiFe]ヒドロゲナーゼは28.8 kDaおよび62.5 kDaの2つのサブユニットから構成され,[NiFe]活性中心や3つの[FeS]クラスターなどいくつかの金属クラスターをもつ.活性中心はFe原子とNi原子を1つずつもち,それらをとりかこむ4つのCysによりヒドロゲナーゼの中心に保持されている1,2).このうち2つのCysはFe原子とNi原子を架橋している.さらに,Fe原子には2つのCN-と1つのCOが配位している(図1).
[NiFe]ヒドロゲナーゼはさまざまな酸化還元状態をとることが知られている.Fe原子とNi原子の第3架橋配位子にはこれらの状態に応じて異なる原子が結合している3).酸素により不活性化された酸化型では架橋配位子はOH-である.水素分子により還元されて活性化するとNi-SIa型,Ni-C型,Ni-R型とよばれる状態をとることが知られており,これらは水素分子を分解あるいは合成する触媒サイクルを構成している3,4)(図1).これまでに,1.4Å分解能のX線結晶構造解析により,[NiFe]ヒドロゲナーゼの酸化型が水素分子により還元され活性化されるとOH-配位子が活性中心から外れることが示されている5).しかし,この比較的高分解能の解析によっても反応中の水素原子を電子密度図としてとらえることはできなかった.また,反応中間体であるNi-C型では,Ni原子とFe原子のあいだにH-が架橋していることが電子スピン共鳴法により確認されている6).このNi-C型からさらに1電子が還元されるともっとも還元されたNi-R型になる.このNi-R型ではNi原子は2価イオンになるため電子スピン共鳴法などでは観測できず,活性中心がどのような構造をとっているのかは長いあいだ不明であった.
ヒドロゲナーゼの触媒機構を理解するためには,このもっとも還元されたNi-R型の詳細な立体構造を知ることが重要である.今回,筆者らは,[NiFe]ヒドロゲナーゼのNi-R型のX線結晶構造を0.89Å分解能で解析することに成功した.このような1Åをこえる超高分解能のデータを用いるときわめて詳細な構造解析を行うことができ,電子数の少ない水素原子についても位置の決定が可能になる.
1.高分解能かつ高精度のタンパク質X線結晶構造解析
解析に用いた硫酸還元細菌Desulfovibrio vulgaris Miyazaki F株に由来する[NiFe]ヒドロゲナーゼは,標準型とよばれる酸素により容易に不活性化されるタイプのヒドロゲナーゼである.この酸化による酵素の不活性化をさけるため,培養から結晶化までのすべての実験操作を嫌気的に行った.その結果,精製された標品およびヒドロゲナーゼの結晶の酸化還元状態をフーリエ変換赤外分光法により同定したところ,いずれももっとも還元されたNi-R型になっていた.
一般に,X線結晶構造解析において金属原子の近傍にある水素原子の検出は電子密度図に現われる重原子のフーリエ変換の副極大の影響をうけるため困難であり,その影響の程度はデータの分解能および原子の熱運動によるゆらぎを表す温度因子に依存することが知られている.それゆえ,分解能の異なる0.89Å分解能のデータと1.06Å分解能のデータについて独立に解析を行い,2つのデータからほぼ同一の電子密度図が得られた(PDB ID:4U9H,4U9I).水素原子を除く活性中心の原子の結合距離は0.002~0.007Åの誤差で決定された.これまで,電子数が等しいため電子密度図からは区別できなかったCO配位子と2つのCN-配位子の結合距離を比べたところ,Fe原子と炭素原子との結合距離は,CO配位子では1.75Å,CN-配位子では1.88Åおよび1.91Åと有意な違いがあり,この2種類の配位子がどのようにFe原子に配位しているかはじめて明らかにされた(図2).また,Ni原子とFe原子との結合距離は2.57Åであり,弱い金属-金属結合を形成していることが示唆された.
2.活性中心におけるH-およびH+の検出
活性中心のNi原子の近傍にあるアミノ酸残基の水素原子のうち,90%以上が電子密度図において確認された.また,タンパク質の内部に存在する124個の水分子の水素原子についても同定された.活性中心についても,Ni原子とFe原子を架橋している第3架橋配位子に相当する位置,および,Cys546の硫黄原子の付近にそれぞれ小さな電子密度があり,これらがH-およびH+であることを見い出した(図2).Ni原子とH-との結合距離は1.58Å,また,Fe原子とH-との結合距離は1.78Åであり,H-架橋配位子は非対称に配位していることが確認された.電子スピン共鳴法によると,Ni-C型においても非対称なH-架橋配位子が存在し,Ni原子とH-との結合距離は1.59ÅでFe原子とH-との結合距離よりも短く,Ni-R型とほぼ同様であった6).一方,ヒドロゲナーゼをモデルとしたモデル錯体ではH-はNi原子よりもFe原子の側により強く結合しており,ヒドロゲナーゼとはこの点が異なっていた7).
これまで,Ni-R型のNi原子のスピン状態が低スピン状態であるのか高スピン状態であるのかは明らかでなかった.Ni原子に配位している硫黄原子との結合距離をみると,4つの硫黄原子のうちCys549の硫黄原子のみ結合距離が長くなっていた(図2).これは,Ni原子の配位子場は四角錐型であるためと考えられ,Ni原子のスピン状態は低スピン状態であることが示唆された.
水素分子が分解されて生じたH+は活性中心からヒドロゲナーゼの表面へと輸送されると考えられる.Ni原子に配位している4つのCysのうちのひとつがこのH+の最初の受容体であると予想されていた.さきに述べたように,分解能の異なる2つのデータともに,Cys546の硫黄原子の近傍に電子密度のピークが観測された.このピークと硫黄原子との距離は1.1~1.3Åであり,S-H結合のX線構造解析における理論値1.2Åと近い値であった.さらに,Cys546の硫黄原子はほかの3つのCysの硫黄原子と比べ熱振動の大きさを表す温度因子が大きく,この硫黄原子がH+の受容基であることが強く示唆された.超高分解能の解析により明らかにされたこれらの活性中心の詳細な立体構造は,これまでに報告されていた密度汎関数理論計算による理論計算値と非常によく合致した8).
Cys546につづく第2のH+の受容基はCys546の近傍のGluであろうと予想されていた9).Cys546ともっとも近いGlu34のカルボン酸基は,一方がC-OH(1.29Å)で他方がC=O(1.22Å)と結合距離に差異がありプロトン化していることが確認された.このGlu34のOH基はThr18との結合距離が2.58Åと短く,さらに,Thr18はGlu16と結合距離2.62Åで隣接しており,どちらも低障壁の水素結合を形成していることが示唆された.これらをあわせると,活性中心において生じたH+はCys546-Glu34-Thr18-Glu16という経路でヒドロゲナーゼの表面へと輸送されると考えられた.
おわりに
今回の結果は,[NiFe]ヒドロゲナーゼにより触媒されるヘテロリティックな水素分子の開裂反応,あるいは,電子やH+の移動についての重要な構造的な知見をあたえるものであった.これらの知見は,天然の酵素が行う巧妙な水素分子の酸化還元の機構を明らかにするのみならず,将来,持続可能な水素(エネルギー)社会をささえる人工触媒や燃料電池などのバイオデバイスを設計するのにも役だつものと期待される.
文 献
- Volbeda, A., Charon, M. H., Piras, C. et al.: Crystal structure of the nickel-iron hydrogenase from Desulfovibrio gigas. Nature, 373, 580-587 (1995)[PubMed]
- Higuchi, Y., Yagi, T. & Yasuoka, N.: Unusual ligand structure in Ni-Fe active center and an additional Mg site in hydrogenase revealed by high resolution X-ray structure analysis. Structure, 5, 1671-1680 (1997)[PubMed]
- Lubitz, W., Ogata, H., Rudiger, O. et al.: Hydrogenases. Chem. Rev., 114, 4081-4148 (2014)[PubMed]
- Ogata, H., Lubitz, W. & Higuchi, Y.: [NiFe] hydrogenases: structural and spectroscopic studies of the reaction mechanism. Dalton Trans., 2009, 7577-7587 (2009)[PubMed]
- Higuchi, Y., Ogata, H., Miki, K. et al.: Removal of the bridging ligand atom at the Ni-Fe active site of [NiFe] hydrogenase upon reduction with H2, as revealed by X-ray structure analysis at 1.4Å resolution. Structure, 7, 549-556 (1999)[PubMed]
- Brecht, M., van Gastel, M., Buhrke, T. et al.: Direct detection of a hydrogen ligand in the [NiFe] center of the regulatory H2-sensing hydrogenase from Ralstonia eutropha in its reduced state by HYSCORE and ENDOR spectroscopy. J. Am. Chem. Soc., 125, 13075-13083 (2003)[PubMed]
- Ogo, S., Ichikawa, K., Kishima, T. et al.: A functional [NiFe] hydrogenase mimic that catalyzes electron and hydride transfer from H2. Science, 339, 682-684 (2013)[PubMed]
- Kramer, T., Kampa, M., Lubitz, W. et al.: Theoretical spectroscopy of the NiII intermediate states in the catalytic cycle and the activation of [NiFe] hydrogenases. Chembiochem, 14, 1898-1905 (2013)[PubMed]
- Dementin, S., Burlat, B., De Lacey, A. L. et al.: A glutamate is the essential proton transfer gate during the catalytic cycle of the [NiFe] hydrogenase. J. Biol. Chem., 279, 10508-10513 (2004)[PubMed]
著者プロフィール
略歴:2010年 兵庫県立大学大学院生命理学研究科博士課程 修了,同年 ドイツMax Planck Institute for Chemical Energy Conversion博士研究員を経て,2012年より兵庫県立大学大学院生命理学研究科 特任助教.
Wolfgang Lubitz
ドイツMax Planck Institute for Chemical Energy Conversion教授.
緒方 英明(Hideaki Ogata)
ドイツMax Planck Institute for Chemical Energy Conversionグループリーダー.
© 2015 西川幸志・Wolfgang Lubitz・緒方英明 Licensed under CC 表示 2.1 日本