カゼインキナーゼ1は減数分裂に特異的なコヒーシンの構成タンパク質Rec11のリン酸化を介して染色体の軸構造の形成および相同組換えを制御する
作野剛士・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:作野剛士
DOI: 10.7875/first.author.2015.016
Phosphorylation of cohesin Rec11/SA3 by casein kinase 1 promotes homologous recombination by assembling the meiotic chromosome axis.
Takeshi Sakuno, Yoshinori Watanabe
Developmental Cell, 32, 220-230 (2015)
減数分裂に特異的なコヒーシンは,姉妹染色分体の接着だけでなく,染色体の軸構造の形成にも必要である.減数分裂期に形成される染色体の軸構造は相同染色体の対合や相同組換えに必要であることがさまざまな生物において観察されてきたが,コヒーシンがどのように染色体の軸構造の形成を制御するのか,その分子機構は不明であった.今回,筆者らは,分裂酵母において,減数分裂に特異的なコヒーシンの構成タンパク質であるRec11のカゼインキナーゼ1によるリン酸化が,シナプトネマ複合体に類似した染色体の軸構造の形成,および,相同組換えの促進に必須な機能をはたすことを見い出した.カゼインキナーゼ1によるRec11のリン酸化は姉妹染色分体の接着には不要であったが,染色体の軸構造の構成タンパク質であるRec10との結合には必要であり,この結合を介して染色体の軸構造の形成が促進されることが判明した.この研究により,減数分裂に特異的なコヒーシンが,姉妹染色分体の接着の機能とは独立に,染色体の軸構造の形成における足場として機能する分子機構が明らかにされた.
有性生殖を行う生物にとり,半数体の配偶子を形成する減数分裂の過程は次世代にゲノムを継承するうえで必須である.そのために生物は,減数分裂期において相同組換えを介してゲノムの多様性を担保すると同時に,キアズマの形成により相同染色体ペアのあいだに物理的な接触を生じさせ,複数ある染色体のなかで染色体分配の組合せをまちがえないようにするしくみを獲得してきた.この相同染色体ペアを正しく認識し分配する過程においてミスが生じると,ヒトの場合には先天性疾患であるDown症候群やKlinefelter症候群,また,早期の流産をひき起こすことのあることが知られている.よって,相同組換えを介した染色体分配の制御機構を分子レベルで理解することは,基礎生物学においてはもちろんのこと,医学の見地からもきわめて重要な研究課題であるといえる.
減数分裂期においては,体細胞分裂期とは異なり,相同染色体のあいだに形成されたキアズマとコヒーシンによる姉妹染色分体の接着を介して相同染色体ペアが物理的に結合する.その結果,減数第1分裂期においては,姉妹染色分体ではなく相同染色体が両極へと分配される還元的な染色体分配が起こる(図1).また,減数分裂期には,体細胞分裂期と一部の構成タンパク質が置き換わったコヒーシンが存在し,多くの生物種にみられるのはKleisinサブユニットであるRec8およびSAサブユニットであるSA3の発現である.分裂酵母の減数分裂期においては,体細胞分裂期型のKleisinサブユニットであるRad21およびSAサブユニットであるPsc3が,それぞれ,Rec8およびRec11とほぼ置き換わっている(図1).興味深いことに,Rec8およびSA3は姉妹染色分体の接着だけでなく,多くの生物においてシナプトネマ複合体の形成に必要であることが示されている1).分裂酵母においては完全なシナプトネマ複合体は形成されないが,類似した染色体の軸構造(linear element)が形成され,この形成もRec8およびRec11に依存しており,rec8変異株やrec11変異株では相同組換えの頻度がいちじるしく低下する2,3).このように,減数分裂に特異的なコヒーシンは相同組換えに必要な染色体の軸構造の形成という進化的に保存された機能をもつことが示されていたが,その分子機構は長いあいだ不明であった.
また,減数第1分裂期において還元型の染色体分配が起こるうえで重要なもうひとつの特徴は,姉妹染色分体が同じ方向から伸びたスピンドル微小管により補捉される1方向性の結合の確立である(図1).出芽酵母では減数第1分裂期における1方向性結合の確立に必要なタンパク質としてカゼインキナーゼ1が報告されており,分裂酵母におけるホモログも減数第1分裂期における染色体の分配に必要であることが示唆されていたが4),その詳細に関しては不明であった.そこで,筆者らは,分裂酵母において,減数第1分裂期の染色体分配の制御におけるカゼインキナーゼ1の機能について解析した.
先行研究により,分裂酵母において,カゼインキナーゼ1の変異株の減数第1分裂期における染色体分配は野生型と同様に還元型の染色体分配であるが,コヒーシンを分解から保護するSgo1との二重変異株では還元型の染色体分配から体細胞分裂期型である均等型の染色体分配へとシフトすることが示されていた4).これまでの解析から,分裂酵母における1方向性の結合の確立に必要なタンパク質としてRec8およびMoa1が同定され,Rec8型コヒーシンを介した動原体の形成部位における接着が1方向性の結合の確立に必須であり,moa1破壊株ではこの接着が失われる結果,減数第1分裂期における染色体分配が還元型の染色体分配から均等型の染色体分配へシフトすることが明らかにされていた5,6).そこで,カゼインキナーゼ1の変異株において動原体の形成部位おける接着について検証した結果,野生株と同様に維持されていた.よって,カゼインキナーゼ1はRec8およびMoa1に依存した経路とは無関係であるといえた.
それでは,カゼインキナーゼ1の機能は何だろうか? そこで,これまでの筆者らによる解析の結果に着目した.Rec12はDNA 2本鎖切断の導入においてはたらくSpo11の分裂酵母におけるホモログであり,rec12破壊株においては減数分裂期における相同組換えが起こらなくなるが,rec12とsgo1との二重破壊株では,減数第1分裂期における染色体分配が還元型の染色体分配から均等型の染色体分配へとシフトする.すなわち,rec12とsgo1との二重破壊株とカゼインキナーゼ1とsgo1との二重変異株の表現型は類似していた.そこで,カゼインキナーゼ1の変異株ではrec12破壊株と同様に相同組換えの頻度が低下している可能性を想定した.実際に,カゼインキナーゼ1の変異株において減数分裂期における相同組換えの頻度を測定したところ,野生株に比べいちじるしく低下していた.よって,分裂酵母のカゼインキナーゼ1は減数分裂期における相同組換えに必要であることが判明した.
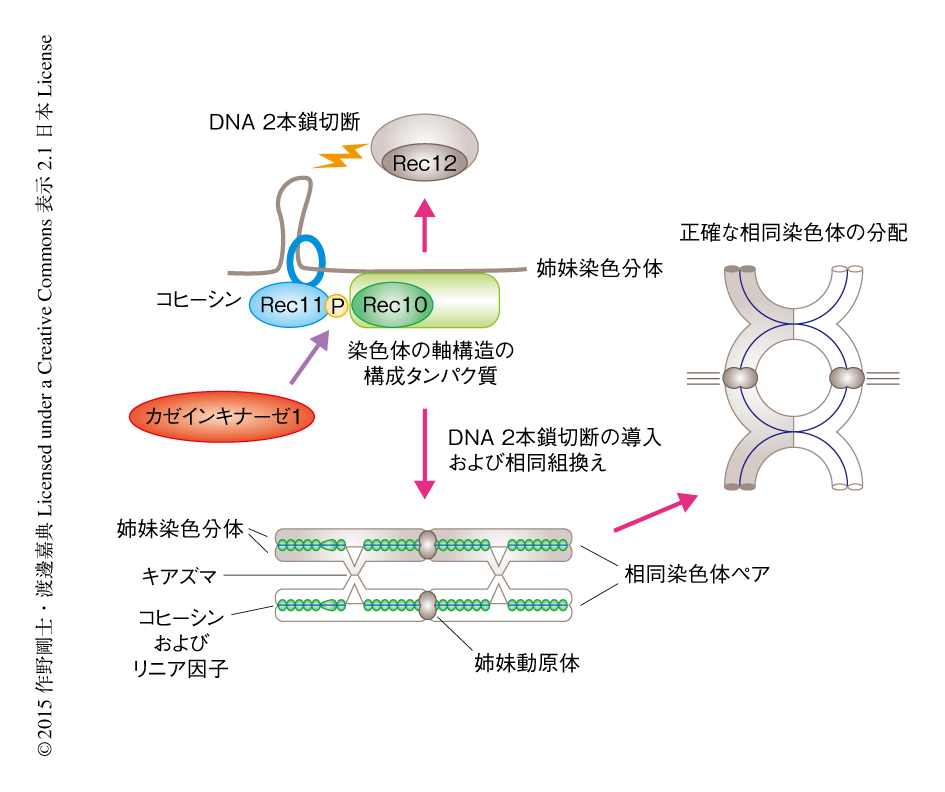
カゼインキナーゼ1はどのような分子機序により相同組換えを制御するのかを明らかにするため,そのリン酸化の基質を探索した.これまでのさまざまな解析から,分裂酵母において,減数分裂期における相同組換えを制御するタンパク質として,減数分裂に特異的なコヒーシンの構成タンパク質や染色体の軸構造の構成タンパク質を含め,14のタンパク質が同定されていた7).そこで,それらを大腸菌に発現させて精製し,カゼインキナーゼ1によるin vitroリン酸化アッセイを行ったところ,減数分裂に特異的なコヒーシンの構成タンパク質であるRec11のN末端側の領域がもっともよくリン酸化されることが判明した.そこで,そのリン酸化部位を同定し,非リン酸化型のrec11変異株を作製してその表現型を観察した結果,カゼインキナーゼ1の変異株やrec11破壊株と同じくらい相同組換えの頻度が低下していた.重要なことに,リン酸化模倣型のrec11変異株はカゼインキナーゼ1の変異株において観察される相同組換えの頻度の低下を有意に抑圧することも明らかにされた.また,カゼインキナーゼ1によるリン酸化を特異的に認識する抗リン酸化Rec11抗体を作製し,細胞におけるRec11のリン酸化について検討した結果,実際に,減数分裂期においてRec11がカゼインキナーゼ1に依存的にリン酸化されることが判明した.さらに,これまで減数分裂に特異的なコヒーシンはDNA 2本鎖切断の導入にも必要であることが示されていたことから,非リン酸化型rec11変異株およびカゼインキナーゼ1の変異株においてDNA 2本鎖切断の導入の頻度を検証した結果,ともに有意に低下していることが明らかにされた.しかしながら,非リン酸化型rec11変異株において,姉妹染色分体の接着は野生株と同様に維持されていた.これらの結果から,カゼインキナーゼ1はRec11のリン酸化を介し,姉妹染色分体の接着に関する機能とは独立に,減数分裂期における相同組換えを制御するという機構が示唆された.
これまでの解析から,減数分裂に特異的なコヒーシンの構成タンパク質であるRec8およびRec11は,姉妹染色分体を接着させると同時にクロマチンのループ構造を構築し,それをもとに,より高次な染色体の軸構造の形成を促進すると考えられており,実際に,rec8破壊株およびrec11破壊株においては染色体の軸構造だけでなくクロマチンのループ構造も失われ,染色体の軸構造は全体として弛緩したクロマチンとして存在することが示唆されていた8).また,染色体の軸構造はコヒーシンによるクロマチンのループ構造の形成には不要である一方8),Rec12を含むDNA 2本鎖切断の導入に必要なタンパク質を呼び込む足場して機能するとともに,相同組換えに必要なクロマチンの環境を提供していると考えられている7).そこで,カゼインキナーゼ1によるRec11のリン酸化がクロマチンのループ構造にあたえる影響について観察した.その結果,rec8破壊株およびrec11破壊株において観察された弛緩したクロマチンの構造は,非リン酸化型rec11変異株では観察されなかったことから,非リン酸化型rec11変異株においては姉妹染色分体の接着と同様に,クロマチンのループ構造も正常に維持されていることが示唆された.非リン酸化型rec11変異株およびカゼインキナーゼ1の変異株における染色体の軸構造の形成を観察したところ,rec8破壊株およびrec11破壊株と同様に,染色体の軸構造の構成タンパク質が染色体に適切に局在できず,その結果として,核において凝集塊を形成するようすがみられた.また,カゼインキナーゼ1の変異株における染色体の軸構造の形成の不全は,リン酸化模倣型rec11変異株においてほぼ抑圧された.以上の結果から,カゼインキナーゼ1によるRec11のリン酸化は,DNA 2本鎖切断の導入に必須な染色体の軸構造の形成を促進することが明らかにされた.
カゼインキナーゼ1によりリン酸化されたRec11が染色体の軸構造の形成の足場になっている可能性を検証する目的で,酵母ツーハイブリッド法によりRec11と既知の染色体の軸構造の構成タンパク質との結合について検証した.その結果,染色体の軸構造の構成タンパク質として報告されている5つのタンパク質のうち,Rec10が野生型Rec11と結合することがわかった.また,その結合はリン酸化模倣型Rec11変異体においては維持され,逆に,非リン酸化型Rec11変異体では失われることが明らかにされた.さらに,減数分裂期の細胞におけるRec11とRec10との相互作用を免疫沈降実験により検証した結果,Rec11はカゼインキナーゼ1によるリン酸化に依存的にRec10と相互作用することが判明した.よって,カゼインキナーゼ1によりリン酸化されたRec11は,染色体の軸構造の構成タンパク質であるRec10と結合することによりRec10および関連するタンパク質を染色体へと呼び込む結果,染色体の軸構造の形成が促進されるという機構が示唆された.
カゼインキナーゼ1によるRec11のリン酸化はRec10との結合のみに必要であるかどうかを検証する目的で,Rec10との結合が失われている非リン酸化型Rec11とRec10とを融合させたタンパク質を発現させてその表現型を観察したところ,染色体の軸構造の形成の不全および相同組換えの欠損の表現型がほぼ完全に抑圧された.また,カゼインキナーゼ1の変異株の表現型は野生型Rec11-Rec10融合タンパク質の発現により抑圧された.よって,カゼインキナーゼ1はRec11をリン酸化しRec10との結合を促進することにより,染色体の軸構造の形成および減数分裂期における相同組換えを制御し,結果的に,正しい染色体分配を保証しているという機構が明らかにされた(図2).
1950年代に減数分裂期に特異的に形成される染色体軸の構造であるシナプトネマ複合体が見い出されてから9),今日にいたるまで,その構築にかかわる分子機構は不明であった.また,分裂酵母の減数分裂に特異的なコヒーシンの構成タンパク質であるRec8およびRec11は,1980年代後半,減数分裂期における相同組換えに欠損を示す変異株の責任タンパク質として見い出されたが3),Rec8およびRec11がどのような分子機構により相同組換えを制御するのか,その詳細も不明であった.今回の研究は,これら2つの積年の課題を解き明かす端緒となったという点において意義深いと考えられる.また,カゼインキナーゼ1やRec11だけでなく,分裂酵母のRec10も出芽酵母やマウスなどにホモログが存在する.マウスの精巣を用いた解析から,クロマチンと結合したSA3はリン酸化されていることが報告されていることから,今回,明らかにされた,カゼインキナーゼ1を介したコヒーシンによる染色体の軸構造の形成機構が進化的に保存されている可能性は十分に考えられる.マウスの卵子では加齢にともない染色体からコヒーシンが脱離する現象が報告され10),加齢とともに頻度の上昇する染色体分配のミスに起因した異数体をもつ卵子の形成との関連が議論されはじめている.今回,明らかにされたカゼインキナーゼ1およびコヒーシンによる相同組換えの制御機構は,減数分裂期における染色体分配のしくみの解明につながる成果であり,将来的には,その正確な理解にもとづき,配偶子の形成の異常に起因する臨床におけるさまざまな課題の解決に資する可能性が期待される.
略歴:2004年 東京大学大学院薬学系研究科にて博士号取得,東京大学分子細胞生物学研究所 ポスドクを経て,同 講師.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 作野剛士・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:作野剛士
DOI: 10.7875/first.author.2015.016
Phosphorylation of cohesin Rec11/SA3 by casein kinase 1 promotes homologous recombination by assembling the meiotic chromosome axis.
Takeshi Sakuno, Yoshinori Watanabe
Developmental Cell, 32, 220-230 (2015)
要 約
減数分裂に特異的なコヒーシンは,姉妹染色分体の接着だけでなく,染色体の軸構造の形成にも必要である.減数分裂期に形成される染色体の軸構造は相同染色体の対合や相同組換えに必要であることがさまざまな生物において観察されてきたが,コヒーシンがどのように染色体の軸構造の形成を制御するのか,その分子機構は不明であった.今回,筆者らは,分裂酵母において,減数分裂に特異的なコヒーシンの構成タンパク質であるRec11のカゼインキナーゼ1によるリン酸化が,シナプトネマ複合体に類似した染色体の軸構造の形成,および,相同組換えの促進に必須な機能をはたすことを見い出した.カゼインキナーゼ1によるRec11のリン酸化は姉妹染色分体の接着には不要であったが,染色体の軸構造の構成タンパク質であるRec10との結合には必要であり,この結合を介して染色体の軸構造の形成が促進されることが判明した.この研究により,減数分裂に特異的なコヒーシンが,姉妹染色分体の接着の機能とは独立に,染色体の軸構造の形成における足場として機能する分子機構が明らかにされた.
はじめに
有性生殖を行う生物にとり,半数体の配偶子を形成する減数分裂の過程は次世代にゲノムを継承するうえで必須である.そのために生物は,減数分裂期において相同組換えを介してゲノムの多様性を担保すると同時に,キアズマの形成により相同染色体ペアのあいだに物理的な接触を生じさせ,複数ある染色体のなかで染色体分配の組合せをまちがえないようにするしくみを獲得してきた.この相同染色体ペアを正しく認識し分配する過程においてミスが生じると,ヒトの場合には先天性疾患であるDown症候群やKlinefelter症候群,また,早期の流産をひき起こすことのあることが知られている.よって,相同組換えを介した染色体分配の制御機構を分子レベルで理解することは,基礎生物学においてはもちろんのこと,医学の見地からもきわめて重要な研究課題であるといえる.
減数分裂期においては,体細胞分裂期とは異なり,相同染色体のあいだに形成されたキアズマとコヒーシンによる姉妹染色分体の接着を介して相同染色体ペアが物理的に結合する.その結果,減数第1分裂期においては,姉妹染色分体ではなく相同染色体が両極へと分配される還元的な染色体分配が起こる(図1).また,減数分裂期には,体細胞分裂期と一部の構成タンパク質が置き換わったコヒーシンが存在し,多くの生物種にみられるのはKleisinサブユニットであるRec8およびSAサブユニットであるSA3の発現である.分裂酵母の減数分裂期においては,体細胞分裂期型のKleisinサブユニットであるRad21およびSAサブユニットであるPsc3が,それぞれ,Rec8およびRec11とほぼ置き換わっている(図1).興味深いことに,Rec8およびSA3は姉妹染色分体の接着だけでなく,多くの生物においてシナプトネマ複合体の形成に必要であることが示されている1).分裂酵母においては完全なシナプトネマ複合体は形成されないが,類似した染色体の軸構造(linear element)が形成され,この形成もRec8およびRec11に依存しており,rec8変異株やrec11変異株では相同組換えの頻度がいちじるしく低下する2,3).このように,減数分裂に特異的なコヒーシンは相同組換えに必要な染色体の軸構造の形成という進化的に保存された機能をもつことが示されていたが,その分子機構は長いあいだ不明であった.
また,減数第1分裂期において還元型の染色体分配が起こるうえで重要なもうひとつの特徴は,姉妹染色分体が同じ方向から伸びたスピンドル微小管により補捉される1方向性の結合の確立である(図1).出芽酵母では減数第1分裂期における1方向性結合の確立に必要なタンパク質としてカゼインキナーゼ1が報告されており,分裂酵母におけるホモログも減数第1分裂期における染色体の分配に必要であることが示唆されていたが4),その詳細に関しては不明であった.そこで,筆者らは,分裂酵母において,減数第1分裂期の染色体分配の制御におけるカゼインキナーゼ1の機能について解析した.
1.分裂酵母のカゼインキナーゼ1は減数分裂期における相同組換えに必要である
先行研究により,分裂酵母において,カゼインキナーゼ1の変異株の減数第1分裂期における染色体分配は野生型と同様に還元型の染色体分配であるが,コヒーシンを分解から保護するSgo1との二重変異株では還元型の染色体分配から体細胞分裂期型である均等型の染色体分配へとシフトすることが示されていた4).これまでの解析から,分裂酵母における1方向性の結合の確立に必要なタンパク質としてRec8およびMoa1が同定され,Rec8型コヒーシンを介した動原体の形成部位における接着が1方向性の結合の確立に必須であり,moa1破壊株ではこの接着が失われる結果,減数第1分裂期における染色体分配が還元型の染色体分配から均等型の染色体分配へシフトすることが明らかにされていた5,6).そこで,カゼインキナーゼ1の変異株において動原体の形成部位おける接着について検証した結果,野生株と同様に維持されていた.よって,カゼインキナーゼ1はRec8およびMoa1に依存した経路とは無関係であるといえた.
それでは,カゼインキナーゼ1の機能は何だろうか? そこで,これまでの筆者らによる解析の結果に着目した.Rec12はDNA 2本鎖切断の導入においてはたらくSpo11の分裂酵母におけるホモログであり,rec12破壊株においては減数分裂期における相同組換えが起こらなくなるが,rec12とsgo1との二重破壊株では,減数第1分裂期における染色体分配が還元型の染色体分配から均等型の染色体分配へとシフトする.すなわち,rec12とsgo1との二重破壊株とカゼインキナーゼ1とsgo1との二重変異株の表現型は類似していた.そこで,カゼインキナーゼ1の変異株ではrec12破壊株と同様に相同組換えの頻度が低下している可能性を想定した.実際に,カゼインキナーゼ1の変異株において減数分裂期における相同組換えの頻度を測定したところ,野生株に比べいちじるしく低下していた.よって,分裂酵母のカゼインキナーゼ1は減数分裂期における相同組換えに必要であることが判明した.
2.カゼインキナーゼ1はRec11のリン酸化を介してDNA 2本鎖切断の導入を促進する
カゼインキナーゼ1はどのような分子機序により相同組換えを制御するのかを明らかにするため,そのリン酸化の基質を探索した.これまでのさまざまな解析から,分裂酵母において,減数分裂期における相同組換えを制御するタンパク質として,減数分裂に特異的なコヒーシンの構成タンパク質や染色体の軸構造の構成タンパク質を含め,14のタンパク質が同定されていた7).そこで,それらを大腸菌に発現させて精製し,カゼインキナーゼ1によるin vitroリン酸化アッセイを行ったところ,減数分裂に特異的なコヒーシンの構成タンパク質であるRec11のN末端側の領域がもっともよくリン酸化されることが判明した.そこで,そのリン酸化部位を同定し,非リン酸化型のrec11変異株を作製してその表現型を観察した結果,カゼインキナーゼ1の変異株やrec11破壊株と同じくらい相同組換えの頻度が低下していた.重要なことに,リン酸化模倣型のrec11変異株はカゼインキナーゼ1の変異株において観察される相同組換えの頻度の低下を有意に抑圧することも明らかにされた.また,カゼインキナーゼ1によるリン酸化を特異的に認識する抗リン酸化Rec11抗体を作製し,細胞におけるRec11のリン酸化について検討した結果,実際に,減数分裂期においてRec11がカゼインキナーゼ1に依存的にリン酸化されることが判明した.さらに,これまで減数分裂に特異的なコヒーシンはDNA 2本鎖切断の導入にも必要であることが示されていたことから,非リン酸化型rec11変異株およびカゼインキナーゼ1の変異株においてDNA 2本鎖切断の導入の頻度を検証した結果,ともに有意に低下していることが明らかにされた.しかしながら,非リン酸化型rec11変異株において,姉妹染色分体の接着は野生株と同様に維持されていた.これらの結果から,カゼインキナーゼ1はRec11のリン酸化を介し,姉妹染色分体の接着に関する機能とは独立に,減数分裂期における相同組換えを制御するという機構が示唆された.
3.カゼインキナーゼ1はRec11のリン酸化を介して染色体の軸構造の形成を促進する
これまでの解析から,減数分裂に特異的なコヒーシンの構成タンパク質であるRec8およびRec11は,姉妹染色分体を接着させると同時にクロマチンのループ構造を構築し,それをもとに,より高次な染色体の軸構造の形成を促進すると考えられており,実際に,rec8破壊株およびrec11破壊株においては染色体の軸構造だけでなくクロマチンのループ構造も失われ,染色体の軸構造は全体として弛緩したクロマチンとして存在することが示唆されていた8).また,染色体の軸構造はコヒーシンによるクロマチンのループ構造の形成には不要である一方8),Rec12を含むDNA 2本鎖切断の導入に必要なタンパク質を呼び込む足場して機能するとともに,相同組換えに必要なクロマチンの環境を提供していると考えられている7).そこで,カゼインキナーゼ1によるRec11のリン酸化がクロマチンのループ構造にあたえる影響について観察した.その結果,rec8破壊株およびrec11破壊株において観察された弛緩したクロマチンの構造は,非リン酸化型rec11変異株では観察されなかったことから,非リン酸化型rec11変異株においては姉妹染色分体の接着と同様に,クロマチンのループ構造も正常に維持されていることが示唆された.非リン酸化型rec11変異株およびカゼインキナーゼ1の変異株における染色体の軸構造の形成を観察したところ,rec8破壊株およびrec11破壊株と同様に,染色体の軸構造の構成タンパク質が染色体に適切に局在できず,その結果として,核において凝集塊を形成するようすがみられた.また,カゼインキナーゼ1の変異株における染色体の軸構造の形成の不全は,リン酸化模倣型rec11変異株においてほぼ抑圧された.以上の結果から,カゼインキナーゼ1によるRec11のリン酸化は,DNA 2本鎖切断の導入に必須な染色体の軸構造の形成を促進することが明らかにされた.
4.カゼインキナーゼ1によるRec11のリン酸化はRec11と染色体の軸構造の構成タンパク質との結合を促進する
カゼインキナーゼ1によりリン酸化されたRec11が染色体の軸構造の形成の足場になっている可能性を検証する目的で,酵母ツーハイブリッド法によりRec11と既知の染色体の軸構造の構成タンパク質との結合について検証した.その結果,染色体の軸構造の構成タンパク質として報告されている5つのタンパク質のうち,Rec10が野生型Rec11と結合することがわかった.また,その結合はリン酸化模倣型Rec11変異体においては維持され,逆に,非リン酸化型Rec11変異体では失われることが明らかにされた.さらに,減数分裂期の細胞におけるRec11とRec10との相互作用を免疫沈降実験により検証した結果,Rec11はカゼインキナーゼ1によるリン酸化に依存的にRec10と相互作用することが判明した.よって,カゼインキナーゼ1によりリン酸化されたRec11は,染色体の軸構造の構成タンパク質であるRec10と結合することによりRec10および関連するタンパク質を染色体へと呼び込む結果,染色体の軸構造の形成が促進されるという機構が示唆された.
カゼインキナーゼ1によるRec11のリン酸化はRec10との結合のみに必要であるかどうかを検証する目的で,Rec10との結合が失われている非リン酸化型Rec11とRec10とを融合させたタンパク質を発現させてその表現型を観察したところ,染色体の軸構造の形成の不全および相同組換えの欠損の表現型がほぼ完全に抑圧された.また,カゼインキナーゼ1の変異株の表現型は野生型Rec11-Rec10融合タンパク質の発現により抑圧された.よって,カゼインキナーゼ1はRec11をリン酸化しRec10との結合を促進することにより,染色体の軸構造の形成および減数分裂期における相同組換えを制御し,結果的に,正しい染色体分配を保証しているという機構が明らかにされた(図2).
おわりに
1950年代に減数分裂期に特異的に形成される染色体軸の構造であるシナプトネマ複合体が見い出されてから9),今日にいたるまで,その構築にかかわる分子機構は不明であった.また,分裂酵母の減数分裂に特異的なコヒーシンの構成タンパク質であるRec8およびRec11は,1980年代後半,減数分裂期における相同組換えに欠損を示す変異株の責任タンパク質として見い出されたが3),Rec8およびRec11がどのような分子機構により相同組換えを制御するのか,その詳細も不明であった.今回の研究は,これら2つの積年の課題を解き明かす端緒となったという点において意義深いと考えられる.また,カゼインキナーゼ1やRec11だけでなく,分裂酵母のRec10も出芽酵母やマウスなどにホモログが存在する.マウスの精巣を用いた解析から,クロマチンと結合したSA3はリン酸化されていることが報告されていることから,今回,明らかにされた,カゼインキナーゼ1を介したコヒーシンによる染色体の軸構造の形成機構が進化的に保存されている可能性は十分に考えられる.マウスの卵子では加齢にともない染色体からコヒーシンが脱離する現象が報告され10),加齢とともに頻度の上昇する染色体分配のミスに起因した異数体をもつ卵子の形成との関連が議論されはじめている.今回,明らかにされたカゼインキナーゼ1およびコヒーシンによる相同組換えの制御機構は,減数分裂期における染色体分配のしくみの解明につながる成果であり,将来的には,その正確な理解にもとづき,配偶子の形成の異常に起因する臨床におけるさまざまな課題の解決に資する可能性が期待される.
文 献
- Mehta, G. D., Kumar, R., Srivastava, S. et al.: Cohesin: functions beyond sister chromatid cohesion. FEBS Lett., 587, 2299-2312 (2013)[PubMed]
- Lorenz, A., Wells, J. L., Pryce, D. W. et al.: S. pombe meiotic linear elements contain proteins related to synaptonemal complex components. J. Cell Sci., 117, 3343-3351 (2004)[PubMed]
- Ponticelli, A. S. & Smith, G. R.: Meiotic recombination-deficient mutants of Schizosaccharomyces pombe. Genetics, 123, 45-54 (1989)[PubMed]
- Petronczki, M., Motos, J., Mori, S. et al.: Monopolar attachment of sister kinetochores at meiosis I requires casein kinase 1. Cell, 126, 1049-1064 (2006)[PubMed]
- Yokobayashi, S. & Watanabe, Y.: The kinetochore protein Moa1 enables cohesion-mediated monopolar attachment at meiosis I. Cell, 123, 803-817 (2005)[PubMed]
- Sakuno, T., Tada, K. & Watanabe, Y.: Kinetochore geometry defined by cohesion within the centromere. Nature, 458, 852-858 (2009)[PubMed]
- Miyoshi, T., Ito, M., Kugou, K. et al.: A central coupler for recombination initiation linking chromosome architecture to S phase checkpoint. Mol. Cell, 47, 722-733 (2012)[PubMed] [新着論文レビュー]
- Ding, D. Q., Sakurai, N., Katou, Y. et al.: Meiotic cohesins modulate chromosome compaction during meiotic prophase in fission yeast. J. Cell Biol., 174, 499-508 (2006)[PubMed]
- Moses, M. J.: Chromosomal structure in crayfish spermatocytes. J. Biophys. Biochem. Cytol., 2, 215-218 (1956)[PubMed]
- Lister, L. M., Kouznetsova, A., Hyslop, L. A. et al.: Age-related meiotic segregation errors in mammalian oocytes are preceded by depletion of cohesin and Sgo2. Curr. Biol., 20, 1511-1521 (2010)[PubMed]
著者プロフィール
略歴:2004年 東京大学大学院薬学系研究科にて博士号取得,東京大学分子細胞生物学研究所 ポスドクを経て,同 講師.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 作野剛士・渡邊嘉典 Licensed under CC 表示 2.1 日本