PAXXはKu70-Ku80ヘテロ二量体と相互作用することによりDNA 2本鎖切断の修復を促進する
越智 崇
(英国Cambridge大学Department of Biochemistry)
email:越智 崇
DOI: 10.7875/first.author.2015.010
PAXX, a paralog of XRCC4 and XLF, interacts with Ku to promote DNA double-strand break repair.
Takashi Ochi, Andrew N. Blackford, Julia Coates, Satpal Jhujh, Shahid Mehmood, Naoka Tamura, Jon Travers, Qian Wu, Viji M. Draviam, Carol V. Robinson, Tom L. Blundell, Stephen P. Jackson
Science, 347, 185-188 (2015)
DNAが放射線にさらされることなどにより発生する高い毒性をもつDNA 2本鎖切断は,ヒトの細胞において相同組換えあるいは非相同末端結合により修復される.非相同末端結合にかかわるタンパク質であるXRCC4およびXLFは,タンパク質間相互作用の仲介する重要な役割を担っており,類似した立体構造をもつ.この研究において,筆者らは,PAXXと命名したタンパク質がXRCC4およびXLFのパラログであることをバイオインフォマティクス解析により見い出し,X線結晶構造解析を用いそれを証明した.また,PAXXはKu70-Ku80ヘテロ二量体と相互作用することにより非相同末端結合によるDNA 2本鎖切断の修復を促進し,非相同末端結合にかかわるタンパク質をDNA 2本鎖切断の部位において安定化することが示された.PAXXの発見は,非相同末端結合によるDNA 2本鎖切断の修復機構の解明に大きく貢献すると思われる.
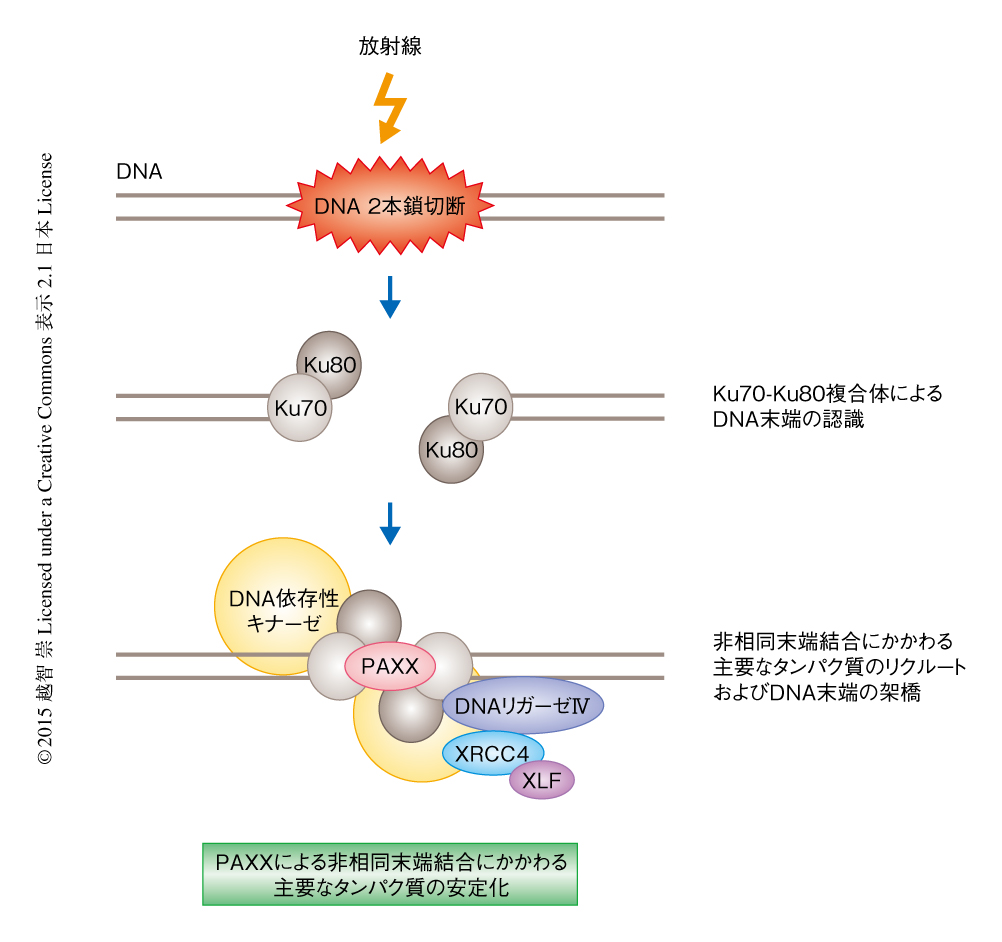
DNA 2本鎖切断はDNA損傷のなかでもっとも細胞毒性が高いといわれており,放射線などの外的な要因,活性酸素など内部の因子,また,V(D)J組換えなど抗体遺伝子の形成において発生する.DNA 2本鎖切断が正しく修復されない場合には細胞死や細胞のがん化をひき起こす原因となりうる1).DNA 2本鎖切断はほとんどの真核生物において,姉妹染色体を鋳型として必要とする相同組換え,あるいは,鋳型を必要としない非相同末端結合により修復される.非相同末端結合は相同組換えと異なり,DNA 2本鎖切断により生じた2つのDNA末端を直接的に結合するため,結合部位において変異を起こすことのあるものの,姉妹染色体を修復に必要としないためすべての細胞周期をつうじて機能する.非相同末端結合においてDNA 2本鎖切断はKu70-Ku80ヘテロ二量体により認識され,それをひき金として非相同末端結合にかかわる主要なタンパク質,DNA依存性キナーゼ,DNAリガーゼIV,XRCC4,XLF(Cernunnosとしても知られる)がDNA 2本鎖切断の部位にリクルートされる.また,DNA末端は損傷の状態によってはDNAポリメラーゼやヌクレアーゼなどにより修飾されることで,DNAリガーゼにより結合の可能な状態にされる2).XRCC4とXLFは同じXRCC4スーパーファミリーに属し,非相同末端結合においてタンパク質間相互作用を仲介する.また,XRCC4およびXLFは互いに相互作用することにより左巻きらせん状の繊維構造を形成し,2つのDNAのあいだの架橋として機能する.なお,XRCC4スーパーファミリーにはらせん構造あるいはリング構造を特徴とし中心体の構成タンパク質であるSAS-6も含まれる3).この研究の目的は,XRCC4スーパーファミリーに属する新規のタンパク質を同定し,その機能解析をつうじXRCC4スーパーファミリーにおける共通性を見い出すことであった.
XRCC4スーパーファミリーを構成するおのおののタンパク質のあいだの1次構造の類似性はおよそ10%と低いため,1次構造からXRCC4スーパーファミリーに属する新規のタンパク質を探し出すことは困難であった.そのため,高次構造を利用しデータベースにある1次構造から相同タンパク質を検索するBackPhyreサーバー4) を利用した.その結果,のちにPAXX(paralog of XRCC4 and XLF)と命名したタンパク質がXRCC4スーパーファミリーのメンバーである可能性のあることをつきとめた.さらに,1次構造をもとにしたPsi-Blast検索5) により,PAXXは真核生物において昆虫を除いたFilozoaグループに属する生物に存在することが明らかにされた.
バイオインフォマティクス解析によりPAXXがXRCC4スーパーファミリーのメンバーと同様の立体構造をもつことが示唆されたことから,PAXXのX線結晶構造解析を行った(PDB ID:3WTD).PAXXはXRCC4スーパーファミリーのほかのメンバーと同様に,コイルドコイルを介して二量体を形成しており,全体のかたちはXRCC4,XLF,SAS-6の3つのうち,XRCC4ともっとも類似していた.1残基~145残基,1残基~166残基,全長のPAXXを精製し立体構造を解析した結果,1残基から145残基までは立体構造を形成するが,146残基からC末端の204残基までは2次構造を形成しないことがわかった.さきに述べたように,XRCC4スーパーファミリーは繊維構造を形成することから,PAXXが結晶において高次構造を形成するかどうかを確認したところ,ジグザク状の繊維構造をとっていた.しかしながら,その繊維構造は結晶化による擬似的なものである可能性があったため,実際の分子量をX線小角散乱法およびネイティブ質量分析により測定したところ,PAXXは二量体であることが実験的に確認された.これらの結果により,PAXXはXRCC4スーパーファミリーに属すること,また,安定な二量体を形成することが示された.
XRCC4スーパーファミリーはほかのタンパク質との相互作用を介して機能することから,PAXXと相互作用するタンパク質の同定を試みた.GFPタグと融合させた1残基~145残基のPAXXおよび全長のPAXXをヒトの細胞において発現させ,GFPナノボディを使った親和性クロマトグラフィーにより精製した.1残基~145残基の立体構造を形成する部位のみからなるPAXXからはめだった共精製タンパク質は検出されなかったが,全長のPAXXからはKu70およびKu80が共精製された.PAXXのC末端側の177残基~204残基には異なる種のあいだでよく保存されたアミノ酸配列が存在したため,その領域にビオチンを修飾したペプチドを合成しプルダウンアッセイを行ったところ,PAXXのC末端側の領域とKu70-Ku80ヘテロ二量体とが相互作用することが確認された.また,点変異体を用いた同様の解析から,PAXXにおいてとくによく保存されていたVal199およびPhe201がその相互作用に重要であることが明らかにされた.同様の結果は,精製したPAXXとKu70-Ku80ヘテロ二量体を用いたゲルシフトアッセイ,および,表面プラズモン共鳴法によっても確認され,PAXXとKu70-Ku80ヘテロ二量体とのタンパク質間相互作用はPAXXのC末端側の断片により阻害されることが示された.以上の結果から,PAXXはKu70-Ku80ヘテロ二量体と相互作用することにより非相同末端結合において機能するという仮説をたてた.
これまで,DNA 2本鎖切断に対する修復あるいは応答に関与するタンパク質のDNA 2本鎖切断の部位へのリクルートは,核に対しレーザーを局所的に照射することにより生成したDNA 2本鎖切断の部位への集積として可視化されることが多く報告されている6).このことを利用し,PAXXがレーザーを照射された線のうえに集積するかどうか検討した.GFPタグを融合したPAXXをヒトの細胞において発現させてレーザーを照射したところ,PAXXがDNA 2本鎖切断の部位に集積することが確認された.
PAXXが非相同末端結合に関与しているならば,PAXXの欠損した細胞においてDNA 2本鎖切断の修復の効率が低下するはずである.この仮説を確かめるため,siRNAを用いてPAXXをノックダウンした細胞に放射線を照射してDNA 2本鎖切断を発生させ,そののちの細胞の生存率をクローン原性生存アッセイ法により測定した.陰性対照となるsiRNAをトランスフェクションした細胞と比較して,PAXXをノックダウンした細胞はXRCC4をノックダウンした細胞と同様の生存率の低下を示した.さらに,PAXXをノックダウンした細胞にプラスミドにより野生型のPAXXを発現させたところ,野生型の細胞と同様の生存率を示した.その一方で,Ku70-Ku80ヘテロ二量体との相互作用を欠損した変異型のPAXXを用いた場合には生存率の回復は認められなかった.同様の結果は,CRISPR/Cas9系を用いてPAXXをノックアウトした細胞においても確認され,また,放射線の代わりにDNA 2本鎖切断を生成する代表的な薬剤であるフレオマイシンを投与した実験系においても観察された.さらに,PAXXをノックアウトした細胞においてXRCC4あるいはXLFをノックダウンし,放射線を照射したのちクローン原性生存アッセイ法により細胞の生存率を測定した結果,それらの遺伝子はエピスタティックであることがわかった.
PAXXをノックアウトした細胞では野生型の細胞と異なり,DNA 2本鎖切断のマーカーとして用いられるリン酸化ヒストンH2AXの量が放射線を照射したのち一定の時間が経過したあとでも高く,つまり,DNA 2本鎖切断の修復が遅延していることが示唆された.PAXXを欠損した細胞におけるDNA 2本鎖切断の修復効率の低下は,中性コメットアッセイ法およびランダムプラスミドインテグレーションアッセイ法によっても確認された.
以上の結果より,PAXXはKu70-Ku80ヘテロ二量体と相互作用することによりDNA 2本鎖切断の修復を促進し,XRCC4あるいはXLFが機能するのと同じDNA 2本鎖切断の修復経路において機能すると考えられ,結論として,PAXXは非相同末端結合にかかわることが示唆された.
PAXXが非相同末端結合においてどのようなはたらきをもつかを調べるため,精製したPAXX,Ku70-Ku80ヘテロ二量体,XRCC4-DNAリガーゼIV複合体(DNAリガーゼIVは単独では不安定なため,一般に,XRCC4と共精製される)を用いて,in vitroにおいてDNAリガーゼ反応を行った.XRCC4-DNAリガーゼIV複合体はKu70-Ku80ヘテロ二量体と相互作用することによりDNAリガーゼ活性が上昇することが知られている7).この実験系に野生型のPAXXをくわえたところ,さらなるDNAリガーゼ活性の上昇が認められたが,Ku70-Ku80ヘテロ二量体との相互作用を欠失した変異型のPAXXくわえてもDNAリガーゼ活性の上昇は検出されなかった.したがって,PAXXはKu70-Ku80ヘテロ二量体と相互作用することによりXRCC4-DNAリガーゼIVによるDNAリガーゼ反応を促進することが示唆された.このin vitroにおけるアッセイは,PAXXが非相同末端結合の機能に直接的に関与していることを意味した.さらに,DNA 2本鎖切断を生成するフレオマイシンにより処理したヒトの細胞からクロマチン免疫沈降を行い,染色体に結合しているタンパク質を野生型の細胞とPAXXをノックアウトした細胞とで比較した.その結果,PAXXをノックアウトした細胞でのみ,非相同末端結合にかかわる主要なタンパク質の結合量が減少していることが見い出された.つまり,PAXXはDNA 2本鎖切断の部位において,非相同末端結合にかかわる主要なタンパク質を安定化することが示された(図1).
筆者らは,XRCC4の立体構造をもとにしたアミノ酸配列のデータベースの検索を利用して,XRCC4スーパーファミリーの新しいメンバーであるPAXXを発見し,X線結晶構造解析によりその立体構造がXRCC4と類似していることを確認した.さらに,PAXXは非相同末端結合においてKu70-Ku80ヘテロ二量体と相互作用し,DNA 2本鎖切断の部位において非相同末端結合にかかわる主要なタンパク質を安定化させることを発見した.しかしながら,PAXXについてはいまだ不明な点が多い.たとえば,PAXXはKu70-Ku80ヘテロ二量体とどう構造的に相互作用して非相同末端結合にかかわるタンパク質を安定化させるのか,PAXXはほかのXRCC4スーパーファミリーのメンバーと同様に繊維構造を形成するのか,非相同末端結合はV(D)J組換えあるいはクラススイッチ組換えにおいて重要な役割をはたしているがPAXXは抗体遺伝子の形成において重要な役割をもつのか.今後の研究においてこれらの疑問が解決され,非相同末端結合がどう機能するのか明らかにされることを期待している.
略歴:2011年 英国Cambridge大学にてPh.D取得,同年より同 研究員.
研究テーマ:非相同末端結合にかかわるタンパク質の構造生物学.
関心事:DNA修復にかかわるタンパク質の空間的および時間的な配置.革製品を磨くこと.
© 2015 越智 崇 Licensed under CC 表示 2.1 日本
(英国Cambridge大学Department of Biochemistry)
email:越智 崇
DOI: 10.7875/first.author.2015.010
PAXX, a paralog of XRCC4 and XLF, interacts with Ku to promote DNA double-strand break repair.
Takashi Ochi, Andrew N. Blackford, Julia Coates, Satpal Jhujh, Shahid Mehmood, Naoka Tamura, Jon Travers, Qian Wu, Viji M. Draviam, Carol V. Robinson, Tom L. Blundell, Stephen P. Jackson
Science, 347, 185-188 (2015)
要 約
DNAが放射線にさらされることなどにより発生する高い毒性をもつDNA 2本鎖切断は,ヒトの細胞において相同組換えあるいは非相同末端結合により修復される.非相同末端結合にかかわるタンパク質であるXRCC4およびXLFは,タンパク質間相互作用の仲介する重要な役割を担っており,類似した立体構造をもつ.この研究において,筆者らは,PAXXと命名したタンパク質がXRCC4およびXLFのパラログであることをバイオインフォマティクス解析により見い出し,X線結晶構造解析を用いそれを証明した.また,PAXXはKu70-Ku80ヘテロ二量体と相互作用することにより非相同末端結合によるDNA 2本鎖切断の修復を促進し,非相同末端結合にかかわるタンパク質をDNA 2本鎖切断の部位において安定化することが示された.PAXXの発見は,非相同末端結合によるDNA 2本鎖切断の修復機構の解明に大きく貢献すると思われる.
はじめに
DNA 2本鎖切断はDNA損傷のなかでもっとも細胞毒性が高いといわれており,放射線などの外的な要因,活性酸素など内部の因子,また,V(D)J組換えなど抗体遺伝子の形成において発生する.DNA 2本鎖切断が正しく修復されない場合には細胞死や細胞のがん化をひき起こす原因となりうる1).DNA 2本鎖切断はほとんどの真核生物において,姉妹染色体を鋳型として必要とする相同組換え,あるいは,鋳型を必要としない非相同末端結合により修復される.非相同末端結合は相同組換えと異なり,DNA 2本鎖切断により生じた2つのDNA末端を直接的に結合するため,結合部位において変異を起こすことのあるものの,姉妹染色体を修復に必要としないためすべての細胞周期をつうじて機能する.非相同末端結合においてDNA 2本鎖切断はKu70-Ku80ヘテロ二量体により認識され,それをひき金として非相同末端結合にかかわる主要なタンパク質,DNA依存性キナーゼ,DNAリガーゼIV,XRCC4,XLF(Cernunnosとしても知られる)がDNA 2本鎖切断の部位にリクルートされる.また,DNA末端は損傷の状態によってはDNAポリメラーゼやヌクレアーゼなどにより修飾されることで,DNAリガーゼにより結合の可能な状態にされる2).XRCC4とXLFは同じXRCC4スーパーファミリーに属し,非相同末端結合においてタンパク質間相互作用を仲介する.また,XRCC4およびXLFは互いに相互作用することにより左巻きらせん状の繊維構造を形成し,2つのDNAのあいだの架橋として機能する.なお,XRCC4スーパーファミリーにはらせん構造あるいはリング構造を特徴とし中心体の構成タンパク質であるSAS-6も含まれる3).この研究の目的は,XRCC4スーパーファミリーに属する新規のタンパク質を同定し,その機能解析をつうじXRCC4スーパーファミリーにおける共通性を見い出すことであった.
1.バイオインフォマティクスによるXRCC4スーパーファミリーに属する新規のタンパク質の同定
XRCC4スーパーファミリーを構成するおのおののタンパク質のあいだの1次構造の類似性はおよそ10%と低いため,1次構造からXRCC4スーパーファミリーに属する新規のタンパク質を探し出すことは困難であった.そのため,高次構造を利用しデータベースにある1次構造から相同タンパク質を検索するBackPhyreサーバー4) を利用した.その結果,のちにPAXX(paralog of XRCC4 and XLF)と命名したタンパク質がXRCC4スーパーファミリーのメンバーである可能性のあることをつきとめた.さらに,1次構造をもとにしたPsi-Blast検索5) により,PAXXは真核生物において昆虫を除いたFilozoaグループに属する生物に存在することが明らかにされた.
2.PAXXはXRCC4と同様の立体構造をもち二量体を形成する
バイオインフォマティクス解析によりPAXXがXRCC4スーパーファミリーのメンバーと同様の立体構造をもつことが示唆されたことから,PAXXのX線結晶構造解析を行った(PDB ID:3WTD).PAXXはXRCC4スーパーファミリーのほかのメンバーと同様に,コイルドコイルを介して二量体を形成しており,全体のかたちはXRCC4,XLF,SAS-6の3つのうち,XRCC4ともっとも類似していた.1残基~145残基,1残基~166残基,全長のPAXXを精製し立体構造を解析した結果,1残基から145残基までは立体構造を形成するが,146残基からC末端の204残基までは2次構造を形成しないことがわかった.さきに述べたように,XRCC4スーパーファミリーは繊維構造を形成することから,PAXXが結晶において高次構造を形成するかどうかを確認したところ,ジグザク状の繊維構造をとっていた.しかしながら,その繊維構造は結晶化による擬似的なものである可能性があったため,実際の分子量をX線小角散乱法およびネイティブ質量分析により測定したところ,PAXXは二量体であることが実験的に確認された.これらの結果により,PAXXはXRCC4スーパーファミリーに属すること,また,安定な二量体を形成することが示された.
3.PAXXは非相同末端結合にかかわるKu70-Ku80ヘテロ二量体と相互作用する
XRCC4スーパーファミリーはほかのタンパク質との相互作用を介して機能することから,PAXXと相互作用するタンパク質の同定を試みた.GFPタグと融合させた1残基~145残基のPAXXおよび全長のPAXXをヒトの細胞において発現させ,GFPナノボディを使った親和性クロマトグラフィーにより精製した.1残基~145残基の立体構造を形成する部位のみからなるPAXXからはめだった共精製タンパク質は検出されなかったが,全長のPAXXからはKu70およびKu80が共精製された.PAXXのC末端側の177残基~204残基には異なる種のあいだでよく保存されたアミノ酸配列が存在したため,その領域にビオチンを修飾したペプチドを合成しプルダウンアッセイを行ったところ,PAXXのC末端側の領域とKu70-Ku80ヘテロ二量体とが相互作用することが確認された.また,点変異体を用いた同様の解析から,PAXXにおいてとくによく保存されていたVal199およびPhe201がその相互作用に重要であることが明らかにされた.同様の結果は,精製したPAXXとKu70-Ku80ヘテロ二量体を用いたゲルシフトアッセイ,および,表面プラズモン共鳴法によっても確認され,PAXXとKu70-Ku80ヘテロ二量体とのタンパク質間相互作用はPAXXのC末端側の断片により阻害されることが示された.以上の結果から,PAXXはKu70-Ku80ヘテロ二量体と相互作用することにより非相同末端結合において機能するという仮説をたてた.
4.PAXXは非相同末端結合にかかわる
これまで,DNA 2本鎖切断に対する修復あるいは応答に関与するタンパク質のDNA 2本鎖切断の部位へのリクルートは,核に対しレーザーを局所的に照射することにより生成したDNA 2本鎖切断の部位への集積として可視化されることが多く報告されている6).このことを利用し,PAXXがレーザーを照射された線のうえに集積するかどうか検討した.GFPタグを融合したPAXXをヒトの細胞において発現させてレーザーを照射したところ,PAXXがDNA 2本鎖切断の部位に集積することが確認された.
PAXXが非相同末端結合に関与しているならば,PAXXの欠損した細胞においてDNA 2本鎖切断の修復の効率が低下するはずである.この仮説を確かめるため,siRNAを用いてPAXXをノックダウンした細胞に放射線を照射してDNA 2本鎖切断を発生させ,そののちの細胞の生存率をクローン原性生存アッセイ法により測定した.陰性対照となるsiRNAをトランスフェクションした細胞と比較して,PAXXをノックダウンした細胞はXRCC4をノックダウンした細胞と同様の生存率の低下を示した.さらに,PAXXをノックダウンした細胞にプラスミドにより野生型のPAXXを発現させたところ,野生型の細胞と同様の生存率を示した.その一方で,Ku70-Ku80ヘテロ二量体との相互作用を欠損した変異型のPAXXを用いた場合には生存率の回復は認められなかった.同様の結果は,CRISPR/Cas9系を用いてPAXXをノックアウトした細胞においても確認され,また,放射線の代わりにDNA 2本鎖切断を生成する代表的な薬剤であるフレオマイシンを投与した実験系においても観察された.さらに,PAXXをノックアウトした細胞においてXRCC4あるいはXLFをノックダウンし,放射線を照射したのちクローン原性生存アッセイ法により細胞の生存率を測定した結果,それらの遺伝子はエピスタティックであることがわかった.
PAXXをノックアウトした細胞では野生型の細胞と異なり,DNA 2本鎖切断のマーカーとして用いられるリン酸化ヒストンH2AXの量が放射線を照射したのち一定の時間が経過したあとでも高く,つまり,DNA 2本鎖切断の修復が遅延していることが示唆された.PAXXを欠損した細胞におけるDNA 2本鎖切断の修復効率の低下は,中性コメットアッセイ法およびランダムプラスミドインテグレーションアッセイ法によっても確認された.
以上の結果より,PAXXはKu70-Ku80ヘテロ二量体と相互作用することによりDNA 2本鎖切断の修復を促進し,XRCC4あるいはXLFが機能するのと同じDNA 2本鎖切断の修復経路において機能すると考えられ,結論として,PAXXは非相同末端結合にかかわることが示唆された.
5.PAXXは非相同末端結合にかかわるタンパク質をDNA 2本鎖切断の部位において安定化させる
PAXXが非相同末端結合においてどのようなはたらきをもつかを調べるため,精製したPAXX,Ku70-Ku80ヘテロ二量体,XRCC4-DNAリガーゼIV複合体(DNAリガーゼIVは単独では不安定なため,一般に,XRCC4と共精製される)を用いて,in vitroにおいてDNAリガーゼ反応を行った.XRCC4-DNAリガーゼIV複合体はKu70-Ku80ヘテロ二量体と相互作用することによりDNAリガーゼ活性が上昇することが知られている7).この実験系に野生型のPAXXをくわえたところ,さらなるDNAリガーゼ活性の上昇が認められたが,Ku70-Ku80ヘテロ二量体との相互作用を欠失した変異型のPAXXくわえてもDNAリガーゼ活性の上昇は検出されなかった.したがって,PAXXはKu70-Ku80ヘテロ二量体と相互作用することによりXRCC4-DNAリガーゼIVによるDNAリガーゼ反応を促進することが示唆された.このin vitroにおけるアッセイは,PAXXが非相同末端結合の機能に直接的に関与していることを意味した.さらに,DNA 2本鎖切断を生成するフレオマイシンにより処理したヒトの細胞からクロマチン免疫沈降を行い,染色体に結合しているタンパク質を野生型の細胞とPAXXをノックアウトした細胞とで比較した.その結果,PAXXをノックアウトした細胞でのみ,非相同末端結合にかかわる主要なタンパク質の結合量が減少していることが見い出された.つまり,PAXXはDNA 2本鎖切断の部位において,非相同末端結合にかかわる主要なタンパク質を安定化することが示された(図1).
おわりに
筆者らは,XRCC4の立体構造をもとにしたアミノ酸配列のデータベースの検索を利用して,XRCC4スーパーファミリーの新しいメンバーであるPAXXを発見し,X線結晶構造解析によりその立体構造がXRCC4と類似していることを確認した.さらに,PAXXは非相同末端結合においてKu70-Ku80ヘテロ二量体と相互作用し,DNA 2本鎖切断の部位において非相同末端結合にかかわる主要なタンパク質を安定化させることを発見した.しかしながら,PAXXについてはいまだ不明な点が多い.たとえば,PAXXはKu70-Ku80ヘテロ二量体とどう構造的に相互作用して非相同末端結合にかかわるタンパク質を安定化させるのか,PAXXはほかのXRCC4スーパーファミリーのメンバーと同様に繊維構造を形成するのか,非相同末端結合はV(D)J組換えあるいはクラススイッチ組換えにおいて重要な役割をはたしているがPAXXは抗体遺伝子の形成において重要な役割をもつのか.今後の研究においてこれらの疑問が解決され,非相同末端結合がどう機能するのか明らかにされることを期待している.
文 献
- Jackson, S. P. & Bartek, J.: The DNA-damage response in human biology and disease. Nature, 461, 1071-1078 (2009)[PubMed]
- Lieber, M. R.: The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway. Annu. Rev. Biochem., 79, 181-211 (2010)[PubMed]
- Cottee, M., Raff, J., Lea, S. et al.: SAS-6 oligomerization: the key to the centriole? Nat. Chem. Biol., 7, 650-653 (2011)[PubMed]
- Kelley, L. A. & Sternberg, M. J.: Protein structure prediction on the Web: a case study using the Phyre server. Nat. Protoc., 4, 363-371 (2009)[PubMed]
- Altschul, S., Madden. T. L,, Schaffer, A. A. et al.: Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res., 25, 3389-3402 (1997)[PubMed]
- Lukas, C., Bartek, J. & Lukas, J.: Imaging of protein movement induced by chromosomal breakage: tiny 'local' lesions pose great 'global' challenges. Chromosoma, 114, 146-154 (2005)[PubMed]
- Nick McElhinny, S. A., Snowden, C. M., McCarville, J. et al.: Ku recruits the XRCC4-ligase IV complex to DNA ends. Mol. Cell. Biol., 20, 2996-3003 (2000)[PubMed]
著者プロフィール
略歴:2011年 英国Cambridge大学にてPh.D取得,同年より同 研究員.
研究テーマ:非相同末端結合にかかわるタンパク質の構造生物学.
関心事:DNA修復にかかわるタンパク質の空間的および時間的な配置.革製品を磨くこと.
© 2015 越智 崇 Licensed under CC 表示 2.1 日本