減数第1分裂に特異的な染色体分配の司令塔としてはたらく新規の動原体タンパク質MEIKIN
石黒啓一郎・金 智慧・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:石黒啓一郎,金 智慧,渡邊嘉典
DOI: 10.7875/first.author.2015.009
Meikin is a conserved regulator of meiosis-I-specific kinetochore function.
Jihye Kim, Kei-ichiro Ishiguro, Aya Nambu, Bungo Akiyoshi, Shihori Yokobayashi, Ayano Kagami, Tadashi Ishiguro, Alberto M. Pendas, Naoki Takeda, Yogo Sakakibara, Tomoya S. Kitajima, Yuji Tanno, Takeshi Sakuno, Yoshinori Watanabe
Nature, 517, 466-471 (2015)
減数分裂における染色体分配の様式は,第1分裂に還元型の染色体分配がある点で,体細胞にみられる均等型の染色体分配とは異なる.減数第1分裂の染色体において特異的にみられる“動原体の一方向性の結合”および“動原体の接着”は,減数分裂における染色体分配の様式の分子機構を理解するための鍵とされてきた.今回,筆者らは,マウスの生殖細胞より減数第1分裂において特異的に発現および局在する新規の動原体タンパク質MEIKINを同定した.ノックアウトマウスの解析から,MEIKINが動原体の一方向性の結合および動原体の接着において重要な役割をはたしていることが明らかにされた.さらに,この機能の多くが,MEIKINと相互作用するPoloキナーゼにより担われていることが明らかにされた.驚くべきことに,MEIKINおよびPoloキナーゼを介する動原体の制御の分子機構は酵母からヒトまで種をこえて保存されていた.MEIKINの発見は,長年にわたり謎につつまれていた減数第1分裂における動原体の制御機構の解明に大きな道筋をあたえた.
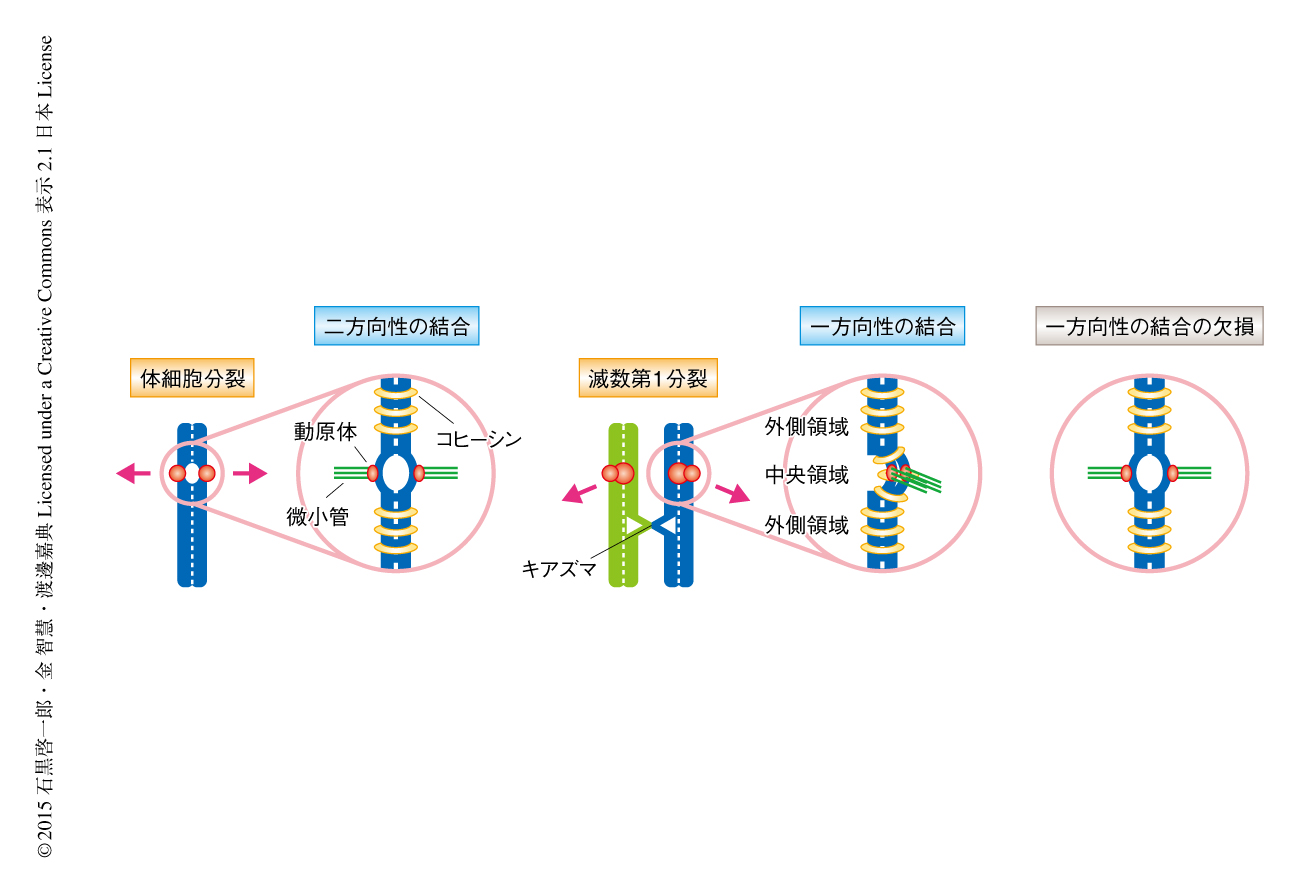
減数分裂における染色体分配は,減数分裂のまえのS期における1回の複製ののち,減数第1分裂にみられる相同染色体の分配(還元型の染色体分配),および,ひきつづいて起こる姉妹染色分体の分離(均等型の染色体分配)の2回の連続した染色体分配の過程からなる(図1).体細胞分裂と比較した場合,減数分裂では減数第1分裂に還元型の染色体分配のある点が両者の本質的な相違である.
体細胞分裂では姉妹染色分体の動原体がそれぞれ両極から伸びてくるスピンドル微小管により反対方向の位置から捕捉されること(動原体の二方向性の結合)により,姉妹染色分体が反対の方向に均等に分配される.これに対して,減数第1分裂では姉妹染色分体の動原体はあたかもひとつの融合した動原体のようにふるまうことにより一方向から伸びてくるスピンドル微小管により捕捉されるようになり(動原体の一方向性の結合),キアズマにより物理的につながった相同染色体がそれぞれ反対の方向に分配される.さらに,減数第1分裂では姉妹染色分体のセントロメアにおける接着が維持されることにより,動原体どうしが接着したままであることが特徴である.このように,減数第1分裂の染色体において特異的にみられる“動原体の一方向性の結合”および“動原体の接着”の2つの問題を解くことが,減数分裂における染色体分配の様式の本質を理解するための鍵とされてきた.
これら動原体の一方向性の結合および動原体の接着の問題については,すでに酵母を用いた先行研究からいくつかの重要な事実が示されている.筆者らの研究室による分裂酵母を用いた研究から,Moa1とよばれる動原体タンパク質が減数第1分裂におけるスピンドル微小管に対する動原体の一方向性の結合,および,セントロメア中央領域における姉妹染色分体の接着の維持に必要であることが明らかにされている1).分裂酵母のセントロメアは動原体タンパク質が位置する中央領域と外側領域から構成される.通常の体細胞分裂ではセントロメア外側領域において体細胞型のRAD21型コヒーシンにより姉妹染色分体の接着が確立されるのに対し,減数第1分裂ではセントロメア外側領域のみならずセントロメア中央領域においても減数分裂型のREC8型コヒーシンにより姉妹染色分体の接着が確立される(図2).これにより,通常の体細胞分裂では姉妹染色分体の動原体が背中合わせ(back-to-back)の配向をとるのに対し,減数第1分裂ではMoa1とREC8によってセントロメア中央領域における姉妹染色分体の接着が維持されることにより姉妹染色分体の動原体が横並び(side-by-side)の配向を示すものと考えられている2,3).実際に,Moa1に変異を導入した分裂酵母における減数第1分裂では,セントロメア中央領域における姉妹染色分体の接着が解消されると同時に動原体の一方向性の結合が失われるため,還元型の染色体分配ではなく均等型の染色体分配が誘発されてしまう1).同様に,出芽酵母においてもSpo13 4,5),あるいは,モノポリンとよばれる動原体タンパク質複合体の構成サブユニットMam1 6) が,減数第1分裂に特異的な動原体の一方向性の結合やセントロメアにおける姉妹染色分体の接着に関与することが示唆されている.しかしながら,酵母の研究において見い出されていたこれらのタンパク質には互いにアミノ酸配列レベルでの相同性がみられず,また,共通の分子機構が保存されているのかどうかについても議論の余地が残されていた.とりわけ高等動物においては,動原体の接着のみならず動原体の一方向性の結合をも含めた減数分裂に特化した染色体分配の様式を生み出す分子機構の存在が予測されながらも,その実体の解明は長年の懸案とされていた.
今回,筆者らは,マウスを用いた研究から,減数分裂に特異的な新規の動原体タンパク質MEIKINを同定した.さらに,MEIKINと相互作用するPoloキナーゼが減数分裂における動原体の一方向性の結合および動原体の接着を制御することが明らかにされた.この減数分裂における動原体の制御の分子機構は,これまでの研究において混沌としていた分裂酵母および出芽酵母の系においても,本質的には保存されていることが明らかにされた.
筆者らの研究室における分裂酵母を用いた先行研究において,動原体タンパク質CENP-Cの分裂酵母ホモログCnp3がMoa1と直接的に結合することが見い出されていた7).さらに,Cnp3のC末端側に位置するMif2モチーフおよびCENPCモチーフがMoa1との相互作用に必須であり,CENP-CのC末端側にあるこれらのモチーフは広い種のあいだで保存されていることがわかっていた.そこで,マウスの減数第1分裂においても,同様のタンパク質がCENP-Cとの相互作用により動原体に局在を示すであろうとの仮説のもと,マウスにおけるMoa1に相当するタンパク質の同定を目的として,マウスのCENP-CのC末端側のペプチドをベイトにした酵母ツーハイブリッドスクリーニングにより,マウスの精巣のcDNAライブラリーからCENP-Cと相互作用するタンパク質をしぼり込んだ.その結果,CENP-Cと相互作用を示す候補タンパク質のなかから,精巣および卵巣において特異的にmRNAの発現を示す未解析のタンパク質4930404A10Rikが同定された.このタンパク質に対する抗体を用いた免疫染色から,精母細胞および卵母細胞の減数第1分裂前期のパキテン期から減数第1分裂中期にかけて動原体に局在し,減数第2分裂において消失することが判明した.この減数第1分裂に特異的な新規の動原体タンパク質をMEIKIN(meiosis-specific kinetochore protein)と命名した.MEIKINはヒトを含む脊椎動物において保存されていたが,これまで酵母においてみつかっていた減数分裂の動原体タンパク質とはアミノ酸配列レベルでの相同性がみられず,また,既知のドメインをもたないユニークなタンパク質であった.
MEIKINの機能を探るためMeikin遺伝子を欠損したマウスを作製し,その表現型を解析した.Meikinノックアウトマウスは正常に発生し成長したものの,雌雄ともに不妊の表現型を示した.Meikinノックアウトマウスの精母細胞および卵母細胞は減数第1分裂前期から減数第1分裂前中期にかけて野生型マウスと同様にステージを進行し,染色体の軸構造の形成,相同染色体の対合,染色体の凝縮についてはいっけん正常な様相を示した.しかしながら,生細胞イメージングによる詳細な解析から,Meikinノックアウトマウスの卵母細胞では減数第1分裂中期から減数第1分裂後期へと進行したとたんに姉妹染色分体が早期に分離してしまい,その結果,減数第2分裂において染色体が赤道面に整列することなくバラバラになる様相が観察された.これを裏づけるように,減数第1分裂の染色体分配が開始される直前までは野生型マウスおよびMeikinノックアウトマウスにおいて姉妹染色分体のあいだの軸に同じ程度の減数分裂型のREC8型コヒーシンの局在が観察されたものの,減数第2分裂へ進行した時点で,野生型マウスにおいてはセントロメアに姉妹染色分体をつなぎとめるREC8型コヒーシンが残存していたのに対し,Meikinノックアウトマウスにおいてはセントロメアの大部分のREC8型コヒーシンが消失していることが判明した.このことは,MEIKINが減数第1分裂の染色体分配において動原体の接着を維持するのに必須の役割をはたしていることを示唆した.
興味深いことに,Meikinノックアウトマウスにおいてみられた表現型は,筆者らの研究室による先行研究において観察されていた,Shugoshin(Sgo)を欠損したときのようす8,9) ともいっけん似ていた.減数第1分裂の過程において,Sgo2がREC8型コヒーシンをセパラーゼとよばれるプロテアーゼによる分解から保護することによりセントロメアにおける姉妹染色分体の接着が維持されることがわかっている9).実際に,MeikinノックアウトマウスにおいてはSgo2のセントロメアへの局在が低下したという観察から,MEIKINが少なくともSgo2の局在を安定化することによりセントロメアの接着を制御していることが示唆された.
減数第1分裂の染色体分配が開始されるまえの減数第1分裂前中期の卵母細胞および精母細胞において姉妹染色分体の動原体のあいだの距離を測定したところ,Meikinノックアウトマウスでは野生型に比べ有意に離れていることが明らかにされた.このことから,Meikinノックアウトマウスでは動原体の一方向性の結合の性質が欠損している可能性が考えられた.
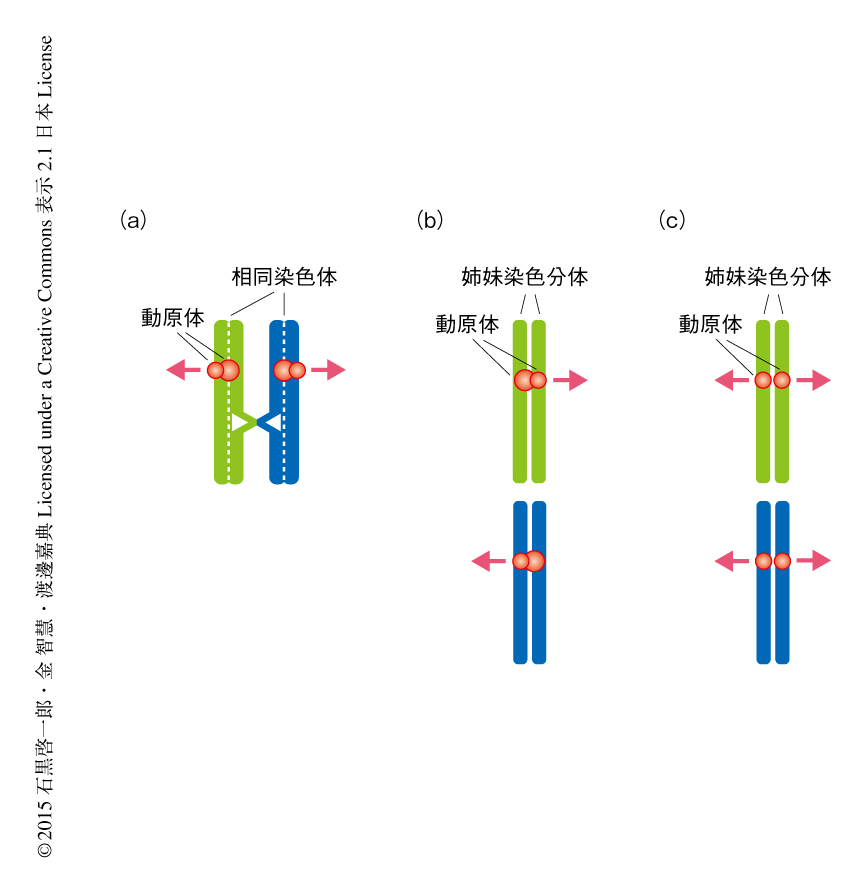
では,Meikinノックアウトマウスでは減数第1分裂のすべての染色体において体細胞のような均等型の染色体分配が誘発されているのであろうか? 先行研究から,2本の相同染色体をつなぐキアズマがあるとそれらのあいだに張力が発生するため,みかけ,動原体の一方向性の結合の欠損が打ち消されてしまうことが知られている1).そこで,Mlh1ノックアウトマウスを用いた遺伝学的なトリックを駆使し,MEIKINの欠損により動原体が一方向性の結合の性質を部分的に失うことを見い出した(図3).
Mlh1ノックアウトマウス10) では減数分裂組換えの交差型の修復に支障があるため,多くの相同染色体のあいだにキアズマが形成されず染色体が赤道面にうまく整列できない.これは,Mlh1ノックアウトマウスのキアズマをもたない染色体においては動原体の一方向性の結合の性質が残っているため,これらが両側からのスピンドル微小管にとらえられないことによる.ところが驚くべきことに,Mlh1ノックアウトマウスにMEIKINの欠損を導入すると,キアズマをもたない染色体においても赤道面への整列が部分的に回復した.この観察は,Mlh1ノックアウトマウスにおけるMEIKINの欠損により,一方向性の結合の性質を失った動原体がそれぞれ反対の方向から延びてきたスピンドル微小管により捕捉されたことを意味した.
MEIKINによりもたらされる動原体の接着の維持および一方向性の結合の分子機構はいったい何であろうか? MEIKINをベイトにした酵母ツーハイブリッド法および精巣のクロマチン画分からのMEIKINの免疫沈降と質量分析法を駆使し,MEIKINと相互作用するタンパク質をスクリーニングした.その結果,Poloキナーゼ1がMEIKINのpoloボックス結合モチーフを介し相互作用することが判明した.野生型マウスの場合,Poloキナーゼ1は減数第1分裂前期のディプロテン期から減数第1分裂後期にかけて動原体に局在すること,さらに,Meikinノックアウトマウスではその局在が大幅に消失することが明らかにされた.
実際に,野生型マウスの減数第1分裂前中期の卵母細胞にPoloキナーゼ1の阻害剤であるBI2536を短時間だけ処理すると,Meikinノックアウトマウスにおいてみられた表現型と同様に,減数第2分裂に進行した時点での染色体の赤道面への整列の異常やセントロメアにおけるREC8型コヒーシンの消失が観察された.このことは,動原体に局在するPoloキナーゼ1が減数第1分裂において動原体の接着を維持するのに重要な役割をはたしていることを示唆した.
さらに,Mlh1ノックアウトマウスの卵母細胞へのPoloキナーゼ1阻害剤の処理により,減数第1分裂前中期の多くの染色体において赤道面への整列が回復すること,さらに,動原体が両方向に引っ張られていることが観察された.これらの事実は,Mlh1とMeikinのダブルノックアウトマウスにおいてみられた表現型と同様に,動原体に局在するPoloキナーゼ1が失活したことにより動原体が一方向性の結合の性質を失ったという考えを支持した.したがって,MEIKINにより動原体にリクルートされるPoloキナーゼ1が,減数第1分裂の染色体分配において動原体の接着の維持および動原体の一方向性の結合に中心的な役割をはたしていると結論された.MEIKINによりリクルートされるPoloキナーゼ1によりリン酸化される基質は何か,また,MEIKINにはPoloキナーゼ1の基質認識の特異性やキナーゼ活性を制御する第3の機構があるのかなど,今後のさらなる分子機構の解明が課題である.
この研究において見い出されたMeikinノックアウトマウスの表現型は,先行研究において明らかにされていた分裂酵母Moa1破壊株の表現型と,動原体の接着および一方向性の結合の欠損という点で共通していた.そこで,マウスの減数第1分裂においてみられたMEIKINとPoloキナーゼ1との相互作用の分子機構が,分裂酵母のMoa1においてもあてはまるかどうか検討した.その結果,マウスの場合と同様に,Moa1がPoloキナーゼの分裂酵母ホモログであるPlo1と相互作用していること,また,Moa1のpoloボックス結合モチーフに変異を導入した株ではPlo1が動原体に局在できないことが明らかにされた.さらに,分裂酵母の減数第1分裂において動原体に局在するPlo1だけをピンポイントで欠失させると,還元型の染色体分配ではなく均等型の染色体分配が誘発されることも判明した.したがって,分裂酵母においてもMoa1とPoloキナーゼとの相互作用を介した動原体の接着の維持および一方向性の結合の機構が保存されていることが明らかにされた.
出芽酵母のSpo13についても,そのpoloボックス結合モチーフを介してPoloキナーゼの出芽酵母のホモログであるCdc5と相互作用することが知られていたが,その機能相関においては未知の点が多かった.実際に,分裂酵母Moa1破壊株にCnp3-Spo13融合タンパク質を発現させてSpo13を強制的に動原体に局在させると,減数第1分裂における還元型の染色体分配が大幅に回復した.一方で,poloボックス結合モチーフに変異を導入したCnp3-Spo13融合タンパク質を発現させた場合には,Moa1破壊株における還元型の染色体分配の回復はみられなかった.したがって,出芽酵母においてもSpo13とPoloキナーゼとの相互作用を介した動原体の接着の維持および一方向性の結合の機構が保存されていることが強く示唆された.すなわち,マウスMEIKIN,分裂酵母Moa1,出芽酵母Spo13は,アミノ酸配列レベルでの相同性を示さないものの,Poloキナーゼとの相互作用を介した共通の分子機構により,減数第1分裂において特有の染色体分配の様式が生み出されていると結論された.
ヒトの加齢した卵子において高頻度にみられる染色体数の異常が,高齢出産におけるダウン症や流産などの出生の異常と強く相関していることが知られている.また,近年の研究から,加齢にともなう減数分裂型のREC8型コヒーシンの染色体における局在量の減少が,セントロメアにおける姉妹染色分体の接着の破綻およびそののちの染色体分配の不安定性をひき起こす原因のひとつであることが指摘されている.筆者らは,MEIKINがヒトにも保存されていることを見い出しており,その機能欠損が出生の異常や不妊の原因になっている可能性が十分に考えられる.今後,MEIKINに照準をおいた臨床への応用研究が展開され,染色体数の異常に端を発するダウン症や不妊の原因の解明に大いに資することが期待される.
略歴:2000年 東京大学大学院理学系研究科にて博士号取得,同年 米国Dana-Farber Cancer Institute,2005年 東京大学分子細胞生物学研究所を経て,2014年より慶應義塾大学医学部 助教.
金 智慧(Jihye Kim)
2015年 東京大学大学院農学生命科学研究科にて博士号取得.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 石黒啓一郎・金 智慧・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:石黒啓一郎,金 智慧,渡邊嘉典
DOI: 10.7875/first.author.2015.009
Meikin is a conserved regulator of meiosis-I-specific kinetochore function.
Jihye Kim, Kei-ichiro Ishiguro, Aya Nambu, Bungo Akiyoshi, Shihori Yokobayashi, Ayano Kagami, Tadashi Ishiguro, Alberto M. Pendas, Naoki Takeda, Yogo Sakakibara, Tomoya S. Kitajima, Yuji Tanno, Takeshi Sakuno, Yoshinori Watanabe
Nature, 517, 466-471 (2015)
この論文に出現する遺伝子・タンパク質のUniprot ID
MEIKIN(Q5F2C3), Meikin(Q5F2C3), Polo様キナーゼ(Q07832), セントロメア, Moa1(Q9UTI4), RAD21型コヒーシン(P30776), REC8型コヒーシン(Q8C5S7), REC8(P36626), Spo13(P23624), モノポリン, Mam1(P40065), CENP-C(P49452), Cnp3(Q9USR9), 4930404A10Rik(Q5F2C3), meiosis-specific kinetochore protein(Q5F2C3), Shugoshin, Sgo, Sgo2(Q7TSY8), セパラーゼ(P60330), プロテアーゼ, Mlh1(Q9JK91), Polo様キナーゼ1(Q07832), Plo1(P50528), Cdc5(P32562), Rec8型コヒーシン(Q8C5S7)
要 約
減数分裂における染色体分配の様式は,第1分裂に還元型の染色体分配がある点で,体細胞にみられる均等型の染色体分配とは異なる.減数第1分裂の染色体において特異的にみられる“動原体の一方向性の結合”および“動原体の接着”は,減数分裂における染色体分配の様式の分子機構を理解するための鍵とされてきた.今回,筆者らは,マウスの生殖細胞より減数第1分裂において特異的に発現および局在する新規の動原体タンパク質MEIKINを同定した.ノックアウトマウスの解析から,MEIKINが動原体の一方向性の結合および動原体の接着において重要な役割をはたしていることが明らかにされた.さらに,この機能の多くが,MEIKINと相互作用するPoloキナーゼにより担われていることが明らかにされた.驚くべきことに,MEIKINおよびPoloキナーゼを介する動原体の制御の分子機構は酵母からヒトまで種をこえて保存されていた.MEIKINの発見は,長年にわたり謎につつまれていた減数第1分裂における動原体の制御機構の解明に大きな道筋をあたえた.
はじめに
減数分裂における染色体分配は,減数分裂のまえのS期における1回の複製ののち,減数第1分裂にみられる相同染色体の分配(還元型の染色体分配),および,ひきつづいて起こる姉妹染色分体の分離(均等型の染色体分配)の2回の連続した染色体分配の過程からなる(図1).体細胞分裂と比較した場合,減数分裂では減数第1分裂に還元型の染色体分配のある点が両者の本質的な相違である.
体細胞分裂では姉妹染色分体の動原体がそれぞれ両極から伸びてくるスピンドル微小管により反対方向の位置から捕捉されること(動原体の二方向性の結合)により,姉妹染色分体が反対の方向に均等に分配される.これに対して,減数第1分裂では姉妹染色分体の動原体はあたかもひとつの融合した動原体のようにふるまうことにより一方向から伸びてくるスピンドル微小管により捕捉されるようになり(動原体の一方向性の結合),キアズマにより物理的につながった相同染色体がそれぞれ反対の方向に分配される.さらに,減数第1分裂では姉妹染色分体のセントロメアにおける接着が維持されることにより,動原体どうしが接着したままであることが特徴である.このように,減数第1分裂の染色体において特異的にみられる“動原体の一方向性の結合”および“動原体の接着”の2つの問題を解くことが,減数分裂における染色体分配の様式の本質を理解するための鍵とされてきた.
これら動原体の一方向性の結合および動原体の接着の問題については,すでに酵母を用いた先行研究からいくつかの重要な事実が示されている.筆者らの研究室による分裂酵母を用いた研究から,Moa1とよばれる動原体タンパク質が減数第1分裂におけるスピンドル微小管に対する動原体の一方向性の結合,および,セントロメア中央領域における姉妹染色分体の接着の維持に必要であることが明らかにされている1).分裂酵母のセントロメアは動原体タンパク質が位置する中央領域と外側領域から構成される.通常の体細胞分裂ではセントロメア外側領域において体細胞型のRAD21型コヒーシンにより姉妹染色分体の接着が確立されるのに対し,減数第1分裂ではセントロメア外側領域のみならずセントロメア中央領域においても減数分裂型のREC8型コヒーシンにより姉妹染色分体の接着が確立される(図2).これにより,通常の体細胞分裂では姉妹染色分体の動原体が背中合わせ(back-to-back)の配向をとるのに対し,減数第1分裂ではMoa1とREC8によってセントロメア中央領域における姉妹染色分体の接着が維持されることにより姉妹染色分体の動原体が横並び(side-by-side)の配向を示すものと考えられている2,3).実際に,Moa1に変異を導入した分裂酵母における減数第1分裂では,セントロメア中央領域における姉妹染色分体の接着が解消されると同時に動原体の一方向性の結合が失われるため,還元型の染色体分配ではなく均等型の染色体分配が誘発されてしまう1).同様に,出芽酵母においてもSpo13 4,5),あるいは,モノポリンとよばれる動原体タンパク質複合体の構成サブユニットMam1 6) が,減数第1分裂に特異的な動原体の一方向性の結合やセントロメアにおける姉妹染色分体の接着に関与することが示唆されている.しかしながら,酵母の研究において見い出されていたこれらのタンパク質には互いにアミノ酸配列レベルでの相同性がみられず,また,共通の分子機構が保存されているのかどうかについても議論の余地が残されていた.とりわけ高等動物においては,動原体の接着のみならず動原体の一方向性の結合をも含めた減数分裂に特化した染色体分配の様式を生み出す分子機構の存在が予測されながらも,その実体の解明は長年の懸案とされていた.
今回,筆者らは,マウスを用いた研究から,減数分裂に特異的な新規の動原体タンパク質MEIKINを同定した.さらに,MEIKINと相互作用するPoloキナーゼが減数分裂における動原体の一方向性の結合および動原体の接着を制御することが明らかにされた.この減数分裂における動原体の制御の分子機構は,これまでの研究において混沌としていた分裂酵母および出芽酵母の系においても,本質的には保存されていることが明らかにされた.
1.減数第1分裂に特異的な新規の動原体タンパク質MEIKINの発見
筆者らの研究室における分裂酵母を用いた先行研究において,動原体タンパク質CENP-Cの分裂酵母ホモログCnp3がMoa1と直接的に結合することが見い出されていた7).さらに,Cnp3のC末端側に位置するMif2モチーフおよびCENPCモチーフがMoa1との相互作用に必須であり,CENP-CのC末端側にあるこれらのモチーフは広い種のあいだで保存されていることがわかっていた.そこで,マウスの減数第1分裂においても,同様のタンパク質がCENP-Cとの相互作用により動原体に局在を示すであろうとの仮説のもと,マウスにおけるMoa1に相当するタンパク質の同定を目的として,マウスのCENP-CのC末端側のペプチドをベイトにした酵母ツーハイブリッドスクリーニングにより,マウスの精巣のcDNAライブラリーからCENP-Cと相互作用するタンパク質をしぼり込んだ.その結果,CENP-Cと相互作用を示す候補タンパク質のなかから,精巣および卵巣において特異的にmRNAの発現を示す未解析のタンパク質4930404A10Rikが同定された.このタンパク質に対する抗体を用いた免疫染色から,精母細胞および卵母細胞の減数第1分裂前期のパキテン期から減数第1分裂中期にかけて動原体に局在し,減数第2分裂において消失することが判明した.この減数第1分裂に特異的な新規の動原体タンパク質をMEIKIN(meiosis-specific kinetochore protein)と命名した.MEIKINはヒトを含む脊椎動物において保存されていたが,これまで酵母においてみつかっていた減数分裂の動原体タンパク質とはアミノ酸配列レベルでの相同性がみられず,また,既知のドメインをもたないユニークなタンパク質であった.
2.MEIKINはセントロメアにおける姉妹染色分体の接着の維持に必要である
MEIKINの機能を探るためMeikin遺伝子を欠損したマウスを作製し,その表現型を解析した.Meikinノックアウトマウスは正常に発生し成長したものの,雌雄ともに不妊の表現型を示した.Meikinノックアウトマウスの精母細胞および卵母細胞は減数第1分裂前期から減数第1分裂前中期にかけて野生型マウスと同様にステージを進行し,染色体の軸構造の形成,相同染色体の対合,染色体の凝縮についてはいっけん正常な様相を示した.しかしながら,生細胞イメージングによる詳細な解析から,Meikinノックアウトマウスの卵母細胞では減数第1分裂中期から減数第1分裂後期へと進行したとたんに姉妹染色分体が早期に分離してしまい,その結果,減数第2分裂において染色体が赤道面に整列することなくバラバラになる様相が観察された.これを裏づけるように,減数第1分裂の染色体分配が開始される直前までは野生型マウスおよびMeikinノックアウトマウスにおいて姉妹染色分体のあいだの軸に同じ程度の減数分裂型のREC8型コヒーシンの局在が観察されたものの,減数第2分裂へ進行した時点で,野生型マウスにおいてはセントロメアに姉妹染色分体をつなぎとめるREC8型コヒーシンが残存していたのに対し,Meikinノックアウトマウスにおいてはセントロメアの大部分のREC8型コヒーシンが消失していることが判明した.このことは,MEIKINが減数第1分裂の染色体分配において動原体の接着を維持するのに必須の役割をはたしていることを示唆した.
興味深いことに,Meikinノックアウトマウスにおいてみられた表現型は,筆者らの研究室による先行研究において観察されていた,Shugoshin(Sgo)を欠損したときのようす8,9) ともいっけん似ていた.減数第1分裂の過程において,Sgo2がREC8型コヒーシンをセパラーゼとよばれるプロテアーゼによる分解から保護することによりセントロメアにおける姉妹染色分体の接着が維持されることがわかっている9).実際に,MeikinノックアウトマウスにおいてはSgo2のセントロメアへの局在が低下したという観察から,MEIKINが少なくともSgo2の局在を安定化することによりセントロメアの接着を制御していることが示唆された.
3.MEIKINは動原体の一方向性の結合を促進する
減数第1分裂の染色体分配が開始されるまえの減数第1分裂前中期の卵母細胞および精母細胞において姉妹染色分体の動原体のあいだの距離を測定したところ,Meikinノックアウトマウスでは野生型に比べ有意に離れていることが明らかにされた.このことから,Meikinノックアウトマウスでは動原体の一方向性の結合の性質が欠損している可能性が考えられた.
では,Meikinノックアウトマウスでは減数第1分裂のすべての染色体において体細胞のような均等型の染色体分配が誘発されているのであろうか? 先行研究から,2本の相同染色体をつなぐキアズマがあるとそれらのあいだに張力が発生するため,みかけ,動原体の一方向性の結合の欠損が打ち消されてしまうことが知られている1).そこで,Mlh1ノックアウトマウスを用いた遺伝学的なトリックを駆使し,MEIKINの欠損により動原体が一方向性の結合の性質を部分的に失うことを見い出した(図3).
Mlh1ノックアウトマウス10) では減数分裂組換えの交差型の修復に支障があるため,多くの相同染色体のあいだにキアズマが形成されず染色体が赤道面にうまく整列できない.これは,Mlh1ノックアウトマウスのキアズマをもたない染色体においては動原体の一方向性の結合の性質が残っているため,これらが両側からのスピンドル微小管にとらえられないことによる.ところが驚くべきことに,Mlh1ノックアウトマウスにMEIKINの欠損を導入すると,キアズマをもたない染色体においても赤道面への整列が部分的に回復した.この観察は,Mlh1ノックアウトマウスにおけるMEIKINの欠損により,一方向性の結合の性質を失った動原体がそれぞれ反対の方向から延びてきたスピンドル微小管により捕捉されたことを意味した.
4.MEIKINは減数第1分裂においてPoloキナーゼ1を動原体にリクルートする
MEIKINによりもたらされる動原体の接着の維持および一方向性の結合の分子機構はいったい何であろうか? MEIKINをベイトにした酵母ツーハイブリッド法および精巣のクロマチン画分からのMEIKINの免疫沈降と質量分析法を駆使し,MEIKINと相互作用するタンパク質をスクリーニングした.その結果,Poloキナーゼ1がMEIKINのpoloボックス結合モチーフを介し相互作用することが判明した.野生型マウスの場合,Poloキナーゼ1は減数第1分裂前期のディプロテン期から減数第1分裂後期にかけて動原体に局在すること,さらに,Meikinノックアウトマウスではその局在が大幅に消失することが明らかにされた.
実際に,野生型マウスの減数第1分裂前中期の卵母細胞にPoloキナーゼ1の阻害剤であるBI2536を短時間だけ処理すると,Meikinノックアウトマウスにおいてみられた表現型と同様に,減数第2分裂に進行した時点での染色体の赤道面への整列の異常やセントロメアにおけるREC8型コヒーシンの消失が観察された.このことは,動原体に局在するPoloキナーゼ1が減数第1分裂において動原体の接着を維持するのに重要な役割をはたしていることを示唆した.
さらに,Mlh1ノックアウトマウスの卵母細胞へのPoloキナーゼ1阻害剤の処理により,減数第1分裂前中期の多くの染色体において赤道面への整列が回復すること,さらに,動原体が両方向に引っ張られていることが観察された.これらの事実は,Mlh1とMeikinのダブルノックアウトマウスにおいてみられた表現型と同様に,動原体に局在するPoloキナーゼ1が失活したことにより動原体が一方向性の結合の性質を失ったという考えを支持した.したがって,MEIKINにより動原体にリクルートされるPoloキナーゼ1が,減数第1分裂の染色体分配において動原体の接着の維持および動原体の一方向性の結合に中心的な役割をはたしていると結論された.MEIKINによりリクルートされるPoloキナーゼ1によりリン酸化される基質は何か,また,MEIKINにはPoloキナーゼ1の基質認識の特異性やキナーゼ活性を制御する第3の機構があるのかなど,今後のさらなる分子機構の解明が課題である.
5.MEIKINによる動原体の制御機構は保存されている
この研究において見い出されたMeikinノックアウトマウスの表現型は,先行研究において明らかにされていた分裂酵母Moa1破壊株の表現型と,動原体の接着および一方向性の結合の欠損という点で共通していた.そこで,マウスの減数第1分裂においてみられたMEIKINとPoloキナーゼ1との相互作用の分子機構が,分裂酵母のMoa1においてもあてはまるかどうか検討した.その結果,マウスの場合と同様に,Moa1がPoloキナーゼの分裂酵母ホモログであるPlo1と相互作用していること,また,Moa1のpoloボックス結合モチーフに変異を導入した株ではPlo1が動原体に局在できないことが明らかにされた.さらに,分裂酵母の減数第1分裂において動原体に局在するPlo1だけをピンポイントで欠失させると,還元型の染色体分配ではなく均等型の染色体分配が誘発されることも判明した.したがって,分裂酵母においてもMoa1とPoloキナーゼとの相互作用を介した動原体の接着の維持および一方向性の結合の機構が保存されていることが明らかにされた.
出芽酵母のSpo13についても,そのpoloボックス結合モチーフを介してPoloキナーゼの出芽酵母のホモログであるCdc5と相互作用することが知られていたが,その機能相関においては未知の点が多かった.実際に,分裂酵母Moa1破壊株にCnp3-Spo13融合タンパク質を発現させてSpo13を強制的に動原体に局在させると,減数第1分裂における還元型の染色体分配が大幅に回復した.一方で,poloボックス結合モチーフに変異を導入したCnp3-Spo13融合タンパク質を発現させた場合には,Moa1破壊株における還元型の染色体分配の回復はみられなかった.したがって,出芽酵母においてもSpo13とPoloキナーゼとの相互作用を介した動原体の接着の維持および一方向性の結合の機構が保存されていることが強く示唆された.すなわち,マウスMEIKIN,分裂酵母Moa1,出芽酵母Spo13は,アミノ酸配列レベルでの相同性を示さないものの,Poloキナーゼとの相互作用を介した共通の分子機構により,減数第1分裂において特有の染色体分配の様式が生み出されていると結論された.
おわりに
ヒトの加齢した卵子において高頻度にみられる染色体数の異常が,高齢出産におけるダウン症や流産などの出生の異常と強く相関していることが知られている.また,近年の研究から,加齢にともなう減数分裂型のREC8型コヒーシンの染色体における局在量の減少が,セントロメアにおける姉妹染色分体の接着の破綻およびそののちの染色体分配の不安定性をひき起こす原因のひとつであることが指摘されている.筆者らは,MEIKINがヒトにも保存されていることを見い出しており,その機能欠損が出生の異常や不妊の原因になっている可能性が十分に考えられる.今後,MEIKINに照準をおいた臨床への応用研究が展開され,染色体数の異常に端を発するダウン症や不妊の原因の解明に大いに資することが期待される.
文 献
- Yokobayashi, S. & Watanabe, Y.: The kinetochore protein Moa1 enables cohesion-mediated monopolar attachment at meiosis I. Cell, 123, 803-817 (2005)[PubMed]
- Sakuno, T., Tada, K. & Watanabe, Y.: Kinetochore geometry defined by cohesion within the centromere. Nature, 458, 852-885 (2009)[PubMed]
- Watanabe, Y.: Geometry and force behind kinetochore orientation: lessons from meiosis. Nat. Rev. Mol. Cell Biol., 13, 370-382 (2012)[PubMed]
- Lee, B. H., Kiburz, B. M. & Amon, A.: Spo13 maintains centromeric cohesion and kinetochore coorientation during meiosis I. Curr. Biol., 14, 2168-2182 (2004)[PubMed]
- Katis, V. L. Matos, J., Mori, S. et al.: Spo13 facilitates monopolin recruitment to kinetochores and regulates maintenance of centromeric cohesion during yeast meiosis. Curr. Biol., 14, 2183-2196 (2004)[PubMed]
- Toth, A., Rabitsch, K. P., Galova, M. et al.: Functional genomics identifies monopolin: a kinetochore protein required for segregation of homologs during meiosis I. Cell, 103, 1155-1168 (2000)[PubMed]
- Tanaka, K., Chang, H. L., Kagami, A. et al.: CENP-C functions as a scaffold for effectors with essential kinetochore functions in mitosis and meiosis. Dev. Cell, 17, 334-343 (2009)[PubMed]
- Kitajima, T. S., Kawashima, S. A. & Watanabe, Y.: The conserved kinetochore protein shugoshin protects centromeric cohesion during meiosis. Nature, 427, 510-517 (2004)[PubMed]
- Lee, J., Kitajima, T. S., Tanno, Y. et al.: Unified mode of centromeric protection by shugoshin in mammalian oocytes and somatic cells. Nat. Cell Biol., 10, 42-52 (2008)[PubMed]
- Tachibana-Konwalski, K., Godwin, J., Borsos, M. et al.: Spindle assembly checkpoint of oocytes depends on a kinetochore structure determined by cohesin in meiosis I. Curr. Biol., 23, 2534-2539 (2013)[PubMed]
著者プロフィール
略歴:2000年 東京大学大学院理学系研究科にて博士号取得,同年 米国Dana-Farber Cancer Institute,2005年 東京大学分子細胞生物学研究所を経て,2014年より慶應義塾大学医学部 助教.
金 智慧(Jihye Kim)
2015年 東京大学大学院農学生命科学研究科にて博士号取得.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 石黒啓一郎・金 智慧・渡邊嘉典 Licensed under CC 表示 2.1 日本