ゼブラフィッシュにおいて変異体の表現型とアンチセンスモルフォリノヌクレオチドにより誘発される表現型との相関は低い
眞 昌寛・Nathan D. Lawson
(米国Massachusetts大学Medical School,Department of Molecular, Cell and Cancer Biology)
email:眞 昌寛
DOI: 10.7875/first.author.2015.007
Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish.
Fatma O. Kok, Masahiro Shin, Chih-Wen Ni, Ankit Gupta, Ann S. Grosse, Andreas van Impel, Bettina C. Kirchmaier, Josi Peterson-Maduro, George Kourkoulis, Ira Male, Dana F. DeSantis, Sarah Sheppard-Tindell, Lwaki Ebarasi, Christer Betsholtz, Stefan Schulte-Merker, Scot A. Wolfe, Nathan D. Lawson
Developmental Cell, 32, 97-108 (2015)
近年,ゼブラフィッシュにおいても,ゲノム編集技術を用いた変異体の作製が普及してきた.今回,筆者らは,20以上の遺伝子に対し変異体を作製してその表現型を解析し,ほとんどの変異体は発生の不全をきたさないことを見い出した.さらに,10の遺伝子に対し作製した変異体の表現型は,報告されていたアンチセンスモルフォリノオリゴヌクレオチドにより誘発される形成異常の表現型とは一致しなかった.この相違は,作製した変異体において,母親に由来するRNAがそれらの表現型をレスキューしているためでも,遺伝子の機能が正常に保たれているためでもなかった.同様に,報告されていたアンチセンスモルフォリノオリゴヌクレオチドにより誘発される形成異常の表現型の約80%は,大規模プロジェクトにおいて作製された変異体の表現型とは一致しなかった.これらのことから,筆者らは,ゼブラフィッシュにおける遺伝子の機能解析においては,アンチセンスモルフォリノオリゴヌクレオチドを用いるまえに,変異体を作製してその表現型を解析することを強く推奨したい.
脊椎動物の発生の研究においてゼブラフィッシュは中心的なモデル生物として貢献してきた1).1990年代に行われた大規模な順遺伝学的な手法によるスクリーニングにより,胚の発生に異常をきたす変異体が数多く同定され,これらの研究成果は学術領域をこえて多大なインパクトをあたえた.しかしながら,2000年を過ぎると順遺伝学的な手法を用いた変異体のスクリーングは飽和状態になり,新規の遺伝子が寄与する変異体の同定は困難になった2).同時に,シークエンサーの発達とともにゼブラフィッシュの全ゲノム情報を利用することが可能になり,逆遺伝学的な手法による遺伝子の機能解析の必要性が生じてきた.
モルフォリノオリゴヌクレオチドは六つのリングからなる環状ヘテロ化合物のオリゴマーで,RNAに対し親和性が高く,in vivoでも安定である.また,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果は少ないとされている3).そのため,ゼブラフィッシュの1細胞期の胚にアンチセンスモルフォリノオリゴヌクレオチドを顕微注入することにより,標的となるmRNAの翻訳あるいはスプライシングを阻害することができる.さらには,マイクロRNAの成熟の阻害や標的となる3’側非翻訳領域に対する結合の競合など,遺伝子ノックダウンの幅広いツールとしてゼブラフィッシュにおいてひろく用いられてきた.しかしながら,アンチセンスモルフォリノオリゴヌクレオチドはp53に依存的なアポトーシスを誘導し,オフターゲット効果により細胞種に特異的な遺伝子発現を変化させてしまうことが多く報告されている.アンチセンスモルフォリノオリゴヌクレオチドがどのようにp53の発現を誘導するかについては依然として明らかではない.このように,胚へのアンチセンスモルフォリノオリゴヌクレオチドの導入には少なからずオフターゲット効果がある.
近年,ゼブラフィッシュにおいても,ZFN(zinc finger nuclease)やTALEN(transcription activator-like effector nuclease)など人工ヌクレアーゼを用いたゲノム編集が可能となり4,5),さらに最近では,ゲノム編集はCRISPR/Cas9系によりさらに簡易化し,研究室レベルでも変異体を作製することができるようになった6).筆者らも含め,いくつのも研究室が変異体の作製とその発展に尽力してきたが,今回,筆者らは,20以上の遺伝子に対し変異体を作製し,それらの表現型を解析した.
なお,ゲノム編集技術については,伊川 正人, ゲノム編集がひらく遺伝子改変マウスの未来. 領域融合レビュー, 3, e008, (2014) も参照されたい.
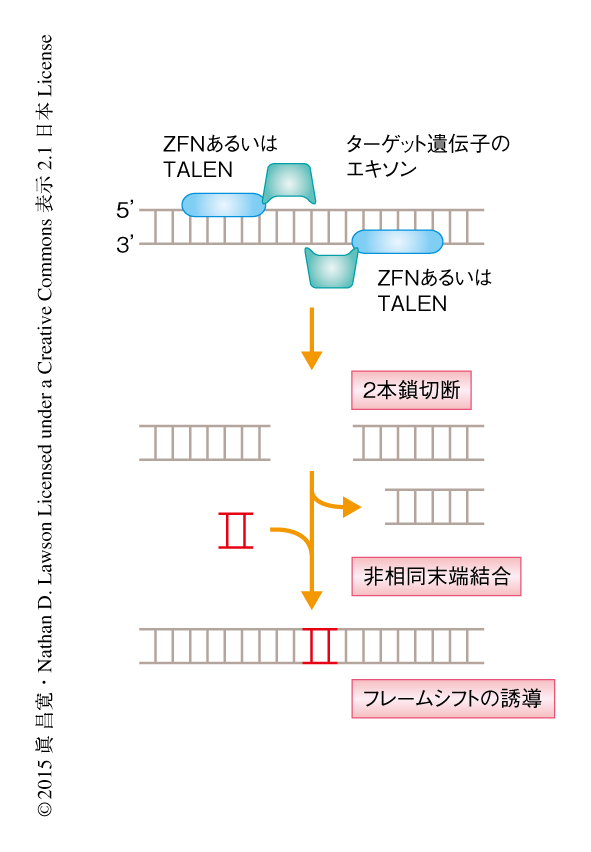
筆者らの目標は,胚期の血管形成にかかわる遺伝子の新規の機能の同定であった.そのため,発生中の血管あるいはリンパ管において強く発現している24の遺伝子について変異体を作製した.そのうち,amot遺伝子,ccbe1遺伝子,elmo1遺伝子,ets1遺伝子,flt4遺伝子,fmnl3遺伝子,gata2a遺伝子,mmp2遺伝子,nrp1a遺伝子,pdgfrb遺伝子の10つについては,アンチセンスモルフォリノオリゴヌクレオチドにより血管あるいはリンパ管の形成異常が誘発されると報告されていた.ccbe1遺伝子およびflt4遺伝子については順遺伝学的な手法による変異体が知られていたため,陽性対照としてくわえた.gata2a遺伝子の変異体は血管形成に異常を示すことがすでに報告されていたが,ZFNを用いた変異体の作製パイプラインによりはじめて得られた変異体であったためくわえた7).変異体の作製にはets1遺伝子を除きZFNあるいはTALENを用い,ets1遺伝子の変異体の作製にはCRISPR/Cas9系を用いた.人工ヌクレアーゼあるいはCas9は標的となる配列の付近を2本鎖切断し非相同末端結合を誘導する.それによりフレームシフトを起こし未熟な終止コドンが出現するので,この変異対立遺伝子から翻訳されたタンパク質はC末端側の領域を欠く機能欠損タンパク質になることが予想される(図1).さらに多くの場合,未熟な終止コドンがナンセンス変異依存性mRNA分解機構(nonsense-mediated mRNA decay:NMD)を誘導しmRNAは分解される.
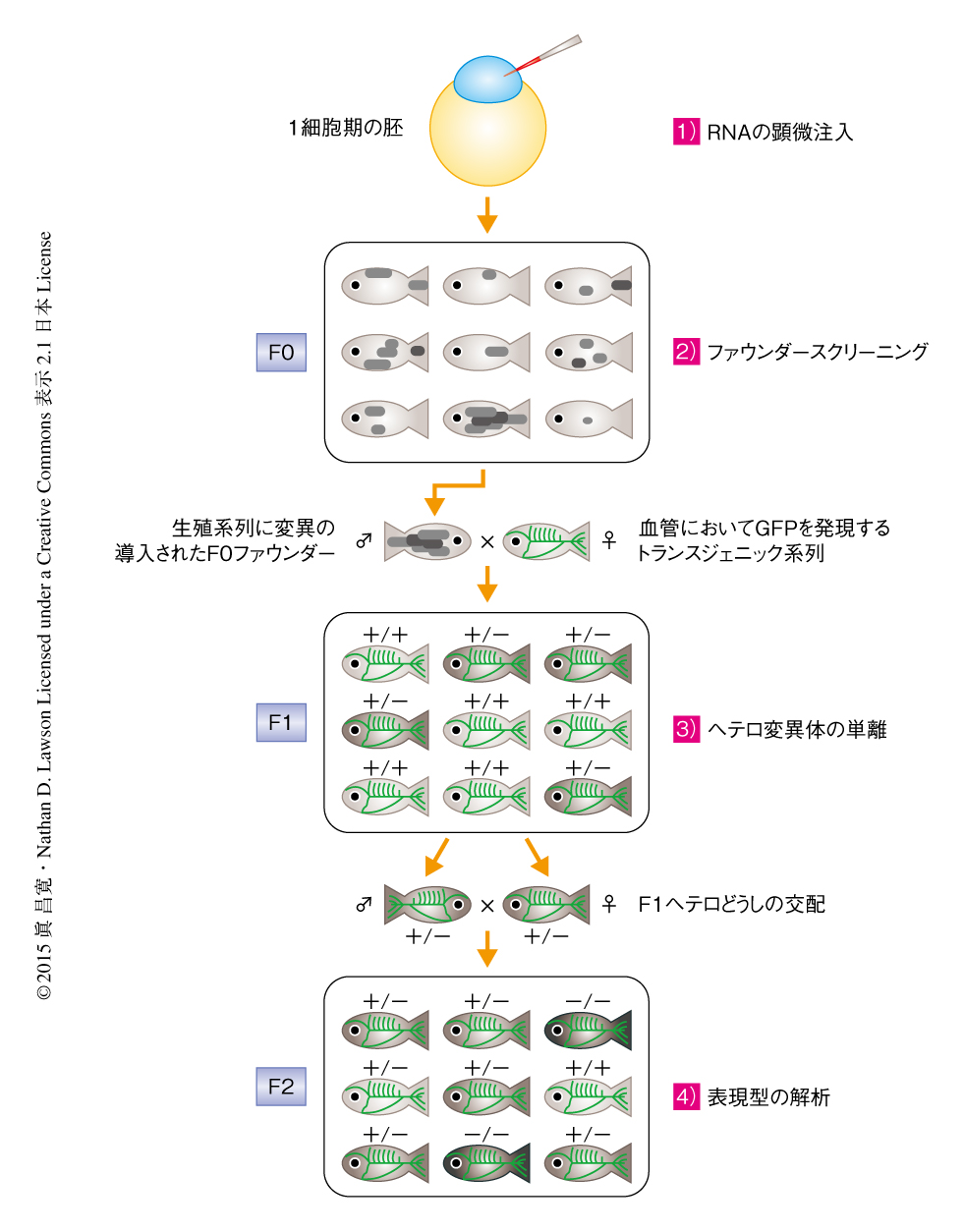
これらの人工ヌクレアーゼをコードするmRNA,あるいは,Cas9をコードするmRNAとsgRNAをゼブラフィッシュの1細胞期の胚に顕微注入し,モザイクに変異の導入されたF0キメラフィッシュを作製した.生殖系列にフレームシフト変異をもつF0をスクリーニングし,血管あるいはリンパ管の形成を可視化できる蛍光タンパク質を発現するトランスジェニック系列と掛け合わせ,ヘテロのF1を得た.表現型の解析は血管およびリンパ管の形成の起こる受精後24時間から受精後5日において,ヘテロのF1どうしを掛け合わせたF2を用いて行った.実体顕微鏡を用いて血管の形成,リンパ管の形成,血流パターン,血流の循環,出血の有無を注意深く観察し,最終的に遺伝子型により判別した(図2).
この表現型の解析により,gata2a遺伝子,ccbe1遺伝子,flt4遺伝子に対する変異体が形成不全を示した.そのうち,ccbe1遺伝子あるいはflt4遺伝子に対する変異体においては,予想どおり,初期のリンパ管の形成が起こらず,のちに主要なリンパ管も形成されなかった.それ以外の遺伝子に対する変異体においては血管の形態や血流は受精後5日まで正常であった.
ゼブラフィッシュの胴部では,体節間動脈が背側大動脈から出芽し,背側の方向に移動して伸張し,受精後30時間までに背側横断吻合血管を形成する.この体節間動脈の形成は血管の新生において重要な遺伝子のスクリーニングにおいて多く用いられている8).arhgef9b遺伝子,kalrnb遺伝子,fgd5a遺伝子,prex2遺伝子に対する変異体の表現型を解析したが,体節間動脈の形成を含む血管の形成に異常はみられなかった.
fmnl3遺伝子あるいはpdgfrb遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは体節間動脈の形成を阻害し,したがって,fmnl3遺伝子およびpdgfrb遺伝子は体節間動脈の形成に必要であると報告されていた.fmnl3あるいはpdgfrb遺伝子に対する変異体を解析したところ,mRNAレベルでの発現がいちじるしく低下しており,fmnl3遺伝子に対する変異体については遺伝子破壊によるエキソンスキップが起こっていなかった.pdgfrb遺伝子に対する変異体ではタンパク質レベルでの発現がなかった.つまり,これらの変異体においては,Fmnl3あるいはPdgfrbの機能がいちじるしく低下しているあるいは失われていることを意味した.にもかかわらず,fmnl3遺伝子あるいはpdgfrb遺伝子に対する変異体は正常な体節間動脈の形成を示した.
flt4遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは頭部静脈の一部の形成,体節間動脈の形成,リンパ管の形成を抑制することが報告されていた.flt4遺伝子に対する変異体においては,頭部静脈およびリンパ管の形成は起こらなかったが,体節間動脈は正常に形成された.
amot遺伝子,elmo1遺伝子,ets1遺伝子についても,アンチセンスモルフォリノオリゴヌクレオチドによる機能の阻害により血管の形成における必要性が報告されていたが,作製された変異体においては血管形成の異常は確認されなかった.ets1遺伝子に対する変異体においては,RT-PCR法により遺伝子破壊に使用されたエキソン3の抜け落ちたcDNAが確認された.このエキソン3はEts1の転写活性に必要な残基を含んでいるため,エキソン3が脱落して翻訳されたEts1の機能はいちじるしく低下していると考えられた.したがって,このets1遺伝子に対する変異体のもつ対立遺伝子は低形質の(hypomorphicな)対立遺伝子である可能性が考えられた.
このほかにも,アンチセンスモルフォリノオリゴヌクレオチドによる機能の阻害からリンパ管の形成への必要性が報告されていたnrp1a遺伝子およびmmp2遺伝子,血球の形成への重要性が報告されていたpik3cg遺伝子およびsmox遺伝子に対する変異体の表現型を解析したが,受精後5日まで正常に発生し成体になるまで生存した.
以上,8つの遺伝子については,作製した変異体の表現型とアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型とが一致しなかった.この矛盾は,ほかの組織器官と比べ血管やリンパ管がアンチセンスモルフォリノオリゴヌクレオチドに対し感受性が高いからというわけではなかった.
fam38a遺伝子は膜タンパク質をコードしており,Fam38Aは感覚性チャネルとしてはたらく.fam38a遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドによりその機能を阻害すると,初期の発生において重篤な発生不全におちいることが報告されていた.また,特殊なアンチセンスモルフォリノオリゴヌクレオチドにより発生の後期においてfam38a遺伝子の機能を阻害すると,尾部の表皮細胞の形成に異常をきたすことが報告されていた9).一方で,別のグループにより,fam38a遺伝子に対する異なるアンチセンスモルフォリノオリゴヌクレオチドを用いてfam38a遺伝子の造血に対する特異的な機能が示され,それ以外のめだった形成不全はないことが報告されていた.このように,同じ遺伝子に対し異なるアンチセンスモルフォリノオリゴヌクレオチドを用いると,ときとして完全に別の表現型を誘発することが知られていた.一方で,作製されたfam38a遺伝子に対する変異体においては,初期の発生不全も後期の尾部表皮の形成不全も起こらなかった.つまり,これまでに報告されたそれらの形成不全は,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果によるものである可能性が高いと思われた.
長鎖ノンコーディングRNAをコードするmegamind遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは後脳において脳水腫を誘発することが報告されていた10).アンチセンスモルフォリノオリゴヌクレオチドの標的となる配列を含むmegamind遺伝子座をすべて欠損した機能欠損型の変異体を作製したところ,脳水腫は生じなかった.さらに,megamind遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドはこの変異体において脳水腫を誘発した.つまり,この脳水腫の表現型はアンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果によることが明確に示された.
アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型が変異体の表現型と一致しない擬陽性はどれだけ普遍的なのだろうか? このことを調べるため,データベースZFIN(Zebrafish Information Network)および大規模プロジェクトZMP(Sanger Zebrafish Mutation Project)の既存のデータセットから,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型の解析がなされている98の遺伝子に対する,変異体の表現型のデータを抽出した.さらに,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型が明らかなものに限定すると24遺伝子になった.この時点で,70%以上の遺伝子に対する変異体がアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と一致しなかった.さらに,母性遺伝子として発現している可能性のある遺伝子を除くと12遺伝子になったが,この場合においても,70%以上の高い頻度で変異体の表現型はアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と一致しなかった.この高い擬陽性の頻度は作製した変異体の結果と類似していた.
ゲノム編集技術の発達によりゼブラフィッシュにおいて逆遺伝学的な手法が可能になり,CRISPR/Cas9系が遺伝子破壊による変異体の作製をより簡便化した.筆者らは,初期の段階から変異体の作製にたずさわり,多大な労力をかけて変異体のコレクションを作製した.これらはフレームシフトによりC末端側の領域の機能ドメインを欠き,ナンセンス変異依存性mRNA分解機構の影響をうけるため,かぎりなく機能欠損型に近い変異体して扱うことができた.しかしながら,そこからみえてきたのは,高い確率で起こるオフターゲット効果による,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型との不一致であった.
アンチセンスモルフォリノオリゴヌクレオチドはその構造から低分子化合物との相互作用は起こりにくいとされている.しかしながら,実際には,RNAとの結合に非依存的なオフターゲット効果について調べた論文はない.さらには,4塩基のミスマッチをもつアンチセンスモルフォリノオリゴヌクレオチドでも標的となるmRNAの機能を効率よく阻害する.このことから,アンチセンスモルフォリノオリゴヌクレオチドが広い範囲でRNAと非特異的に結合し,その非特異的な作用が包括的なRNAの翻訳,スプライシング,マイクロRNAを含む小分子RNAのプロセシングに対し悪影響をあたえている可能性がある.また,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果の代表例として,p53の活性化によるアポトーシスおよび遺伝子発現の変化がある.オフターゲット効果によるp53の活性化はp53遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドを用いることで解消できるが,最近,それでは解消できないp53に非依存的なオフターゲット効果が報告された.このように,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果についてはわからないことが多く,今後,より詳細な研究が望まれる.
アンチセンスモルフォリノオリゴヌクレオチドを用いるうえでのガイドラインでは,変異体の入手が可能であれば,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と変異体の表現型とを比較することが推奨されている11).しかしながら,現在では,CRISPR/Cas9系により容易に変異体を作製することができる.筆者らは,変異体の作製とその評価を優先し,そのつぎに,得られた変異体の表現型と比較してアンチセンスモルフォリノオリゴヌクレオチドの効果を慎重に評価することを強く推奨したい.
略歴:2005年 東京都立大学大学院理学研究科博士課程 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2009年より米国Massachusetts大学Medical School研究員.
研究テーマ:シグナル伝達系と血管およびリンパ管の形成.
Nathan D. Lawson
米国Massachusetts大学Medical SchoolにてProfessor.
研究室URL:http://lawsonlab.umassmed.edu/
© 2015 眞 昌寛・Nathan D. Lawson Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Molecular, Cell and Cancer Biology)
email:眞 昌寛
DOI: 10.7875/first.author.2015.007
Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish.
Fatma O. Kok, Masahiro Shin, Chih-Wen Ni, Ankit Gupta, Ann S. Grosse, Andreas van Impel, Bettina C. Kirchmaier, Josi Peterson-Maduro, George Kourkoulis, Ira Male, Dana F. DeSantis, Sarah Sheppard-Tindell, Lwaki Ebarasi, Christer Betsholtz, Stefan Schulte-Merker, Scot A. Wolfe, Nathan D. Lawson
Developmental Cell, 32, 97-108 (2015)
要 約
近年,ゼブラフィッシュにおいても,ゲノム編集技術を用いた変異体の作製が普及してきた.今回,筆者らは,20以上の遺伝子に対し変異体を作製してその表現型を解析し,ほとんどの変異体は発生の不全をきたさないことを見い出した.さらに,10の遺伝子に対し作製した変異体の表現型は,報告されていたアンチセンスモルフォリノオリゴヌクレオチドにより誘発される形成異常の表現型とは一致しなかった.この相違は,作製した変異体において,母親に由来するRNAがそれらの表現型をレスキューしているためでも,遺伝子の機能が正常に保たれているためでもなかった.同様に,報告されていたアンチセンスモルフォリノオリゴヌクレオチドにより誘発される形成異常の表現型の約80%は,大規模プロジェクトにおいて作製された変異体の表現型とは一致しなかった.これらのことから,筆者らは,ゼブラフィッシュにおける遺伝子の機能解析においては,アンチセンスモルフォリノオリゴヌクレオチドを用いるまえに,変異体を作製してその表現型を解析することを強く推奨したい.
はじめに
脊椎動物の発生の研究においてゼブラフィッシュは中心的なモデル生物として貢献してきた1).1990年代に行われた大規模な順遺伝学的な手法によるスクリーニングにより,胚の発生に異常をきたす変異体が数多く同定され,これらの研究成果は学術領域をこえて多大なインパクトをあたえた.しかしながら,2000年を過ぎると順遺伝学的な手法を用いた変異体のスクリーングは飽和状態になり,新規の遺伝子が寄与する変異体の同定は困難になった2).同時に,シークエンサーの発達とともにゼブラフィッシュの全ゲノム情報を利用することが可能になり,逆遺伝学的な手法による遺伝子の機能解析の必要性が生じてきた.
モルフォリノオリゴヌクレオチドは六つのリングからなる環状ヘテロ化合物のオリゴマーで,RNAに対し親和性が高く,in vivoでも安定である.また,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果は少ないとされている3).そのため,ゼブラフィッシュの1細胞期の胚にアンチセンスモルフォリノオリゴヌクレオチドを顕微注入することにより,標的となるmRNAの翻訳あるいはスプライシングを阻害することができる.さらには,マイクロRNAの成熟の阻害や標的となる3’側非翻訳領域に対する結合の競合など,遺伝子ノックダウンの幅広いツールとしてゼブラフィッシュにおいてひろく用いられてきた.しかしながら,アンチセンスモルフォリノオリゴヌクレオチドはp53に依存的なアポトーシスを誘導し,オフターゲット効果により細胞種に特異的な遺伝子発現を変化させてしまうことが多く報告されている.アンチセンスモルフォリノオリゴヌクレオチドがどのようにp53の発現を誘導するかについては依然として明らかではない.このように,胚へのアンチセンスモルフォリノオリゴヌクレオチドの導入には少なからずオフターゲット効果がある.
近年,ゼブラフィッシュにおいても,ZFN(zinc finger nuclease)やTALEN(transcription activator-like effector nuclease)など人工ヌクレアーゼを用いたゲノム編集が可能となり4,5),さらに最近では,ゲノム編集はCRISPR/Cas9系によりさらに簡易化し,研究室レベルでも変異体を作製することができるようになった6).筆者らも含め,いくつのも研究室が変異体の作製とその発展に尽力してきたが,今回,筆者らは,20以上の遺伝子に対し変異体を作製し,それらの表現型を解析した.
なお,ゲノム編集技術については,伊川 正人, ゲノム編集がひらく遺伝子改変マウスの未来. 領域融合レビュー, 3, e008, (2014) も参照されたい.
1.変異体の作製および表現型の解析
筆者らの目標は,胚期の血管形成にかかわる遺伝子の新規の機能の同定であった.そのため,発生中の血管あるいはリンパ管において強く発現している24の遺伝子について変異体を作製した.そのうち,amot遺伝子,ccbe1遺伝子,elmo1遺伝子,ets1遺伝子,flt4遺伝子,fmnl3遺伝子,gata2a遺伝子,mmp2遺伝子,nrp1a遺伝子,pdgfrb遺伝子の10つについては,アンチセンスモルフォリノオリゴヌクレオチドにより血管あるいはリンパ管の形成異常が誘発されると報告されていた.ccbe1遺伝子およびflt4遺伝子については順遺伝学的な手法による変異体が知られていたため,陽性対照としてくわえた.gata2a遺伝子の変異体は血管形成に異常を示すことがすでに報告されていたが,ZFNを用いた変異体の作製パイプラインによりはじめて得られた変異体であったためくわえた7).変異体の作製にはets1遺伝子を除きZFNあるいはTALENを用い,ets1遺伝子の変異体の作製にはCRISPR/Cas9系を用いた.人工ヌクレアーゼあるいはCas9は標的となる配列の付近を2本鎖切断し非相同末端結合を誘導する.それによりフレームシフトを起こし未熟な終止コドンが出現するので,この変異対立遺伝子から翻訳されたタンパク質はC末端側の領域を欠く機能欠損タンパク質になることが予想される(図1).さらに多くの場合,未熟な終止コドンがナンセンス変異依存性mRNA分解機構(nonsense-mediated mRNA decay:NMD)を誘導しmRNAは分解される.
これらの人工ヌクレアーゼをコードするmRNA,あるいは,Cas9をコードするmRNAとsgRNAをゼブラフィッシュの1細胞期の胚に顕微注入し,モザイクに変異の導入されたF0キメラフィッシュを作製した.生殖系列にフレームシフト変異をもつF0をスクリーニングし,血管あるいはリンパ管の形成を可視化できる蛍光タンパク質を発現するトランスジェニック系列と掛け合わせ,ヘテロのF1を得た.表現型の解析は血管およびリンパ管の形成の起こる受精後24時間から受精後5日において,ヘテロのF1どうしを掛け合わせたF2を用いて行った.実体顕微鏡を用いて血管の形成,リンパ管の形成,血流パターン,血流の循環,出血の有無を注意深く観察し,最終的に遺伝子型により判別した(図2).
2.作製した変異体の表現型はアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型とは一致しない
この表現型の解析により,gata2a遺伝子,ccbe1遺伝子,flt4遺伝子に対する変異体が形成不全を示した.そのうち,ccbe1遺伝子あるいはflt4遺伝子に対する変異体においては,予想どおり,初期のリンパ管の形成が起こらず,のちに主要なリンパ管も形成されなかった.それ以外の遺伝子に対する変異体においては血管の形態や血流は受精後5日まで正常であった.
ゼブラフィッシュの胴部では,体節間動脈が背側大動脈から出芽し,背側の方向に移動して伸張し,受精後30時間までに背側横断吻合血管を形成する.この体節間動脈の形成は血管の新生において重要な遺伝子のスクリーニングにおいて多く用いられている8).arhgef9b遺伝子,kalrnb遺伝子,fgd5a遺伝子,prex2遺伝子に対する変異体の表現型を解析したが,体節間動脈の形成を含む血管の形成に異常はみられなかった.
fmnl3遺伝子あるいはpdgfrb遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは体節間動脈の形成を阻害し,したがって,fmnl3遺伝子およびpdgfrb遺伝子は体節間動脈の形成に必要であると報告されていた.fmnl3あるいはpdgfrb遺伝子に対する変異体を解析したところ,mRNAレベルでの発現がいちじるしく低下しており,fmnl3遺伝子に対する変異体については遺伝子破壊によるエキソンスキップが起こっていなかった.pdgfrb遺伝子に対する変異体ではタンパク質レベルでの発現がなかった.つまり,これらの変異体においては,Fmnl3あるいはPdgfrbの機能がいちじるしく低下しているあるいは失われていることを意味した.にもかかわらず,fmnl3遺伝子あるいはpdgfrb遺伝子に対する変異体は正常な体節間動脈の形成を示した.
flt4遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは頭部静脈の一部の形成,体節間動脈の形成,リンパ管の形成を抑制することが報告されていた.flt4遺伝子に対する変異体においては,頭部静脈およびリンパ管の形成は起こらなかったが,体節間動脈は正常に形成された.
amot遺伝子,elmo1遺伝子,ets1遺伝子についても,アンチセンスモルフォリノオリゴヌクレオチドによる機能の阻害により血管の形成における必要性が報告されていたが,作製された変異体においては血管形成の異常は確認されなかった.ets1遺伝子に対する変異体においては,RT-PCR法により遺伝子破壊に使用されたエキソン3の抜け落ちたcDNAが確認された.このエキソン3はEts1の転写活性に必要な残基を含んでいるため,エキソン3が脱落して翻訳されたEts1の機能はいちじるしく低下していると考えられた.したがって,このets1遺伝子に対する変異体のもつ対立遺伝子は低形質の(hypomorphicな)対立遺伝子である可能性が考えられた.
このほかにも,アンチセンスモルフォリノオリゴヌクレオチドによる機能の阻害からリンパ管の形成への必要性が報告されていたnrp1a遺伝子およびmmp2遺伝子,血球の形成への重要性が報告されていたpik3cg遺伝子およびsmox遺伝子に対する変異体の表現型を解析したが,受精後5日まで正常に発生し成体になるまで生存した.
以上,8つの遺伝子については,作製した変異体の表現型とアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型とが一致しなかった.この矛盾は,ほかの組織器官と比べ血管やリンパ管がアンチセンスモルフォリノオリゴヌクレオチドに対し感受性が高いからというわけではなかった.
fam38a遺伝子は膜タンパク質をコードしており,Fam38Aは感覚性チャネルとしてはたらく.fam38a遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドによりその機能を阻害すると,初期の発生において重篤な発生不全におちいることが報告されていた.また,特殊なアンチセンスモルフォリノオリゴヌクレオチドにより発生の後期においてfam38a遺伝子の機能を阻害すると,尾部の表皮細胞の形成に異常をきたすことが報告されていた9).一方で,別のグループにより,fam38a遺伝子に対する異なるアンチセンスモルフォリノオリゴヌクレオチドを用いてfam38a遺伝子の造血に対する特異的な機能が示され,それ以外のめだった形成不全はないことが報告されていた.このように,同じ遺伝子に対し異なるアンチセンスモルフォリノオリゴヌクレオチドを用いると,ときとして完全に別の表現型を誘発することが知られていた.一方で,作製されたfam38a遺伝子に対する変異体においては,初期の発生不全も後期の尾部表皮の形成不全も起こらなかった.つまり,これまでに報告されたそれらの形成不全は,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果によるものである可能性が高いと思われた.
長鎖ノンコーディングRNAをコードするmegamind遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドは後脳において脳水腫を誘発することが報告されていた10).アンチセンスモルフォリノオリゴヌクレオチドの標的となる配列を含むmegamind遺伝子座をすべて欠損した機能欠損型の変異体を作製したところ,脳水腫は生じなかった.さらに,megamind遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドはこの変異体において脳水腫を誘発した.つまり,この脳水腫の表現型はアンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果によることが明確に示された.
3.アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果は表現型の擬陽性の頻度を高くする
アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型が変異体の表現型と一致しない擬陽性はどれだけ普遍的なのだろうか? このことを調べるため,データベースZFIN(Zebrafish Information Network)および大規模プロジェクトZMP(Sanger Zebrafish Mutation Project)の既存のデータセットから,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型の解析がなされている98の遺伝子に対する,変異体の表現型のデータを抽出した.さらに,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型が明らかなものに限定すると24遺伝子になった.この時点で,70%以上の遺伝子に対する変異体がアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と一致しなかった.さらに,母性遺伝子として発現している可能性のある遺伝子を除くと12遺伝子になったが,この場合においても,70%以上の高い頻度で変異体の表現型はアンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と一致しなかった.この高い擬陽性の頻度は作製した変異体の結果と類似していた.
おわりに
ゲノム編集技術の発達によりゼブラフィッシュにおいて逆遺伝学的な手法が可能になり,CRISPR/Cas9系が遺伝子破壊による変異体の作製をより簡便化した.筆者らは,初期の段階から変異体の作製にたずさわり,多大な労力をかけて変異体のコレクションを作製した.これらはフレームシフトによりC末端側の領域の機能ドメインを欠き,ナンセンス変異依存性mRNA分解機構の影響をうけるため,かぎりなく機能欠損型に近い変異体して扱うことができた.しかしながら,そこからみえてきたのは,高い確率で起こるオフターゲット効果による,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型との不一致であった.
アンチセンスモルフォリノオリゴヌクレオチドはその構造から低分子化合物との相互作用は起こりにくいとされている.しかしながら,実際には,RNAとの結合に非依存的なオフターゲット効果について調べた論文はない.さらには,4塩基のミスマッチをもつアンチセンスモルフォリノオリゴヌクレオチドでも標的となるmRNAの機能を効率よく阻害する.このことから,アンチセンスモルフォリノオリゴヌクレオチドが広い範囲でRNAと非特異的に結合し,その非特異的な作用が包括的なRNAの翻訳,スプライシング,マイクロRNAを含む小分子RNAのプロセシングに対し悪影響をあたえている可能性がある.また,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果の代表例として,p53の活性化によるアポトーシスおよび遺伝子発現の変化がある.オフターゲット効果によるp53の活性化はp53遺伝子に対するアンチセンスモルフォリノオリゴヌクレオチドを用いることで解消できるが,最近,それでは解消できないp53に非依存的なオフターゲット効果が報告された.このように,アンチセンスモルフォリノオリゴヌクレオチドのオフターゲット効果についてはわからないことが多く,今後,より詳細な研究が望まれる.
アンチセンスモルフォリノオリゴヌクレオチドを用いるうえでのガイドラインでは,変異体の入手が可能であれば,アンチセンスモルフォリノオリゴヌクレオチドにより誘発される表現型と変異体の表現型とを比較することが推奨されている11).しかしながら,現在では,CRISPR/Cas9系により容易に変異体を作製することができる.筆者らは,変異体の作製とその評価を優先し,そのつぎに,得られた変異体の表現型と比較してアンチセンスモルフォリノオリゴヌクレオチドの効果を慎重に評価することを強く推奨したい.
文 献
- Haffter, P., Granato, M., Brand, M. et al.: The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development, 123, 1-36 (1996)[PubMed]
- Lawson, N. D. & Wolfe, S. A.: Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev. Cell, 21, 48-64 (2011)[PubMed]
- Summerton, J. & Weller, D.: Morpholino antisense oligomers: design, preparation, and properties. Antisense Nucleic Acid Drug Dev., 7, 187-195 (1997)[PubMed]
- Meng, X., Noyes, M. B., Zhu, L. J. et al.: Targeted gene inactivation in zebrafish using engineered zinc-finger nucleases. Nat. Biotechnol., 26, 695-701 (2008)[PubMed]
- Cade, L., Reyon, D., Hwang, W. Y. et al.: Highly efficient generation of heritable zebrafish gene mutations using homo- and heterodimeric TALENs. Nucleic Acids Res., 40, 8001-8010 (2012)[PubMed]
- Hwang, W. Y., Fu, Y., Reyon, D. et al.: Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat. Biotechnol., 31, 227-229 (2013)[PubMed]
- Zhu, C., Smith, T., McNulty, J. et al.: Evaluation and application of modularly assembled zinc-finger nucleases in zebrafish. Development, 138, 4555-4564 (2011)[PubMed]
- Covassin, L. D., Siekmann, A. F., Kacergis, M. C. et al.: A genetic screen for vascular mutants in zebrafish reveals dynamic roles for Vegf/Plcg1 signaling during artery development. Dev. Biol., 329, 212-226 (2009)[PubMed]
- Eisenhoffer, G. T., Loftus, P. D., Yoshigi, M. et al.: Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia. Nature, 484, 546-549 (2012)[PubMed]
- Ulitsky, I., Shkumatava, A., Jan, C. H. et al.: Conserved function of lincRNAs in vertebrate embryonic development despite rapid sequence evolution. Cell, 147, 1537-1550 (2011)[PubMed]
- Eisen, J. S. & Smith, J. C.: Controlling morpholino experiments: don’t stop making antisense. Development, 135, 1735-1743 (2008)[PubMed]
著者プロフィール
略歴:2005年 東京都立大学大学院理学研究科博士課程 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2009年より米国Massachusetts大学Medical School研究員.
研究テーマ:シグナル伝達系と血管およびリンパ管の形成.
Nathan D. Lawson
米国Massachusetts大学Medical SchoolにてProfessor.
研究室URL:http://lawsonlab.umassmed.edu/
© 2015 眞 昌寛・Nathan D. Lawson Licensed under CC 表示 2.1 日本