インターロイキン10を産生するプラズマブラストは自己免疫疾患における炎症反応を抑制する
松本真典・黒崎知博・馬場義裕
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:松本真典
DOI: 10.7875/first.author.2014.157
Interleukin-10-producing plasmablasts exert regulatory function in autoimmune inflammation.
Masanori Matsumoto, Akemi Baba, Takafumi Yokota, Hiroyoshi Nishikawa, Yasuyuki Ohkawa, Hisako Kayama, Axel Kallies, Stephen L. Nutt, Shimon Sakaguchi, Kiyoshi Takeda, Tomohiro Kurosaki, Yoshihiro Baba
Immunity, 41, 1040-1051 (2014)
これまで,B細胞は抗体の産生や抗原の提示などを介して免疫反応を正に制御することが知られていたが,近年,抑制性サイトカインであるインターロイキン10を分泌して自己免疫疾患における炎症反応を負に制御するB細胞も存在することが明らかにされた.しかし,このインターロイキン10を産生するB細胞がどのB細胞の集団に分類され,どのような分子機構を介して自己免疫疾患を抑制しているのかは不明であった.そこで,筆者らは,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,所属リンパ節に局在するプラズマブラストがインターロイキン10を産生する主要なB細胞であること,および,プラズマブラストを欠損したマウスでは脳脊髄炎の悪化が観察されることを明らかにした.また,このプラズマブラストが産生するインターロイキン10は樹状細胞のもつサイトカイン産生能を阻害するだけでなく,脳脊髄炎の悪化をひき起こすT細胞の分化も抑制していた.以上の結果から,プラズマブラストはインターロイキン10を産生して樹状細胞の機能を阻害することにより脳脊髄炎を抑制していることが示唆された.実際に,マウスだけでなくヒトのB細胞においても,プラズマブラストはインターロイキン10を産生する主要なB細胞であったことから,プラズマブラストは多発性硬化症の病因および病態の抑制において重要な役割をはたしている可能性が示唆された.
B細胞は抗体の産生や抗原の提示により細菌やウイルスなどの病原体から身を守る役割をはたしているが,近年,B細胞のなかには抑制性サイトカインであるインターロイキン10を産生して自己免疫疾患を抑制するものも存在することが明らかにされた.これらインターロイキン10を産生するB細胞は制御性B細胞とよばれ1,2),炎症性腸疾患,関節リウマチ,多発性硬化症などの自己免疫疾患のマウス実験モデルにおいて炎症反応を抑制することが明らかにされている3-5).これまで,制御性B細胞としていくつかのB細胞の集団が報告されているが,とりわけ,脾臓に存在するCD1d高発現CD5陽性B細胞はマウスに投与するとさまざまな自己免疫疾患を抑制すること,および,in vitroにおいて刺激するとインターロイキン10を産生することから,現在のところ,このCD1d高発現CD5陽性B細胞が主要な制御性B細胞であると考えられている6).しかしながら,実際に,どのB細胞の集団がin vivoにおいてインターロイキン10を産生し,どのような分子機構を介して自己免疫疾患を抑制しているかは不明であった.この論文では,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,プラズマブラストとよばれるB細胞の集団がインターロイキン10を特異的に産生し樹状細胞の機能を阻害することにより脳脊髄炎の悪化を抑制していることを明らかにした.
多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,in vivoにおいてインターロイキン10を産生するB細胞はどのB細胞の集団であるか検討した.髄鞘構成タンパク質として知られるミエリンオリゴデンドロサイト糖タンパク質のペプチドをアジュバントとともにインターロイキン10レポーターマウスへ皮下注射して脳脊髄炎を誘発させたところ,脾臓に存在するCD1d高発現CD5陽性B細胞ではなく,所属リンパ節に存在するCD138陽性細胞がインターロイキン10を産生する主要なB細胞であることが見い出された.このCD138陽性細胞は転写因子Blimp1を低レベルで発現していたことから,プラズマブラストとよばれるB細胞の集団であることが明らかになった.また,B細胞がプラズマブラストへ分化するためにはBlimp1の発現が必須であることから,プラズマブラストが脳脊髄炎の悪化を抑制するかどうか検討するため,B細胞において特異的にBlimp1を欠損するマウスを作製して脳脊髄炎を誘発させた.その結果,このプラズマブラストを欠損するB細胞に特異的なBlimp1ノックアウトマウスには有意に脳脊髄炎の悪化が観察された.以上の結果から,所属リンパ節に存在するプラズマブラストはインターロイキン10を産生する制御性B細胞として脳脊髄炎の悪化を抑制していることが示唆された.
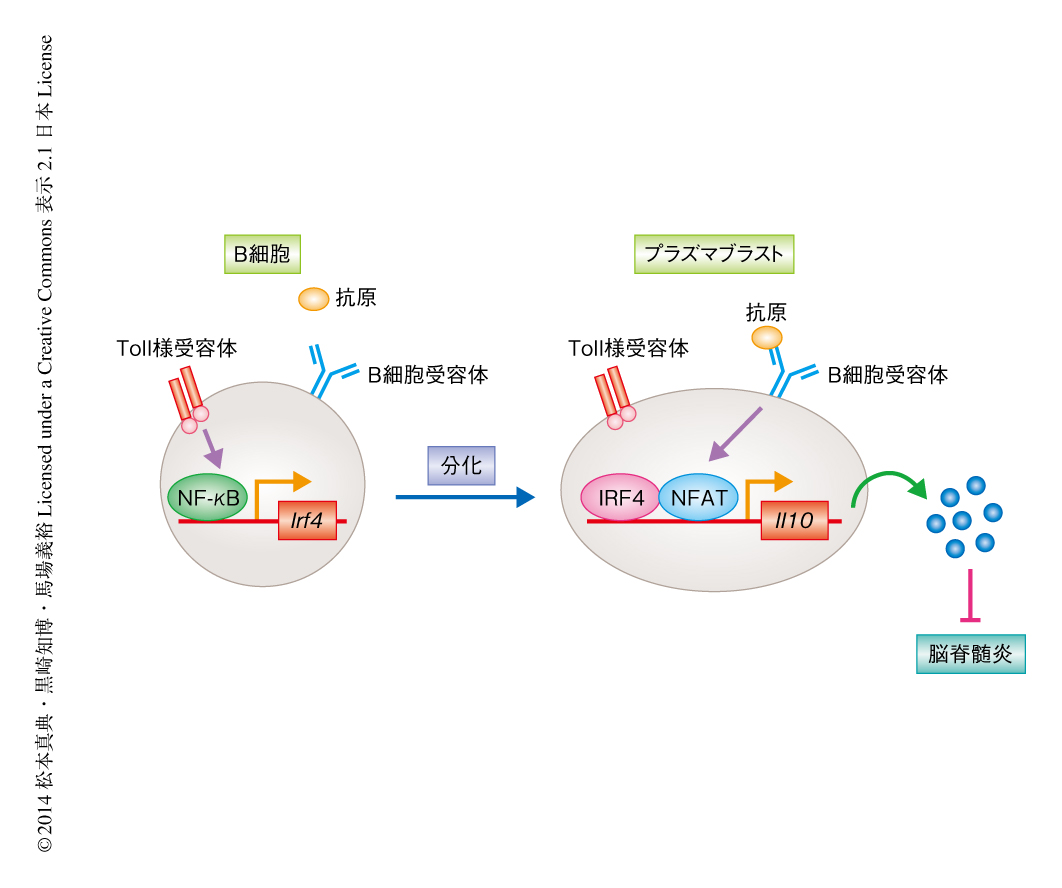
プラズマブラストがどのような分子機構を介して脳脊髄炎の悪化を抑制しているかを解明するため,脳脊髄炎を誘発させたマウスの所属リンパ節におけるプラズマブラストの局在を免疫組織染色法により検討した.その結果,プラズマブラストはB細胞濾胞とT細胞領域の境界部位において,おもに樹状細胞と共局在していた.そこで,プラズマブラストが産生するインターロイキン10が樹状細胞の機能を阻害するかどうか検討するため,野生型のプラズマブラストの培養上清およびインターロイキン10を欠損したプラズマブラストの培養上清のもとで,樹状細胞の産生するサイトカインの量を測定した.野生型プラズマブラストの培養上清のもとでは,インターロイキン10を欠損したプラズマブラストの培養上清のもととは異なり,樹状細胞によるインターロイキン6やインターロイキン12aなど炎症性サイトカインの産生が低下していた.実際に,ミエリンオリゴデンドロサイト糖タンパク質に特異的なT細胞受容体を発現するナイーブT細胞と樹状細胞をプラズマブラストの培養上清のもと共培養すると,野生型プラズマブラストの培養上清のもとでのみエフェクターT細胞への分化が阻害された.これらの結果から,プラズマブラストはインターロイキン10の産生を介して樹状細胞の機能を阻害することにより,脳脊髄炎の悪化をひき起こすエフェクターT細胞への分化を抑制していることが強く示唆された(図1).
これまで,筆者らは,Toll様受容体を刺激したB細胞においてB細胞受容体を刺激すると多量のインターロイキン10が産生されること,および,このインターロイキン10の産生にはB細胞受容体を刺激したのち転写因子NFATのCa2+に依存的な活性化が必須であることを報告してきた7).しかしながら,ナイーブB細胞においてB細胞受容体を刺激した際にはNFATが活性化されるにもかかわらずインターロイキン10の産生は検出されないことから,これらの結果は,Toll様受容体からのシグナルがインターロイキン10の産生に必須であることを示していた.そこで,Toll様受容体からのどのようなシグナルがインターロイキン10の産生に必須であるかを明らかにするため,Blimp1レポーターマウスから単離したB細胞においてToll様受容体を刺激し,Blimp1陽性細胞によるインターロイキン10の産生について検討したところ,Blimp1陽性のB細胞のみがB細胞受容体を刺激したのちインターロイキン10を産生することが見い出された.つづいて,Blimp1を欠損したB細胞においてインターロイキン10の産生能が低下しているかどうか検討したが,対照となる細胞と同様に多量のインターロイキン10を産生したことからBlimp1はインターロイキン10の産生には必須ではないことが示唆された.このBlimp1を欠損したB細胞はプラズマ細胞へと分化することはできないが,その初期の分化は誘導されることが報告されている8).そこで,このプラズマ細胞の初期の分化にかかわる転写因子IRF4がインターロイキン10の産生に必須かどうか検討した.IRF4ノックアウトマウスから単離したB細胞においてインターロイキン10の産生能について検討したところ,B細胞受容体を刺激したのちにもインターロイキン10の産生はほとんど観察されなかった.また,B細胞において特異的にIRF4を欠損したマウスにおいても脳脊髄炎の悪化が観察されたことから,Toll様受容体を刺激されたB細胞はIRF4を発現してプラズマブラストへと分化し,そののち,B細胞受容体の刺激に依存的なNFATの活性化を介してインターロイキン10を産生することにより脳脊髄炎を抑制していることが示唆された(図2).
マウスだけでなく,ヒトのB細胞においてもプラズマブラストがインターロイキン10を産生する主要なB細胞であるかどうか検討した.ヒトのB細胞をToll様受容体のひとつTLR9のリガンドであるCpG,および,インターフェロンα,インターロイキン2,インターロイキン6など各種のサイトカインにより刺激すると,プラズマブラストへの分化が誘導されることが報告されていた9,10).健常人の末梢血から単離したB細胞をin vitroにおいてCpGおよびサイトカインにより刺激したところ,CD27弱陽性およびCD27強陽性の2種類のプラズマブラストへの分化が誘導された.興味深いことに,このうちCD27弱陽性のプラズマブラストのみがインターロイキン10の産生能をもっていた.そこで,なぜ,CD27弱陽性のプラズマブラストのみがインターロイキン10を産生するかについて検討した.末梢血のB細胞はおもに,ナイーブ成熟B細胞,ナイーブ未成熟B細胞,メモリーB細胞の3つの異なるB細胞の集団から構成されている.末梢血からこれらB細胞の集団を単離したのちプラズマブラストへの分化を誘導したところ,メモリーB細胞はおもにCD27強陽性のプラズマブラストへと分化したが,ナイーブ成熟B細胞およびナイーブ未成熟B細胞はインターロイキン10を産生するCD27弱陽性のプラズマブラストへと分化した.以上の結果から,ヒトにおいてもプラズマブラストがインターロイキン10を産生する制御性B細胞として多発性硬化症の抑制に重要な役割をはたしている可能性が示唆された.
これまで,自己免疫疾患を抑制する制御性B細胞の存在が報告されていたが,そのB細胞の集団の正体は不明であった.筆者らは,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いた解析から,プラズマブラストが脳脊髄炎を抑制するインターロイキン10を産生するB細胞として機能しているだけでなく,ヒトにおいてもプラズマブラストがインターロイキン10を産生する主要なB細胞であることを見い出した.しかしながら,これら発見は制御性B細胞の役割の一端を明らかにしたにすぎず,多くの課題が残されている.たとえば,これまで,脾臓のCD1d高発現CD5陽性B細胞はインターロイキン10を産生しないにもかかわらずマウスへ移入すると脳脊髄炎を抑制することが報告されているが6),なぜ,このB細胞の集団は脳脊髄炎を抑制できるのか? また,インターロイキン10を産生するプラズマブラストをマウスへ移入すると脳脊髄炎の悪化が抑制されるのか? さらには,ヒトのプラズマブラストによるインターロイキン10の産生能の低下は多発性硬化症の病因や病態に関与しうるのか? これら疑問の解決は,制御性B細胞を介した自己免疫疾患に対する新たな治療法の開発につながる重要な研究課題であることから,今後の研究の進展が期待される.
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同年 大阪大学免疫学フロンティア研究センター 特任研究員を経て,2012年より同 特任助教.
研究テーマ:自己免疫疾患を抑制する制御性B細胞による抑制の分子機構.
黒崎 知博(Tomohiro Kurosaki)
大阪大学免疫学フロンティア研究センター 特任教授.
馬場 義裕(Yoshihiro Baba)
大阪大学免疫学フロンティア研究センター 特任准教授.
© 2014 松本真典・黒崎知博・馬場義裕 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:松本真典
DOI: 10.7875/first.author.2014.157
Interleukin-10-producing plasmablasts exert regulatory function in autoimmune inflammation.
Masanori Matsumoto, Akemi Baba, Takafumi Yokota, Hiroyoshi Nishikawa, Yasuyuki Ohkawa, Hisako Kayama, Axel Kallies, Stephen L. Nutt, Shimon Sakaguchi, Kiyoshi Takeda, Tomohiro Kurosaki, Yoshihiro Baba
Immunity, 41, 1040-1051 (2014)
要 約
これまで,B細胞は抗体の産生や抗原の提示などを介して免疫反応を正に制御することが知られていたが,近年,抑制性サイトカインであるインターロイキン10を分泌して自己免疫疾患における炎症反応を負に制御するB細胞も存在することが明らかにされた.しかし,このインターロイキン10を産生するB細胞がどのB細胞の集団に分類され,どのような分子機構を介して自己免疫疾患を抑制しているのかは不明であった.そこで,筆者らは,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,所属リンパ節に局在するプラズマブラストがインターロイキン10を産生する主要なB細胞であること,および,プラズマブラストを欠損したマウスでは脳脊髄炎の悪化が観察されることを明らかにした.また,このプラズマブラストが産生するインターロイキン10は樹状細胞のもつサイトカイン産生能を阻害するだけでなく,脳脊髄炎の悪化をひき起こすT細胞の分化も抑制していた.以上の結果から,プラズマブラストはインターロイキン10を産生して樹状細胞の機能を阻害することにより脳脊髄炎を抑制していることが示唆された.実際に,マウスだけでなくヒトのB細胞においても,プラズマブラストはインターロイキン10を産生する主要なB細胞であったことから,プラズマブラストは多発性硬化症の病因および病態の抑制において重要な役割をはたしている可能性が示唆された.
はじめに
B細胞は抗体の産生や抗原の提示により細菌やウイルスなどの病原体から身を守る役割をはたしているが,近年,B細胞のなかには抑制性サイトカインであるインターロイキン10を産生して自己免疫疾患を抑制するものも存在することが明らかにされた.これらインターロイキン10を産生するB細胞は制御性B細胞とよばれ1,2),炎症性腸疾患,関節リウマチ,多発性硬化症などの自己免疫疾患のマウス実験モデルにおいて炎症反応を抑制することが明らかにされている3-5).これまで,制御性B細胞としていくつかのB細胞の集団が報告されているが,とりわけ,脾臓に存在するCD1d高発現CD5陽性B細胞はマウスに投与するとさまざまな自己免疫疾患を抑制すること,および,in vitroにおいて刺激するとインターロイキン10を産生することから,現在のところ,このCD1d高発現CD5陽性B細胞が主要な制御性B細胞であると考えられている6).しかしながら,実際に,どのB細胞の集団がin vivoにおいてインターロイキン10を産生し,どのような分子機構を介して自己免疫疾患を抑制しているかは不明であった.この論文では,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,プラズマブラストとよばれるB細胞の集団がインターロイキン10を特異的に産生し樹状細胞の機能を阻害することにより脳脊髄炎の悪化を抑制していることを明らかにした.
1.プラズマブラストにより産生されるインターロイキン10は脳脊髄炎を抑制する
多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて,in vivoにおいてインターロイキン10を産生するB細胞はどのB細胞の集団であるか検討した.髄鞘構成タンパク質として知られるミエリンオリゴデンドロサイト糖タンパク質のペプチドをアジュバントとともにインターロイキン10レポーターマウスへ皮下注射して脳脊髄炎を誘発させたところ,脾臓に存在するCD1d高発現CD5陽性B細胞ではなく,所属リンパ節に存在するCD138陽性細胞がインターロイキン10を産生する主要なB細胞であることが見い出された.このCD138陽性細胞は転写因子Blimp1を低レベルで発現していたことから,プラズマブラストとよばれるB細胞の集団であることが明らかになった.また,B細胞がプラズマブラストへ分化するためにはBlimp1の発現が必須であることから,プラズマブラストが脳脊髄炎の悪化を抑制するかどうか検討するため,B細胞において特異的にBlimp1を欠損するマウスを作製して脳脊髄炎を誘発させた.その結果,このプラズマブラストを欠損するB細胞に特異的なBlimp1ノックアウトマウスには有意に脳脊髄炎の悪化が観察された.以上の結果から,所属リンパ節に存在するプラズマブラストはインターロイキン10を産生する制御性B細胞として脳脊髄炎の悪化を抑制していることが示唆された.
2.プラズマブラストは樹状細胞の機能を阻害することにより脳脊髄炎を抑制する
プラズマブラストがどのような分子機構を介して脳脊髄炎の悪化を抑制しているかを解明するため,脳脊髄炎を誘発させたマウスの所属リンパ節におけるプラズマブラストの局在を免疫組織染色法により検討した.その結果,プラズマブラストはB細胞濾胞とT細胞領域の境界部位において,おもに樹状細胞と共局在していた.そこで,プラズマブラストが産生するインターロイキン10が樹状細胞の機能を阻害するかどうか検討するため,野生型のプラズマブラストの培養上清およびインターロイキン10を欠損したプラズマブラストの培養上清のもとで,樹状細胞の産生するサイトカインの量を測定した.野生型プラズマブラストの培養上清のもとでは,インターロイキン10を欠損したプラズマブラストの培養上清のもととは異なり,樹状細胞によるインターロイキン6やインターロイキン12aなど炎症性サイトカインの産生が低下していた.実際に,ミエリンオリゴデンドロサイト糖タンパク質に特異的なT細胞受容体を発現するナイーブT細胞と樹状細胞をプラズマブラストの培養上清のもと共培養すると,野生型プラズマブラストの培養上清のもとでのみエフェクターT細胞への分化が阻害された.これらの結果から,プラズマブラストはインターロイキン10の産生を介して樹状細胞の機能を阻害することにより,脳脊髄炎の悪化をひき起こすエフェクターT細胞への分化を抑制していることが強く示唆された(図1).
3.転写因子IRF4はプラズマブラストがインターロイキン10を産生するのに必須である
これまで,筆者らは,Toll様受容体を刺激したB細胞においてB細胞受容体を刺激すると多量のインターロイキン10が産生されること,および,このインターロイキン10の産生にはB細胞受容体を刺激したのち転写因子NFATのCa2+に依存的な活性化が必須であることを報告してきた7).しかしながら,ナイーブB細胞においてB細胞受容体を刺激した際にはNFATが活性化されるにもかかわらずインターロイキン10の産生は検出されないことから,これらの結果は,Toll様受容体からのシグナルがインターロイキン10の産生に必須であることを示していた.そこで,Toll様受容体からのどのようなシグナルがインターロイキン10の産生に必須であるかを明らかにするため,Blimp1レポーターマウスから単離したB細胞においてToll様受容体を刺激し,Blimp1陽性細胞によるインターロイキン10の産生について検討したところ,Blimp1陽性のB細胞のみがB細胞受容体を刺激したのちインターロイキン10を産生することが見い出された.つづいて,Blimp1を欠損したB細胞においてインターロイキン10の産生能が低下しているかどうか検討したが,対照となる細胞と同様に多量のインターロイキン10を産生したことからBlimp1はインターロイキン10の産生には必須ではないことが示唆された.このBlimp1を欠損したB細胞はプラズマ細胞へと分化することはできないが,その初期の分化は誘導されることが報告されている8).そこで,このプラズマ細胞の初期の分化にかかわる転写因子IRF4がインターロイキン10の産生に必須かどうか検討した.IRF4ノックアウトマウスから単離したB細胞においてインターロイキン10の産生能について検討したところ,B細胞受容体を刺激したのちにもインターロイキン10の産生はほとんど観察されなかった.また,B細胞において特異的にIRF4を欠損したマウスにおいても脳脊髄炎の悪化が観察されたことから,Toll様受容体を刺激されたB細胞はIRF4を発現してプラズマブラストへと分化し,そののち,B細胞受容体の刺激に依存的なNFATの活性化を介してインターロイキン10を産生することにより脳脊髄炎を抑制していることが示唆された(図2).
4.ヒトのプラズマブラストはインターロイキン10を産生する主要なB細胞である
マウスだけでなく,ヒトのB細胞においてもプラズマブラストがインターロイキン10を産生する主要なB細胞であるかどうか検討した.ヒトのB細胞をToll様受容体のひとつTLR9のリガンドであるCpG,および,インターフェロンα,インターロイキン2,インターロイキン6など各種のサイトカインにより刺激すると,プラズマブラストへの分化が誘導されることが報告されていた9,10).健常人の末梢血から単離したB細胞をin vitroにおいてCpGおよびサイトカインにより刺激したところ,CD27弱陽性およびCD27強陽性の2種類のプラズマブラストへの分化が誘導された.興味深いことに,このうちCD27弱陽性のプラズマブラストのみがインターロイキン10の産生能をもっていた.そこで,なぜ,CD27弱陽性のプラズマブラストのみがインターロイキン10を産生するかについて検討した.末梢血のB細胞はおもに,ナイーブ成熟B細胞,ナイーブ未成熟B細胞,メモリーB細胞の3つの異なるB細胞の集団から構成されている.末梢血からこれらB細胞の集団を単離したのちプラズマブラストへの分化を誘導したところ,メモリーB細胞はおもにCD27強陽性のプラズマブラストへと分化したが,ナイーブ成熟B細胞およびナイーブ未成熟B細胞はインターロイキン10を産生するCD27弱陽性のプラズマブラストへと分化した.以上の結果から,ヒトにおいてもプラズマブラストがインターロイキン10を産生する制御性B細胞として多発性硬化症の抑制に重要な役割をはたしている可能性が示唆された.
おわりに
これまで,自己免疫疾患を抑制する制御性B細胞の存在が報告されていたが,そのB細胞の集団の正体は不明であった.筆者らは,多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いた解析から,プラズマブラストが脳脊髄炎を抑制するインターロイキン10を産生するB細胞として機能しているだけでなく,ヒトにおいてもプラズマブラストがインターロイキン10を産生する主要なB細胞であることを見い出した.しかしながら,これら発見は制御性B細胞の役割の一端を明らかにしたにすぎず,多くの課題が残されている.たとえば,これまで,脾臓のCD1d高発現CD5陽性B細胞はインターロイキン10を産生しないにもかかわらずマウスへ移入すると脳脊髄炎を抑制することが報告されているが6),なぜ,このB細胞の集団は脳脊髄炎を抑制できるのか? また,インターロイキン10を産生するプラズマブラストをマウスへ移入すると脳脊髄炎の悪化が抑制されるのか? さらには,ヒトのプラズマブラストによるインターロイキン10の産生能の低下は多発性硬化症の病因や病態に関与しうるのか? これら疑問の解決は,制御性B細胞を介した自己免疫疾患に対する新たな治療法の開発につながる重要な研究課題であることから,今後の研究の進展が期待される.
文 献
- Lampropoulou, V., Calderon-Gomez, E., Roch, T. et al.: Suppressive functions of activated B cells in autoimmune diseases reveal the dual roles of Toll-like receptors in immunity. Immunol. Rev., 233, 146-161 (2010)[PubMed]
- Bouaziz, J., Yanaba, K. & Tedder, T.: Regulatory B cells as inhibitors of immune responses and inflammation. Immunol. Rev., 224, 201-214 (2008)[PubMed]
- Fillatreau, S., Sweenie, C. H., McGeachy, M. J. et al.: B cells regulate autoimmunity by provision of IL-10. Nat. Immunol., 3, 944-950 (2002)[PubMed]
- Mizoguchi, A., Mizoguchi, E., Takedatsu, H. et al.: Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity, 16, 219-230 (2002)[PubMed]
- Mauri, C., Gray, D., Mushtaq, N. et al.: Prevention of arthritis by interleukin 10-producing B cells. J. Exp. Med., 197, 489-501 (2003)[PubMed]
- Matsushita, T., Yanaba, K., Bouaziz, J. D. et al.: Regulatory B cells inhibit EAE initiation in mice while other B cells promote disease progression. J. Clin. Invest., 118, 3420-3430 (2008)[PubMed]
- Matsumoto, M., Fujii, Y., Baba, A. et al.: The calcium sensors STIM1 and STIM2 control B cell regulatory function through interleukin-10 production. Immunity, 34, 703-714 (2011)[PubMed]
- Kallies, A., Hasbold, J., Fairfax, K. et al.: Initiation of plasma-cell differentiation is independent of the transcription factor Blimp-1. Immunity, 26, 555-566 (2007)[PubMed]
- Jego, G., Palucka, A. K., Blanck, J. P. et al.: Plasmacytoid dendritic cells induce plasma cell differentiation through type I interferon and interleukin 6. Immunity, 19, 225-234 (2003)[PubMed]
- Joo, H., Coquery, C., Xue, Y. et al.: Serum from patients with SLE instructs monocytes to promote IgG and IgA plasmablast differentiation. J. Exp. Med., 209, 1335-1348 (2012)[PubMed]
著者プロフィール
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同年 大阪大学免疫学フロンティア研究センター 特任研究員を経て,2012年より同 特任助教.
研究テーマ:自己免疫疾患を抑制する制御性B細胞による抑制の分子機構.
黒崎 知博(Tomohiro Kurosaki)
大阪大学免疫学フロンティア研究センター 特任教授.
馬場 義裕(Yoshihiro Baba)
大阪大学免疫学フロンティア研究センター 特任准教授.
© 2014 松本真典・黒崎知博・馬場義裕 Licensed under CC 表示 2.1 日本