ケミカルシャペロンによるタンパク質の構造異常の修復はてんかんモデルマウスにおいてけいれん感受性を軽減する
横井紀彦・深田優子・深田正紀
(生理学研究所 生体膜研究部門)
email:横井紀彦,深田優子,深田正紀
DOI: 10.7875/first.author.2014.158
Chemical corrector treatment ameliorates increased seizure susceptibility in a mouse model of familial epilepsy.
Norihiko Yokoi, Yuko Fukata, Daisuke Kase, Taisuke Miyazaki, Martine Jaegle, Toshika Ohkawa, Naoki Takahashi, Hiroko Iwanari, Yasuhiro Mochizuki, Takao Hamakubo, Keiji Imoto, Dies Meijer, Masahiko Watanabe, Masaki Fukata
Nature Medicine, 21, 19-26 (2015)
てんかんはもっともよくみられる脳疾患のひとつである.神経分泌タンパク質をコードするLGI1遺伝子の変異は常染色体優性の外側側頭葉てんかんをひき起こすが,その分子病態は明らかではなかった.筆者らは,既知の22種類のLGI1ミスセンス変異体を分泌不全型と分泌型とに分類し,それぞれを発現するてんかんモデルマウスを作製し解析した.383番目のGluがAlaに変異した分泌不全型のLGI1変異体は構造異常により小胞体にとどまり分解が亢進していた.一方,473番目のSerがLeuに変異した分泌型のLGI1変異体は異常な二量体を形成し,受容体のひとつであるADAM22との結合が選択的に阻害されていた.つまり,どちらの変異もシナプスにおけるLGI1とADAM22との結合の減少をひき起こした.さらに,タンパク質の構造異常を修復するケミカルシャペロンのひとつ4-フェニル酪酸を,分泌不全型LGI1変異体を発現するてんかんモデルマウスへ投与したところ,分泌不全型LGI1変異体の分泌およびADAM22との結合が回復し,けいれん感受性が緩和された.この結果は,脳機能におけるLGI1とADAM22との結合の重要性,および,ヒトのてんかんの新たな治療戦略を示した.
脳において興奮性シナプス伝達と抑制性シナプス伝達とのバランスは精密に制御されているが,いったんそのバランスがくずれると統合失調症,自閉症,てんかんなどの神経精神疾患がひき起こされると考えられている.てんかんは罹患率1%程度の頻度の高い脳疾患であり,激しいけいれんや意識の消失,ときには幻覚や幻聴などをともなうが,その病態および病因には不明な点も多く根本的な治療にいたらない場合もある.家族性てんかんの患者において神経分泌タンパク質をコードするLGI1遺伝子には30種類以上の変異が見い出されているが1-3),これまで明らかになっているてんかんの原因遺伝子産物のほとんどがイオンチャネルであるのに対し,LGI1は分泌タンパク質であることから,その生理機能の解明は新しい作用点をもつ抗てんかん薬の創出につながると考えられる.
筆者らは,独自に,脳内の速い興奮性シナプス伝達を担うAMPA受容体のシナプス足場タンパク質PSD-95を含むタンパク質複合体の一部としてLGI1とADAM22との複合体を同定し4),ひきつづき,LGI1の分子機能を調べてきた.そして,LGI1が膜タンパク質であるADAM22およびADAM23のリガンドとして機能しAMPA受容体の機能を促進させること,LGI1ホモノックアウトマウスは生後3週間以内にてんかん発作の重積によりすべて死亡するという顕著な表現型を示すことを報告した5).今回,LGI1の主要な生理機能を明らかにするため,ヒトの家族性てんかんにおけるLGI1変異体に着目した.
これまでに報告されている30種類以上の家族性のLGI1遺伝子変異のうち,22種類がミスセンス変異であり,いくつかの変異はLGI1の分泌を阻害することがすでに報告されていた6).そこで,LGI1の22種類すべてのミスセンス変異体をHEK293T細胞に発現させ,細胞からの分泌の有無を評価した.その結果,19種類が分泌不全型,3種類が分泌型であることを見い出した.以下,分泌不全型変異を代表して383番目のGluのAlaへの変異,分泌型変異を代表して473番目のSerのLeuへの変異について,実験を進めた.
LGI1変異体がどのようにてんかんをひき起こすかを明らかにするため,LGI1変異体を発現するマウスを作製した.以前に筆者らは,脳のニューロンにおいて野生型LGI1を発現するマウスを作製し,LGI1ヘテロノックアウトマウス系統との交配により脳のニューロンにおいてトランス遺伝子にコードされた野生型LGI1を発現するLGI1ホモノックアウトトマウスを作製し,LGI1ホモノックアウトマウスの自発的なけいれん症状が完全にレスキューできることを報告した5).今回,同様に,脳のニューロンにおいて分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウス,および,脳のニューロンにおいて分泌型LGI1変異体を発現するLGI1ホモノックアウトマウスを作製し,レスキュー実験を行った.その結果,これらのマウスはLGI1ホモノックアウトマウスと同様に自発的なけいれん症状を示し,ほぼ同じく生後3週間以内に死亡した.さらに,以前に,けいれん誘発剤ペンチレンテトラゾールに対し,LGI1ヘテロノックアウトマウスは野生型マウスよりも高いけいれん感受性を示すことを見い出していたことから5),分泌不全型LGI1変異体を発現するLGI1ヘテロノックアウトマウスおよび分泌型LGI1変異体を発現するLGI1ヘテロノックアウトマウスに対し同様にけいれん感受性について評価したところ,LGI1ヘテロノックアウトマウスと同様にペンチレンテトラゾールに対する高いけいれん感受性を示した.以上の結果から,分泌不全型LGI1変異体および分泌型LGI1変異体は機能欠損型の表現型を示すことがわかった.
LGI1変異体を発現するマウスの脳内の分泌不全型LGI1変異体のタンパク質の量は内在性のLGI1の約40%と顕著に減少していた.一方,分泌不全型LGI1変異体のmRNAの発現量は内在性のLGI1と比べ2倍以上も多かった.この結果から,分泌不全型LGI1変異体は不安定であり分解が亢進していると考えられた.
LGI1の海馬における局在を組織染色により評価したところ,内在性のLGI1はおもにシナプスが存在する領域に局在していた一方5),分泌不全型LGI1変異体は細胞体に局在し小胞体マーカーであるBiPとの共局在を示した.この結果から,分泌不全型LGI1変異体は小胞体にとどまっていることがわかった.
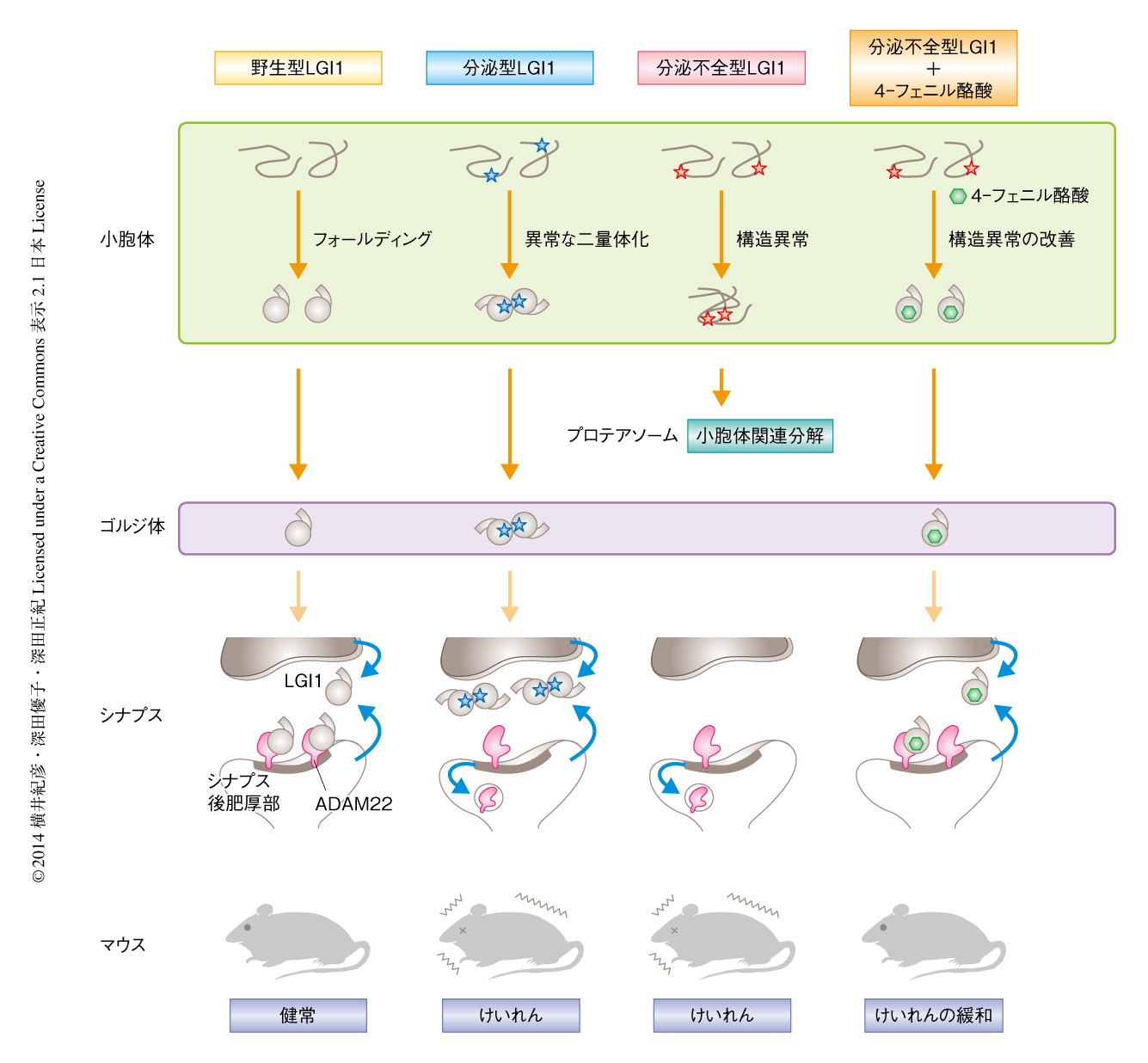
LGI1変異体を発現するマウスの脳から分泌不全型LGI1変異体を精製し共沈降するタンパク質を探索した.野生型LGI1とその受容体であるADAM22あるいはADAM23との結合が検出される条件下において5),分泌不全型LGI1変異体とこれら受容体との結合は確認されなかった.一方,分泌不全型LGI1変異体は小胞体においてタンパク質の品質管理にかかわるUGT1およびBiPと特異的に結合していることが見い出された.つまり,分泌不全型LGI1変異体は小胞体におけるタンパク質のフォールディングに異常をきたしており,最終的に小胞体関連分解により分解されていることが強く示唆された.以上の結果により,分泌不全型LGI1変異体によりひき起こされるてんかんは,タンパク質の構造異常を原因とするコンホメーション病であることが示された(図1).
分泌型LGI1変異体を発現するマウスの脳から同様に分泌型LGI1変異体を精製したところ,分泌型LGI1変異体は野生型LGI1と同様にADAM23と結合していたが,ADAM22とはほとんど結合していなかった.スクロース密度勾配遠心分離法を用いて野生型LGI1および分泌型LGI1変異体の存在様式を調べたところ,HEK293T細胞から分泌された野生型LGI1は約65%が単量体として存在したが,分泌型LGI1変異体は単量体として存在するものが31%,二量体以上の多量体として存在するものが69%であり,変異により異常な二量体の形成が進むことがわかった(図1).分泌型LGI1変異体は多量体を形成することによりADAM22との結合が阻害されているものと推測された.
以上の結果から,分泌不全型と分泌型のどちらの変異によってもLGI1とADAM22との結合が阻害されることが明らかになった.そこで,LGI1とADAM22との結合の欠損によりADAM22の局在が変化するかどうかを生化学的および組織化学的に検証した.その結果,LGI1ホモノックアウトマウス,分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウス,分泌型LGI1変異体を発現するLGI1ホモノックアウトマウスの脳において,野生型マウスに比べADAM22のシナプスへの局在が顕著に減少していることがわかった.ADAM22ノックアウトマウスは自発的なけいれん症状を起こしLGI1ノックアウトマウスとよく似た表現型を示すことから7),LGI1によるADAM22のシナプスへの局在の制御が脳機能において重要と考えられた.そこで,LGI1とADAM22との結合がシナプスの形成に関連するかどうかを明らかにするため,LGI1ホモノックアウトマウスのシナプスの形態を電子顕微鏡を用いて解析したところ,野生型マウスと比べ顕著な異常は確認されなかった.このことから,LGI1とADAM22との結合はシナプスの形成や構造の制御ではなく,おもにシナプスの機能の制御に寄与していることが示された.
分泌不全型LGI1変異体によりひき起こされるてんかんがタンパク質の構造異常を原因としたことから,その構造異常の改善により分泌を回復させることが新たなてんかんの治療戦略につながると考えた.そして,タンパク質の構造異常を原因とする疾患のひとつである嚢胞性線維症の治療戦略として着目されているケミカルシャペロン,4-フェニル酪酸の利用を試みた.嚢胞性線維症ではイオンチャネルであるCFTRが1アミノ酸変異により構造異常を起こし小胞体にとどまるが,4-フェニル酪酸によりその構造異常が改善され,CFTR変異体が細胞膜の表面へと輸送されることが報告されている8).そこで,4-フェニル酪酸を含む複数のケミカルシャペロンを用い,HEK293T細胞からの分泌不全型LGI1変異体の分泌が回復するかどうか検討した.その結果,4-フェニル酪酸がもっとも効果が高いことを見い出した.また,4-フェニル酪酸により分泌が誘導された分泌不全型LGI1変異体はADAM22との結合能をもつことも確認された.
LGI1変異体を発現するマウスの示すけいれん症状に対する4-フェニル酪酸の効果について検討した.LGI1遺伝子変異によるてんかんは常染色体優性の遺伝疾患であることから,まず,分泌不全型LGI1変異体を発現するLGI1ヘテロノックアウトマウスのペンチレンテトラゾールに対するけいれん感受性を評価した.このマウスの腹腔内に10日間にわたり4-フェニル酪酸を投与したのち,ペンチレンテトラゾールに対するけいれん感受性を評価した.その結果,野生型マウスに比べ,このマウスはLGI1ヘテロノックアウトマウスと同様にペンチレンテトラゾールに対する高いけいれん感受性を示したが,4-フェニル酪酸の投与によりけいれん感受性が低下することが見い出された.この4-フェニル酪酸の効果はLGI1ヘテロノックアウトマウスおよび分泌型LGI1変異体を発現するLGI1ヘテロノックアウトマウスにおいては確認されなかったことから,けいれん症状の回復は分泌不全型LGI1変異体に対する4-フェニル酪酸の特異的な作用によると考えられた.実際に,4-フェニル酪酸を投与した脳において,分泌不全型LGI1変異体の成熟度が上昇していること,分泌不全型LGI1変異体とADAM22との結合が増加していることが生化学的な手法により明らかにされた.
分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウスは自発的なけいれんにより生後3週間程度で死亡してしまうが,4-フェニル酪酸の投与によりこの自発的なけいれん症状が改善されるかどうか検討した.その結果,数日ではあるが4-フェニル酪酸を投与されたマウスは自発的なけいれんの発症時期が遅れ,寿命が有意に延長することが見い出された.また,分泌不全型LGI1変異体は小胞体にとどまるため海馬の歯状回では顆粒細胞層に濃縮したが,4-フェニル酪酸の投与によりシナプスがおもに存在する領域への局在,および,ADAM22との共局在が増加することが確かめられた.以上の結果から,ケミカルシャペロンである4-フェニル酪酸により,分泌不全型LGI1変異体の構造異常を改善し,分泌を回復させADAM22との結合量を回復させることにより,てんかんモデルマウスのけいれん感受性が緩和されることが強く示唆された(図1).
ヒトにおいててんかんをひき起こすLGI1の22種類のミスセンス変異体は19種類の分泌不全型と3種類の分泌型とに分類されたが,分泌不全型LGI1変異体の一部はごく少量分泌していることがウェスタンブロットの条件の検討により見い出された.一方,LGI1遺伝子変異のてんかんの発症における浸透度は100%ではなく,遺伝子変異の種類により異なっていた9).そこで,報告されていた家系図より浸透度をもとめ,LGI1変異体の分泌量との関連性を検証した.その結果,遺伝子産物がわずかに分泌する12種類のLGI1遺伝子変異における平均の浸透度56%に対し,遺伝子産物がまったく分泌しない7種類のLGI1遺伝子変異における平均の浸透度は85%と有意に高い値になった(2014年12月27日 著者からの依頼により,一部修正).つまり,LGI1遺伝子変異の保有者は,LGI1変異体のわずかな分泌によりLGI1とADAM22との複合体の必要量が保たれているときには,てんかんの発症が抑制されていると推測された.このことから,分泌不全型LGI1変異体の分泌量が少量でも増加できれば,てんかんの治療につながることが期待された.
これまでにも,ケミカルシャペロンである4-フェニル酪酸は嚢胞性線維症やリソソーム病といったタンパク質の構造異常を原因とする遺伝性の疾患に対し試みられてきたが,この研究により,一部のてんかんもタンパク質の構造異常を原因とすることが明らかになり,ケミカルシャペロンの投与がてんかんの治療戦略になりうることが示された.これまでのてんかんの治療薬の多くはイオンチャネルを標的タンパク質としており,今回の知見は,新たなてんかんの治療法の提案となった.しかしながら,4-フェニル酪酸によるLGI1の分泌の改善の効果は十分とは考えられなかったため,より改善効果の高いケミカルシャペロンの開発が待たれる.また,遺伝子産物が分泌不全型あるいは分泌型となるいずれのLGI1遺伝子変異においても結果的にADAM22との結合が減少してんかんをひき起こしたこと,そして,LGI1とADAM22との結合がシナプスの形成ではなくシナプスの機能の制御に重要であったことから,LGI1とADAM22との結合を補助もしくは模倣する小分子も新しい薬剤として有効であることが期待される.
ごく最近,LGI1は記憶障害やけいれんをおもな症状とする辺縁系脳炎をひき起こす自己抗体の標的タンパク質のひとつであることが報告された10,11).筆者らは,免疫沈降法およびELISA法により,LGI1が辺縁系脳炎をひき起こす自己抗体のもっとも主要な標的タンパク質であることを明らかにし,このLGI1の自己抗体がLGI1とADAM22との結合を阻害することを見い出した12).このように,LGI1とADAM22との結合が脳の興奮性の恒常性の維持および記憶の形成においてきわめて重要な役割をもつことは明らかであり,LGI1およびADAM22の下流の分子機構の解明が待たれる.
略歴:2009年 名古屋大学大学院理学研究科博士課程 修了,同年 生理学研究所 研究員を経て,2013年より同 特任助教.
研究テーマ:神経修飾リガンド/受容体による脳の興奮性維持機構.
関心事:タンパク質複合体の構造ダイナミクスから脳機能を記述できるか.
深田 優子(Yuko Fukata)
生理学研究所 准教授.
深田 正紀(Masaki Fukata)
生理学研究所 教授.
研究室URL:http://www.nips.ac.jp/fukata/
© 2014 横井紀彦・深田優子・深田正紀 Licensed under CC 表示 2.1 日本
(生理学研究所 生体膜研究部門)
email:横井紀彦,深田優子,深田正紀
DOI: 10.7875/first.author.2014.158
Chemical corrector treatment ameliorates increased seizure susceptibility in a mouse model of familial epilepsy.
Norihiko Yokoi, Yuko Fukata, Daisuke Kase, Taisuke Miyazaki, Martine Jaegle, Toshika Ohkawa, Naoki Takahashi, Hiroko Iwanari, Yasuhiro Mochizuki, Takao Hamakubo, Keiji Imoto, Dies Meijer, Masahiko Watanabe, Masaki Fukata
Nature Medicine, 21, 19-26 (2015)
要 約
てんかんはもっともよくみられる脳疾患のひとつである.神経分泌タンパク質をコードするLGI1遺伝子の変異は常染色体優性の外側側頭葉てんかんをひき起こすが,その分子病態は明らかではなかった.筆者らは,既知の22種類のLGI1ミスセンス変異体を分泌不全型と分泌型とに分類し,それぞれを発現するてんかんモデルマウスを作製し解析した.383番目のGluがAlaに変異した分泌不全型のLGI1変異体は構造異常により小胞体にとどまり分解が亢進していた.一方,473番目のSerがLeuに変異した分泌型のLGI1変異体は異常な二量体を形成し,受容体のひとつであるADAM22との結合が選択的に阻害されていた.つまり,どちらの変異もシナプスにおけるLGI1とADAM22との結合の減少をひき起こした.さらに,タンパク質の構造異常を修復するケミカルシャペロンのひとつ4-フェニル酪酸を,分泌不全型LGI1変異体を発現するてんかんモデルマウスへ投与したところ,分泌不全型LGI1変異体の分泌およびADAM22との結合が回復し,けいれん感受性が緩和された.この結果は,脳機能におけるLGI1とADAM22との結合の重要性,および,ヒトのてんかんの新たな治療戦略を示した.
はじめに
脳において興奮性シナプス伝達と抑制性シナプス伝達とのバランスは精密に制御されているが,いったんそのバランスがくずれると統合失調症,自閉症,てんかんなどの神経精神疾患がひき起こされると考えられている.てんかんは罹患率1%程度の頻度の高い脳疾患であり,激しいけいれんや意識の消失,ときには幻覚や幻聴などをともなうが,その病態および病因には不明な点も多く根本的な治療にいたらない場合もある.家族性てんかんの患者において神経分泌タンパク質をコードするLGI1遺伝子には30種類以上の変異が見い出されているが1-3),これまで明らかになっているてんかんの原因遺伝子産物のほとんどがイオンチャネルであるのに対し,LGI1は分泌タンパク質であることから,その生理機能の解明は新しい作用点をもつ抗てんかん薬の創出につながると考えられる.
筆者らは,独自に,脳内の速い興奮性シナプス伝達を担うAMPA受容体のシナプス足場タンパク質PSD-95を含むタンパク質複合体の一部としてLGI1とADAM22との複合体を同定し4),ひきつづき,LGI1の分子機能を調べてきた.そして,LGI1が膜タンパク質であるADAM22およびADAM23のリガンドとして機能しAMPA受容体の機能を促進させること,LGI1ホモノックアウトマウスは生後3週間以内にてんかん発作の重積によりすべて死亡するという顕著な表現型を示すことを報告した5).今回,LGI1の主要な生理機能を明らかにするため,ヒトの家族性てんかんにおけるLGI1変異体に着目した.
1.LGI1変異体を発現するてんかんモデルマウスの作製
これまでに報告されている30種類以上の家族性のLGI1遺伝子変異のうち,22種類がミスセンス変異であり,いくつかの変異はLGI1の分泌を阻害することがすでに報告されていた6).そこで,LGI1の22種類すべてのミスセンス変異体をHEK293T細胞に発現させ,細胞からの分泌の有無を評価した.その結果,19種類が分泌不全型,3種類が分泌型であることを見い出した.以下,分泌不全型変異を代表して383番目のGluのAlaへの変異,分泌型変異を代表して473番目のSerのLeuへの変異について,実験を進めた.
LGI1変異体がどのようにてんかんをひき起こすかを明らかにするため,LGI1変異体を発現するマウスを作製した.以前に筆者らは,脳のニューロンにおいて野生型LGI1を発現するマウスを作製し,LGI1ヘテロノックアウトマウス系統との交配により脳のニューロンにおいてトランス遺伝子にコードされた野生型LGI1を発現するLGI1ホモノックアウトトマウスを作製し,LGI1ホモノックアウトマウスの自発的なけいれん症状が完全にレスキューできることを報告した5).今回,同様に,脳のニューロンにおいて分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウス,および,脳のニューロンにおいて分泌型LGI1変異体を発現するLGI1ホモノックアウトマウスを作製し,レスキュー実験を行った.その結果,これらのマウスはLGI1ホモノックアウトマウスと同様に自発的なけいれん症状を示し,ほぼ同じく生後3週間以内に死亡した.さらに,以前に,けいれん誘発剤ペンチレンテトラゾールに対し,LGI1ヘテロノックアウトマウスは野生型マウスよりも高いけいれん感受性を示すことを見い出していたことから5),分泌不全型LGI1変異体を発現するLGI1ヘテロノックアウトマウスおよび分泌型LGI1変異体を発現するLGI1ヘテロノックアウトマウスに対し同様にけいれん感受性について評価したところ,LGI1ヘテロノックアウトマウスと同様にペンチレンテトラゾールに対する高いけいれん感受性を示した.以上の結果から,分泌不全型LGI1変異体および分泌型LGI1変異体は機能欠損型の表現型を示すことがわかった.
2.分泌不全型LGI1変異体は構造の異常により小胞体にとどまり分解される
LGI1変異体を発現するマウスの脳内の分泌不全型LGI1変異体のタンパク質の量は内在性のLGI1の約40%と顕著に減少していた.一方,分泌不全型LGI1変異体のmRNAの発現量は内在性のLGI1と比べ2倍以上も多かった.この結果から,分泌不全型LGI1変異体は不安定であり分解が亢進していると考えられた.
LGI1の海馬における局在を組織染色により評価したところ,内在性のLGI1はおもにシナプスが存在する領域に局在していた一方5),分泌不全型LGI1変異体は細胞体に局在し小胞体マーカーであるBiPとの共局在を示した.この結果から,分泌不全型LGI1変異体は小胞体にとどまっていることがわかった.
LGI1変異体を発現するマウスの脳から分泌不全型LGI1変異体を精製し共沈降するタンパク質を探索した.野生型LGI1とその受容体であるADAM22あるいはADAM23との結合が検出される条件下において5),分泌不全型LGI1変異体とこれら受容体との結合は確認されなかった.一方,分泌不全型LGI1変異体は小胞体においてタンパク質の品質管理にかかわるUGT1およびBiPと特異的に結合していることが見い出された.つまり,分泌不全型LGI1変異体は小胞体におけるタンパク質のフォールディングに異常をきたしており,最終的に小胞体関連分解により分解されていることが強く示唆された.以上の結果により,分泌不全型LGI1変異体によりひき起こされるてんかんは,タンパク質の構造異常を原因とするコンホメーション病であることが示された(図1).
3.分泌型LGI1変異体はADAM22との結合能を特異的に欠損している
分泌型LGI1変異体を発現するマウスの脳から同様に分泌型LGI1変異体を精製したところ,分泌型LGI1変異体は野生型LGI1と同様にADAM23と結合していたが,ADAM22とはほとんど結合していなかった.スクロース密度勾配遠心分離法を用いて野生型LGI1および分泌型LGI1変異体の存在様式を調べたところ,HEK293T細胞から分泌された野生型LGI1は約65%が単量体として存在したが,分泌型LGI1変異体は単量体として存在するものが31%,二量体以上の多量体として存在するものが69%であり,変異により異常な二量体の形成が進むことがわかった(図1).分泌型LGI1変異体は多量体を形成することによりADAM22との結合が阻害されているものと推測された.
4.LGI1とADAM22との結合の欠損はシナプスの形成ではなく機能の異常をひき起こす
以上の結果から,分泌不全型と分泌型のどちらの変異によってもLGI1とADAM22との結合が阻害されることが明らかになった.そこで,LGI1とADAM22との結合の欠損によりADAM22の局在が変化するかどうかを生化学的および組織化学的に検証した.その結果,LGI1ホモノックアウトマウス,分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウス,分泌型LGI1変異体を発現するLGI1ホモノックアウトマウスの脳において,野生型マウスに比べADAM22のシナプスへの局在が顕著に減少していることがわかった.ADAM22ノックアウトマウスは自発的なけいれん症状を起こしLGI1ノックアウトマウスとよく似た表現型を示すことから7),LGI1によるADAM22のシナプスへの局在の制御が脳機能において重要と考えられた.そこで,LGI1とADAM22との結合がシナプスの形成に関連するかどうかを明らかにするため,LGI1ホモノックアウトマウスのシナプスの形態を電子顕微鏡を用いて解析したところ,野生型マウスと比べ顕著な異常は確認されなかった.このことから,LGI1とADAM22との結合はシナプスの形成や構造の制御ではなく,おもにシナプスの機能の制御に寄与していることが示された.
5.分泌不全型LGI1変異体の構造異常の改善によりてんかんモデルマウスにおいてけいれん感受性が緩和される
分泌不全型LGI1変異体によりひき起こされるてんかんがタンパク質の構造異常を原因としたことから,その構造異常の改善により分泌を回復させることが新たなてんかんの治療戦略につながると考えた.そして,タンパク質の構造異常を原因とする疾患のひとつである嚢胞性線維症の治療戦略として着目されているケミカルシャペロン,4-フェニル酪酸の利用を試みた.嚢胞性線維症ではイオンチャネルであるCFTRが1アミノ酸変異により構造異常を起こし小胞体にとどまるが,4-フェニル酪酸によりその構造異常が改善され,CFTR変異体が細胞膜の表面へと輸送されることが報告されている8).そこで,4-フェニル酪酸を含む複数のケミカルシャペロンを用い,HEK293T細胞からの分泌不全型LGI1変異体の分泌が回復するかどうか検討した.その結果,4-フェニル酪酸がもっとも効果が高いことを見い出した.また,4-フェニル酪酸により分泌が誘導された分泌不全型LGI1変異体はADAM22との結合能をもつことも確認された.
LGI1変異体を発現するマウスの示すけいれん症状に対する4-フェニル酪酸の効果について検討した.LGI1遺伝子変異によるてんかんは常染色体優性の遺伝疾患であることから,まず,分泌不全型LGI1変異体を発現するLGI1ヘテロノックアウトマウスのペンチレンテトラゾールに対するけいれん感受性を評価した.このマウスの腹腔内に10日間にわたり4-フェニル酪酸を投与したのち,ペンチレンテトラゾールに対するけいれん感受性を評価した.その結果,野生型マウスに比べ,このマウスはLGI1ヘテロノックアウトマウスと同様にペンチレンテトラゾールに対する高いけいれん感受性を示したが,4-フェニル酪酸の投与によりけいれん感受性が低下することが見い出された.この4-フェニル酪酸の効果はLGI1ヘテロノックアウトマウスおよび分泌型LGI1変異体を発現するLGI1ヘテロノックアウトマウスにおいては確認されなかったことから,けいれん症状の回復は分泌不全型LGI1変異体に対する4-フェニル酪酸の特異的な作用によると考えられた.実際に,4-フェニル酪酸を投与した脳において,分泌不全型LGI1変異体の成熟度が上昇していること,分泌不全型LGI1変異体とADAM22との結合が増加していることが生化学的な手法により明らかにされた.
分泌不全型LGI1変異体を発現するLGI1ホモノックアウトマウスは自発的なけいれんにより生後3週間程度で死亡してしまうが,4-フェニル酪酸の投与によりこの自発的なけいれん症状が改善されるかどうか検討した.その結果,数日ではあるが4-フェニル酪酸を投与されたマウスは自発的なけいれんの発症時期が遅れ,寿命が有意に延長することが見い出された.また,分泌不全型LGI1変異体は小胞体にとどまるため海馬の歯状回では顆粒細胞層に濃縮したが,4-フェニル酪酸の投与によりシナプスがおもに存在する領域への局在,および,ADAM22との共局在が増加することが確かめられた.以上の結果から,ケミカルシャペロンである4-フェニル酪酸により,分泌不全型LGI1変異体の構造異常を改善し,分泌を回復させADAM22との結合量を回復させることにより,てんかんモデルマウスのけいれん感受性が緩和されることが強く示唆された(図1).
6.分泌不全型LGI1変異体のわずかな分泌量とてんかんの発症率は逆相関する
ヒトにおいててんかんをひき起こすLGI1の22種類のミスセンス変異体は19種類の分泌不全型と3種類の分泌型とに分類されたが,分泌不全型LGI1変異体の一部はごく少量分泌していることがウェスタンブロットの条件の検討により見い出された.一方,LGI1遺伝子変異のてんかんの発症における浸透度は100%ではなく,遺伝子変異の種類により異なっていた9).そこで,報告されていた家系図より浸透度をもとめ,LGI1変異体の分泌量との関連性を検証した.その結果,遺伝子産物がわずかに分泌する12種類のLGI1遺伝子変異における平均の浸透度56%に対し,遺伝子産物がまったく分泌しない7種類のLGI1遺伝子変異における平均の浸透度は85%と有意に高い値になった(2014年12月27日 著者からの依頼により,一部修正).つまり,LGI1遺伝子変異の保有者は,LGI1変異体のわずかな分泌によりLGI1とADAM22との複合体の必要量が保たれているときには,てんかんの発症が抑制されていると推測された.このことから,分泌不全型LGI1変異体の分泌量が少量でも増加できれば,てんかんの治療につながることが期待された.
おわりに
これまでにも,ケミカルシャペロンである4-フェニル酪酸は嚢胞性線維症やリソソーム病といったタンパク質の構造異常を原因とする遺伝性の疾患に対し試みられてきたが,この研究により,一部のてんかんもタンパク質の構造異常を原因とすることが明らかになり,ケミカルシャペロンの投与がてんかんの治療戦略になりうることが示された.これまでのてんかんの治療薬の多くはイオンチャネルを標的タンパク質としており,今回の知見は,新たなてんかんの治療法の提案となった.しかしながら,4-フェニル酪酸によるLGI1の分泌の改善の効果は十分とは考えられなかったため,より改善効果の高いケミカルシャペロンの開発が待たれる.また,遺伝子産物が分泌不全型あるいは分泌型となるいずれのLGI1遺伝子変異においても結果的にADAM22との結合が減少してんかんをひき起こしたこと,そして,LGI1とADAM22との結合がシナプスの形成ではなくシナプスの機能の制御に重要であったことから,LGI1とADAM22との結合を補助もしくは模倣する小分子も新しい薬剤として有効であることが期待される.
ごく最近,LGI1は記憶障害やけいれんをおもな症状とする辺縁系脳炎をひき起こす自己抗体の標的タンパク質のひとつであることが報告された10,11).筆者らは,免疫沈降法およびELISA法により,LGI1が辺縁系脳炎をひき起こす自己抗体のもっとも主要な標的タンパク質であることを明らかにし,このLGI1の自己抗体がLGI1とADAM22との結合を阻害することを見い出した12).このように,LGI1とADAM22との結合が脳の興奮性の恒常性の維持および記憶の形成においてきわめて重要な役割をもつことは明らかであり,LGI1およびADAM22の下流の分子機構の解明が待たれる.
文 献
- Kalachikov, S., Evgrafov, O., Ross, B. et al.: Mutations in LGI1 cause autosomal-dominant partial epilepsy with auditory features. Nat. Genet., 30, 335-341 (2002)[PubMed]
- Ho, Y. Y., Ionita-Laza, I. & Ottman, R.: Domain-dependent clustering and genotype-phenotype analysis of LGI1 mutations in ADPEAF. Neurology, 78, 563-568 (2012)[PubMed]
- Morante-Redolat, J. M., Gorostidi-Pagola, A., Piquer-Sirerol, S. et al.: Mutations in the LGI1/Epitempin gene on 10q24 cause autosomal dominant lateral temporal epilepsy. Hum. Mol. Genet., 11, 1119-1128 (2002)[PubMed]
- Fukata, Y., Adesnik, H., Iwanaga, T. et al.: Epilepsy-related ligand/receptor complex LGI1 and ADAM22 regulate synaptic transmission. Science, 313, 1792-1795 (2006)[PubMed]
- Fukata, Y., Lovero, K. L., Iwanaga, T. et al.: Disruption of LGI1-linked synaptic complex causes abnormal synaptic transmission and epilepsy. Proc. Natl. Acad. Sci. USA, 107, 3799-3804 (2010)[PubMed]
- Senechal, K. R., Thaller, C. & Noebels, J. L.: ADPEAF mutations reduce levels of secreted LGI1, a putative tumor suppressor protein linked to epilepsy. Hum. Mol. Genet., 14, 1613-1620 (2005)[PubMed]
- Sagane, K., Hayakawa, K., Kai, J. et al.: Ataxia and peripheral nerve hypomyelination in ADAM22-deficient mice. BMC Neurosci., 6, 33 (2005)[PubMed]
- Rubenstein, R. C., Egan, M. E. & Zeitlin, P. L.: In vitro pharmacologic restoration of CFTR-mediated chloride transport with sodium 4-phenylbutyrate in cystic fibrosis epithelial cells containing ΔF508-CFTR. J. Clin. Invest., 100, 2457-2465 (1997)[PubMed]
- Rosanoff, M. J. & Ottman, R.: Penetrance of LGI1 mutations in autosomal dominant partial epilepsy with auditory features. Neurology, 71, 567-571 (2008)[PubMed]
- Irani, S. R., Alexander, S., Waters, P. et al.: Antibodies to Kv1 potassium channel-complex proteins leucine-rich, glioma inactivated 1 protein and contactin-associated protein-2 in limbic encephalitis, Morvan's syndrome and acquired neuromyotonia. Brain, 133, 2734-2748 (2010)[PubMed]
- Lai, M., Huijbers, M. G., Lancaster, E. et al.: Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurol., 9, 776-785 (2010)[PubMed]
- Ohkawa, T., Fukata, Y., Yamasaki, M. et al.: Autoantibodies to epilepsy-related LGI1 in limbic encephalitis neutralize LGI1-ADAM22 interaction and reduce synaptic AMPA receptors. J. Neurosci., 33, 18161-18174 (2013)[PubMed]
著者プロフィール
略歴:2009年 名古屋大学大学院理学研究科博士課程 修了,同年 生理学研究所 研究員を経て,2013年より同 特任助教.
研究テーマ:神経修飾リガンド/受容体による脳の興奮性維持機構.
関心事:タンパク質複合体の構造ダイナミクスから脳機能を記述できるか.
深田 優子(Yuko Fukata)
生理学研究所 准教授.
深田 正紀(Masaki Fukata)
生理学研究所 教授.
研究室URL:http://www.nips.ac.jp/fukata/
© 2014 横井紀彦・深田優子・深田正紀 Licensed under CC 表示 2.1 日本