神経活動を可視化する超高感度・超高速赤色カルシウムセンサーの開発
井上昌俊・尾藤晴彦
(東京大学大学院医学系研究科 神経生化学分野)
email:井上昌俊,尾藤晴彦
DOI: 10.7875/first.author.2014.156
Rational design of a high-affinity, fast, red calcium indicator R-CaMP2.
Masatoshi Inoue, Atsuya Takeuchi, Shin-ichiro Horigane, Masamichi Ohkura, Keiko Gengyo-Ando, Hajime Fujii, Satoshi Kamijo, Sayaka Takemoto-Kimura, Masanobu Kano, Junichi Nakai, Kazuo Kitamura, Haruhiko Bito
Nature Methods, 12, 64-70 (2015)
生きている哺乳類の脳における神経活動およびシナプス活動を計測するため,蛍光Ca2+センサーが利用されるようになってきた.しかし,これまでの実用的な蛍光Ca2+センサーは計測波長域が緑色域に限定されており,生体において神経活動を高感度かつ高速に計測できる赤色Ca2+センサーの開発が望まれていた.また,従来の蛍光Ca2+センサーには高頻度の神経発火を読み解くことができないという問題があった.筆者らは,Ca2+との結合領域に新規の配列を用いることによりCa2+に対する結合能を上げ,高頻度の神経発火の計測に可能な超高感度かつ超高速の赤色Ca2+センサー“R-CaMP2”を開発した.その応用として,R-CaMP2と従来の緑色Ca2+センサーとを組み合わせることにより,マウスの大脳皮質における興奮性と抑制性の2つの異なる種のニューロンの神経活動を同時に計測することに成功した.さらに,自由行動している線虫において,光遺伝学的な手法との組合せも可能であることが示された.今後,神経回路ネットワークの動作原理の解明が飛躍的に進むことが期待される.
Ca2+は神経機能や筋収縮をはじめとして,さまざまな細胞機能を制御する重要な分子である1).また,脳は複数の異なる種のニューロンからなり,それぞれが協調的にはたらくことにより正常な脳機能を発揮すると考えられている2,3).近年,神経発火により細胞内のCa2+濃度が上昇することから,神経発火を検出する方法として蛍光Ca2+センサーを用いて神経活動をイメージングできるようになった4-6).これを応用して,数百~数千個のニューロンの活動を同時に記録することにより,脳のはたらき方の原理をはじめとして,記憶障害や精神疾患の原因を解明することが重要な課題となっている.
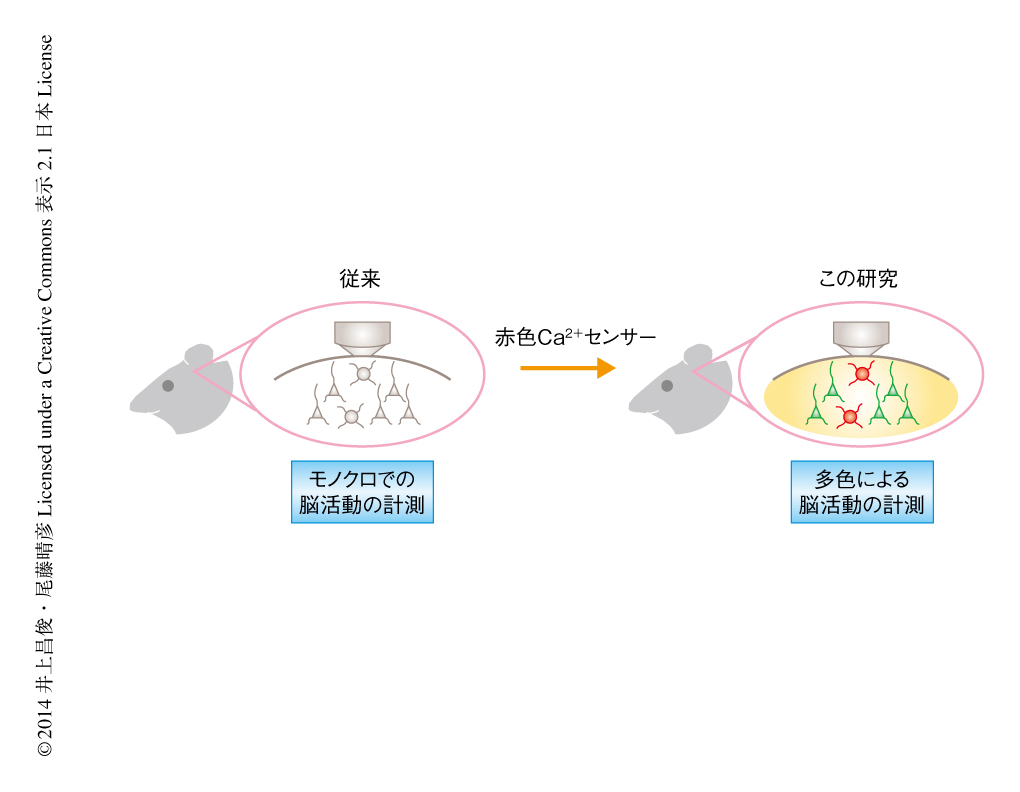
とくに,遺伝子にコードされた蛍光Ca2+センサーは特定の種のニューロンに発現させることができ長期にわたる観察が可能であることから,広く用いられつつある7,8).しかしながら,赤色Ca2+センサーは開発されてはいたものの感度が十分に高くないため9-11),生きた動物の個体におけるイメージングにおいて実用化されているのは緑色Ca2+センサーのみであり,従来の蛍光Ca2+センサーのみでは2つの種のニューロンのあいだの関係を検討することは困難であった(図1).また,記憶が成立する際に高頻度の神経発火が重要な役割をはたすことから,脳機能の解明には神経発火の頻度を読み解くことが重要であると考えられていた.しかし,従来の蛍光Ca2+センサーは神経入力の有無もしくは強度のみを検出しており,高頻度の神経発火のときにどのような入力(神経発火の頻度および回数)が起こっているのかを計測するには不十分であった(図2).この問題点を解決するため,反応速度(キネティクス)が速く,神経発火の回数と蛍光強度の変化とのあいだに線形関係を示す,遺伝子にコードされた蛍光Ca2+センサーの開発が望まれていた.神経発火の回数と蛍光強度の変化とのあいだに線形関係を示すという条件を実現するためには,Ca2+濃度と蛍光強度の変化との関係を示すHill係数が1に近づいた蛍光Ca2+センサーを作出することが必要であった.しかし,従来の高感度な蛍光Ca2+センサーはHill係数が2付近またはそれ以上であったことから,複数の活動電位に対し蛍光強度が非線形的に変化し,また,広範囲のCa2+濃度を検出するのが困難であった.したがって,生きた動物の個体において神経入力の検出が可能な赤色Ca2+センサーの開発をとおし,異なる種のニューロンのあいだで反応の検出を可能にする系の構築が望まれていた.
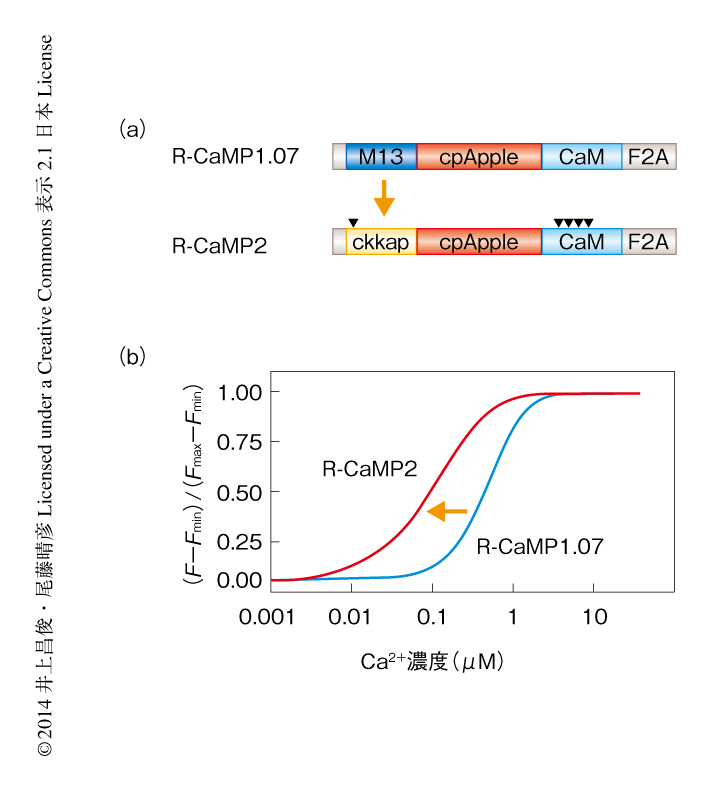
これまで困難であった高頻度の神経発火の計測を可能にするには,複数の活動電位シグナルが生じた際に起こる蛍光強度の増強に線形性を確保することが重要であった.また,緑色Ca2+センサーの改良はこの数年で飛躍的に進んだにもかかわらず,多色による同時計測や脳の深部などへの応用が期待される赤色Ca2+センサーの開発は遅れていた.これまでに,筆者らの研究グループは,Ca2+/カルモジュリン依存性プロテインキナーゼキナーゼはCa2+とカルモジュリンとの複合体に対し高親和性であることを示唆する結果を見い出していた12,13).そこで,Ca2+/カルモジュリン依存性プロテインキナーゼキナーゼのCa2+/カルモジュリン結合配列であるckkap配列は,従来の遺伝子にコードされた蛍光Ca2+センサーに広く用いられているCa2+/カルモジュリン結合配列であるM13配列よりも,Ca2+に対し高親和性であるとの仮説をたてた.このアイディアを直接的に検証するため,遺伝子にコードされた蛍光Ca2+センサーのひとつR-CaMP1.07 10) を骨格として用い,M13配列をckkap配列と置換した.さらに,カルモジュリン配列およびckkap配列に変異を導入した,合計で150個の候補となる変異体をHEK293T細胞に発現させ,Ca2+に対して低いKd値と高いダイナミックレンジをもつという観点からin vitroにおいてスクリーニングをした.その結果,既存の赤色Ca2+センサーに比べ感度が3倍も向上し,かつ,Hill係数が1付近であることから線形性が圧倒的に高い赤色Ca2+センサーを作出し,R-CaMP2と命名した(図3).
急性脳切片での神経活動の測定におけるR-CaMP2の有用性を検証するため,子宮内電気穿孔法により大脳皮質バレル野第2/3層にR-CaMP2あるいはR-CaMP1.07を強制発現させ,成体になったのち急性脳皮質切片においてイメージングを実施した.2光子顕微鏡を用いてホールセルパッチクランプ記録のもと高速のラインスキャンを行った.急性脳皮質切片において最小の活動単位である単一の活動電位を発生させると,従来のR-CaMP1.07を発現したニューロンに比べR-CaMP2を発現したニューロンにおいて有意に大きい蛍光強度の応答が生じた.シグナル/ノイズ比は4.0倍に上昇し,立ち上がり時間は2.6倍も短く,減衰時定数は3.4倍も大きいなど,複数のパラメーターに改善が示された.これら改善されたパラメーターと一致して,4回までの連続した発火に対しても蛍光強度の変化およびシグナル/ノイズ比において改善がみられた.さらに,従来のR-CaMP1.07を発現したニューロンに比べ4~8倍に相当する20~40 Hzという高い周波数の発火にも追従した.このことは,遺伝子にコードされたすべての蛍光Ca2+センサーのなかでR-CaMP2が世界最高速であることを意味していた.
生きた動物の個体での神経活動の測定におけるR-CaMP2の有用性を検証するため,麻酔し頭部を固定したマウスの大脳皮質バレル野第2/3層のニューロンにおいてin vivoにおけるCa2+イメージングを行った.その結果,自発的な蛍光強度の増大(Ca2+スパイク)が確実に記録された.触覚情報の表象はニューロンにまばらにコードされていることと一致して,ヒゲへのエアパフ刺激はかぎられたニューロンでしかCa2+の変動を生じなかった.また,生きたマウスの大脳皮質バレル野第2/3層における樹状突起スパインのCa2+イメージングを行った.スパインにおける活動電位の発生の閾値より下における興奮性ポストシナプスCa2+変動,および,樹状突起のCa2+スパイクを検出できるかどうかを検討した.その結果,興奮性ポストシナプスCa2+変動はよく観察され,あるスパインでは樹状突起シャフトにおいて有意な蛍光シグナルの上昇が存在しないにもかかわらず興奮性ポストシナプスCa2+変動が生じ,別のスパインにおける興奮性ポストシナプスCa2+変動は隣接する樹状突起シャフトにおいて発生した興奮性ポストシナプスCa2+変動に先行した.さらに,in vivoにおける活動電位とCa2+の変動との関係を検証するため,セルアタッチ記録とCa2+イメージングを同時に行った.その結果,R-CaMP2は入力回数と蛍光強度の変化とのあいだに強い線形の関係をもつことが見い出され,単一の活動電位を鋭敏に記録することが可能な赤色Ca2+センサーであることが示された.
生きた動物の個体における神経活動およびシナプス活動をモニターすることの可能な赤色Ca2+センサーを開発したことより,従来の蛍光Ca2+センサーのみでは不可能であった2つの異なる種のニューロンにおける神経活動の同時計測が可能かどうか検証した.アデノ随伴ウイルスを用いて,ソマトスタチン陽性の抑制性ニューロンにR-CaMP2を,それと同時に,Ca2+/カルモジュリン依存性プロテインキナーゼII陽性の興奮性ニューロンに緑色Ca2+センサーを発現させた.その結果,in vivoにおいてソマトスタチン陽性の抑制性ニューロンとCa2+/カルモジュリン依存性プロテインキナーゼII陽性の興奮性ニューロンの神経活動の同時イメージングに成功した.また,これまで電気生理学的な手法により見い出されていた知見と一致して,抑制性ニューロンどうしには活動パターンに強い同期性が示されたのに対し,近接している興奮性ニューロンどうしでは活動パターンの同期性に大きなばらつきがあることが示された.このことより,2色の蛍光Ca2+センサーを用いた同時イメージングにより,はじめて2つの種の異なるニューロンのあいだの関係を明らかにできることが示された.
光のみによる行動の制御および神経活動の計測が可能であるかどうか検証するため,自由行動している線虫においてイメージングを試みた.GABA作動性抑制性運動ニューロンにチャネルロドプシンおよび緑色Ca2+センサーを発現させ,一方,その投射先である体壁筋にR-CaMP2を発現させて,それぞれの神経活動を同時に計測した.光の照射により,GABA作動性抑制性運動ニューロンでは活動が上昇する一方,標的である体壁筋の細胞ではCa2+濃度の急速な低下にともない弛緩が生じ,それまで動いていた線虫を停止させることに成功した.
この研究は,従来の遺伝子にコードされた蛍光Ca2+センサーで用いられていたM13配列をckkap配列に置換することを着想したことがブレークスルーになった.また,これまでのスクリーニングは大きなダイナミックレンジをもつ蛍光Ca2+センサーを得ることに注力していた.一方,筆者らは,生理的に小さなCa2+変動を検出する小さいKd値および1に近いHill係数をもつ蛍光Ca2+センサーを見い出すためのスクリーニングをしたことが,超高感度かつ超高速の赤色Ca2+センサーの開発につながったと考えられた.NMR法による構造解析によりckkap配列はM13配列とはまったく異なる様式でCa2+とカルモジュリンとの複合体と結合することが知られていることから14),Ca2+に対しきわめて高親和性であるにもかかわらず超高速のCa2+センサーが実現したと考えられた.なお,R-CaMP2の超高速性は,ニューロンにおける実測のほかにも,精製したタンパク質のキネティクスをストップドフロー法にて確認した.筆者らがデザインし作出したR-CaMP2の性能は,これまでの高親和性の蛍光Ca2+センサーはキネティクスが遅いという定説あるいは常識をくつがえすものであり,今後の蛍光Ca2+センサーの改良において新たな発展の可能性を示したという点でも意義深い.
この研究により,はじめて生きた動物の個体において計測を行える赤色Ca2+センサーが作出された.赤色光の特徴として,光の波長が長くなると組織の散乱がより少なくなるため励起光が組織の深部に到達することがある.また,組織の深部からの蛍光も波長が長いほど散乱されにくいことから,従来の井戸状に大脳皮質を除去していた海馬CA1領域のイメージングを非侵襲にすることが期待される.しかしながら,改良の余地はまだ残されている.たとえば,より高速な赤色Ca2+センサーの開発をめざすため,基底状態においてより明るい赤色の蛍光タンパク質“mApple”をベースに設計したが,mAppleには非常に強い光の照射により光活性化するという性質が報告されており11),赤色蛍光タンパク質それ自体の改善が強く望まれる.また,この研究では40 Hzの周波数まで分解能のあることが示されたが,神経活動は100 Hz以上の高頻度で発火することがあるので,さらなる高速の蛍光Ca2+センサーの開発が望まれる.
この研究により,従来は不可能であった,生きた動物の個体において2つの異なる神経ネットワークのあいだの関係を解明することが可能になった.この方法を用いることにより,行動あるいは記憶の過程において正常な脳がどのようにはたらいているのかを調べることが可能になり,将来的には,精神疾患やアルツハイマー病などの高次の脳機能の障害の解明に役立つことが期待される.この研究は脳活動の計測に着目したが,Ca2+の動態はすべての細胞また生命現象において重要であることから,Ca2+シグナルの変化の関連する生理的な事象や恒常性の維持の機構の理解,および,Ca2+の動態の異常あるいは破綻が起因となる循環器疾患,免疫疾患,内分泌疾患などの原因の解明やこれを標的とした創薬の探索にもつながることが期待される.
略歴:2013年 東京大学大学院医学系研究科 修了,同年より同 特任研究員.
研究テーマ:神経活動のイメージング法の開発.シナプスから核へのシグナル伝達の機構.
関心事:山歩き.イメージングによる脳活動の計測および制御.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2014 井上昌俊・尾藤晴彦 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生化学分野)
email:井上昌俊,尾藤晴彦
DOI: 10.7875/first.author.2014.156
Rational design of a high-affinity, fast, red calcium indicator R-CaMP2.
Masatoshi Inoue, Atsuya Takeuchi, Shin-ichiro Horigane, Masamichi Ohkura, Keiko Gengyo-Ando, Hajime Fujii, Satoshi Kamijo, Sayaka Takemoto-Kimura, Masanobu Kano, Junichi Nakai, Kazuo Kitamura, Haruhiko Bito
Nature Methods, 12, 64-70 (2015)
要 約
生きている哺乳類の脳における神経活動およびシナプス活動を計測するため,蛍光Ca2+センサーが利用されるようになってきた.しかし,これまでの実用的な蛍光Ca2+センサーは計測波長域が緑色域に限定されており,生体において神経活動を高感度かつ高速に計測できる赤色Ca2+センサーの開発が望まれていた.また,従来の蛍光Ca2+センサーには高頻度の神経発火を読み解くことができないという問題があった.筆者らは,Ca2+との結合領域に新規の配列を用いることによりCa2+に対する結合能を上げ,高頻度の神経発火の計測に可能な超高感度かつ超高速の赤色Ca2+センサー“R-CaMP2”を開発した.その応用として,R-CaMP2と従来の緑色Ca2+センサーとを組み合わせることにより,マウスの大脳皮質における興奮性と抑制性の2つの異なる種のニューロンの神経活動を同時に計測することに成功した.さらに,自由行動している線虫において,光遺伝学的な手法との組合せも可能であることが示された.今後,神経回路ネットワークの動作原理の解明が飛躍的に進むことが期待される.
はじめに
Ca2+は神経機能や筋収縮をはじめとして,さまざまな細胞機能を制御する重要な分子である1).また,脳は複数の異なる種のニューロンからなり,それぞれが協調的にはたらくことにより正常な脳機能を発揮すると考えられている2,3).近年,神経発火により細胞内のCa2+濃度が上昇することから,神経発火を検出する方法として蛍光Ca2+センサーを用いて神経活動をイメージングできるようになった4-6).これを応用して,数百~数千個のニューロンの活動を同時に記録することにより,脳のはたらき方の原理をはじめとして,記憶障害や精神疾患の原因を解明することが重要な課題となっている.
とくに,遺伝子にコードされた蛍光Ca2+センサーは特定の種のニューロンに発現させることができ長期にわたる観察が可能であることから,広く用いられつつある7,8).しかしながら,赤色Ca2+センサーは開発されてはいたものの感度が十分に高くないため9-11),生きた動物の個体におけるイメージングにおいて実用化されているのは緑色Ca2+センサーのみであり,従来の蛍光Ca2+センサーのみでは2つの種のニューロンのあいだの関係を検討することは困難であった(図1).また,記憶が成立する際に高頻度の神経発火が重要な役割をはたすことから,脳機能の解明には神経発火の頻度を読み解くことが重要であると考えられていた.しかし,従来の蛍光Ca2+センサーは神経入力の有無もしくは強度のみを検出しており,高頻度の神経発火のときにどのような入力(神経発火の頻度および回数)が起こっているのかを計測するには不十分であった(図2).この問題点を解決するため,反応速度(キネティクス)が速く,神経発火の回数と蛍光強度の変化とのあいだに線形関係を示す,遺伝子にコードされた蛍光Ca2+センサーの開発が望まれていた.神経発火の回数と蛍光強度の変化とのあいだに線形関係を示すという条件を実現するためには,Ca2+濃度と蛍光強度の変化との関係を示すHill係数が1に近づいた蛍光Ca2+センサーを作出することが必要であった.しかし,従来の高感度な蛍光Ca2+センサーはHill係数が2付近またはそれ以上であったことから,複数の活動電位に対し蛍光強度が非線形的に変化し,また,広範囲のCa2+濃度を検出するのが困難であった.したがって,生きた動物の個体において神経入力の検出が可能な赤色Ca2+センサーの開発をとおし,異なる種のニューロンのあいだで反応の検出を可能にする系の構築が望まれていた.
1.高感度な赤色Ca2+センサーの開発
これまで困難であった高頻度の神経発火の計測を可能にするには,複数の活動電位シグナルが生じた際に起こる蛍光強度の増強に線形性を確保することが重要であった.また,緑色Ca2+センサーの改良はこの数年で飛躍的に進んだにもかかわらず,多色による同時計測や脳の深部などへの応用が期待される赤色Ca2+センサーの開発は遅れていた.これまでに,筆者らの研究グループは,Ca2+/カルモジュリン依存性プロテインキナーゼキナーゼはCa2+とカルモジュリンとの複合体に対し高親和性であることを示唆する結果を見い出していた12,13).そこで,Ca2+/カルモジュリン依存性プロテインキナーゼキナーゼのCa2+/カルモジュリン結合配列であるckkap配列は,従来の遺伝子にコードされた蛍光Ca2+センサーに広く用いられているCa2+/カルモジュリン結合配列であるM13配列よりも,Ca2+に対し高親和性であるとの仮説をたてた.このアイディアを直接的に検証するため,遺伝子にコードされた蛍光Ca2+センサーのひとつR-CaMP1.07 10) を骨格として用い,M13配列をckkap配列と置換した.さらに,カルモジュリン配列およびckkap配列に変異を導入した,合計で150個の候補となる変異体をHEK293T細胞に発現させ,Ca2+に対して低いKd値と高いダイナミックレンジをもつという観点からin vitroにおいてスクリーニングをした.その結果,既存の赤色Ca2+センサーに比べ感度が3倍も向上し,かつ,Hill係数が1付近であることから線形性が圧倒的に高い赤色Ca2+センサーを作出し,R-CaMP2と命名した(図3).
2.急性脳切片におけるR-CaMP2の性能の評価
急性脳切片での神経活動の測定におけるR-CaMP2の有用性を検証するため,子宮内電気穿孔法により大脳皮質バレル野第2/3層にR-CaMP2あるいはR-CaMP1.07を強制発現させ,成体になったのち急性脳皮質切片においてイメージングを実施した.2光子顕微鏡を用いてホールセルパッチクランプ記録のもと高速のラインスキャンを行った.急性脳皮質切片において最小の活動単位である単一の活動電位を発生させると,従来のR-CaMP1.07を発現したニューロンに比べR-CaMP2を発現したニューロンにおいて有意に大きい蛍光強度の応答が生じた.シグナル/ノイズ比は4.0倍に上昇し,立ち上がり時間は2.6倍も短く,減衰時定数は3.4倍も大きいなど,複数のパラメーターに改善が示された.これら改善されたパラメーターと一致して,4回までの連続した発火に対しても蛍光強度の変化およびシグナル/ノイズ比において改善がみられた.さらに,従来のR-CaMP1.07を発現したニューロンに比べ4~8倍に相当する20~40 Hzという高い周波数の発火にも追従した.このことは,遺伝子にコードされたすべての蛍光Ca2+センサーのなかでR-CaMP2が世界最高速であることを意味していた.
3.生きた動物の個体におけるR-CaMP2の性能の評価
生きた動物の個体での神経活動の測定におけるR-CaMP2の有用性を検証するため,麻酔し頭部を固定したマウスの大脳皮質バレル野第2/3層のニューロンにおいてin vivoにおけるCa2+イメージングを行った.その結果,自発的な蛍光強度の増大(Ca2+スパイク)が確実に記録された.触覚情報の表象はニューロンにまばらにコードされていることと一致して,ヒゲへのエアパフ刺激はかぎられたニューロンでしかCa2+の変動を生じなかった.また,生きたマウスの大脳皮質バレル野第2/3層における樹状突起スパインのCa2+イメージングを行った.スパインにおける活動電位の発生の閾値より下における興奮性ポストシナプスCa2+変動,および,樹状突起のCa2+スパイクを検出できるかどうかを検討した.その結果,興奮性ポストシナプスCa2+変動はよく観察され,あるスパインでは樹状突起シャフトにおいて有意な蛍光シグナルの上昇が存在しないにもかかわらず興奮性ポストシナプスCa2+変動が生じ,別のスパインにおける興奮性ポストシナプスCa2+変動は隣接する樹状突起シャフトにおいて発生した興奮性ポストシナプスCa2+変動に先行した.さらに,in vivoにおける活動電位とCa2+の変動との関係を検証するため,セルアタッチ記録とCa2+イメージングを同時に行った.その結果,R-CaMP2は入力回数と蛍光強度の変化とのあいだに強い線形の関係をもつことが見い出され,単一の活動電位を鋭敏に記録することが可能な赤色Ca2+センサーであることが示された.
4.R-CaMP2と緑色Ca2+センサーを用いた2つの種のニューロンにおける神経活動の同時イメージング
生きた動物の個体における神経活動およびシナプス活動をモニターすることの可能な赤色Ca2+センサーを開発したことより,従来の蛍光Ca2+センサーのみでは不可能であった2つの異なる種のニューロンにおける神経活動の同時計測が可能かどうか検証した.アデノ随伴ウイルスを用いて,ソマトスタチン陽性の抑制性ニューロンにR-CaMP2を,それと同時に,Ca2+/カルモジュリン依存性プロテインキナーゼII陽性の興奮性ニューロンに緑色Ca2+センサーを発現させた.その結果,in vivoにおいてソマトスタチン陽性の抑制性ニューロンとCa2+/カルモジュリン依存性プロテインキナーゼII陽性の興奮性ニューロンの神経活動の同時イメージングに成功した.また,これまで電気生理学的な手法により見い出されていた知見と一致して,抑制性ニューロンどうしには活動パターンに強い同期性が示されたのに対し,近接している興奮性ニューロンどうしでは活動パターンの同期性に大きなばらつきがあることが示された.このことより,2色の蛍光Ca2+センサーを用いた同時イメージングにより,はじめて2つの種の異なるニューロンのあいだの関係を明らかにできることが示された.
光のみによる行動の制御および神経活動の計測が可能であるかどうか検証するため,自由行動している線虫においてイメージングを試みた.GABA作動性抑制性運動ニューロンにチャネルロドプシンおよび緑色Ca2+センサーを発現させ,一方,その投射先である体壁筋にR-CaMP2を発現させて,それぞれの神経活動を同時に計測した.光の照射により,GABA作動性抑制性運動ニューロンでは活動が上昇する一方,標的である体壁筋の細胞ではCa2+濃度の急速な低下にともない弛緩が生じ,それまで動いていた線虫を停止させることに成功した.
おわりに
この研究は,従来の遺伝子にコードされた蛍光Ca2+センサーで用いられていたM13配列をckkap配列に置換することを着想したことがブレークスルーになった.また,これまでのスクリーニングは大きなダイナミックレンジをもつ蛍光Ca2+センサーを得ることに注力していた.一方,筆者らは,生理的に小さなCa2+変動を検出する小さいKd値および1に近いHill係数をもつ蛍光Ca2+センサーを見い出すためのスクリーニングをしたことが,超高感度かつ超高速の赤色Ca2+センサーの開発につながったと考えられた.NMR法による構造解析によりckkap配列はM13配列とはまったく異なる様式でCa2+とカルモジュリンとの複合体と結合することが知られていることから14),Ca2+に対しきわめて高親和性であるにもかかわらず超高速のCa2+センサーが実現したと考えられた.なお,R-CaMP2の超高速性は,ニューロンにおける実測のほかにも,精製したタンパク質のキネティクスをストップドフロー法にて確認した.筆者らがデザインし作出したR-CaMP2の性能は,これまでの高親和性の蛍光Ca2+センサーはキネティクスが遅いという定説あるいは常識をくつがえすものであり,今後の蛍光Ca2+センサーの改良において新たな発展の可能性を示したという点でも意義深い.
この研究により,はじめて生きた動物の個体において計測を行える赤色Ca2+センサーが作出された.赤色光の特徴として,光の波長が長くなると組織の散乱がより少なくなるため励起光が組織の深部に到達することがある.また,組織の深部からの蛍光も波長が長いほど散乱されにくいことから,従来の井戸状に大脳皮質を除去していた海馬CA1領域のイメージングを非侵襲にすることが期待される.しかしながら,改良の余地はまだ残されている.たとえば,より高速な赤色Ca2+センサーの開発をめざすため,基底状態においてより明るい赤色の蛍光タンパク質“mApple”をベースに設計したが,mAppleには非常に強い光の照射により光活性化するという性質が報告されており11),赤色蛍光タンパク質それ自体の改善が強く望まれる.また,この研究では40 Hzの周波数まで分解能のあることが示されたが,神経活動は100 Hz以上の高頻度で発火することがあるので,さらなる高速の蛍光Ca2+センサーの開発が望まれる.
この研究により,従来は不可能であった,生きた動物の個体において2つの異なる神経ネットワークのあいだの関係を解明することが可能になった.この方法を用いることにより,行動あるいは記憶の過程において正常な脳がどのようにはたらいているのかを調べることが可能になり,将来的には,精神疾患やアルツハイマー病などの高次の脳機能の障害の解明に役立つことが期待される.この研究は脳活動の計測に着目したが,Ca2+の動態はすべての細胞また生命現象において重要であることから,Ca2+シグナルの変化の関連する生理的な事象や恒常性の維持の機構の理解,および,Ca2+の動態の異常あるいは破綻が起因となる循環器疾患,免疫疾患,内分泌疾患などの原因の解明やこれを標的とした創薬の探索にもつながることが期待される.
文 献
- Berridge, M. J., Bootman, M. D. & Lipp, P.: Calcium: a life and death signal. Nature, 395, 645-648 (1998)[PubMed]
- Yizhar, O., Fenno, L. E., Prigge, M. et al.: Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature, 477, 171-178 (2011)[PubMed]
- Xue, M., Atallah, B. V. & Scanziani, M.: Equalizing excitation-inhibition ratios across visual cortical neurons. Nature, 511, 596-600 (2014)[PubMed]
- Miyawaki, A., Llopis, J., Heim, R. et al.: Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature, 388, 882-887 (1997)[PubMed]
- Nakai, J., Ohkura, M. & Imoto, K.: A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nat. Biotechnol., 19, 137-141 (2001)[PubMed]
- Tada, M., Takeuchi, A., Hashizume, M. et al.: A highly sensitive fluorescent indicator dye for calcium imaging of neural activity in vitro and in vivo. Eur. J. Neurosci., 39, 1720-1728 (2014)[PubMed]
- Tian, L., Hires, S. A., Mao, T. et al.: Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods, 6, 875-881 (2009)[PubMed]
- Chen, T. W., Wardill, T. J., Sun, Y. et al.: Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature, 499, 295-300 (2013)[PubMed]
- Zhao, Y., Araki, S., Wu, J. et al.: An expanded palette of genetically encoded Ca2+ indicators. Science, 333, 1888-1891 (2011)[PubMed]
- Ohkura, M., Sasaki, T., Kobayashi, C. et al.: An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS One, 7, e39933 (2012)[PubMed]
- Akerboom, J., Carreras Calderon, N., Tian, L. et al.: Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front. Mol. Neurosci. 6, 2 (2013)[PubMed]
- Bito, H., Deisseroth, K. & Tsien, R. W.: CREB phosphorylation and dephosphorylation: a Ca2+- and stimulus duration-dependent switch for hippocampal gene expression. Cell, 87, 1203-1214 (1996)[PubMed]
- Takemoto-Kimura, S., Ageta-Ishihara, N., Nonaka, M. et al.: Regulation of dendritogenesis via a lipid-raft-associated Ca2+/calmodulin-dependent protein kinase CLICK-III/CaMKIγ. Neuron 54, 755-770 (2007)[PubMed]
- Osawa, M., Tokumitsu, H., Swindells, M. B. et al.: A novel target recognition revealed by calmodulin in complex with Ca2+-calmodulin-dependent kinase kinase. Nat. Struct. Biol., 6, 819-824 (1999)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院医学系研究科 修了,同年より同 特任研究員.
研究テーマ:神経活動のイメージング法の開発.シナプスから核へのシグナル伝達の機構.
関心事:山歩き.イメージングによる脳活動の計測および制御.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2014 井上昌俊・尾藤晴彦 Licensed under CC 表示 2.1 日本