小児における脳腫瘍のES細胞を用いたモデリング
船戸洸佑・Viviane Tabar
(米国Memorial Sloan-Kettering Cancer Center,Department of Neurosurgery)
email:船戸洸佑
DOI: 10.7875/first.author.2014.153
Use of human embryonic stem cells to model pediatric gliomas with H3.3K27M histone mutation.
Kosuke Funato, Tamara Major, Peter W. Lewis, C. David Allis, Viviane Tabar
Science, 346, 1529-1533 (2014)
小児びまん性橋膠腫は脳幹部のおもに橋に発生する悪性腫瘍である.近年の網羅的なゲノム解析により,小児びまん性橋膠腫の約70%の患者の検体から,ヒストンバリアントであるヒストンH3.3の27番目のLysがMetに置換するという変異が発見された.しかし,この変異によるがん化の機構についてはよくわかっていなかった.この研究では,ヒトのES細胞に由来する正常な神経幹細胞に,27番目のLysをMetへと変異させたヒストンH3.3を導入してがん化させることにより,がん化の機構の解明および新規の治療標的の探索を行った.その結果,この変異は神経幹細胞に対し特異的に増殖を亢進させること,また,ほかの変異と協調して細胞をがん化させることがわかった.また,マイクロアレイ法による遺伝子発現の解析やクロマチン免疫沈降-シークエンシング法による解析により,この変異は神経幹細胞を発生学的により原始的な細胞へと変化させていることが明らかにされた.さらに,がん化させた細胞を用いた薬剤スクリーニングにより,小児びまん性橋膠腫の新しい治療標的としてMEN1遺伝子が同定された.これらの結果から,ES細胞を用いたがんのモデリングが,変異の機能解析のみならず,新規の治療標的を探索する手法として有用であることが示された.
小児びまん性橋膠腫は脳幹部のおもに橋に発生する悪性腫瘍である.3~7歳の幼児に多く,呼吸や意識をつかさどる脳幹部に浸潤することから手術による摘出は困難である.そのため,一般的に放射線治療が行われるが,一時的に腫瘍が退縮してもふたたび増大することが多く,予後はきわめて悪い.現在まで,多くの抗がん剤が試されてきたが有効なものはなく,確立された治療法のないのが現状である.それゆえ,発症機構の解明や新しい治療法の開発が強くもとめられている.
近年の網羅的なゲノム解析により,小児びまん性橋膠腫を含む脳腫瘍における変異の全体像が明らかにされつつある.その一端として,小児びまん性橋膠腫の約70%の患者の検体から,ヒストンバリアントであるヒストンH3.3の27番目のLysがMetに置換するという変異が発見された1-4).ヌクレオソームを構成するヒストンのひとつであるヒストンH3.3は,ヒストンH3.1やヒストンH3.2と比べ4残基ないし5残基の違いしかないが,異なる発現様式や機能をもつことが知られている.興味深いことに,テント上の大脳に発生する小児腫瘍では27番目のLysのMetへの変異の代わりに,34番目のGlyがArgあるいはValに置換するという変異がみつかっており,脳幹部に発生する小児びまん性橋膠腫とテント上の大脳に発生する小児腫瘍は異なるがん化の機構をもつと考えられている.のちの研究により,ヒストンH3.3の27番目のLysのMetへの変異はヒストンの修飾において重要なPRC2複合体の活性を抑制し,ヒストンH3の27番目のLysのメチル化をゲノムの全体において減少させることがわかっている5-7).しかし,それがどのようにがん化につながるのか,その詳細な機構は未解明であった.そこで,この研究では,ヒトのES細胞に由来する正常な神経幹細胞に,27番目のLysをMetへと変異させたヒストンH3.3を導入してがん化させることにより,がん化の機構の解明および新規の治療標的の探索をめざした.
筆者らの研究室では,先行研究として,ヒトに由来するES細胞やiPS細胞をさまざまな神経系細胞に分化させる手法を確立している8,9).具体的には,Smadシグナル伝達の二重阻害によりES細胞を神経外胚葉へと分化させ,EGFあるいはFGFの存在のもとで培養することにより神経幹細胞を得ることができる.そののち,神経幹細胞は特定の培養条件においてニューロン,アストロサイト,オリゴデンドロサイトへとそれぞれ分化させることができる.まず,さまざまな細胞にヒストンH3.3の27番目のLysのMetへの変異を導入してその効果を調べた.その結果,この変異により,神経幹細胞では細胞の増殖が亢進したのに対し,ヒトのES細胞では変化はなく,アストロサイトおよび繊維芽細胞では逆に細胞の増殖が抑制され細胞老化をひき起こすことがわかった.これらの結果は,ヒストンH3.3の27番目のLysのMetへの変異の効果は細胞種に特異的であり,小児びまん性橋膠腫の由来は神経幹細胞,あるいは,それに近い前駆細胞であることが示唆された.一方で,テント上の大脳に発生する小児腫瘍にみられるヒストンH3.3の34番目のGlyのArgあるいはValへの変異では,神経幹細胞における増殖の亢進の効果はみられなかった.
ヒストンH3.3の27番目のLysのMetへの変異と,小児びまん性橋膠腫の患者でみつかっているほかの変異とを組み合わせることにより,神経幹細胞ががん化するかどうかを調べた.ヒストンH3.3の27番目のLysのMetへの変異と同時に,活性化型PDGF受容体およびp53をノックダウンするshRNAを導入した細胞では,細胞の増殖のさらなる亢進のほか,低密度培養および浮遊培養における増殖能の亢進,細胞の運動能の亢進,放射線への耐性,アストロサイトへの分化の抑制がみられた.興味深いことに,これらの効果はヒストンH3.3の27番目のLysのMetへの変異のみを導入した神経幹細胞ではみられず,ほかの変異と協調的にはたらくことががん化において重要であることが明らかになった.さらに,免疫不全マウスへの移植実験において,これら3つの変異をあわせもつ細胞では脳幹部に浸潤する腫瘍が形成されたのに対し,正常な神経幹細胞あるいは野生型のヒストンH3.3を導入した細胞ではめだった腫瘍の形成はみられなかった.
ヒストンH3.3の27番目のLysのMetへの変異によるがん化の機構を明らかにするため,遺伝子の発現およびヒストンの修飾について網羅的に解析した.まず,マイクロアレイ法による遺伝子発現の解析により,ヒストンH3.3の27番目のLysのMetへの変異により特異的に発現の変動する遺伝子を探索した.その結果,LIN28B遺伝子,PLAG1遺伝子,PLAGL1遺伝子など,初期の神経外胚葉のマーカーとして知られる遺伝子の発現が上昇していることが明らかになった10).これらの遺伝子はヒストンH3.3の27番目のLysのMetへの変異をもつ小児びまん性橋膠腫の患者の検体においても高発現しており,shRNAによりそれらをノックダウンするとがん化した細胞の増殖が有意に抑制された.さらに,クロマチン免疫沈降-シークエンシング法による解析により,ヒストンH3.3の27番目のLysのMetへの変異によりこれらの遺伝子の周辺のヒストン修飾が変化していることが明らかになった.とくに,ヒストンH3の27番目のLysのトリメチル化はゲノムの広い範囲にわたり顕著に減少し,Nkx2.2遺伝子やMBP遺伝子などの特定の分化制御遺伝子の周辺では逆に増加していた.このようなヒストンメチル化のゲノムワイドな変化は過去に報告されている知見とも一致した5-7).これらの結果より,ヒストンH3.3の27番目のLysのMetへの変異は,ヒストンの修飾を介して神経幹細胞を発生学的に“より原始的な細胞”へと変化させていることが示唆された.同様の現象はほかの小児の脳腫瘍においてもみられ11),初期の神経外胚葉様の未分化な細胞の存在ががん化に重要であると考えられた.
小児びまん性橋膠腫の新規の治療標的を探索するため,がん化させた神経幹細胞を用いて薬剤スクリーニングを行った.具体的には,GFPにより標識した正常な神経幹細胞と,RFPにより標識したがん化した神経幹細胞とを混合して培養し,個々の薬剤に対する感受性を蛍光の強度により定量した.薬剤ライブラリーとしてエピジェネティクスに関連するタンパク質を標的とする80の化合物,さらに,対照となる薬剤としてPDGF受容体を含むチロシンキナーゼに対する阻害剤であるイマチニブやスニチニブを用いた.
スクリーニングの結果,MEN1遺伝子にコードされるMeninに対する阻害剤であるMI-2が候補化合物として同定された12).MI-2はヒストンH3.3の27番目のLysのMetへの変異をもつ細胞の増殖を顕著に阻害し細胞死を誘導したのに対し,野生型のヒストンH3.3のみをもつ細胞ではこのような効果はみられなかった.同様の結果は,shRNAによりMeninをノックダウンすることによっても得られ,さらに,Meninの機能阻害によりがん化した細胞のアストロサイトへの分化能が回復した.また,Meninの発現はES細胞から神経幹細胞に分化する過程において低下し,ヒストンH3.3の27番目のLysのMetへの変異を導入することによりふたたび上昇することも明らかになった.さらに,阻害剤あるいはshRNAによるMeninの機能阻害により,免疫不全マウスの脳における腫瘍の増殖が有意に抑制されることがわかった.これらの結果から,MeninはヒストンH3.3の27番目のLysのMetへの変異をもつ小児びまん性橋膠腫の治療標的として有望であり,その阻害剤であるMI-2をシード化合物とした新規の薬剤の開発が期待される.
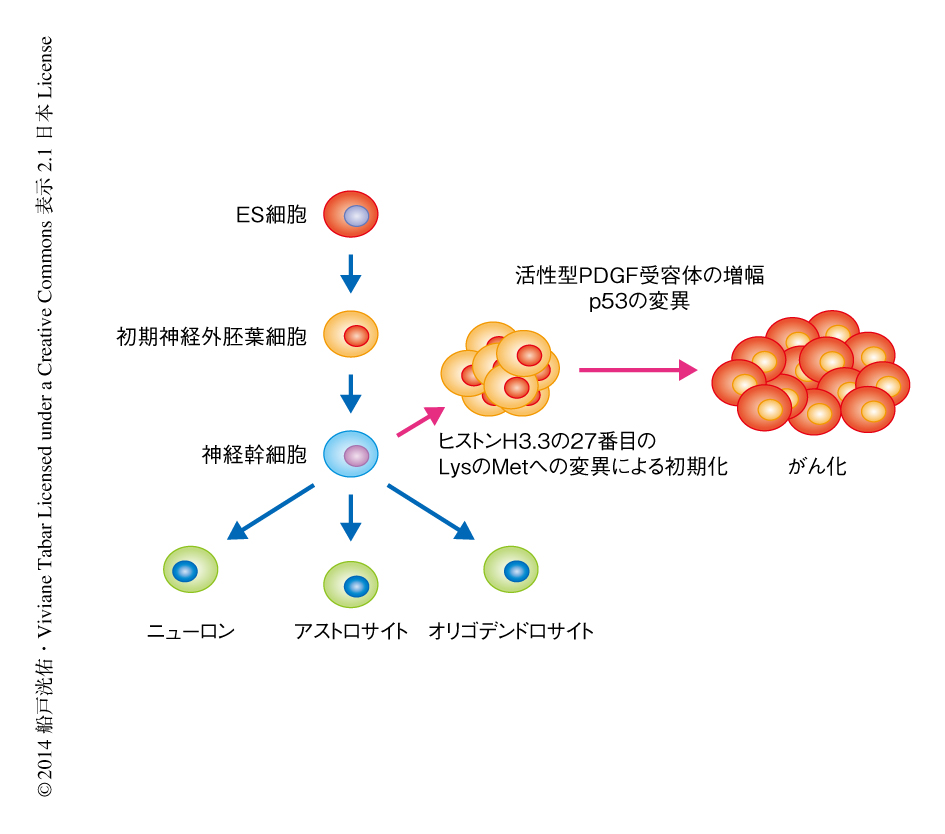
この研究では,ヒトのES細胞に由来する正常な神経幹細胞にヒストンH3.3の27番目のLysのMetへの変異を導入することにより,小児びまん性橋膠腫の発症機構の一端を明らかにした(図1).なお,ヒトのES細胞をがんのモデルとして使用した報告は,この研究がはじめてである.近年の次世代シークエンサーをはじめとしたゲノム解析技術の進歩により,多くのがんの変異を網羅的に解析することが可能になった.しかし,みつかった変異には機能が未知なものも多く含まれている.筆者らのES細胞を用いたモデルは,がん化における変異の役割を解析する手法として非常に有用である.また,大量培養のできるES細胞の利点を生かして大規模な薬剤スクリーニングを行うことにより,がんの治療あるいは早期の発見につながるような化合物や標的遺伝子の探索を効率的に進めることが可能である.今後は,ヒストンH3.3の27番目のLysのMetへの変異のさらなる機能解析と並行して,ほかの脳腫瘍においても同様の手法を用いて研究したい.
[Download]
略歴:2011年 東京大学大学院理学系研究科 修了,同年 東京大学分子細胞生物学研究所 研究員を経て,同年より米国Memorial Sloan-Kettering Cancer Center研究員.
研究テーマ:脳腫瘍の発症の機構.
抱負:基礎研究をとおして脳腫瘍の治療に貢献したい.
Viviane Tabar
米国Memorial Sloan-Kettering Cancer Center脳神経外科医.
© 2014 船戸洸佑・Viviane Tabar Licensed under CC 表示 2.1 日本
(米国Memorial Sloan-Kettering Cancer Center,Department of Neurosurgery)
email:船戸洸佑
DOI: 10.7875/first.author.2014.153
Use of human embryonic stem cells to model pediatric gliomas with H3.3K27M histone mutation.
Kosuke Funato, Tamara Major, Peter W. Lewis, C. David Allis, Viviane Tabar
Science, 346, 1529-1533 (2014)
要 約
小児びまん性橋膠腫は脳幹部のおもに橋に発生する悪性腫瘍である.近年の網羅的なゲノム解析により,小児びまん性橋膠腫の約70%の患者の検体から,ヒストンバリアントであるヒストンH3.3の27番目のLysがMetに置換するという変異が発見された.しかし,この変異によるがん化の機構についてはよくわかっていなかった.この研究では,ヒトのES細胞に由来する正常な神経幹細胞に,27番目のLysをMetへと変異させたヒストンH3.3を導入してがん化させることにより,がん化の機構の解明および新規の治療標的の探索を行った.その結果,この変異は神経幹細胞に対し特異的に増殖を亢進させること,また,ほかの変異と協調して細胞をがん化させることがわかった.また,マイクロアレイ法による遺伝子発現の解析やクロマチン免疫沈降-シークエンシング法による解析により,この変異は神経幹細胞を発生学的により原始的な細胞へと変化させていることが明らかにされた.さらに,がん化させた細胞を用いた薬剤スクリーニングにより,小児びまん性橋膠腫の新しい治療標的としてMEN1遺伝子が同定された.これらの結果から,ES細胞を用いたがんのモデリングが,変異の機能解析のみならず,新規の治療標的を探索する手法として有用であることが示された.
はじめに
小児びまん性橋膠腫は脳幹部のおもに橋に発生する悪性腫瘍である.3~7歳の幼児に多く,呼吸や意識をつかさどる脳幹部に浸潤することから手術による摘出は困難である.そのため,一般的に放射線治療が行われるが,一時的に腫瘍が退縮してもふたたび増大することが多く,予後はきわめて悪い.現在まで,多くの抗がん剤が試されてきたが有効なものはなく,確立された治療法のないのが現状である.それゆえ,発症機構の解明や新しい治療法の開発が強くもとめられている.
近年の網羅的なゲノム解析により,小児びまん性橋膠腫を含む脳腫瘍における変異の全体像が明らかにされつつある.その一端として,小児びまん性橋膠腫の約70%の患者の検体から,ヒストンバリアントであるヒストンH3.3の27番目のLysがMetに置換するという変異が発見された1-4).ヌクレオソームを構成するヒストンのひとつであるヒストンH3.3は,ヒストンH3.1やヒストンH3.2と比べ4残基ないし5残基の違いしかないが,異なる発現様式や機能をもつことが知られている.興味深いことに,テント上の大脳に発生する小児腫瘍では27番目のLysのMetへの変異の代わりに,34番目のGlyがArgあるいはValに置換するという変異がみつかっており,脳幹部に発生する小児びまん性橋膠腫とテント上の大脳に発生する小児腫瘍は異なるがん化の機構をもつと考えられている.のちの研究により,ヒストンH3.3の27番目のLysのMetへの変異はヒストンの修飾において重要なPRC2複合体の活性を抑制し,ヒストンH3の27番目のLysのメチル化をゲノムの全体において減少させることがわかっている5-7).しかし,それがどのようにがん化につながるのか,その詳細な機構は未解明であった.そこで,この研究では,ヒトのES細胞に由来する正常な神経幹細胞に,27番目のLysをMetへと変異させたヒストンH3.3を導入してがん化させることにより,がん化の機構の解明および新規の治療標的の探索をめざした.
1.ヒストンH3.3の27番目のLysのMetへの変異はほかの変異と協調して神経幹細胞をがん化させる
筆者らの研究室では,先行研究として,ヒトに由来するES細胞やiPS細胞をさまざまな神経系細胞に分化させる手法を確立している8,9).具体的には,Smadシグナル伝達の二重阻害によりES細胞を神経外胚葉へと分化させ,EGFあるいはFGFの存在のもとで培養することにより神経幹細胞を得ることができる.そののち,神経幹細胞は特定の培養条件においてニューロン,アストロサイト,オリゴデンドロサイトへとそれぞれ分化させることができる.まず,さまざまな細胞にヒストンH3.3の27番目のLysのMetへの変異を導入してその効果を調べた.その結果,この変異により,神経幹細胞では細胞の増殖が亢進したのに対し,ヒトのES細胞では変化はなく,アストロサイトおよび繊維芽細胞では逆に細胞の増殖が抑制され細胞老化をひき起こすことがわかった.これらの結果は,ヒストンH3.3の27番目のLysのMetへの変異の効果は細胞種に特異的であり,小児びまん性橋膠腫の由来は神経幹細胞,あるいは,それに近い前駆細胞であることが示唆された.一方で,テント上の大脳に発生する小児腫瘍にみられるヒストンH3.3の34番目のGlyのArgあるいはValへの変異では,神経幹細胞における増殖の亢進の効果はみられなかった.
ヒストンH3.3の27番目のLysのMetへの変異と,小児びまん性橋膠腫の患者でみつかっているほかの変異とを組み合わせることにより,神経幹細胞ががん化するかどうかを調べた.ヒストンH3.3の27番目のLysのMetへの変異と同時に,活性化型PDGF受容体およびp53をノックダウンするshRNAを導入した細胞では,細胞の増殖のさらなる亢進のほか,低密度培養および浮遊培養における増殖能の亢進,細胞の運動能の亢進,放射線への耐性,アストロサイトへの分化の抑制がみられた.興味深いことに,これらの効果はヒストンH3.3の27番目のLysのMetへの変異のみを導入した神経幹細胞ではみられず,ほかの変異と協調的にはたらくことががん化において重要であることが明らかになった.さらに,免疫不全マウスへの移植実験において,これら3つの変異をあわせもつ細胞では脳幹部に浸潤する腫瘍が形成されたのに対し,正常な神経幹細胞あるいは野生型のヒストンH3.3を導入した細胞ではめだった腫瘍の形成はみられなかった.
2.ヒストンH3.3の27番目のLysのMetへの変異は神経幹細胞をより原始的な細胞へと変化させる
ヒストンH3.3の27番目のLysのMetへの変異によるがん化の機構を明らかにするため,遺伝子の発現およびヒストンの修飾について網羅的に解析した.まず,マイクロアレイ法による遺伝子発現の解析により,ヒストンH3.3の27番目のLysのMetへの変異により特異的に発現の変動する遺伝子を探索した.その結果,LIN28B遺伝子,PLAG1遺伝子,PLAGL1遺伝子など,初期の神経外胚葉のマーカーとして知られる遺伝子の発現が上昇していることが明らかになった10).これらの遺伝子はヒストンH3.3の27番目のLysのMetへの変異をもつ小児びまん性橋膠腫の患者の検体においても高発現しており,shRNAによりそれらをノックダウンするとがん化した細胞の増殖が有意に抑制された.さらに,クロマチン免疫沈降-シークエンシング法による解析により,ヒストンH3.3の27番目のLysのMetへの変異によりこれらの遺伝子の周辺のヒストン修飾が変化していることが明らかになった.とくに,ヒストンH3の27番目のLysのトリメチル化はゲノムの広い範囲にわたり顕著に減少し,Nkx2.2遺伝子やMBP遺伝子などの特定の分化制御遺伝子の周辺では逆に増加していた.このようなヒストンメチル化のゲノムワイドな変化は過去に報告されている知見とも一致した5-7).これらの結果より,ヒストンH3.3の27番目のLysのMetへの変異は,ヒストンの修飾を介して神経幹細胞を発生学的に“より原始的な細胞”へと変化させていることが示唆された.同様の現象はほかの小児の脳腫瘍においてもみられ11),初期の神経外胚葉様の未分化な細胞の存在ががん化に重要であると考えられた.
3.MEN1遺伝子は小児びまん性橋膠腫の新規の治療標的である
小児びまん性橋膠腫の新規の治療標的を探索するため,がん化させた神経幹細胞を用いて薬剤スクリーニングを行った.具体的には,GFPにより標識した正常な神経幹細胞と,RFPにより標識したがん化した神経幹細胞とを混合して培養し,個々の薬剤に対する感受性を蛍光の強度により定量した.薬剤ライブラリーとしてエピジェネティクスに関連するタンパク質を標的とする80の化合物,さらに,対照となる薬剤としてPDGF受容体を含むチロシンキナーゼに対する阻害剤であるイマチニブやスニチニブを用いた.
スクリーニングの結果,MEN1遺伝子にコードされるMeninに対する阻害剤であるMI-2が候補化合物として同定された12).MI-2はヒストンH3.3の27番目のLysのMetへの変異をもつ細胞の増殖を顕著に阻害し細胞死を誘導したのに対し,野生型のヒストンH3.3のみをもつ細胞ではこのような効果はみられなかった.同様の結果は,shRNAによりMeninをノックダウンすることによっても得られ,さらに,Meninの機能阻害によりがん化した細胞のアストロサイトへの分化能が回復した.また,Meninの発現はES細胞から神経幹細胞に分化する過程において低下し,ヒストンH3.3の27番目のLysのMetへの変異を導入することによりふたたび上昇することも明らかになった.さらに,阻害剤あるいはshRNAによるMeninの機能阻害により,免疫不全マウスの脳における腫瘍の増殖が有意に抑制されることがわかった.これらの結果から,MeninはヒストンH3.3の27番目のLysのMetへの変異をもつ小児びまん性橋膠腫の治療標的として有望であり,その阻害剤であるMI-2をシード化合物とした新規の薬剤の開発が期待される.
おわりに
この研究では,ヒトのES細胞に由来する正常な神経幹細胞にヒストンH3.3の27番目のLysのMetへの変異を導入することにより,小児びまん性橋膠腫の発症機構の一端を明らかにした(図1).なお,ヒトのES細胞をがんのモデルとして使用した報告は,この研究がはじめてである.近年の次世代シークエンサーをはじめとしたゲノム解析技術の進歩により,多くのがんの変異を網羅的に解析することが可能になった.しかし,みつかった変異には機能が未知なものも多く含まれている.筆者らのES細胞を用いたモデルは,がん化における変異の役割を解析する手法として非常に有用である.また,大量培養のできるES細胞の利点を生かして大規模な薬剤スクリーニングを行うことにより,がんの治療あるいは早期の発見につながるような化合物や標的遺伝子の探索を効率的に進めることが可能である.今後は,ヒストンH3.3の27番目のLysのMetへの変異のさらなる機能解析と並行して,ほかの脳腫瘍においても同様の手法を用いて研究したい.
[Download]
文 献
- Schwartzentruber, J., Korshunov, A., Liu, X. Y. et al.: Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature, 482, 226-231 (2012)[PubMed]
- Wu, G., Broniscer, A., McEachron, T. A. et al.: Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and non-brainstem glioblastomas. Nat. Genet., 44, 251-253 (2012)[PubMed]
- Sturm, D., Witt, H., Hovestadt, V. et al.: Hotspot mutations in H3F3A and IDH1 define distinct epigenetic and biological subgroups of glioblastoma. Cancer Cell, 22, 425-437 (2012)[PubMed]
- Zhang, J., Wu, G., Miller, C. P. et al.: Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas. Nat. Genet., 45, 602-612 (2013)[PubMed]
- Lewis, P. W., Muller, M. M., Koletsky, M. S. et al.: Inhibition of PRC2 activity by a gain-of-function H3 mutation found in pediatric glioblastoma. Science, 340, 857-861 (2013)[PubMed]
- Chan, K. M., Fang, D., Gan, H. et al.: The histone H3.3K27M mutation in pediatric glioma reprograms H3K27 methylation and gene expression. Genes Dev., 27, 985-990 (2013)[PubMed]
- Bender, S., Tang, Y., Lindroth, A. M. et al.: Reduced H3K27me3 and DNA hypomethylation are major drivers of gene expression in K27M mutant pediatric high-grade gliomas. Cancer Cell, 24, 660-672 (2013)[PubMed]
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P. et al.: Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat. Biotechnol., 27, 275-280 (2009)[PubMed]
- Lafaille, F. G., Pessach, I. M., Zhang, S. Y. et al.: Impaired intrinsic immunity to HSV-1 in human iPSC-derived TLR3-deficient CNS cells. Nature, 491, 769-773 (2012)[PubMed]
- Elkabetz, Y., Panagiotakos, G., Al Shamy, G. et al.: Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev., 22, 152-165 (2008)[PubMed]
- Kleinman, C. L., Gerges, N., Papillon-Cavanagh, S. et al.: Fusion of TTYH1 with the C19MC microRNA cluster drives expression of a brain-specific DNMT3B isoform in the embryonal brain tumor ETMR. Nat. Genet., 46, 39-44 (2014)[PubMed]
- Grembecka, J., He, S., Shi, A. et al.: Menin-MLL inhibitors reverse oncogenic activity of MLL fusion proteins in leukemia. Nat. Chem. Biol., 8, 277-284 (2012)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院理学系研究科 修了,同年 東京大学分子細胞生物学研究所 研究員を経て,同年より米国Memorial Sloan-Kettering Cancer Center研究員.
研究テーマ:脳腫瘍の発症の機構.
抱負:基礎研究をとおして脳腫瘍の治療に貢献したい.
Viviane Tabar
米国Memorial Sloan-Kettering Cancer Center脳神経外科医.
© 2014 船戸洸佑・Viviane Tabar Licensed under CC 表示 2.1 日本