リボソームおよび新規のペプチドリガーゼによる協同的なペプチドの生成
大利 徹1・森田洋行2
(1北海道大学大学院工学研究院 生物機能高分子部門応用生物化学研究室,2富山大学和漢医薬学総合研究所 資源開発部門天然物化学分野)
email:大利 徹,森田洋行
DOI: 10.7875/first.author.2014.149
A peptide ligase and the ribosome cooperate to synthesize the peptide pheganomycin.
Motoyoshi Noike, Takashi Matsui, Koichi Ooya, Ikuo Sasaki, Shouta Ohtaki, Yoshimitsu Hamano, Chitose Maruyama, Jun Ishikawa, Yasuharu Satoh, Hajime Ito, Hiroyuki Morita, Tohru Dairi
Nature Chemical Biology, 11, 71-76 (2015)
放線菌の生産するペプチド系抗生物質フェガノマイシンは,非タンパク質性のアミノ酸からなるL-ジヒドロキシアミジノフェニルグリシンと,タンパク質性のアミノ酸からなるAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrとがペプチド結合した2種類が知られている.フェガノマイシンは非リボソームペプチド合成酵素により生合成されると推定されていたが,非リボソームペプチド合成酵素による基質の認識は厳密であり,2種類の配列および長さからなるペプチドを生成する機構は説明できなかった.解析の結果,新規のペプチドリガーゼPGM1が,まず,L-ジヒドロキシアミジノフェニルグリシンをリン酸化により活性化し,ついで,リボソームにより生合成されたAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrが求核剤としてはたらきペプチド結合を形成することが明らかになった.このPGM1はペプチドを求核剤として用いるはじめての例であり,また,リボソームとそれ以外の機構とが協同してペプチドの基本骨格を形成するはじめての例でもあった.PGM1は幅広い基質特異性を示し,2残基から18残基までの多様なペプチドを求核剤として利用することができた.結晶構造解析の結果,活性残基の周辺に大きな基質認識ポケットが存在した.また,L-ジヒドロキシアミジノフェニルグリシンおよびタンパク質性のアミノ酸からなるペプチドの認識に重要な残基を見い出すことに成功し,変異導入実験によりこれらの関与が確認された.
天然におけるペプチド系抗生物質の生合成においては,リボソームの関与するペプチドの生合成機構にくわえ1),非リボソームペプチド合成酵素に代表されるリボソームの関与しない生合成機構も用いられている2).リボソームの関与するものとしては,乳酸菌が生産し特徴的なアミノ酸であるランチオニンを含むランチビオテックに関する先駆的な研究がある3).また,放線菌においては内部にSerあるいはCysに由来するオキサゾール環骨格あるいはチアゾール環骨格をもつものや,ペプチド骨格が環化修飾,プレニル化修飾,グリコシル化修飾されている例もある.また最近,カイメンのメタゲノムからポリセオナミドの生合成遺伝子がクローニングされ,わずか6つの酵素がエピメリ化を含む48もの修飾反応を行うことが示され4),新たな生合成機構として注目されている.他方,非リボソームペプチド合成酵素によるものでは,タンパク質性あるいは非タンパク質性のアミノ酸をアデニル化したのち,縮合反応によりペプチド結合を形成する.多くの場合,エピメリ化,ヘテロ環化,メチル化などペプチド骨格の修飾や,ポリケチドや脂質などほかの骨格との結合をともなう.さらに近年,ATP依存性のアミノ酸リガーゼや5),tRNAに依存する環状ジペプチドの生合成機構も報告されている6).しかし,ペプチド骨格そのものはリボソームあるいは非リボソームペプチド合成酵素のいずれかにより生合成される.
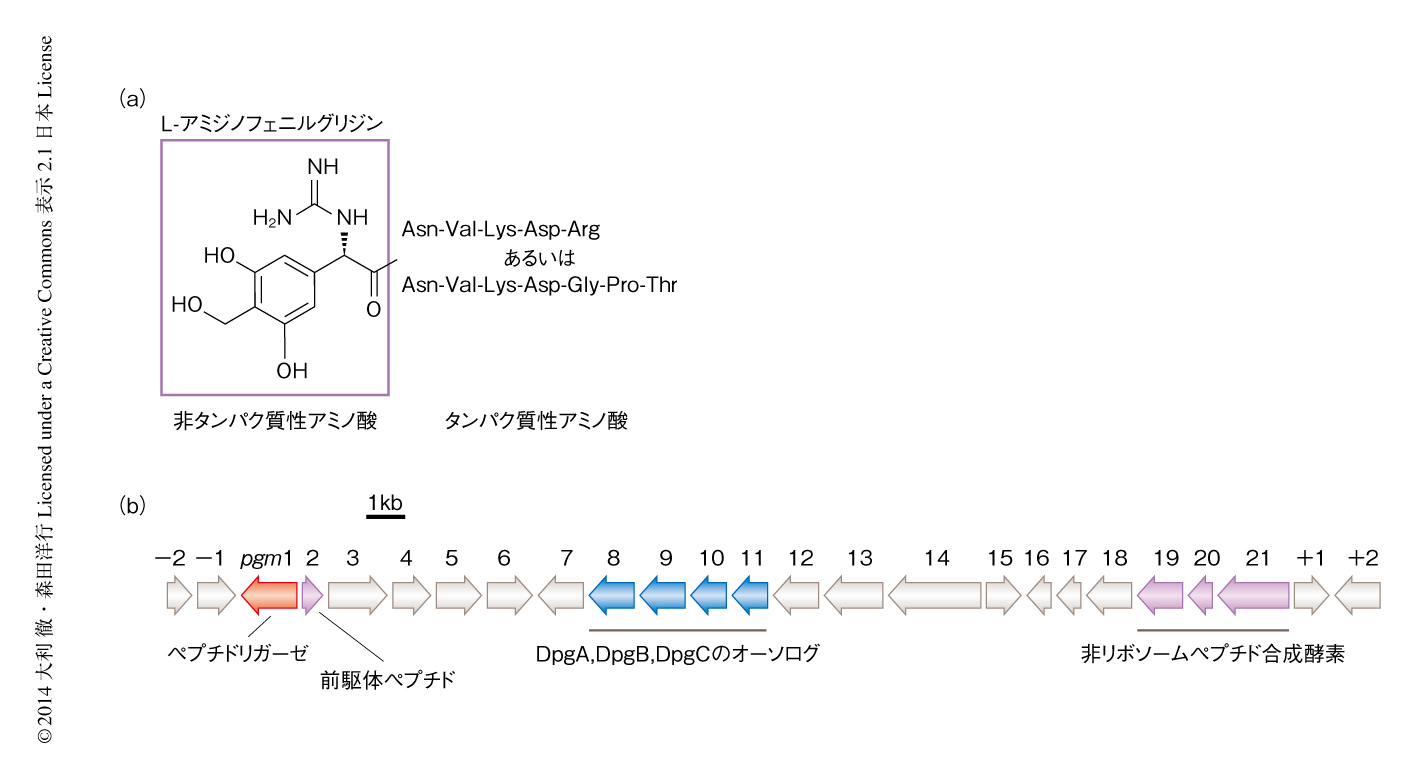
放線菌の生産するペプチド系抗生物質フェガノマイシン(図1a)は,非タンパク質性のアミノ酸からなるL-ジヒドロキシアミジノフェニルグリシンに,タンパク質性のアミノ酸からなるAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrが結合した2種類が知られている.フェガノマイシンは非タンパク質性のアミノ酸をもつことから非リボソームペプチド合成酵素により生合成されると推定されていたが,一般に,非リボソームペプチド合成酵素による基質アミノ酸の認識は厳密であり,どのように2種類の配列および長さからなるペプチドが生合成されるのか興味がもたれていた.
放線菌において抗生物質生合成遺伝子はクラスターを形成することが知られている.そこで,フェガノマイシンの生合成機構を推定するため,フェガノマイシン生合成遺伝子クラスターをクローニングした.バンコマイシンのもつL-ジヒドロキシアミジノフェニルグリシン骨格はIII型ポリケチド生合成酵素および修飾酵素であるDpgA,DpgB,DpgCにより生合成されることが報告されている7).そこで,それらのオーソログの遺伝子を放線菌のドラフトゲノム配列において探索した結果,フェガノマイシン生合成遺伝子クラスターを見い出すことに成功した(図1b).この遺伝子クラスターにはL-ジヒドロキシアミジノフェニルグリシンの修飾に関与すると推定される酵素の遺伝子が存在したが,フェガノマイシンを生合成するのに必要な最大で8つのAドメインをもつ非リボソームペプチド合成酵素の遺伝子は存在しなかった.そこで,この遺伝子クラスターにはペプチダーゼの遺伝子が存在したことも考慮し,タンパク質性のアミノ酸からなるペプチドがリボソームにより生合成される可能性を考え配列を精査した結果,38残基をコードする遺伝子を見い出した.この遺伝子にコードされる前駆体ペプチドはAsn-Val-Lys-Asp-ArgおよびAsn-Val-Lys-Asp-Gly-Pro-Thrの両方の配列を含んでおり,フェガノマイシンの多様性を矛盾なく説明できた.実際に,この遺伝子を欠失させた変異株ではフェガノマイシンの産生が消失したことから,Asn-Val-Lys-Asp-ArgおよびAsn-Val-Lys-Asp-Gly-Pro-Thrはリボソームによる生合成により供給されると結論づけた.
フェガノマイシン生合成遺伝子クラスターにはL-ジヒドロキシアミジノフェニルグリシンとタンパク質性のアミノ酸からなるペプチドとのペプチド結合を触媒する酵素の候補として,非リボソームペプチド合成酵素のAドメイン(1つ),Tドメイン,Cドメインをコードする遺伝子が存在した(図1b).これまで,非リボソームペプチド合成酵素のAドメインにより活性化されたアミノ酸に対し,ペプチドが求核剤となり非リボソームペプチド合成酵素のCドメインにより縮合されてペプチド結合が形成されたという報告はなかったが,その可能性を確かめるため,非リボソームペプチド合成酵素のCドメインを含む遺伝子を破壊した.その結果,この破壊株はフェガノマイシンの産生を維持したことから,非リボソームペプチド合成酵素はフェガノマイシンの生合成には関与しないと結論づけた.
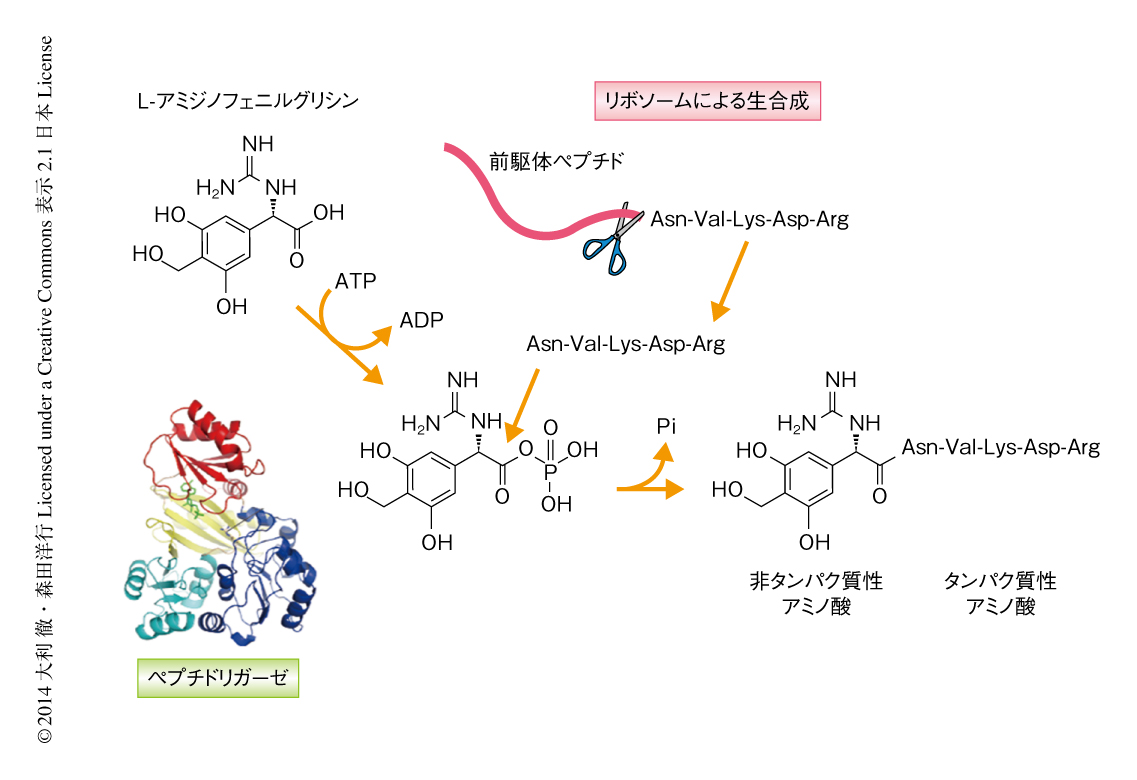
そこで,フェガノマイシン生合成遺伝子クラスターに存在する機能未知の遺伝子がフェガノマイシンの生合成に関与する可能性について検討した.既知のペプチドリガーゼはATPを基質の活性化に用いる場合が多いことから,ATP結合モチーフをもつORFを探索し,前駆体ペプチドをコードする遺伝子のとなりにATP-graspモチーフをもつ遺伝子を見い出した.この遺伝子を破壊したところフェガノマイシンの産生が消失したことから,この遺伝子がフェガノマイシンの生合成に関与することがわかった.そこで,この遺伝子にコードされるPGM1の組換えタンパク質を調製し,化学合成したL-アミジノフェニルグリシン(本来の基質は市販されていないため,構造類縁体を有機合成した)とAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-ThrをMg2+およびATPの存在のもとで反応させた結果,この2つの基質がペプチド結合した化合物が生成した.また,ATP-graspモチーフの存在から予想されたように,このPGM1は基質をATPを用いたリン酸化により活性化し,ペプチドが求核剤となりペプチド結合を形成することがわかった.これまで,ATP-graspモチーフをもついくつかの酵素の機能解析が行われているが,PGM1はペプチドを求核剤として用いるはじめての例であり,また,リボソームとそれ以外の機構とが協同してペプチドの基本骨格を形成するはじめての例でもあった.
PGM1の組換えタンパク質を用いてその酵素学的な性質について検討した結果,PGM1は幅広い基質特異性をもつことがわかった.D-アミジノフェニルグリシン,2-グアニジノ酢酸,クレアチンも基質となった.求核剤に関してはさらに幅広い基質特異性を示し,2残基から18残基までの多様なペプチドを求核剤として利用することができ,フェガノマイシンとはまったく関連のない,人工甘味料であるアスパルテームや昆虫に由来する抗菌ペプチドであるアピダエシンなど多様なペプチドが基質になることがわかった.逆の見方をすれば,PGM1は種々のペプチドのN末端キャッピング酵素であるといえた.したがって,PGM1により多様なペプチドのN末端に非タンパク質性のアミノ酸からなるL-アミジノフェニルグリシンを付加することにより,種々のエキソ型のペプチド分解酵素からペプチドを保護できる可能性が示唆された.
PGM1の示す幅広い基質特異性について理解するため結晶構造解析を行った.種々の基質との結晶化を試みた結果,AMPとの複合体として結晶を得ることができた.結晶構造解析の結果(PDB ID:3WVR),配列相同性は18%と低いが,同じくATP-graspモチーフをもつグリシンアミドリボヌクレオチドシンテターゼと構造的に類似していることがわかった.また,ペプチドという巨大分子を基質として認識しうる,ほかの酵素にはみられないような大きな空洞と長い割れ目からなる活性中心,および,L-アミジノフェニルグリシンの認識およびタンパク質性のアミノ酸からなるペプチドの認識に重要な残基を見い出すことができ,変異酵素を用いた生化学的な解析によりこれらの関与が確認された.
放線菌の生産するペプチド系抗生物質フェガノマイシンの生合成について,非タンパク質性のアミノ酸からなるL-アミジノフェニルグリシンを認識し,リン酸化により活性化したのち,リボソームにより生合成された前駆体ペプチドに由来するペプチドを求核剤として用い,この2つの基質のあいだでペプチド結合を形成する新規の酵素を見い出した(図2).また,結晶構造解析および変異導入実験により活性中心および反応に関与する残基を同定した.この酵素は幅広い基質特異性をもつことから,種々のペプチドのN末端キャッピング酵素であるともいえ,医薬品として生理活性ペプチドを使用する場合の欠点のひとつであるエキソ型ペプチド分解酵素からの保護,あるいは,液体クロマトグラフィー-質量分析計を用いたプロテオーム解析において内部標準の作成などにも応用が可能と考えられた.
略歴:1992年 東京大学大学院農学系研究科にて博士号取得,協和発酵工業,1994年 富山県立大学工学部 助手,1995年同 助教授を経て,2010年より北海道大学大学院工学研究院 教授.
研究テーマ:微生物のもつ新規の生合成経路および代謝経路.
森田 洋行(Hiroyuki Morita)
富山大学和漢医薬学総合研究所 教授.
© 2014 大利 徹・森田洋行 Licensed under CC 表示 2.1 日本
(1北海道大学大学院工学研究院 生物機能高分子部門応用生物化学研究室,2富山大学和漢医薬学総合研究所 資源開発部門天然物化学分野)
email:大利 徹,森田洋行
DOI: 10.7875/first.author.2014.149
A peptide ligase and the ribosome cooperate to synthesize the peptide pheganomycin.
Motoyoshi Noike, Takashi Matsui, Koichi Ooya, Ikuo Sasaki, Shouta Ohtaki, Yoshimitsu Hamano, Chitose Maruyama, Jun Ishikawa, Yasuharu Satoh, Hajime Ito, Hiroyuki Morita, Tohru Dairi
Nature Chemical Biology, 11, 71-76 (2015)
要 約
放線菌の生産するペプチド系抗生物質フェガノマイシンは,非タンパク質性のアミノ酸からなるL-ジヒドロキシアミジノフェニルグリシンと,タンパク質性のアミノ酸からなるAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrとがペプチド結合した2種類が知られている.フェガノマイシンは非リボソームペプチド合成酵素により生合成されると推定されていたが,非リボソームペプチド合成酵素による基質の認識は厳密であり,2種類の配列および長さからなるペプチドを生成する機構は説明できなかった.解析の結果,新規のペプチドリガーゼPGM1が,まず,L-ジヒドロキシアミジノフェニルグリシンをリン酸化により活性化し,ついで,リボソームにより生合成されたAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrが求核剤としてはたらきペプチド結合を形成することが明らかになった.このPGM1はペプチドを求核剤として用いるはじめての例であり,また,リボソームとそれ以外の機構とが協同してペプチドの基本骨格を形成するはじめての例でもあった.PGM1は幅広い基質特異性を示し,2残基から18残基までの多様なペプチドを求核剤として利用することができた.結晶構造解析の結果,活性残基の周辺に大きな基質認識ポケットが存在した.また,L-ジヒドロキシアミジノフェニルグリシンおよびタンパク質性のアミノ酸からなるペプチドの認識に重要な残基を見い出すことに成功し,変異導入実験によりこれらの関与が確認された.
はじめに
天然におけるペプチド系抗生物質の生合成においては,リボソームの関与するペプチドの生合成機構にくわえ1),非リボソームペプチド合成酵素に代表されるリボソームの関与しない生合成機構も用いられている2).リボソームの関与するものとしては,乳酸菌が生産し特徴的なアミノ酸であるランチオニンを含むランチビオテックに関する先駆的な研究がある3).また,放線菌においては内部にSerあるいはCysに由来するオキサゾール環骨格あるいはチアゾール環骨格をもつものや,ペプチド骨格が環化修飾,プレニル化修飾,グリコシル化修飾されている例もある.また最近,カイメンのメタゲノムからポリセオナミドの生合成遺伝子がクローニングされ,わずか6つの酵素がエピメリ化を含む48もの修飾反応を行うことが示され4),新たな生合成機構として注目されている.他方,非リボソームペプチド合成酵素によるものでは,タンパク質性あるいは非タンパク質性のアミノ酸をアデニル化したのち,縮合反応によりペプチド結合を形成する.多くの場合,エピメリ化,ヘテロ環化,メチル化などペプチド骨格の修飾や,ポリケチドや脂質などほかの骨格との結合をともなう.さらに近年,ATP依存性のアミノ酸リガーゼや5),tRNAに依存する環状ジペプチドの生合成機構も報告されている6).しかし,ペプチド骨格そのものはリボソームあるいは非リボソームペプチド合成酵素のいずれかにより生合成される.
放線菌の生産するペプチド系抗生物質フェガノマイシン(図1a)は,非タンパク質性のアミノ酸からなるL-ジヒドロキシアミジノフェニルグリシンに,タンパク質性のアミノ酸からなるAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-Thrが結合した2種類が知られている.フェガノマイシンは非タンパク質性のアミノ酸をもつことから非リボソームペプチド合成酵素により生合成されると推定されていたが,一般に,非リボソームペプチド合成酵素による基質アミノ酸の認識は厳密であり,どのように2種類の配列および長さからなるペプチドが生合成されるのか興味がもたれていた.
1.フェガノマイシン生合成遺伝子クラスターのクローニング
放線菌において抗生物質生合成遺伝子はクラスターを形成することが知られている.そこで,フェガノマイシンの生合成機構を推定するため,フェガノマイシン生合成遺伝子クラスターをクローニングした.バンコマイシンのもつL-ジヒドロキシアミジノフェニルグリシン骨格はIII型ポリケチド生合成酵素および修飾酵素であるDpgA,DpgB,DpgCにより生合成されることが報告されている7).そこで,それらのオーソログの遺伝子を放線菌のドラフトゲノム配列において探索した結果,フェガノマイシン生合成遺伝子クラスターを見い出すことに成功した(図1b).この遺伝子クラスターにはL-ジヒドロキシアミジノフェニルグリシンの修飾に関与すると推定される酵素の遺伝子が存在したが,フェガノマイシンを生合成するのに必要な最大で8つのAドメインをもつ非リボソームペプチド合成酵素の遺伝子は存在しなかった.そこで,この遺伝子クラスターにはペプチダーゼの遺伝子が存在したことも考慮し,タンパク質性のアミノ酸からなるペプチドがリボソームにより生合成される可能性を考え配列を精査した結果,38残基をコードする遺伝子を見い出した.この遺伝子にコードされる前駆体ペプチドはAsn-Val-Lys-Asp-ArgおよびAsn-Val-Lys-Asp-Gly-Pro-Thrの両方の配列を含んでおり,フェガノマイシンの多様性を矛盾なく説明できた.実際に,この遺伝子を欠失させた変異株ではフェガノマイシンの産生が消失したことから,Asn-Val-Lys-Asp-ArgおよびAsn-Val-Lys-Asp-Gly-Pro-Thrはリボソームによる生合成により供給されると結論づけた.
2.ペプチド結合の形成を触媒する酵素の探索
フェガノマイシン生合成遺伝子クラスターにはL-ジヒドロキシアミジノフェニルグリシンとタンパク質性のアミノ酸からなるペプチドとのペプチド結合を触媒する酵素の候補として,非リボソームペプチド合成酵素のAドメイン(1つ),Tドメイン,Cドメインをコードする遺伝子が存在した(図1b).これまで,非リボソームペプチド合成酵素のAドメインにより活性化されたアミノ酸に対し,ペプチドが求核剤となり非リボソームペプチド合成酵素のCドメインにより縮合されてペプチド結合が形成されたという報告はなかったが,その可能性を確かめるため,非リボソームペプチド合成酵素のCドメインを含む遺伝子を破壊した.その結果,この破壊株はフェガノマイシンの産生を維持したことから,非リボソームペプチド合成酵素はフェガノマイシンの生合成には関与しないと結論づけた.
そこで,フェガノマイシン生合成遺伝子クラスターに存在する機能未知の遺伝子がフェガノマイシンの生合成に関与する可能性について検討した.既知のペプチドリガーゼはATPを基質の活性化に用いる場合が多いことから,ATP結合モチーフをもつORFを探索し,前駆体ペプチドをコードする遺伝子のとなりにATP-graspモチーフをもつ遺伝子を見い出した.この遺伝子を破壊したところフェガノマイシンの産生が消失したことから,この遺伝子がフェガノマイシンの生合成に関与することがわかった.そこで,この遺伝子にコードされるPGM1の組換えタンパク質を調製し,化学合成したL-アミジノフェニルグリシン(本来の基質は市販されていないため,構造類縁体を有機合成した)とAsn-Val-Lys-Asp-ArgあるいはAsn-Val-Lys-Asp-Gly-Pro-ThrをMg2+およびATPの存在のもとで反応させた結果,この2つの基質がペプチド結合した化合物が生成した.また,ATP-graspモチーフの存在から予想されたように,このPGM1は基質をATPを用いたリン酸化により活性化し,ペプチドが求核剤となりペプチド結合を形成することがわかった.これまで,ATP-graspモチーフをもついくつかの酵素の機能解析が行われているが,PGM1はペプチドを求核剤として用いるはじめての例であり,また,リボソームとそれ以外の機構とが協同してペプチドの基本骨格を形成するはじめての例でもあった.
3.PGM1は幅広い基質特異性をもつ
PGM1の組換えタンパク質を用いてその酵素学的な性質について検討した結果,PGM1は幅広い基質特異性をもつことがわかった.D-アミジノフェニルグリシン,2-グアニジノ酢酸,クレアチンも基質となった.求核剤に関してはさらに幅広い基質特異性を示し,2残基から18残基までの多様なペプチドを求核剤として利用することができ,フェガノマイシンとはまったく関連のない,人工甘味料であるアスパルテームや昆虫に由来する抗菌ペプチドであるアピダエシンなど多様なペプチドが基質になることがわかった.逆の見方をすれば,PGM1は種々のペプチドのN末端キャッピング酵素であるといえた.したがって,PGM1により多様なペプチドのN末端に非タンパク質性のアミノ酸からなるL-アミジノフェニルグリシンを付加することにより,種々のエキソ型のペプチド分解酵素からペプチドを保護できる可能性が示唆された.
4.PGM1の結晶構造
PGM1の示す幅広い基質特異性について理解するため結晶構造解析を行った.種々の基質との結晶化を試みた結果,AMPとの複合体として結晶を得ることができた.結晶構造解析の結果(PDB ID:3WVR),配列相同性は18%と低いが,同じくATP-graspモチーフをもつグリシンアミドリボヌクレオチドシンテターゼと構造的に類似していることがわかった.また,ペプチドという巨大分子を基質として認識しうる,ほかの酵素にはみられないような大きな空洞と長い割れ目からなる活性中心,および,L-アミジノフェニルグリシンの認識およびタンパク質性のアミノ酸からなるペプチドの認識に重要な残基を見い出すことができ,変異酵素を用いた生化学的な解析によりこれらの関与が確認された.
おわりに
放線菌の生産するペプチド系抗生物質フェガノマイシンの生合成について,非タンパク質性のアミノ酸からなるL-アミジノフェニルグリシンを認識し,リン酸化により活性化したのち,リボソームにより生合成された前駆体ペプチドに由来するペプチドを求核剤として用い,この2つの基質のあいだでペプチド結合を形成する新規の酵素を見い出した(図2).また,結晶構造解析および変異導入実験により活性中心および反応に関与する残基を同定した.この酵素は幅広い基質特異性をもつことから,種々のペプチドのN末端キャッピング酵素であるともいえ,医薬品として生理活性ペプチドを使用する場合の欠点のひとつであるエキソ型ペプチド分解酵素からの保護,あるいは,液体クロマトグラフィー-質量分析計を用いたプロテオーム解析において内部標準の作成などにも応用が可能と考えられた.
文 献
- Arnison, P. G., Bibb, M. J., Bierbaum, G. et al.: Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat. Prod. Rep., 30, 108-160 (2013)[PubMed]
- Koglin, A. & Walsh, C. T.: Structural insights into nonribosomal peptide enzymatic assembly lines. Nat. Prod. Rep., 26, 987-1000 (2009)[PubMed]
- Asaduzzaman, S. M. & Sonomoto, K.: Lantibiotics: diverse activities and unique modes of action. J. Biosci. Bioeng., 107, 475-487 (2009)[PubMed]
- Freeman, M. F., Gurgui, C., Helf, M. J. et al.: Metagenome mining reveals polytheonamides as posttranslationally modified ribosomal peptides. Science, 338, 387-390 (2012)[PubMed]
- Tabata, K., Ikeda, H. & Hashimoto, S.: ywfE in Bacillus subtilis codes for a novel enzyme, L-mino acid ligase. J. Bacteriol., 187, 5195-5202 (2005)[PubMed]
- Gondry, M., Sauguet, L., Belin, P. et al.: Cyclodipeptide synthases are a family of tRNA-dependent peptide bond-forming enzymes. Nat. Chem. Biol., 5, 414-420 (2009)[PubMed]
- Chen, H., Tseng, C. C., Hubbard, B. K.: et al.: Glycopeptide antibiotic biosynthesis: enzymatic assembly of the dedicated amino acid monomer (S)-3,5-dihydroxyphenylglycine. Proc. Natl. Acad. Sci. USA, 98, 14901-14906 (2001)[PubMed]
著者プロフィール
略歴:1992年 東京大学大学院農学系研究科にて博士号取得,協和発酵工業,1994年 富山県立大学工学部 助手,1995年同 助教授を経て,2010年より北海道大学大学院工学研究院 教授.
研究テーマ:微生物のもつ新規の生合成経路および代謝経路.
森田 洋行(Hiroyuki Morita)
富山大学和漢医薬学総合研究所 教授.
© 2014 大利 徹・森田洋行 Licensed under CC 表示 2.1 日本