真核生物の繊毛のもつくり返し構造の長さは分子定規により決定される
小田賢幸・柳澤春明・吉川雅英
(東京大学大学院医学系研究科 生体構造学分野)
email:吉川雅英
DOI: 10.7875/first.author.2014.146
A molecular ruler determines the repeat length in eukaryotic cilia and flagella.
Toshiyuki Oda, Haruaki Yanagisawa, Ritsu Kamiya, Masahide Kikkawa
Science, 346, 857-860 (2014)
細胞内にある構造の多くは決まった長さや大きさをもつ.ここから,“細胞はどのように長さや大きさを測っているのだろうか?”という疑問が自然とうかぶ.この疑問に対する説明として,“分子定規”という仮説が提唱されてきた.この仮説によれば,オルガネラなどの長さや大きさは,決まった長さの生体分子が分子定規としてはたらくことにより規定される.しかし,このような分子定規は細菌やウイルスにおいてはみつかっていたが,真核生物においてはみつかっておらず,真核生物において長さや大きさがどのように決められているのかは不明であった.筆者らは,緑藻クラミドモナスの鞭毛においてはたらく分子定規を発見した.鞭毛の内部では,分子モーターであるダイニンや運動の制御装置が微小管のうえで96 nmという決まった周期で整列していることが知られていた.鞭毛タンパク質であるFAP59およびFAP172を欠損したクラミドモナスの鞭毛をクライオ電子トモグラフィーを用いて観察したところ,この96 nmの周期が消失していた.また,電子顕微鏡による構造解析により,FAP59とFAP172は複合体を形成し,その長さは96 nmであることが判明した.さらに,FAP59とFAP172との複合体の長さを遺伝子操作により延長すると,鞭毛における96 nmの周期を120 nmや128 nmに延長することができた.これらの結果から,FAP59とFAP172との複合体は鞭毛において周期を決定する分子定規であると結論づけられた.
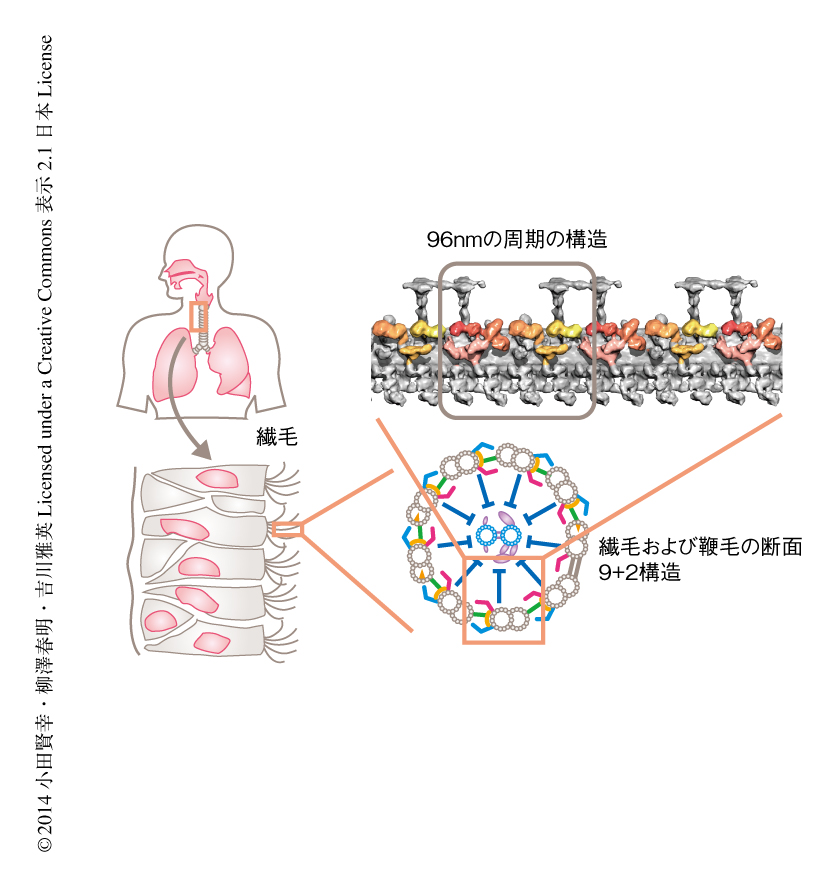
繊毛および鞭毛は波打ち運動により液体の流れをつくりだす運動性のオルガネラである.その構造および遺伝子は真核生物において単細胞生物からヒトにいたるまで広く保存されている.繊毛はヒトにおいて,気管における異物の除去,脳脊髄液のかくはん,精子の運動,発生の初期における左右の決定など,重要な役割を担う.繊毛および鞭毛の内部には,微小管が円筒状にならんだ9 + 2構造をもつ軸糸とよばれる運動装置があり,分子モーターであるダイニンやその制御装置が96 nmの周期で整然とならんでいる(図1).
細胞における正確な長さの決定の機構としては,“分子定規”仮説が提唱されてきた.しかし,これまで分子定規としては,サルモネラ菌のinjectisome 1) やλファージの尾部2) など,かぎられた例しか報告されていない.真核生物では骨格筋において細いフィラメントや太いフィラメントの長さがほぼ一定の長さである.この長さを規定する分子定規としてnebulinやtitinが候補としてあげられていたが,近年の研究により疑義がもたれている3-5).
当初,この研究の目的は分子定規の同定ではなく,真核生物のあいだで保存された鞭毛タンパク質であるFAP59およびFAP172の機能の解析を目的としていた.緑藻クラミドモナスのFAP59およびFAP172は,マウスのCCDC39およびCCDC40のホモログである.CCDC39およびCCDC40の欠損は,哺乳類(イヌおよびヒト)や魚類において繊毛の運動の不全を起こし,それにより繊毛病の典型的な症候である慢性気管支炎,副鼻腔炎,内臓逆位を起こすことが知られていた6,7).しかし,この2つの鞭毛タンパク質が鞭毛あるいは繊毛のなかで,どこに存在し何をしているのかはわかっていなかった.
そこで,FAP59およびFAP172に対する抗体を用い,クラミドモナスにおいてそれらの遺伝子を欠損した変異体を単離した.これらの変異体は短い鞭毛しかもたず,微小管どうしを架橋するネキシン-ダイニン制御複合体,および,ダイニンの一部である内腕ダイニンがほぼ消失していた.また,共沈実験により,FAP59とFAP172は複合体を形成することも判明した.これらの結果は,FAP59-FAP172複合体が軸糸の構築に必須であることを示していた.
FAP59-FAP172複合体の欠損が軸糸の構造にどのような影響を及ぼすのかを調べるため,クライオ電子線トモグラフィーによる3次元構造解析を行った.野生型のクラミドモナスの軸糸は長さがおよそ10μmで,そのなかの周辺微小管には96 nmの周期をとる構造がある.この96 nmの周期のなかには,2本のラジアルスポーク,7種類の内腕ダイニン,1つのネキシン-ダイニン制御複合体が存在する(図1).これに対して,FAP59およびFAP172を欠損した軸糸では,内腕ダイニンやネキシン-ダイニン制御複合体は欠損していたが,ラジアルスポークは逆にその数が増えており,32 nmほどの短い周期で野生型よりも高密度に存在していた.つまり,これらの軸糸では,96 nmの周期をとる構造を構成する要素であるラジアルスポークと内腕ダイニンおよびネキシン-ダイニン制御複合体が,増加と欠損という正反対の変化を示したのである.いずれの場合も96 nmの周期は消失していたことから,FAP59-FAP172複合体は分子定規ではないかと考えた.
もし,FAP59-FAP172複合体が96 nmの周期の分子定規であるならば,その長さは周期と同じ96 nmであるはずである.複雑な軸糸の構造においてFAP59-FAP172複合体を区別するため,クライオ電子トモグラフィーに構造標識という方法を組み合わせた.この方法は,光学顕微鏡による観察においてGFPを付加して特定のタンパク質を光らせてその位置を同定するのと同様に,目的のタンパク質(この場合は,FAP59およびFAP172)に標識タンパク質を付加し,電子顕微鏡で観察したときに“出っ張り”として位置を同定するものである8).FAP59およびFAP172のN末端,中央部,C末端にビオチン化タグを挿入し,ストレプトアビジンを結合させることにより3次元構造における位置を決定した.その結果,FAP59およびFAP172とも96 nmの細長い構造をとっており,96 nmの周期をとる構造に並走して存在することがわかった.
以上の結果から,FAP59-FAP172複合体の長さが96 nmであることはわかったが,それが鞭毛において周期の長さを決めているとはいいきれない.FAP59-FAP172複合体が分子定規であることを示すには,その長さにより周期の長さが規定されていることを確かめる必要があった.
そこで,FAP59およびFAP172の長さを遺伝子操作により延長し,鞭毛において周期の延長がひき起こされるかどうかをクライオ電子線トモグラフィーにより確かめた.まず,N末端側の約240アミノ酸残基を2回くり返すことにより延長すると,96 nmの周期が128 nmに延長された.この128 nmの周期においては,野生株では2本のラジアルスポークが3本に増えており,また,延長した部分に相当する内腕ダイニンの一部が重複していた.つぎに,中央部の約180アミノ酸残基を2回くり返す配列にすると周期が120 nmになった.この120 nmの周期ではラジアルスポークは2本のままであったが,構造に野生型にはない隙間が生じていた.さらに,C末端側の240アミノ酸残基を2回くり返す配列にすると周期は128 nmになり,ラジアルスポークは3本になった.そして,内腕ダイニンの一部とネキシン-ダイニン制御複合体が重複していた.これらの結果から,FAP59-FAP172複合体は96 nmの周期を規定する分子定規であることが明確に示された.それにくわえ,FAP59-FAP172複合体は内腕ダイニンなどの配列を決めていることも判明した.したがって,このFAP59-FAP172複合体からなる分子定規は,単に長さを決定するだけでなく,周期をとる構造を構成する要素の配列をも規定する“スーパー定規”であるといえた.
ヒトにおいて繊毛の遺伝子が欠損すると,慢性副鼻腔炎,気管支拡張症,内臓逆位を特徴とする原発性繊毛運動不全症をひき起こす.繊毛あるいは鞭毛に関係するタンパク質は数百種類あり,その変異や欠損は原発性繊毛運動不全症をひき起こす可能性がある.興味深いことに,報告されている原発性繊毛運動不全症のうち,CCDC39あるいはCCDC40が原因となるものはおよそ18%にものぼる9).このことは,繊毛の運動性に分子定規が重要な役割を担うことを示唆しているのではないかと考えている.
今後は,FAP59-FAP172複合体がなぜ微小管の特別な位置に結合するのか,また,下流に相当する分子モーターダイニンとはどのようにつながっているのか,などの疑問に,遺伝学的な手法とクライオ電子線トモグラフィーを組み合わせてチャレンジしていきたいと考えている.これにより,繊毛および鞭毛の構築の全貌を明らかにするとともに,原発性繊毛運動不全症の病態の解明を試みていきたい.
東京大学大学院医学系研究科 助教.
柳澤 春明(Haru-aki Yanagisawa)
東京大学大学院医学系研究科 助教.
吉川 雅英(Masahide Kikkawa)
東京大学大学院医学系研究科 教授.
研究室URL:http://structure.m.u-tokyo.ac.jp/index.html
© 2014 小田賢幸・柳澤春明・吉川雅英 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 生体構造学分野)
email:吉川雅英
DOI: 10.7875/first.author.2014.146
A molecular ruler determines the repeat length in eukaryotic cilia and flagella.
Toshiyuki Oda, Haruaki Yanagisawa, Ritsu Kamiya, Masahide Kikkawa
Science, 346, 857-860 (2014)
要 約
細胞内にある構造の多くは決まった長さや大きさをもつ.ここから,“細胞はどのように長さや大きさを測っているのだろうか?”という疑問が自然とうかぶ.この疑問に対する説明として,“分子定規”という仮説が提唱されてきた.この仮説によれば,オルガネラなどの長さや大きさは,決まった長さの生体分子が分子定規としてはたらくことにより規定される.しかし,このような分子定規は細菌やウイルスにおいてはみつかっていたが,真核生物においてはみつかっておらず,真核生物において長さや大きさがどのように決められているのかは不明であった.筆者らは,緑藻クラミドモナスの鞭毛においてはたらく分子定規を発見した.鞭毛の内部では,分子モーターであるダイニンや運動の制御装置が微小管のうえで96 nmという決まった周期で整列していることが知られていた.鞭毛タンパク質であるFAP59およびFAP172を欠損したクラミドモナスの鞭毛をクライオ電子トモグラフィーを用いて観察したところ,この96 nmの周期が消失していた.また,電子顕微鏡による構造解析により,FAP59とFAP172は複合体を形成し,その長さは96 nmであることが判明した.さらに,FAP59とFAP172との複合体の長さを遺伝子操作により延長すると,鞭毛における96 nmの周期を120 nmや128 nmに延長することができた.これらの結果から,FAP59とFAP172との複合体は鞭毛において周期を決定する分子定規であると結論づけられた.
はじめに
繊毛および鞭毛は波打ち運動により液体の流れをつくりだす運動性のオルガネラである.その構造および遺伝子は真核生物において単細胞生物からヒトにいたるまで広く保存されている.繊毛はヒトにおいて,気管における異物の除去,脳脊髄液のかくはん,精子の運動,発生の初期における左右の決定など,重要な役割を担う.繊毛および鞭毛の内部には,微小管が円筒状にならんだ9 + 2構造をもつ軸糸とよばれる運動装置があり,分子モーターであるダイニンやその制御装置が96 nmの周期で整然とならんでいる(図1).
細胞における正確な長さの決定の機構としては,“分子定規”仮説が提唱されてきた.しかし,これまで分子定規としては,サルモネラ菌のinjectisome 1) やλファージの尾部2) など,かぎられた例しか報告されていない.真核生物では骨格筋において細いフィラメントや太いフィラメントの長さがほぼ一定の長さである.この長さを規定する分子定規としてnebulinやtitinが候補としてあげられていたが,近年の研究により疑義がもたれている3-5).
1.FAP59およびFAP172の変異体の単離とその解析
当初,この研究の目的は分子定規の同定ではなく,真核生物のあいだで保存された鞭毛タンパク質であるFAP59およびFAP172の機能の解析を目的としていた.緑藻クラミドモナスのFAP59およびFAP172は,マウスのCCDC39およびCCDC40のホモログである.CCDC39およびCCDC40の欠損は,哺乳類(イヌおよびヒト)や魚類において繊毛の運動の不全を起こし,それにより繊毛病の典型的な症候である慢性気管支炎,副鼻腔炎,内臓逆位を起こすことが知られていた6,7).しかし,この2つの鞭毛タンパク質が鞭毛あるいは繊毛のなかで,どこに存在し何をしているのかはわかっていなかった.
そこで,FAP59およびFAP172に対する抗体を用い,クラミドモナスにおいてそれらの遺伝子を欠損した変異体を単離した.これらの変異体は短い鞭毛しかもたず,微小管どうしを架橋するネキシン-ダイニン制御複合体,および,ダイニンの一部である内腕ダイニンがほぼ消失していた.また,共沈実験により,FAP59とFAP172は複合体を形成することも判明した.これらの結果は,FAP59-FAP172複合体が軸糸の構築に必須であることを示していた.
2.クライオ電子線トモグラフィーによるFAP59およびFAP172の変異体における軸糸の構造解析
FAP59-FAP172複合体の欠損が軸糸の構造にどのような影響を及ぼすのかを調べるため,クライオ電子線トモグラフィーによる3次元構造解析を行った.野生型のクラミドモナスの軸糸は長さがおよそ10μmで,そのなかの周辺微小管には96 nmの周期をとる構造がある.この96 nmの周期のなかには,2本のラジアルスポーク,7種類の内腕ダイニン,1つのネキシン-ダイニン制御複合体が存在する(図1).これに対して,FAP59およびFAP172を欠損した軸糸では,内腕ダイニンやネキシン-ダイニン制御複合体は欠損していたが,ラジアルスポークは逆にその数が増えており,32 nmほどの短い周期で野生型よりも高密度に存在していた.つまり,これらの軸糸では,96 nmの周期をとる構造を構成する要素であるラジアルスポークと内腕ダイニンおよびネキシン-ダイニン制御複合体が,増加と欠損という正反対の変化を示したのである.いずれの場合も96 nmの周期は消失していたことから,FAP59-FAP172複合体は分子定規ではないかと考えた.
3.構造標識によるFAP59-FAP172複合体の長さの計測
もし,FAP59-FAP172複合体が96 nmの周期の分子定規であるならば,その長さは周期と同じ96 nmであるはずである.複雑な軸糸の構造においてFAP59-FAP172複合体を区別するため,クライオ電子トモグラフィーに構造標識という方法を組み合わせた.この方法は,光学顕微鏡による観察においてGFPを付加して特定のタンパク質を光らせてその位置を同定するのと同様に,目的のタンパク質(この場合は,FAP59およびFAP172)に標識タンパク質を付加し,電子顕微鏡で観察したときに“出っ張り”として位置を同定するものである8).FAP59およびFAP172のN末端,中央部,C末端にビオチン化タグを挿入し,ストレプトアビジンを結合させることにより3次元構造における位置を決定した.その結果,FAP59およびFAP172とも96 nmの細長い構造をとっており,96 nmの周期をとる構造に並走して存在することがわかった.
4.FAP59-FAP172複合体の延長による96 nmの周期の変化
以上の結果から,FAP59-FAP172複合体の長さが96 nmであることはわかったが,それが鞭毛において周期の長さを決めているとはいいきれない.FAP59-FAP172複合体が分子定規であることを示すには,その長さにより周期の長さが規定されていることを確かめる必要があった.
そこで,FAP59およびFAP172の長さを遺伝子操作により延長し,鞭毛において周期の延長がひき起こされるかどうかをクライオ電子線トモグラフィーにより確かめた.まず,N末端側の約240アミノ酸残基を2回くり返すことにより延長すると,96 nmの周期が128 nmに延長された.この128 nmの周期においては,野生株では2本のラジアルスポークが3本に増えており,また,延長した部分に相当する内腕ダイニンの一部が重複していた.つぎに,中央部の約180アミノ酸残基を2回くり返す配列にすると周期が120 nmになった.この120 nmの周期ではラジアルスポークは2本のままであったが,構造に野生型にはない隙間が生じていた.さらに,C末端側の240アミノ酸残基を2回くり返す配列にすると周期は128 nmになり,ラジアルスポークは3本になった.そして,内腕ダイニンの一部とネキシン-ダイニン制御複合体が重複していた.これらの結果から,FAP59-FAP172複合体は96 nmの周期を規定する分子定規であることが明確に示された.それにくわえ,FAP59-FAP172複合体は内腕ダイニンなどの配列を決めていることも判明した.したがって,このFAP59-FAP172複合体からなる分子定規は,単に長さを決定するだけでなく,周期をとる構造を構成する要素の配列をも規定する“スーパー定規”であるといえた.
おわりに
ヒトにおいて繊毛の遺伝子が欠損すると,慢性副鼻腔炎,気管支拡張症,内臓逆位を特徴とする原発性繊毛運動不全症をひき起こす.繊毛あるいは鞭毛に関係するタンパク質は数百種類あり,その変異や欠損は原発性繊毛運動不全症をひき起こす可能性がある.興味深いことに,報告されている原発性繊毛運動不全症のうち,CCDC39あるいはCCDC40が原因となるものはおよそ18%にものぼる9).このことは,繊毛の運動性に分子定規が重要な役割を担うことを示唆しているのではないかと考えている.
今後は,FAP59-FAP172複合体がなぜ微小管の特別な位置に結合するのか,また,下流に相当する分子モーターダイニンとはどのようにつながっているのか,などの疑問に,遺伝学的な手法とクライオ電子線トモグラフィーを組み合わせてチャレンジしていきたいと考えている.これにより,繊毛および鞭毛の構築の全貌を明らかにするとともに,原発性繊毛運動不全症の病態の解明を試みていきたい.
文 献
- Journet, L., Agrain, C., Broz, P. et al.: The needle length of bacterial injectisomes is determined by a molecular ruler. Science, 302, 1757-1760 (2003)[PubMed]
- Katsura, I.: Determination of bacteriophage lambda tail length by a protein ruler. Nature, 327, 73-75 (1987)[PubMed]
- Fernandes, I. & Schock, F.: The nebulin repeat protein Lasp regulates I-band architecture and filament spacing in myofibrils. J. Cell Biol., 206, 559-572 (2014)[PubMed]
- Greaser, M. L. & Pleitner, J. M.: Titin isoform size is not correlated with thin filament length in rat skeletal muscle. Front. Physiol., 3, 35 (2014)[PubMed]
- Castillo, A., Nowak, R., Littlefield, K. P. et al.: A nebulin ruler does not dictate thin filament lengths. Biophys. J., 96, 1856-1865 (2009)[PubMed]
- Merveille, A. C., Davis, E. E., Becker-Heck, A. et al.: CCDC39 is required for assembly of inner dynein arms and the dynein regulatory complex and for normal ciliary motility in humans and dogs. Nat. Genet., 43, 72-78 (2011)[PubMed]
- Becker-Heck, A., Zohn, I. E., Okabe, N. et al.: The coiled-coil domain containing protein CCDC40 is essential for motile cilia function and left-right axis formation. Nat. Genet. 43, 79-84 (2011)[PubMed]
- Oda, T. & Kikkawa, M.: Novel structural labeling method using cryo-electron tomography and biotin-streptavidin system. J. Struct. Biol., 183, 305-311 (2013)[PubMed]
- Antony, D., Becker-Heck, A., Zariwala, M. A. et al.: Mutations in CCDC39 and CCDC40 are the major cause of primary ciliary dyskinesia with axonemal disorganization and absent inner dynein arms. Hum. Mutat., 34, 462-472 (2013)[PubMed]
著者プロフィール
東京大学大学院医学系研究科 助教.
柳澤 春明(Haru-aki Yanagisawa)
東京大学大学院医学系研究科 助教.
吉川 雅英(Masahide Kikkawa)
東京大学大学院医学系研究科 教授.
研究室URL:http://structure.m.u-tokyo.ac.jp/index.html
© 2014 小田賢幸・柳澤春明・吉川雅英 Licensed under CC 表示 2.1 日本